
- •Предисловие.
- •Тема 5. Потенциалы.
- •Потенциал и рН (кислотность).
- •Потенциал и концентрации (и кислотность).
- •Частицы и свойства.
- •Системы окислители и восстановители.
- •Участники реакции, соотнесение.
- •Уравнения Нернста.
- •Расчёт потенциала по Нернсту.
- •Расчёт эдс.
- •Определение возможности протекания реакции.
- •Верные утверждения.
Уравнения Нернста.
Пример:

…
Как с этим бороться:
Уравнение Нернста в исходном варианте выглядит так:

E – это потенциал
Е0 – стандартный потенциал Z – количество электронов.
Важно понять, как это работает! Дальше будут задачи с этой формулой. Этот вопрос лучше решать ручкой на бумажке, а не в уме. Подставляем концентрации из реакции в формулу.
Получается

Вместо Z подставили «2», потому что в уравнение 2 электрона, умножили на (концентрацию хинона в первой степени * концентрацию водорода во второй степени). Заметим, что у твёрдых веществ, как и в прошлой теме, концентраций нет. Где-то там был I2(тв). Вместо таких подставлять 1. У твердых веществ концентрации не может быть. Так как хинон и гидрохинон равны, то они сокращаются нахуй. Из-за странного математического бага степень 2 и количество электронов 2 тоже сокращаются. Внимание! Это такое странное свойство логарифма. Если степень 3, а в Z=2, то они, конечно, не сокращаются.
В итоге от формулы остается:

ОТВЕТ: D
Расчёт потенциала по Нернсту.
Пример:

…
Как с этим бороться:
Потенциал рассчитывается по формуле предыдущей.
RТ/F=0,06 – об этом не надо беспокоится, не учитываем. Это то самое 0,06, которое и так уже в формуле.
Для преподов, студентам не читать, заметим, что вообще-то RT/F не равно 0,06. Ну ёбанный стыд, как так можно косячить. R=8.31 Дж/моль*К, T=298 К (не обязательно, но имелось в виду это), F=96500 Кл/моль. Если это всё посчитать, то получится примерно 0,026. Однако, в формуле надо действительно 0,06, дело в том, что там не просто RT/F, а 2,3RT/F, а это самое 2,3 — коэффициент перевода из натурального в десятичный логарифм. Впрочем, это редкостное занудство, а всем, как обычно, похуй.
Берем Нернста в общем виде
Вставляем концентрации как в реакции, в виде букв

Внимательно, степени не проебите! Авторы этого пособия проверили на себе, при практической реализации данных расчётов степени теряются легко и неприждённо, а потом следуют вопросы, почему у меня не максимум.
Подставляем цифры из дано (не потеряйте степени, тут тоже):
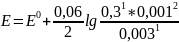
Как это считать:
Сначала считаем всю дробь за логарифмом.

Затем вычисляем логарифм, это просто кнопка на калькуляторе. Чтобы включить инженерный вид на яблофоне, его поворачивают на бочок. Андроид выводит по кнопке «инженерный». Вводим нужное число и жмем кнопку lg или log10. Калькулятор сам вычисляет нужное значение. Слава роботам!
lg(0,00001)=-5
Обратите внимание, что из логарифма должно получаться простое число. Если нет, то, возможно, Вы делаете что-то не так (хотя это не 100% критерий).
Дальнейшее вычисления для дебилов
будущих медиков: E=0,216+0,03*(-5)=0,066
ОТВЕТ:
0,066 (важно вводить именно запятую, а не
точку)
Расчёт эдс.
Пример:

.
Как с этим бороться:
Важно определить, что является окислителем, а что восстановителем. Это может делаться двумя способами:
Как в школе. Кто уменьшает степень окисления — окислитель, кто увеличивает —восстановитель. Этот способ может прокатывать не всегда, хотя его нельзя забывать.
С применением таблицы на страницы 91. Если степень окисления определить невозможно (как для НАД, например).
На странице 91 написано много процессов, все процессы как окислители, если в реакции, процесс протекает так же, как в таблице, то это вещество — окислитель, если процесс в задаче протекает обратно к процессу в таблице — это восстановитель. Например, в таблице третья снизу строка переход НАД+ в НАДН – окислитель, а вот в примере наоборот, НАДН переходит в НАД+, значит это восстановитель. Значит пируват/лактат это окислитель, не может же быть два воссановителя. Кстати, в таблице можно найти переход именно пирувата в латат, как в нашей реакции, что точно подтверждает — пируват таки окислитель. Ну что ж, значения потенциалов даны в условии, осталось одно действие.
Расчет ЭДС:
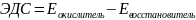


ОТВЕТ: -0,125
