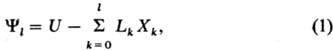Шпаргалка По Физике (Штеренберг А. М.) / 40.Уравнение политропы
.doc40.Уравнение политропы. Коэффициент Пуассона. Термодинамические потенциалы.
Политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость c газа остаётся неизменной. Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими.
Для идеального газа уравнение политропы может быть записано в виде:
pVn = const, где величина n= C-Cp / C-Cv называется показателем политропы.
В зависимости от процесса можно определить значение n:
1. Изотермический процесс: n = 1, так как PV1 = const, значит PV = const, значит T = const.
2. Изобарный процесс: n = 0, так как PV0 = P = const.
3. Адиабатный процесс: n = γ, это следует из уравнения Пуассона.
4.
Изохорный процесс:
![]() ,
так как
,
так как
![]() ,
значит P1
/ P2
= (V2
/ V1)n,
значит V2
/ V1
= (P1
/ P2)(1
/ n),
значит, чтобы P1
и P2
обратились в 1, n должна быть бесконечность.
,
значит P1
/ P2
= (V2
/ V1)n,
значит V2
/ V1
= (P1
/ P2)(1
/ n),
значит, чтобы P1
и P2
обратились в 1, n должна быть бесконечность.
C=Cp – изобарный
C=Cv – изохорный
C=1 - изотерма
C=0 – адиабата
Коэффициент Пуассона характеризует упругие свойства материала. При приложении к телу растягивающего усилия оно начинает удлиняться (то есть длина увеличивается), а поперечное сечение уменьшается. Коэффициент Пуассона показывает, во сколько раз изменяется поперечное сечение деформируемого тела при его растяжении или сжатии. Для абсолютно хрупкого материала коэффициент Пуассона = 0, для абсолютно упругого — 0,5. Для большинства сталей этот коэффициент лежит в районе 0,3, для резины он примерно равен 0,5. (Измеряется в относительных единицах (мм/мм, м/м))
![]() ,
,
где
ν — коэффициент Пуассона,
![]() — деформация в поперечном направлении
(отрицательный для осевого растяжения,
положительный для осевого сжатия),
— деформация в поперечном направлении
(отрицательный для осевого растяжения,
положительный для осевого сжатия),![]() — продольная деформация (положительный
для осевого растяжения, отрицательный
для осевого сжатия
— продольная деформация (положительный
для осевого растяжения, отрицательный
для осевого сжатия
Термодинамические потенциалы (термодинамические функции) — функции основных макроскопических параметров (температура, давление, энтропия и т. д.) термодинамической системы, характеризующие её состояние:
внутренняя энергия, энтальпия, свободная энергия Гельмгольца, потенциал Гиббса, большой термодинамический потенциал
Общая формула для термодинамических потенциалов: