
- •Атомные орбитали. Законы расположения электронов в атоме.
- •2.Ионное произведение воды, ph
- •Вода, агрегатные состояния воды, водородные связи
- •2. Порядок и молекулярность реакции
- •1. Энергия Гиббса
- •2.Постулаты Бора. Принцип Гейзенберга.
- •1.Дисперсные системы
- •2) Растворы. Законы Рауля.
- •2) Вода, агрегатные состояния воды, водородные связи
- •Вода, агрегатные состояния воды, водородные связи
- •3)Молекулярность, порядок реакции
- •Типы окислительно-восстановительных реакций
- •1. Стандартные условия, принцип Бертло-Томсена.
- •2. Осмос. Закон Вант-Гоффа
- •1)Растворимость, способы ее выражения
- •Вопрос 19
- •2)Константа скорости реакции
- •2. Катализ.
- •1.Энтальпия
- •Современные представления о таблице Менделеева и периодической системе. Зависимость элементов.
- •Принципы образования химических связей. Примеры
- •2. Электролиты. Сильные и слабые. Примеры.
- •1. Понятие энтропии. Второе и третье начало термодинамики.
- •Второй закон термодинамики
- •2. Хлорокислородные кислоты.
- •1) Превращения энергии в химических реакциях
- •2) Понятие гидротация
- •1)Энергия Гиббса, её связь с константой равновесия
- •2)Основные классы неорганических соединений
Атомные орбитали. Законы расположения электронов в атоме.
Электронный паспорт элемента(по-моему так)
Атомное ядро состоит из протонов – положительно заряженных частиц и нейтронов – частиц, не имеющих заряда.
Согласно квантовой теории строения атома, все электроны в атоме движутся по энергетическим уровням или орбитам. Эти уровни состоят из подуровней. В свою очередь подуровни состоят из атомных орбиталей.
Электронные орбиты в модели Бора обозначаются целыми числами:1, 2, 3, 4,… и так до n, или латинскими буквами по алфавиту, начиная с буквы K, L, M, N, O P, Q. Начиная от ближайшего к ядру уровня.
Уровни в свою очередь состоят из подуровней. Число подуровней на каждом уровне равно номеру уровня. Подуровни имеют названия.
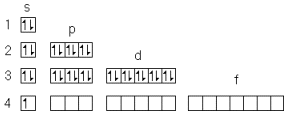
1ый подуровень каждого уровня называется S,
2-ой подуровень каждого уровня называется P,
3-ий подуровень каждого уровня называется d,
4-ий подуровень каждого уровня называется f
Атомная орбиталь (АО) - область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
Положение элемента в Периодической системе определяет тип орбиталей его атомов (s-, p-, d-, f-АО и т.д.), различающихся энергией, формой, размерами и пространственной направленностью.
Для элементов 1-го периода (Н, He) характерна одна АО - 1s.
В элементах 2-го периода электроны занимают пять АО на двух энергетических уровнях: первый уровень 1s; второй уровень - 2s, 2px, 2py, 2pz. (цифры обозначают номер энергетического уровня, буквы - форму орбитали).
Законы
1.Любая частица стремится к минимальному запасу потенциальной энергии.
2. Запрет Паули. В атоме не может быть двух электронов, имеющих одинаковые значения всех четырёх квантовых чисел. Запрет Паули определяет электронную ёмкость орбиталей, подуровней и уровней. Электронная ёмкость уровней рассчитывается по формуле: N = 2n2, где N – число электронов на данном уровне, n – главное квантовое число.
3. Принцип Хунда. На данном энергетическом подуровне электроны располагаются таким образом, чтобы модуль их суммарного спина был максимальным.
4. Первый закон Клечковского. Электронами в первую очередь заполняются орбитали с меньшим значением суммы главного и орбитального чисел, а затем уже орбитали с большим значением суммы этих двух чисел. Согласно первому закону Клечковского, в первую очередь заполняются электронами ns-орбитали, а затем (n-1)d, которые имеют больший запас потенциальной энергии.
5. Второй закон Клечковского. Если две орбитали имеют одинаковое значение суммы главного и орбитального чисел, то в первую очередь электронами заполняется та орбиталь, у которой главное квантовое число имеет меньшее значение.
электронный паспорт атома водорода выглядит следующим образом: 1s1.
аналитический электронный паспорт атома меди. Он будет выглядеть вот так: 1s22s22p63s23p63d104s1
графический электронный паспорт атома меди.
2) степень гидролиза
Обменная реакция между водой и соединением называется гидролизом.
Гидролиз солей - взаимодействие в водных растворах катионов и (или) анионов солей с молекулами воды, при котором к катиону, оказавшемуся в растворе, присоединяется группа ОН- , а к аниону - ион Н+ молекулы воды.
В результате гидролиза в растворе появляются ионы Н+ и ОН-, и среда становится соответственно кислой или щелочной.
Возможны следующие случаи гидролиза солей:
1) по аниону,
2)катиону,
3) катиону и аниону одновременно.
Na2S + H2SO4(конц) ---> Na2SO4 + H2S эта реакция не является окислительно-восстановительной!
Это реакция ионного обмена
----------------------------------------------------------------------------------------------------------------------
1.Корпоскулярно-волновая теория. Принцип неопределенности. Теория Бора.
Корпоскулярно-волновая теория
- важнейшее универсальное свойство природы, заключающееся в том, что всем микрообъектам присущи одновременно и корпускулярные и волновые характеристики. Так, напр., электрон, нейтрон, фотон в одних условиях проявляются как частицы, движущиеся по классич. траекториям и обладающие определ. энергией и импульсом, а в других - обнаруживают свою волновую природу, характерную для явлений интерференции и дифракции частиц. В качестве первичного принципа К.-в. д. лежит в основе квантовой механики и квантовой теории поля.
НЕОПРЕДЕЛЕННОСТИ ПРИНЦИП - фундаментальное положение квантовой теории, утверждающее, что характеризующие физическую систему т. н. дополнительные физические величины (напр., координата и импульс) не могут одновременно принимать точные значения; отражает двойственную, корпускулярно-волновую природу частиц материи (электронов, протонов и т. д.)
Теория Бора основана на двух постулатах.
Существуют стационарные состояния атома, в которых он не излучает и не поглощает энергию.
Излучение и поглощение энергии атомом происходит при скачкообразном переходе из одного стационарного состояния в другое, при этом имеют место два соотношения:
1.
![]()
где
![]() —
излучённая (поглощённая) энергия,
—
излучённая (поглощённая) энергия,
![]() —
номера квантовых состояний. В спектроскопии
—
номера квантовых состояний. В спектроскопии
![]() и
и
![]() называются
термами.
называются
термами.
