
- •Методичні рекомендації
- •Методичні рекомендації до виконання лабораторних робіт з дисципліни Фізико-хімічні основи використання низькопотенційних джерел енергії
- •Правила з техніки безпеки
- •Методика проведення лабораторних робіт
- •Опис експериментальної установки
- •Хід роботи
- •Обробка результатів.
- •Опис експериментальної установки
- •Хід роботи
- •Обробка результатів.
- •Метод найменших квадратів
- •Опис експериментальної установки
- •Хід роботи
- •Обробка результатів.
- •Опис експериментальної установки
- •Хід роботи
- •Обробка результатів
- •Контрольні питання
- •Опис лабораторної установки
- •Хід роботи
- •Обробка результатів
- •Мета роботи
- •Завдання
- •Загальні відомості
- •Теплопровідність через циліндричну одношарову стінку
- •Експериментальне визначення коефіцієнта теплопровідності
- •Опис експериментальної установки
- •Хід роботи
- •Обробка результатів
- •Контрольні питання
- •Мета роботи
- •Завдання
- •Загальні відомості
- •Хід роботи
- •Обробка результатів
- •Контрольні питання
- •Мета роботи
- •Завдання
- •Загальні відомості
- •Опис експериментальної установки
- •Контрольні питання
- •Опис системи
- •Хід роботи
- •Обробка результатів
- •Контрольні питання
- •Опис експериментальної установки
- •Хід роботи
- •Обробка результатів
- •Контрольні питання
- •5. Фізично поясніть можливість застосування формули (1) тільки до зразків малої теплоємності. Рекомендована література
Опис експериментальної установки
Експериментальна установка складається (рис. 2) з закритої судини, до якої під’єднується диференційна манометрична трубка. У судині розташована термопара, яка під’єднується до мультиметра, що працює в режимі вимірювання температури. Судина розміщується у сосуді Дьюара (вакуумована колба) з гарячою водою (водяна баня).
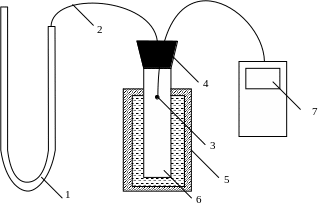
Рис. 2. Експериментальна установка з дослідження ізохорного процесу.
1 – диференційна манометрична трубка; 2 – трубка; 3 – термопара; 4 – пробка; 5 – вакуумована колба з гарячою водою (водяна баня); 6 – судина; 7 – мультиметр.
Хід роботи
Залити гарячу воду (70-80 °С) у вакуумовану колбу.
Помістити склянку на водяну баню.
Знімати показання термопари через 2-3 градуси, та відповідні показання манометра.
Провести обробку результатів.
Обробка результатів.
Нанести експериментальні результати вимірювань тиску і температури газу в судині на графік у р-Т координатах вказуючи похибку виміру (не забудьте, що диференційний манометр показує надлишковий тиск.. Абсолютний тиск у судині є сумою його показань та атмосферного тиску).
За методом найменших квадратів визначити залежність р(Т), що апроксимує експериментальну залежність та нанести відповідну пряму на графік з експериментальними точками.
Перевірити закон Шарля.
Оцінити значення тиску, що відповідає абсолютному нулю температури по шкалі Кельвіна шляхом підстановки відповідної температури у отриману лінійну залежність р(Т).
Метод найменших квадратів
Коефіцієнти
прямої, що відповідає найменшій сумі
квадратів відхилень значень від вихідних
точок
![]() визначаються за наступними формулами:
визначаються за наступними формулами:
 ;
;
![]()
де:
![]() ;
;
![]() ;
;
![]() ;
;
![]()
Для даної роботи х0 відповідає тиску, х1 – температурі.
Контрольні питання
1. Сформулюйте закон Шарля.
2.Які емпіричні газові закони приводять до універсального газового закону?
3.Що таке абсолютний нуль температури?
4.Що таке диференційний манометр?
5. Які методичні похибки проведення лабораторної роботи?
Лабораторна робота №2
ДОСЛІДЖЕННЯ ІЗОТЕРМІЧНОГО ПРОЦЕСУ. ЗАКОН БОЙЛЯ-МАРІОТА
Мета роботи
Дослідження залежність тиску повітря в судині від його об'єму. Оцінити положення абсолютного нуля температур.
Завдання
1. Виміряти залежності тиску в системі від об’єму судини.
2. Перевірити справедливість закону Бойля-Маріота.
3. Оцінити значення тиску, що відповідає нескінченному об’єму судини шляхом обробки масиву даних за допомогою метода найменших квадратів.
Загальні відомості
Для ізотермічного процесу, що протікає при сталій температурі, справджується закон Бойля-Маріотта, який є частинним випадком об’єднаного газового закону, а саме
![]() .
.
Отже, можна сказати, що для даної маси газу, який перебуває в двох і більше станах, добуток його тиску на об’єм у кожному із станів є величиною сталою, або тиск газу даної маси при сталій температурі змінюється обернено пропорційно до його об’єму.
Добуток рV залежить від хімічної природи газу, температури, при якій проводились вимірювання, і маси газу.
Закон Бойля-Маріотта, як і інші газові закони, для реальних газів справджується наближено. У технічних розрахунках закон Бойля-Маріотта можна застосувати для реальних газів, які перебувають при ненадто великих тисках і не надто низьких температурах.
Якщо в рівнянні стану вважати T = const то права частина рівняння буде величиною сталою, тобто рV = const.
Ця формула виражає закон, встановлений дослідним шляхом у середині ХІХ ст. англійським ученим Р. Бойлем і французьким фізиком Е. Маріоттом. Закон Бойля-Маріотта, або рівняння стану ідеального газу при ізотермічному процесі, означає: добуток тиску даної маси газу на об’єм, що його займає газ за сталої температури є величиною сталою.
Графічно залежність між тиском і об’ємом газу за сталої температури зображають, добре відомою з курсу математики, гіперболою. Кожному значенню температури відповідає своя крива. Ці криві називають ізотермами (кривими одинакових температур). Чим вища температура за якої відбувається процес, тим вище розташована ізотерма.
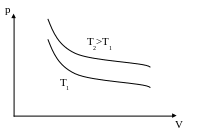
Рис. 1. Ізотермічний процес у р-V координатах
В системах координат Р,Т і V,T ізотермічний процес зображується прямою, паралельною відносно осі Р або V. Ці прямі є також ізотермами. Третій параметр (V або Р ) не зберігає вздовж них сталого значення.
