
- •Предисловие.
- •Тема 1. Способы выражения концентрации растворов.
- •Задачи с массовой долей.
- •Посчитать массовую долю если даны массы веществ.
- •Масса по массовой доле.
- •Массовая доля / масса, если даны масса, объем и плотность.
- •Массовая доля и моли
- •Массовая доля и разбавление
- •Задачи с молярной концентрацией.
- •Молярная концентрация и моли
- •Молярная концентрация и объем растворённого газа
- •Молярная концентрация и масса
- •Задачи про моляльность.
- •Моляльность
- •Моляльность и масса
- •Вопросы без расчетов.
- •Вопросы про размерность
- •Разная теоретическая фигня.
- •Формульные вопросы
Задачи с молярной концентрацией.
Молярная концентрация и моли
Пример:

Лёгкая разновидность.
Как с этим бороться:
В одно действие. Читаем условие, понимаем, что есть n=0,2 моль и V=250 мл, хотят c-? Оно ищется в одну формулу, вот эту:
Не нужны преобразования, посторонние действия, красота. Только нужно объем из мл. перевести в л. 250 мл = 0,25 л, и тогда
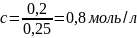
Молярная концентрация и объем растворённого газа
Пример:

Внимание, подводные грабли.
Как с этим бороться:
Бывает,
что растворённое вещество — газ. Тогда
в задаче есть два объема. Один — объем
жидкого раствора, а второй — объем
газообразного растворенного газа. Их
не надо путать, разные числа. Задачи
такого типа видно по примечанию (н.у.).
Читаем задачу, видим, что дан V=500
мл это раствор, с=0,4М, просят найти объем
бромоводорода. Несложно Сложно
сообразить, что бромоводород —
газообразное растворенное вещество.
Задача решается в два действия. Объем
газов, напомню, встречался только в
Но чтобы ей пользоваться, нужно n, его нет, но можно добыть из:
Используя блондиночные преобразования, получим (объем из 500 мл. переводим в 0,5 л):
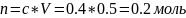
Возвращаемся к первой формуле, применим блондиночные преобразования к ней также, чтобы добыть V
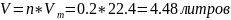
Задача может быть обратной, дан объем газа, найти молярную концентрацию.
Молярная концентрация и масса
Пример:

Аналог прошлой задачи, даже легче.
Как с этим бороться:
Аналогично прошлому примеру, но вместо объема будет масса. Из условия понимаем, что массу, пожалуй, проще будет найти через
Молярная масса как раз есть, а моли щас найдем, как в прошлом примере через
Снова применим блондиночные преобразования (400 мл = 0,4 л)

Вернемся к первой формуле, преобразуем и вставим цифры:

Также возможна обратная задача.
Задачи про моляльность.
Моляльность
Пример:
...
Как с этим бороться: Чет не нашёл. Посчитать моляльность по формуле.
.
Моляльность и масса
Пример:

Аналог прошлых задач с чуть другой формулой.
Как с этим бороться:
Как и в предыдущих задачах, читаем и понимаем условие. Из него видно, что b=0.4 моль/кг, mвода = 2 кг, М=120 г/моль. Предлагают найти m растворенного вещества. Проще использовать формулу
Для неё нужно n, которое может быть получено из формулы моляльности.
Преобразуем
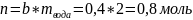
Возвращаемся к первой формуле, преобразуем, подставляем
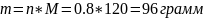
Вопросы без расчетов.
Вопросы про размерность
Пример:

Такие дела.
Как с этим бороться:
Масса — килограммы или граммы.
Объем — литры или милилитры
Плотность — г/мл
Количество вещества — моли
Массовая доля — доли единицы или % или ‰ или мг%
Молярная концентрация — моль/л или М, бывает и ммоль/л.
Моляльность — моль/кг
Массовая концентрация – г/л
Разная теоретическая фигня.
Пример:

Мда.
Как с этим бороться:
Затруднительно. Плохо поддается какой бы то ни было классификации, поэтому приведем то, что встретилось нам. Растворы — однородные гомогенные системы. Растворимость газов и твёрдых зависит от природы вещества и растворителя, температуры, наличия других растворенных веществ и, для газов еще от давления. Не зависит от объема или массы воды, массы тв., объема газа. При растворении газов — выделение теплоты. Растворимость газов — литр/литр воды, растворимость тв. — моль/литр или г/литр. Массовая доля — масса на 100 гр. раствора. Молярная концентрация — количество моль на 1 литр раствора. Моляльность — количество моль на 1 кг растворителя (не раствора). Растворимость газов увеличивается при увеличении давления.
