
- •Законы Менделя.
- •Взаимодействие аллелей одного гена.
- •Митохондриальный или цитоплазматический тип наследования
- •Генетическое значение митоза и мейоза
- •Хромосомы человека.
- •Условия выполнения законов Менделя.
- •Цитологические основы наследственности.
- •Клонирование генов.
- •Работа с микроорганизмами
- •15. Развитие представлений о гене.
- •Конъюгация - прямой контакт двух разнокачественных клеток, сопровождаемый хотя бы частичным переносом генетического материала от клетки-донора к клетке-реципиенту.
- •Трансдукция - перенос генетического материала с помощью вирусов из клетки-донора в клетку-реципиент.
- •18. Механизмы онтогенетической изменчивости.
- •20. Хромосомные перестройки.
- •21. Принципы построения генетических карт.
- •22. Матричные процессы у эукариот и прокариот.
- •23. Инбридинг и гетерозис.
- •24. Универсальные свойства генетического материала.
- •25. Генная инженерия.
- •26. Проблемы экологической генетики.
- •27. Моногенные болезни человека.
- •28. Полигибридное скрещивание.
- •29. Цитологический метод в генетике человека.
- •30. Врожденные аномалии развития.
- •2. 1952Г. Эксперимент Альфреда Херши и Марты Чейз.
- •36. Факторы генетической динамики популяции.
- •37. Повторяющиеся последовательности в геноме человека.
- •38. Оперон и его работа
- •39. Тесты на аллелизм: правила и исключения.
- •44. Сцепленное с полом наследование.
- •45. Причины отклонения от законов Менделя.
- •46. Рестрикционное картирование.
- •47. Внутригенное картирование.
- •48. Клонирование нуклеотидных последовательностей.
- •49. Полиплоидия.
- •50. Генетика количественных признаков.
- •51. Хромосомные болезни человека.
- •52. Метод родословных.
- •53. Цитологические карты человека.
- •54. Молекулярные методы идентификации личности.
- •55. Модификационная изменчивость.
- •56. Трансляция. Генетический код.
- •Генетический код, активация аминокислот
- •Транскрипция
- •Созревание рнк
- •60. Особенности генетики человека.
39. Тесты на аллелизм: правила и исключения.
Функциональный тест на аллелизм (цис-транс-тест) - метод определения принадлежности двух рецессивных аллелей (мутаций), сходных в фенотипическом выражении, к одному и тому же или разным генам.
Если обе мутации действуют на разные независимые функции (затрагивают два разных гена), то такой гибрид имеет дикий фенотип, т. к. образуется дигетерозигота, в которой нормальные аллели доминируют над мутантными. Если исследуемые мутации действуют на одну и ту же функцию (повреждают один и тот же ген), то гибрид должен иметь мутантный фенотип.
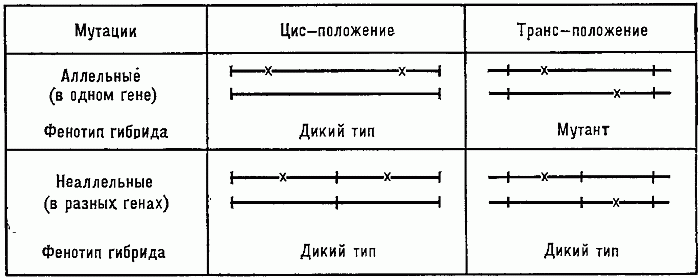
Ограничения достоверности (исключения) связаны с невозможностью анализа таким способом полярных мутаций (влияние мутации в одном гене на экспрессию другого, расположенного в том же опероне), а также с нарушающим истинную картину влиянием межаллельной комплементации. Межаллельная комплементация: в данной ситуации гомозиготный по рецессивным, но различным между собой, аллелям генотип фенотипически проявляется как гетерозиготный, то есть происходит нормальное формирование признака даже при отсутствии доминантного аллеля. Причина в том, что продукты рецессивных генов, взаимодействуя, и дополняя друг друга, формируют признак идентичный деятельности доминантного аллеля.
40. Методы работы с ДНК.
Выделение ДНК:
1. Лизис клеток (используют SDS, гуанидин, лизоцим)
2. Избавление от лишних примесей (белки, липиды и т.д.) – фенол, хлороформ, концентрированные соли
3. Преципитация ДНК– осаждение (этанол, изопропанол), преципитация на сорбент (glass milk, колонки)
4. Растворение ДНК.
Электрофорез ДНК — это аналитический метод, применяемый для разделения фрагментов ДНК по размеру. Силы ЭП заставляют фрагменты ДНК мигрировать через гель. Сахарофосфатный остов молекул ДНК заряжен отрицательно и поэтому цепи ДНК двигаются от катода, заряженного отрицательно, к положительному аноду. Более длинные молекулы мигрируют медленнее, так как задерживаются в геле, более короткие молекулы двигаются быстрее. Чтобы визуализировать ход электрофореза в процессе к образцам обычно добавляют низкомолекулярный кислый краситель.
Рестрикция ДНК. Рестриктазы, или рестрикционные эндонуклеазы, - ферменты, обладающие эндонуклеазной активностью. Длина распознаваемого участка варьирует от 4 до 12 нуклеотидов. Обнаружив эту последовательность, рестриктаза разрезает молекулу ДНК на фрагменты в местах ее локализации, называемых сайтами рестрикции. Сайты рестрикции часто используют в качестве генетических маркеров ДНК, так как образующиеся в результате рестрикции фрагменты ДНК могут быть упорядочены по длине путем электрофореза в агарозном или полиакриламидном геле в зависимости от их молекулярной массы. Зная молекулярную массу фрагментов, можно определить физическое расстояние между сайтом рестрикции и концами исходного фрагмента ДНК, что является основой метода, получившего название физического картирования.
Гибридизация ДНК— соединение in vitro комплементарных одноцепочечных НК в одну молекулу. При полной комплементарности объединение происходит легко и быстро, а в случае частичной некомплементарности слияние цепочек замедляется, что позволяет оценить степень комплементарности. Существует два вида гибридизации нуклеиновых кислот: Саузерн-блоттинг и нозерн-блоттинг (используется для исследования РНК). Оба метода используют радиоактивно-меченную одноцепочечную ДНК с известной последовательностью нуклеотидов для определения последовательности в другой одноцепочечной ДНК или РНК.
ПЦР – метод, позволяющий избирательно синтезировать большие количества определённых фрагментов ДНК. «Полимеразная» - используется фермент ДНК-полимераза. «Цепная» - состоит из повторяющихся циклов, количество ДНК с каждым циклом увеличивается в геометрической прогрессии. Компоненты: праймеры (определяют амплифицируемый участок),матрица(анализир. ДНК), буфер, полимераза(синтез ДНК), «строительный материал»( dNTP). ПЦР состоит из многократных повторений цикла, состоящего из трех этапов: 1) денатурации (плавления) двухцепочечных структур - перевод их водноцепочечную форму путем нагревания до температуры 94 °С; 2) отжига комплементарных участков ДНК с праймерами при температуре 37—68 °С; 3) синтеза последовательности, комплементарной матричной ДНК при 72 °С. Секвенирование ДНК - определение их первичной нуклеотидной последовательности . Для проведения секвенирования необходимы: секвенирующий праймер (искусственно синтезированная олигонуклеотидная последовательность, комплементарная определенному участку исходной молекулы ДНК), четыре пробирки с набором из четырех дезоксинуклеотидов dATP, dCTP, dGTP и dTTP, один из которых изотопно меченный соответственно добавляемому одному из четырех дидезоксинуклеотидов), и ДНК-полимераза.
Метод Сэнгера — метод секвенирования (определения первичной последовательности нуклеотидов молекулы нуклеиновых кислот) ДНК и РНК. Метод Сэнгера также известен как метод обрыва цепи. Метод основан на присоединении к однонитчатой секвенируемой молекуле ДНК прямого или обратного секвенирующего праймера и синтезе de novo молекулы нуклеиновой кислоты с применением dNTP. При этом синтезируются молекулы разной длины с определённым дидезоксинуклеотидом на конце. После разделения синтезированных молекул ДНК электрофорезом возможно определение первичной последовательности. В современной интерпретации, метод обрыва цепи позволяет секвенировать за один этап последовательность ДНК длиной около 800-1000 нуклеотидов.
Сам метод включает следующие этапы: 1) гибридизацию изучаемого фрагмента ДНК с праймером,2) ферментативный синтез ДНК,3) денатурацию полученных продуктов формамидом (в результате образуются уникальные различающиеся по длине олигонуклеотидные последовательности, содержащие праймер), 4) электрофорез в полиакриламидном геле на четырех дорожках (по числу типов нуклеотидов) 5) анализ результатов авторадиографически. ДНК-микрочип — это сложная технология, используемая в молекулярной биологии и медицине. ДНК-микрочип представляет собой небольшую поверхность, на которую с большой плотностью в определённом порядке нанесены фрагменты одноцепочечной синтетической ДНК с известной последовательностью. Эти фрагменты выступают в роли зондов, с которыми гибридизуются (образуют двуцепочечные молекулы) комплементарные им цепи ДНК из исследуемого образца, обычно меченные флуоресцентным красителем.
41. Уровни регуляции экспрессии гена.
Отличия эукариот от прокариот в регуляции экспрессии генов:
Три различные РНК-полимеразы
Нет оперонов
Транскрипция и трансляция разобщены во времени и пространстве
Транскрипционные комплексы
Уровни регуляции экспрессии генов в развитии:
На уровне репликации. Кольцевые молекулы ДНК, кодирующие рРНК в ооцитах Xenopus laevis. Политенные хромосомы двукрылых
На уровне хроматина. Гетерохроматин и эухроматин . Модификация гистонов: метилирование, ацетилирование.
На уровне транскрипции.
Взаимодействие транскрипционных факторов по правилу ЗК: Концентрация, Конкуренция, Кооперация
а) промоторы - 3 вида, на каждый из которых садится специфическая полимераза. РНК-полимераза I реплицирует рибосомные гены, РНК-полимераза II - структурные гены белков, РНК-полимераза III - гены, кодирующие небольшие РНК. Промоторы РНК-полимеразы I и РНК-полимеразы II находятся перед участком инициации транскрипции, промотор РНК-полимеразы III - в рамках структурного гена;
б) модуляторы - последовательности ДНК, усиливающие уровень транскрипции;
в) (энхансеры) усилители - последовательности, усиливающие уровень транскрипции и действующие независимо от своего положения относительно кодирующей части гена и состояния начальной точки синтеза РНК;
г) терминаторы - специфические последовательности, прекращающие и трансляцию, и транскрипцию.
Альтернативный сплайсинг — процесс, в ходе которого экзоны, вырезаемые из пре-мРНК, объединяются в различных комбинациях, что порождает различные формы зрелой мРНК.
На уровне сплайсинга. Из мРНК удаляются участки, не кодирующие белок (интроны) и соединяются друг с другом кодирующие аминокислотную последовательность участки — экзоны.
На уровне трансляции. Фосфорилирование факторов трансляции. Так, фактор инициации eIF2 при фосфорилировании теряет активность, а при дефосфорилировании – приобретает.
42. Кроссинговер митотический и мейотический.
Мейотический кроссинговер - процесс обмена участками гомологичных хромосом во время конъюгации в профазе I мейоза. Его удалось использовать для картирования «групп сцепления» (хромосом). Возможность картирования была основана на предположении о том, что, чем чаще наблюдается кроссинговер между двумя генами, тем дальше друг от друга расположены эти гены в группе сцепления и тем чаще будут наблюдаться отклонения от сцепленного наследования.
Митотический кроссинговер: Сущность соматического кроссинговера заключается в том, что он осуществляется при митотическом делении соматических клеток главным образом эмбриональных тканей. Кроссинговер происходит между двумя несестринскими хроматидами гомологичных хромосом.
Результат:
1)Мозаицизм - это существование в пределах одного организма генетически различающихся клеток.
2)Утрата гетерозиготности (loss of heterozygosity, LOH) - потеря функции нормального аллеля в диплоидной клетке, в которой второй аллель этого же гена уже был инактивирован. Термин используется главным образом в онкологии. При наследственной предрасположенности к раку один из аллелей гена опухолевого супрессора может быть инактиврован в зародышевой линии клеток и в таком виде передаваться по наследству. Отсутствие его функционального продукта компенсируется у гетерозигот по данному гену нормальным аллелем. Однако при повреждении функционально полноценного аллеля теряется гетерозиготность и продукт, кодируемый геном-супрессором в клетке, более не продуцируется. Это способствует процессу онкогенеза.
43. Генетические карты. (см. 21)
Генетической картой хромосом называют схему относительного расположения генов, находящихся в данной группе сцепления.
Они составлены пока лишь для некоторых наиболее изученных с генетической точки зрения объектов: дрозофилы, кукурузы, томатов, мыши, нейроспоры, кишечной палочки и др.
Генетические карты составляют для каждой пары гомологичных хромосом. Группы сцепления нумеруют. Так, например, у дрозофилы группа сцепления генов Х-хромосомы обозначена как I, две группы сцепления, соответствующие двум длинным метацентрическим (двуплечим) хромосомам,— II и III группы сцепления, наименьшая — IV.
Для того чтобы составить карты, необходимо изучить закономерности наследования большого числа генов. У дрозофилы, например, изучено около 500 генов, локализованных в 4 группах сцепления.
При составлении генетических карт указывается группа сцепления, полное или сокращенное название генов, расстояние в процентах от одного из концов хромосомы, принятого за нулевую точку, иногда обозначается место центромеры.
