
- •43. Кетоенольная таутомерия. Енолизация альдегидов и кетонов в реакциях галогенирования, изотопного обмена водорода и рацемизации оптически активных кетонов. Кислотный и основной катализ этих реакций.
- •47. Окисление альдегидов, реагенты окисления. Окисление кетонов перкислотами по Байеру Веллигеру. Диспропорционирование альдегидов по Канниццаро (прямая и перекрестная реакции)
- •Окисление кетонов перкислотами по Байеру Веллигеру
- •Диспропорционирование альдегидов по Канниццаро (прямая и перекрестная реакции)
- •Методы получения.
- •Номенклатура сложных эфиров
- •Изомерия сложных эфиров одноосновных карбоновых кислот
- •Физические свойства.
- •Химические свойства.
- •51. Галогенирование кислот по Гелю - Фольгарду - Зелинскому. Электролиз солей карбоновых кислот по Кольбе, декарбоксилирование по Хунсдиккеру.
- •54. Кетены. Получение и свойства.
- •56. Ацетоуксусный эфир и его использование в синтезе. Кетоенольная таутомерия эфиров 1,3-кетокислот и 1,3-дикетонов, амбидентный характер енолятиона.
43. Кетоенольная таутомерия. Енолизация альдегидов и кетонов в реакциях галогенирования, изотопного обмена водорода и рацемизации оптически активных кетонов. Кислотный и основной катализ этих реакций.
Таутомерия - тип изомерии, при которой происходит быстрое самопроизвольное обратимое взаимопревращение структурных изомеров - таутомеров. Процесс взаимопревращения таутомеров называется таутомеризацией.
Кетоны, которые имеют по крайней мере один α-водородный атом, подвергаются кето-енольной таутомеризации.

Для оксосоединений, имеющих атом водорода в α-положении по отношннию к карбонильной группе, существует равновесие между таутомерными формами. Для подавляющего большинства оксосоединений это равновесие смещено в сторону кето-формы. Процесс перехода кето-формы в енольную называют енолизацией . На этом основана способность таких кетонов реагировать как С-или О-нуклеофилы. Концентрация енольной формы зависит от строения кетонов и составляет (в %): 0,0025 (ацетон), 2 (циклогексанон), 80 (ацетилацетон). Скорость енолизации возрастает в присутствии кислот и оснований.

Результатом
галогенирования является замещение
водорода при a -углеродном
атоме по отношению к карбонильной
группе
Так как в этой стадии галоген не участвует, скорость реакции не зависит от природы и концентрации галогена. В то же время чувствительность реакции к ускорению кислотами и основаниями является признаком кето-енольной таутомерии.
В
результате введения в a -положение
карбонильного соединения электроноакцепторного
атома галогена, следующий атом водорода
при a -углеродном
атоме приобретает более высокую
кислотность. Поэтому образующиеся
моногалогенпроизводные реагируют
быстрее в системе последовательных
реакций и реакцию трудно остановить на
стадии образования моногалогенпроизводного
в условиях основного катализа. Чтобы
решить задачу получения моногалогенкарбонильного
соединения реакцию необходимо проводить
в условиях кислотного катализа.
Если объектом галогенирования является метилкетон или ацетальдегид, то из-за активирующего действия галогенов-заместителей на последующее галогенирование быстро образуется a ,a ,a -тригалогенпроизводное, которое легко расщепляется основанием:

Приведенная последовательность реакций называется галоформной реакцией, поскольку в результате ее образуется хлороформ, бромоформ или иодоформ в зависимости от галогена, используемого при галогенировании. Галоформная реакция служит удобной качественной пробой на присутствие кетонов, особенно в случае иодирования, так как иодоформ представляет собой плохо растворимое вещество ярко-желтого цвета. Реакция оказывается удобной для синтеза карбоновых кислот в тех случаях, когда метилкетон более доступен, чем другие реагенты для синтеза кислот.
Реакции изотопного обмена Обмен водорода при а-углеродных атомах карбонильных соединениях на дейтерий под действием тяжелой воды может быть представлен стехиометрическим уравнением
![]()
Эта реакция катализируется кислотами и основаниями. Кислотно-каталитическая реакция предполагает ключевую роль енольной формы карбонильного соединения

Первичная реакция изотопного обмена может сопровождаться последующим дейтерированием, если при a -углеродном атоме остаются незамещенные атомы водорода.
Катализ изотопного обмена основаниями протекает через следующие стадии

Рацемизация оптически активных кетонов
![]() Рацемизация
таких оптически активных соединений
катализируется кислотами и основаниями.
Основно-каталитическая рацемизация
может быть легко обоснована образованием
карбаниона при отрыве протона основанием
от хлорального углеродного атома.
Рацемизация
таких оптически активных соединений
катализируется кислотами и основаниями.
Основно-каталитическая рацемизация
может быть легко обоснована образованием
карбаниона при отрыве протона основанием
от хлорального углеродного атома.
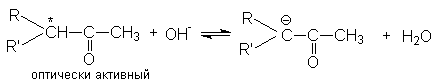
Поскольку оптически активный карбанион имеет плоское строение последующая атака воды при ее протолитическом взаимодействии с a -углеродным атомом равновероятна с противоположных сторон и поэтому дает рацемическую смесь.

Кислотно-каталитическая рацемизация приводит к образованию енольной формы кетона, в которой хиральность атома углерода утрачивается, поэтому обратная реакция образования кето-формы дает рацемическую смесь.
44. Кетоенольная таутомерия кетонов, 1,3-дикетонов и 1,3-кетоэфиров. Влияние структурных факторов и природы растворителя на положение кетоенольного равновесия и зависимость его от соотношения СН и ОН кислотности кетона и енола. Двойственная реакционная способность енолятионов. Интерпретация данных в рамках принципа ЖМКО. Алкилирование и ацилирование енаминов.


Алкилирование и ацилирование енаминов.
а) Алкилирование
Алкилирование енаминов алкилгалогенидами и другими алкилирующими реагентами протекает, как правило, по b -углеродному атому. Последующий гидролиз иммониевой соли приводит к карбонильному соединению.
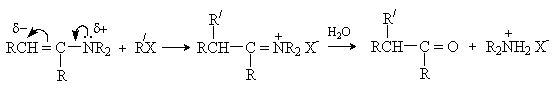
Последовательность превращений – получение енамина из карбонильного соединения, алкилирование, гидролиз приводит к алкилированию исходного карбонильного соединения по a -положению и носит название реакция Сторка. Этот метод имеет преимущества перед алкилированием кетонов, так как требует более мягких условий и дает в основном продукты моноалкилирования.
Для проведения этой реакции чаще всего используют циклические амины – пирролидин, пиперидин, морфолин. Лучшие результаты достигаются при использовании активных галогенидов – аллил- и бензилгалогенидов, a -галогензамещенных производных простых и сложных эфиров. Например:

б) Ацилирование
При действии галогенангидридов и ангидридов кислот енамины дают продукты С-ацилирования. Последующий гидролиз приводит к дикарбонильному соединению.

Таким образом, последовательность реакция – получение енамина из карбонильного соединения, ацилирование, гидролиз – метод получения b -дикарбонильных соединений. Например:


45. Альдольно-кротоновая конденсация альдегидов и кетонов в кислой и щелочной среде, механизм реакций. Направленная альдольная конденсация разноименных альдегидов с использованием литиевых, борных енолятов и кремниевых эфиров енолов. Конденсация альдегидов и кетонов с малоновым эфиром и другими соединениями с активной метиленовой группой. Аминометилирование альдегидов и кетонов (Манних). Бензоиновая конденсация.
В альдольно-кротоновой конденсации карбонильными компонентами могут быть любые альдегиды и кетоны, а метиленовыми — альдегиды и кетоны, имеющие хотя бы один a-водородный атом. Таким образом, метиленовыми компонентами обычно не могут быть такие карбонильные соединения, как формальдегид, бензальдегид или триметилуксусный (пивалиновый) альдегид.

В качестве катализаторов альдольно-кротоновых конденсаций обычно применяют водные растворы едких щелочей; реже реакцию проводят в присутствии более слабых оснований — Ca(OH)2, Ba(OH)2, KHCO3, аминов. В некоторых случаях кротоновая конденсация катализируется минеральными кислотами.
Альдольно-кротоновые конденсации являются обратимыми реакциями.
Механизм реакции:
в щелочной среде:
В щелочной среде альдольная конденсация протекает по механизму нуклеофильного присоединения. Под влиянием основания (катализатора) от a-углеродного атома метиленового компонента (1) отщепляется протон, что приводит к его активированию: он превращается в сильный нуклеофильный реагент — анион (2), стабилизированный делокализацией отрицательного заряда. Активированный метиленовый компонент (2) атакует карбонильный углерод второй молекулы альдегида — карбонильного компонента (3). Это приводит к образованию аниона (4), при протонировании которого получается альдоль (5):

При нагревании альдоля может отщепляться вода: это приводит к образованию a,b-непредельного альдегида; в простейшем случае при конденсации уксусного альдегида получается кротоновый альдегид:

Реакцию конденсации альдегидов (кетонов), приводящую к образованию a,b-непредельных карбонильных соединений, называют кротоновой конденсацией.Следует отметить, что кротоновый альдегид может и дальше присоединять карбанион с последующей дегидратацией и т.д. Именно так получают низкомолекулярные полимеры при нагревании простых алифатических альдегидов с водным раствором NaOH. Чтобы остановить реакцию на стадии получения альдоля в качестве катализатора лучше использовать основную ионообменную смолу.
в кислой среде:
В кислой среде альдольная и кротоновая конденсация протекает по иному механизму. Если в щелочной среде катализатор активирует метиленовый компонент, то в кислой — карбонильный (1). Кроме того, в кислой среде метиленовый компонент превращается в енол (2):


Протонирование карбонильной группы облегчает отрыв протона от a-углеродного атома. Активированный карбонильный компонент (1) реагирует с енольной формой метиленового компонента (2):

46. Восстановление альдегидов и кетонов до спиртов, реагенты восстановления; восстановление С=О группы до СН2группы: реакции Кижнера Вольфа и Клемменсена. Ионрадикальная димеризация альдегидов и кетонов.
1. Каталитическое гидрирование
Для восстановления карбонильных соединений водородом подходят многие металлические катализаторы. Наиболее эффективны платина и активные сорта скелетного никеля.

При частичном гидрировании ,-непредельных альдегидов и кетонов реагирует только связь С=С:

При полном гидрировании (2 моль водорода) , -непредельных альдегидов и кетонов на никеле Ренея образуется предельный спирт.
2. Восстановление комплексными гидридами металлов
Алюмогидрид лития и боргидрид натрия восстанавливают алифатические альдегиды и кетоны соответственно до первичных и вторичных спиртов. Метод часто применяется в лабораторной практике
 Комплексный
ион AlH4 - выступает в роли переносчика
гидрид-иона, который является нуклеофильным
агентом по отношению к карбонильному
атому углерода:
Комплексный
ион AlH4 - выступает в роли переносчика
гидрид-иона, который является нуклеофильным
агентом по отношению к карбонильному
атому углерода:

В случае ,-непредельных альдегидов и кетонов эти реагенты восстанавливают преимущественно карбонильную группу:

3.Восстановление по Клемменсену
При действии на альдегиды и кетоны амальгамированного цинка в соляной кислоте происходит их восстановление до углеводородов (метод Клемменсена)

Многие α-замещенные кетоны в условиях реакции Клемменсена претерпевают восстановительное отщепление заместителя:

Метод Клемменсена даѐт хорошие выходы углеводородов при восстановлении многих альдегидов, алифатических и жирноароматических кетонов.
4.Восстановление по Кижнеру-Вольфу
Если альдегиды и кетоны неустойчивы в кислой среде, то восстановление проводят по методу Кижнера-Вольфа.

Метод применим как к альдегидам, так и кетонам, но в случае альдегидов выходы продуктов реакции не всегда оказываются удовлетворительными. Механизм процесса:

5.Восстановление в присутствии алкоголятов металлов

6.Перекрестная реакция Канниццаро

