
- •Адипоцити жирової тканини та їх роль в обміні ліпідів і біоенергетичних процесах в організмі.
- •Біосинтез триацилгліцеролів. Біосинтез фосфогліцеридів. Ферментативні реакції, значення фосфатидної кислоти.
- •2. Окислення гліцину до діоксиду вуглецю та аміаку: 3. Зворотне перетворення гліцину до серину:
- •Обмін триптофану: кінуреніновий та серотоніновий шлях.
- •Катаболізм піримідинових нуклеотидів; метаболізм продуктів їх розпаду.
- •Молекулярні основи біоелектричних процесів на мембранах нейронів.
- •Патобіохімія гіпертонічної хвороби. Зміни біохімічних показників на різних стадіях гіпертонічної хвороби та їх оцінка. Симптоматичні артеріальні гіпертензії.
- •Регуляція процесів травлення гормонами геп-системи.
- •Антианемічні вітаміни (в12, фолієва кислота), їх будова, участь коферментів у обміні речовин, джерела для людини, добова потреба, ознаки гіповітамінозу, застосування у медицині.
Патобіохімія гіпертонічної хвороби. Зміни біохімічних показників на різних стадіях гіпертонічної хвороби та їх оцінка. Симптоматичні артеріальні гіпертензії.
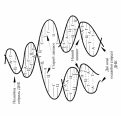
Пояснити
механізм утворення подвійної спіралі
ДНК.
Модель
подвійної спіралі ДНК, запропонованої
в 1953 році Дж. Уотсоном
та Ф. Кріком, не тільки описує структуру
ДНК, але й показує механізм подвоєння
– реплікацію ДНК – рівний розподіл
між дочірніми клітинами генетичного
матеріалу, що має важливе біологічне
значення у процесі збереження і передачі
генетичної інформації.
За
участю ДНК відбувається утворення
білків, які є матеріальною основою
життєвих процесів. Інформація, що
визначає особливості структури білків,
закодована в ДНК і передається в ряді
поколінь її молекулами. Процес перенесення
генетичної інформації (однієї з форм
біологічної пам’яті) є визначальним
і дуже важливим для розвитку та нормальної
життєдіяльності клітин організму.
Оскільки нуклеотидні послідовності
двох ланцюгів молекули ДНК комплементарні,
то після розділення ланцюгів материнської
молекули кожний з них служить матрицею
для біосинтезу комплементарного
дочірнього ланцюга.
При
поділі клітини подвійна спіраль ДНК
розкручується і розподіляється на два
ланцюги. На кожному ланцюзі, як на
матриці, проходить біосинтез нового
ланцюга ДНК з врахуванням
принципу комплементарності(рис.8.1).Утворений
полінуклеотидний ланцюг не ідентичний,
але комплементарний вихідній матриці.
У результаті утворюються дві нові
подвійні спіралі, кожна з яких включає
один старий (материнський) і один новий
- синтезований (дочірний) ланцюг. Такий
процес точного копіювання молекули
ДНК, в результаті якого утворюються
дві однакові двоспіральні молекули,
називається реплікацією.
Таким чином, спадкові ознакизберігаються
в поколіннях. Реалізація генетичної
інформації здійснюється за рахунок
передачі закодованої в ДНК інформації
молекулам мРНК (транскрипції) та
подальшого розшифрування цієї інформації
при синтезі білка (трансляції).
Пояснити механізм утворення шпильок в молекулі тРНК. Вторинна структура одноланцюгових поліри- бонуклеотидів еукаріотів характеризується наяв- ністю ділянок, що мають двоспіральну структуру. Ці ділянки молекул РНК (так звані “шпильки”) утво- рюються за рахунок згинів полірибонуклеотидного ланцюга та взаємодії між собою комплементарних азотистих основ (А–У та Г–Ц) у межах одного ланцюга. Такі спіралізовані ділянки містять 20-30 нук- леотидних пар і чергуються з неспіралізованими фрагментами РНК
Потреби
організму людини в поживних речовинах
– вуглеводах, ліпідах, білках. Енергетична
цінність основних поживних речовин.
Раціональне харчування. Азотистий
баланс організму. Вміст поживних речовин
у поширених продуктах харчування.
До
складу раціону харчування здорової
людини повинні входити, насамперед,
поживні сполуки, що виконують енергетичну,
структурну (пластичну) функції або
необхідні для функціонування певних
ферментних систем, входячи до їх складу.
Поживні сполуки (нутрієнти), що входять
як складові компоненти до нормального
харчування людини, поділяються на: –
макрокомпоненти — вуглеводи, жири,
білки; – мікрокомпоненти — вітаміни
і неорганічні елементи, що потрібні
для життєдіяльності в незначних
кількостях (звичайно, менше 1 г/добу).
Вуглеводи, жири (нейтральні жири) та
білки, що надходять в організм із їжею,
в шлунково-кишковому тракті розщеплюються
до глюкози (яка утворюється, в основному,
з крохмалю їжі) та деяких інших
моносахаридів, гліцеролу, жирних кислот,
амінокислот та пептидів, які всмоктуються
в травному каналі і надходять у кров.
Вуглеводи та жири (і, відповідно, продукти
їх травлення) мають енергетичну функцію,
забезпечуючи добову потребу організму
людини в макроергічних фосфатах
(головним чином, АТФ) та відновних
еквівалентах. Білки (та амінокислоти,
що з них утворюються) також виконують
певну енергетичну роль, але більшість
амінокислот (переважно, незамінні
амінокислоти) використовуються для
побудови власних біомолекул та
структурних елементів організму. Значну
енергетичну цінність має також етанол,
що в певних умовах може бути суттєвим
компонентом раціону.Здорова доросла
людина знаходиться в умовах енергетичної
рівноваги, тобто споживання енергетичних
матеріалів з продуктами харчування
повинно дорівнювити витратам енергії
в процесах життєдіяльності. У зв’язку
з цією обставиною, нормування харчового
раціону людини грунтується на: а)
індивідуальних витратах енергії певним
організмом; б) зазначеній вище енергетичній
цінності поживних сполук. Індивідуальні
енергетичні витрати людини визначаються
такими фізіологічними факторами: –
основним обміном, тобто витратами
енергії на підтримання основних
фізіологічних функцій організму в
умовах спокою; – фізичною активністю,
що найбільш суттєво впливає на показники
енергетичного обміну; так, зокрема,
коливання енерговитрат у стані спокою
та максимальної фізичної активності
у спортсменів досягають 10-кратних
значень; – температурою навколишнього
середовища, яка впливає на характер
енерговитрат, що спрямовані на зігрівання
або охолодження організму.
 Вуглеводи
є головним джерелом енергії в харчуванні
людини. Добова потреба організму
здорової людини у вуглеводах дорівнює
в середньому 450-500 г. Враховуючи енергетичну
цінність вуглеводів (табл. 26.1), така
кількість вуглеводів відповідає
приблизно 70 (65-75) % потреб у добовій
калорійності продуктів харчування.
Нейтральні
жири (жири) — друге за вуглеводами
джерело енергії в харчовому раціоні
людини, яке отримують, в основному, з
тваринними продуктами харчування.
Потреба в харчових жирах складає в
середньому 60-90 г/добу, що забезпечує
близько 30 (від 25 до 35) % потреб у добовій
калорійності для дорослої людини.
Білки
— поживні речовини, які мають насамперед
пластичну цінність для організму
людини; амінокислоти, що входять до їх
складу, є джерелом для побудови клітинних
та тканинних білків власних біоструктур
— рис. 26.1. Енергетичне значення білків
в умовах нормального харчування
невелике; при достатній забезпеченості
вуглеводами та жирами безазотисті
залишки амінокислот використовуються
в загальному пулі метаболічного палива
незначною мірою. Для визначення потреби
організму людини в білках користуються
поняттям азотистої рівноваги, яка
визначається як стан, при якому кількість
азоту, що надходить в організм (в
основному, у складі білкових компонентів
продуктів харчування) дорівнює кількості
азоту, що виділяється з організму
(головним чином, у вигляді сечовини та
солей амонію).
Вуглеводи
є головним джерелом енергії в харчуванні
людини. Добова потреба організму
здорової людини у вуглеводах дорівнює
в середньому 450-500 г. Враховуючи енергетичну
цінність вуглеводів (табл. 26.1), така
кількість вуглеводів відповідає
приблизно 70 (65-75) % потреб у добовій
калорійності продуктів харчування.
Нейтральні
жири (жири) — друге за вуглеводами
джерело енергії в харчовому раціоні
людини, яке отримують, в основному, з
тваринними продуктами харчування.
Потреба в харчових жирах складає в
середньому 60-90 г/добу, що забезпечує
близько 30 (від 25 до 35) % потреб у добовій
калорійності для дорослої людини.
Білки
— поживні речовини, які мають насамперед
пластичну цінність для організму
людини; амінокислоти, що входять до їх
складу, є джерелом для побудови клітинних
та тканинних білків власних біоструктур
— рис. 26.1. Енергетичне значення білків
в умовах нормального харчування
невелике; при достатній забезпеченості
вуглеводами та жирами безазотисті
залишки амінокислот використовуються
в загальному пулі метаболічного палива
незначною мірою. Для визначення потреби
організму людини в білках користуються
поняттям азотистої рівноваги, яка
визначається як стан, при якому кількість
азоту, що надходить в організм (в
основному, у складі білкових компонентів
продуктів харчування) дорівнює кількості
азоту, що виділяється з організму
(головним чином, у вигляді сечовини та
солей амонію).

Характеристика процесу травлення в шлунку: механізм активації та специфічність дії ферментів (пепсин, гастриксин, ренін). Біохімічні аспекти активування та стимуляції виділення ферментів. Основні процеси травлення поживних речовин їжі відбуваються в шлунку — розщеплення білків до пептидних молекул та в різних відділах тонкого кишечника — розщеплення пептидів, вуглеводів, жирів (ліпідів). Шлунок виробляє власні протеолітичні ферменти (пепсиноген, ренін); кишечник (залози Брунера та Ліберкюна) синтезує деякі пептидази, дисахаридази, фосфоліпази та полінуклеотидази. Травлення в кишечнику неможливе без участі гідролітичних ферментів, які надходять сюди з підшлункової залози — протеаз (трипсину, хімотрипсину, еластази), карбоксипептидази, амілаз, ліпаз. Пепсин — протеаза з м.м. 42 кД, що синтезується головними клітинами слизової оболонки шлунка у вигляді проферменту пепсиногену (м.м. 35 кД). За механізмом дії пепсин є ендопептидазою, що специфічно атакує пептидні зв’язки, в утворенні яких беруть участь залишки ароматичних (фенілаланіну, тирозину), а також дикарбонових (глутамату, аспартату) амінокислот. Під дією пепсину білки розшеплюються на великі поліпептидні фрагменти — пептони, гідроліз яких завершується в тонкій кишці. Реннін (хімозин, сичужний фермент) — протеаза, що міститься в шлунковому соку новонароджених дітей. Реннін є ферментом, який за участю іонів Са2+ спричиняє перетворення розчинних білків молока — казеїнів у нерозчинні — параказеїни, які підлягають протеолітичній дії пепсину (“створожування молока”).
Механізм утворення та роль хлоридної кислоти. Кислотність шлункового соку та форми її вираження; кількісні показники в нормі та за умов патології (за методом рН-метрії). Шлунковий сік, під дією якого відбувається гідроліз білків, — це кисла рідина з рН 1,5-2,5. Основними біохімічними компонентами шлункового соку, що беруть участь в перетворенні білків продуктів харчування, є соляна кислота та протеолітичний фермент пепсин. Крім того, до складу шлункового соку входять кислі фосфати (переважно NaH2PO4) та деякі органічні кислоти, складаючи загальну кислотність шлунка. Соляна кислота виробляється в спеціальних обкладинних (оксинтних) клітинах слизової оболонки шлунка за участю хлоридів, які надходять із крові. Донором протонів, необхідних для утворення HCl, є вугільна кислота, що утворюється з Н2О та СО2 за участю карбоангідрази: Секреція іонів Н+ в порожнину шлунка відбувається при дії протонної помпи мембран оксинтних клітин — Н+, К+-АТФази (рис. 26.2). Концентрація HCl у шлунковому соку складає 0,45-0,60 %. Соляна кислота необхідна для утворення активного ферменту пепсину і прояву максимуму його каталітичної активності.

Травлення
білків у тонкій кишці: протеолітичні
ферменти підшлункової залози та тонкої
кишки, механізм їх активування та
специфічність дії. Механізми всмоктування
продуктів гідролізу білків. Частково
перетравлена напіврідка маса поживних
сполук, що утворюється в шлунку (хімус)
періодично надходить через пілоричний
клапан у дванадцятипалу кишку. В
цю ж частину травного каналу надходять
із підшлункової залози протеолітичні
ферменти та пептидази, які діють на
пептиди, що надходять зі шлунка.
Каталітична дія цих ферментів відбувається
в слабколужному середовищі (рН 7,5-8,0),
яке утворюється наявними в кишковому
соку бікарбонатами NaHCO3. Більшість
ферментів протеолітичної дії, що
функціонують у тонкій кишці, синтезуються
в екзокринних клітинах підшлункової
залози у вигляді проферментів, які
активуються після їх надходження в
дванадцятипалу кишку (трипсиноген,
хімотрипсиноген, проеластаза,
прокарбоксипептидази А і В). Гідроліз
білків та пептидів, що надходять із
шлунка, відбувається як у порожнині
тонкої кишки, так і на поверхні ентероцитів
— пристінкове, або мембранне травлення.
Трипсин — протеолітичний фермент з
м.м. 24,7 кД, що утворюється в порожнині
кишечника з неактивного проферменту
трипсиногену під дією ентерокінази,
яка відщеплює від молекули проферменту
N-кінцевий гексапептид з утворенням
каталітично активного трипсину:![]() Трипсин
є ендопептидазою, яка найбільш активна
відносно пептидних зв’язків, утворених
основними амінокислотами аргініном
та лізином. Хімотрипсин — протеолітичний
фермент (м.м. 29 кД), який утворюється з
проферменту хімотрипсиногену за
каталітичної дії трипсину, що відщеплює
від молекули проферменту декілька
інгібіторних пептидів
Трипсин
є ендопептидазою, яка найбільш активна
відносно пептидних зв’язків, утворених
основними амінокислотами аргініном
та лізином. Хімотрипсин — протеолітичний
фермент (м.м. 29 кД), який утворюється з
проферменту хімотрипсиногену за
каталітичної дії трипсину, що відщеплює
від молекули проферменту декілька
інгібіторних пептидів![]() Хімотрипсин
є ендопептидазою, яка розщеплює до 50 %
пептидних зв’язків в молекулах білків
та пептидів їжі, в тому числі зв’язків,
нечутливих до дії пепсину та трипсину.
Еластаза — ендопептидаза, що також має
широку субстратну специфічність,
розщеплюючи пептидні за’язки, що
утворюються залишками амінокислот
малого розміру — гліцину, аланіну,
серину. Утворені при дії зазначених
вище ендопептидаз короткі пептиди
підлягають дії екзопептидаз кишечника
— карбоксипептидаз А і В, амінопептидаз
та дипептидаз. Карбоксипептидази —
пептидази, що гідролізують пептидні
зв’язки, утворені С-кінцевими
амінокислотами: карбоксипептидаза А
відщеплює від С-кінця амінокислоти з
гідрофобними радикалами, а карбоксипептидаза
В — С-кінцеві залишки лізину й аргініну.
Амінопептидази — ферменти ентероцитів,
що відщеплюють від коротких пептидів
N-кінцеві амінокислотні залишки.
Дипептидази — пептидогідролази, що
розщеплюють дипептиди до вільних
амінокислот. Послідовна дія всього
набору шлункових, панкреатичних і
кишечних пептидогідролаз забезпечує
повне розщеплення білків та пептидів
продуктів харчування до амінокислот.
У кровотік слизовою оболонкою кишечника
всмоктуються тільки вільні амінокислоти.
Хімотрипсин
є ендопептидазою, яка розщеплює до 50 %
пептидних зв’язків в молекулах білків
та пептидів їжі, в тому числі зв’язків,
нечутливих до дії пепсину та трипсину.
Еластаза — ендопептидаза, що також має
широку субстратну специфічність,
розщеплюючи пептидні за’язки, що
утворюються залишками амінокислот
малого розміру — гліцину, аланіну,
серину. Утворені при дії зазначених
вище ендопептидаз короткі пептиди
підлягають дії екзопептидаз кишечника
— карбоксипептидаз А і В, амінопептидаз
та дипептидаз. Карбоксипептидази —
пептидази, що гідролізують пептидні
зв’язки, утворені С-кінцевими
амінокислотами: карбоксипептидаза А
відщеплює від С-кінця амінокислоти з
гідрофобними радикалами, а карбоксипептидаза
В — С-кінцеві залишки лізину й аргініну.
Амінопептидази — ферменти ентероцитів,
що відщеплюють від коротких пептидів
N-кінцеві амінокислотні залишки.
Дипептидази — пептидогідролази, що
розщеплюють дипептиди до вільних
амінокислот. Послідовна дія всього
набору шлункових, панкреатичних і
кишечних пептидогідролаз забезпечує
повне розщеплення білків та пептидів
продуктів харчування до амінокислот.
У кровотік слизовою оболонкою кишечника
всмоктуються тільки вільні амінокислоти.
Характеристика
процесів гниття білків у товстій кишці.
У процесі перетравлювання у шлунку і
тонкому кишечнику основна маса білків
розщеплюється і всмоктується переважно
у вигляді амінокислот. Проте частина
білків сухожиль, апоневрозів шкіри,
які важко перетравлюються, і деяка
кількість вільних амінокислот надходять
у товсту кишку.
При багатьох захворюваннях, особливо
у разі кишкових інфекцій, перетравлювання
і всмоктуваня білків погіршується,
тому більшість їх потрапляє у товстий
кишечник. Залежно від кількості харчових
продуктів і стану апарату травлення
кількість нерозщеплених білків може
складати від 2-3 до 5-10\%, а іноді й більше.
Товстий
кишечник населений мікроорганізмами,
які використовують харчові амінокислоти
для свого росту. Вони мають ферментні
системи, що каталізують різноманітні
перетворення харчових білків і вільних
амінокислот (гідроліз, окислення,
відновлення, дезамінування,
декарбоксилювання, деметилювання).
Через це в товстому кишечнику створюються
оптимальні умови для утворення отруйних
продуктів розпаду амінокислот, зокрема
фенолу, індолу, крезолу, скатолу,
сірководню, метилмеркаптану, а також
нетоксичних для організму сполук -
спиртів, жирних кислот, кетокислот,
гідроксикислот та ін. Усі ці перетворення
амінокислот, які зумовлені діяльністю
мікроорганізмів кишечника, одержали
загальну назву: гниття білків у кишечнику.
У процесі поступового і глибокого
розпаду сірковмісних амінокислот
(цистину, цистеїну і метіоніну) в
кишечнику утворюються сірководень
(H2S)
і метилмеркаптан (CH3SH).
Диамінокислоти зазнають процесу
декарбоксилювання з утворенням амінів.
Два з них - путресцин і кадаверин - давно
відомі через їх неприємний запах.
Путресцин (putrificatio
- гниття, лат.) - утворюється при
декарбоксилюванні орнітину, а кадаверин
(cadaver
- труп, лат.) - при декарбоксилюванні
лізину. Путресцин
може утворюватися й іншим шляхом, а
саме: внаслідок декарбоксилювання
аргініну, з утворенням агматину. Останній
перетворюється на путресцин у ході
реакції, котра каталізується
аг-матинуреагідролазою, яку також
містить кишкова паличка.
Агматин
є біологічно активним диаміном. Він
здатний викликати зниження вмісту
цукру в крові. Путресцин і кадаверин,
ймовірніше за все, знешкоджуються в
клітинах слизової оболонки кишечника
під впливом специфічних диаміно-оксидаз,
після чого легко всмоктуються в кров
і виділяються з сечею. Із циклічних
амінокислот тирозину і триптофану за
послідовного руйнування їх бічного
ланцюга в результаті реакції
декарбок-силювання, дезамінування, а
потім і деметилювання утворюються
токсичні продукти: крезол і фенол - із
тирозину, скатол та індол - із триптофану.



Травлення ліпідів у травному тракті. Специфічність дії ліполітичних ферментів, роль жовчних кислот у травленні ліпідів. Особливості всмоктування продуктів гідролізу ліпідів. Перетравлення ліпідів харчових продуктів здійснюється в дванадцятипалій кишці під впливом ферментів, що синтезуються в неактивній формі в екзокринних клітинах підшлункової залози, а саме — ліпази, фосфоліпази А2, холестеролестерази та власних ферментів кишечника. 1. Гідроліз нейтральних жирів відбувається за рахунок дії ліпази підшлункової залози. Панкреатична ліпаза специфічна до складноефірних зв’язків в положеннях 1 та 3 триацилгліцеролів, тому продуктами дії ферменту є вільні жирні кислоти та 2-моноацилгліцерол: Активне функціонування панкреатичної ліпази реалізується за умов оптимальної лужності (рН панкреатичного секрету = 7,5-8,0) та наявності амфіпатичних молекул жовчних кислот (головним чином — глікохолевої і таурохолевої), які необхідні для емульгування харчових жирів і утворення міцел триацилгліцеролів. Процес взаємодії ферментного білка ліпази з поверхнею розподілу фаз у системі жовчнокисла сіль/триацилгліцерол потребує також наявності додаткового фактора — білка коліпази, який міститься в секреті підшлункової залози. Крім емульгування харчових жирів, що є передумовою дії панкреатичної ліпази, жовчні кислоти беруть також участь у формуванні і всмоктуванні міцелярних структур (вільні жирні кислоти, моногліцериди), що формуються після гідролізу триацилгліцеролів. Основна маса жовчних кислот (9095 % їх загальної кількості) всмоктується з кров’ю v. porta в нижніх відділах тонкї кишки і надходить у печінку, де повторно використовується для формування жовчі — процес ентерогепатичної циркуляції. Таким чином, з каловими масами щодобово виводиться лише до 0,5 г жовчних кислот; їх втрата компенсується за рахунок синтезу в гепатоцитах нових молекул первинних жовчних кислот (холевої та хенодезоксихолевої) з холестерину. 2. Гідроліз фосфоліпідів (гліцерофосфоліпідів) каталізується фосфоліпазою А2, яка синтезується в підшлунковій залозі у вигляді проферменту та перетворюється в активну форму шляхом триптичного гідролізу певних пептидних зв’язків у молекулі каталітично неактивного білка. Панкреатична фосфоліпаза А2 гідролізує складноефірні зв’язки в положенні 2 фосфогліцеридів з утворенням лізофосфоліпідів. Інші фосфоліпази, що містяться в кишковому соку, розщеплюють гліцерофосфоліпіди до гліцерину, вищих жирних кислот, азотистих основ та фосфорної кислоти: 3. Гідроліз ефірів холестерину відбувається під дією холестеролестерази (гідролази холестерилових ефірів) з утворенням холестеролу, який всмоктується ентероцитами у вільній формі. У результаті розглянутих біохімічних процесів, що відбуваються з харчовими ліпідами в порожнині кишечника, утворюється складна суміш продуктів, основними компонентами якої є: – вільні вищі жирні кислоти (у вигляді Nа+ та К+-солей); – 2-моноацилгліцероли; – вільний (неетерифікований) холестерин; – продукти гідролізу гліцерофосфоліпідів (гліцерин, аміноспирти, солі фосфорної кислоти); – триацилгліцероли, що містять залишки коротколанцюгових (переважно С8-С10) жирних кислот. Такі триацилгліцероли складають до 10 % від загальної кількості нейтральних жирів їжі; вони можуть всмоктуватися епітелієм слизової оболонки тонкої кишки в негідролізованій формі \і розщеплюються до гліцерину та жирних кислот всередині ентероцитів. Всмоктування продуктів перетравлення ліпідів Складна суміш продуктів гідролізу ліпідів, зазначена вище, утворює ліпідні міцели, які можуть абсорбуватися слизовою оболонкою кишечника, і практично всі жири харчових продуктів надходять до грудної лімфатичної протоки завдяки всмоктуванню цих міцел. Проникнення ліпідних міцел всередину ентероцитів відбувається шляхом піноцитозу або дифузії окремих ліпідних молекул через апікальну мембрану клітин.

Травлення вуглеводів у травному тракті. Гліколітичні ферменти. Механізм всмоктування вуглеводів у травному тракті. Основні реакції розщеплення вуглеводів відбуваються в тонкому кишечнику за рахунок дії ферментів підшлункової залози, що потрапляють у порожнину дванадцятипалої кишки, і власних ферментів кишкового соку. Подібно до перетворення білків та пептидів, поряд з порожнинним травленням, у кишечнику відбувається пристінкове (на поверхні мембран ентероцитів) травлення вуглеводів. Амілази, що діють у кишечнику — це ферменти α-амілаза (переважно) та β-амілаза, які синтезуються в підшлунковій залозі. Панкреатична α-амілаза — це ендоглікозидаза, подібна до ферменту слини, яка гідролізує крохмаль та глікоген з утворенням суміші розгалужених і нерозгалужених олігосахаридів і деякої кількості мальтози і мальтотріози. β-Амілаза — панкреатична екзоглікозидаза, яка відщеплює від нерозгалужених гомополісахаридних ланцюгів залишки мальтози. Дисахариди та олігосахаридази — ферменти, що синтезуються в тонкій кишці і спричиняють розщеплення до моносахаридів відповідних цукрів, які утворюються як продукти дії амілаз або надходять до травного каналу в складі рослинних продуктів харчування: мальтаза, лактаза, сахараза.
