
- •1) Типы химических связей в органических соединениях
- •2)Виды изомерии в органических соединениях
- •3)Предельные углеводороды, их химические свойства.
- •4)Получение алканов.
- •5)Галогенопроизводные углеводородов
- •6)Алкены и их химические свойства.
- •7)Диеновые углеводороды. Особенности реакции присоединения в зависимости от положения двойных связей.
- •8)Алкины. Ацетилен и его химические свойства.
- •9)Получение непредельных углеводородов.
- •10)Качественные реакции на двойную, тройную связь.
- •11)Ароматические соединения. Бензол и его химические свойства
- •12)Гомологи бензола. Получения и свойства.
- •13)Особенности замещения в бензольном кольце. Правило ориентации второго заместителя
- •14)Спирты одноатомные и многоатомные. Первичные, вторичные и третичные спирты. Получение спиртов.
- •15)Химические свойства спиртов.
- •16)Двухатомные и трёхатомные спирты.
- •1 7)Фенолы и их свойства.
- •18)Получение фенолов. Кислотные свойства фенолов
- •19)Альдегиды и их химические свойства.
- •20)Получение альдегидов.
- •21)Полимеризация и конденсация альдегидов.
- •22)Кетоны. Получение и химические свойства.
- •23)Общность и различие химических свойств альдегидов и кетонов.
- •24Одноосновные карбоновые кислоты. Способы получения кислот.
- •25)Химические свойства одноосновных предельных кислот.
- •26)Непредельные кислоты и их химические свойства.
- •27)Дикарбоновые кислоты.
- •28)Гидроксикислоты. Их химические свойства. Оптическая изомерия.
- •29)Кетокислоты. Кето — енольная таутометрия.
- •30)Высшие предельные и непредельные жирные кислоты. Понятие о незаменимых кислотах.
- •31)Получение простых эфиров и сложных эфиров.
- •32)Строение триглицерида. Омыление жира. Гидрогенизация жира. Прогоркание жира. Мыла растворимые и нерастворимые.
- •33)Фосфолипиды Строение серинфосфатида, лецитина и кефалина.
- •34)Стерина и стериды. Химическая структура холестерола.
- •35)Использование магнийорганических соединений для получения различных органических соединений.
- •36)Пентозы. Строение рибозы, дезоксирибозы, ксилозы и арабинозы.
- •37)Гексозы. Строение глюкозы, галактозы, маннозы, фруктозы.
- •38)Циклическое строение моносахаридов.
- •39)Понятие об ассиметрическом атоме углерода. Зеркальная изомерия.
- •40)Восстанавливающие и невосстанавливающие!! дисахариды.
- •41)Полисахариды. Схема строения крахмала и клетчатки.
- •42)Химические свойства моносахаров.
- •43)Химические свойства полисахаридов.
- •44)Моноаминокарбоновые кислоты. Способы получения аминокислот.
- •45)Моноаминодикарбоновые и диаминомонокарбоновые кислоты.
- •46)Циклические аминокислоты. Понятие о незаменимых аминокислотах.
- •47)Химические свойства аминокислот.
- •48)Строение белковой молекулы (первичная, вторичная, третичная, четвертичная структуры).
- •49)Ди - и трипептиды.
- •51)Пиримидиновые основания. Пиримидиновые нуклеотиды
- •51)Пуриновые основания. Пуриновые нуклеотиды
- •52)Нуклеозиды и нукпеотиды.
- •53)Схема строения рнк и днк.
- •54)Хромопротеиды. Структура гема.
- •55) Дисперсные системы и их свойства
- •56) Заряд белка. Изоэлектрическая точка.
- •57) Белки и их основные свойства:
- •58) Активная реакция среды . РН. Методы определения рН.
- •59) Буферные системы, их типы. Механизм действия буферных систем.
- •60) Диализ. Электрофорез.
- •61)Явление осмоса. Осмотическое давление.
- •62)Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
- •63)Катализ. Виды катализа.
- •64)Грубодисперсные системы: эмульсии, суспензии, аэрозоли.
- •65)Золь:гидрофобные золи, гидрофильные золи.
- •66)Адсорбция, суть, значение.
- •67)Хроматография:
- •75)Фазовый переход золь-гель. Желатинирование.
1) Типы химических связей в органических соединениях
Ковалентной связью называется внутримолекулярная химическая связь, осуществляемая за счет одной или нескольких электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов.
Сигма-связь – связь, образованная в результате перекрывания электронных облаков и расположенная на прямой, соединяющей центры ядер атомов.
Пи – связь – связь, образованная в результате перекрывания электронных облаков и расположенная вне прямой, соединяющей центры ядер атомов.
2)Виды изомерии в органических соединениях
Изомерия-явление сущ-ия Изомеров.Изомер-вещ-ва имеющие одинаковый сост-в атомов, но различное в строе ние.
А)Структурная изомер-я 1)Изомерия углеродного скелета.
Различая во взаимном расположении атомов С.
2)Изомерия по положению кратной связи
(двойной).
3)Из положения функциональной группы Различия положения функциональной группы относительно углеродного скеле та.
В)Пространственная изомер-я
Связана с различным положе нием атомов или групп атомов относительно двойной связи.(цис-(ванна) и транс-изомеря(кресло), зеркальная изоиерия)
3)Предельные углеводороды, их химические свойства.
А![]() лканы
(парафины) - это насы щенные (предельные)
углево дороды с открытой цепью. Они
имеют общую формулу СnН2n+2, В алканах
атомы углерода связаны между собой
только простыми (одинарными) связями,
а остальные валент ности углероданасыщены
ато мами водорода. Характерный суффикс
для насыщенных углеводородов-ан.,
лканы
(парафины) - это насы щенные (предельные)
углево дороды с открытой цепью. Они
имеют общую формулу СnН2n+2, В алканах
атомы углерода связаны между собой
только простыми (одинарными) связями,
а остальные валент ности углероданасыщены
ато мами водорода. Характерный суффикс
для насыщенных углеводородов-ан.,
СН4 - метан; С2Н6 - этан; С3Н8 - пропан
С4Н10 - бутан (2 изомера)
С5Н12 - пентан (3 изомера)
С6Н14 - гексан , С7Н16 - гептан
С8Н18 - октан С9Н20 - нонан С10Н22 – декан
Химические св-ва:
1)Замещение: CH4+Cl2→CH3Cl+HCl (хлористый метил)
CH3Cl+HCl→CH2Cl2+HCl (хлористый метилен) CH2Cl2+Cl2→CHCl3+HCl (хлороформ)
3)Нитрование: характерно для имеющим вторичный или третичный атом углерода.

Р-я КОНОВАЛОВА
4)При температуре 100-500ºС и доступе кислорода образуются жирные кислоты, а при температуре 500-600ºС наблюдается крекинговый процесс
- р-я горения CH4+2O2 →CO2+H20(полное), 2СН4+О22СО+4Н2(неполное)
-Каталитическое окисление2СН3-СН2-СН2-СН3 + 5О2 →4СН3СООН (уксусная кислота),
-реакция
отщипления: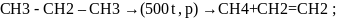 (крекинг)
(крекинг)
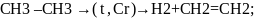
-изомеризация
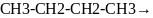

4)Получение алканов.
Получение метана
в промышленности:
1. Фракционированием природного газа и перегонкой нефти.
2. Синтез из элементов при высокой температуре (вольтова дуга),
C + 2H2 →CH4
Химические способы получения: 1)Из солей органических кислот. Cплавление ацета та натрия со щелочью: СН3СOONa + NaOH →CH4 + Na2CO3
2)Синтез Вюрца: CH3Cl+2Na+ClCH2-CH3→2NaCl+C3H8
3)Из магний органических соединений: CH3Br+Mg→CH3MgBr CH3MgBr+H2O→CH4+Mg(OH)Br
4)Синтез Бертло: C2H5I+HI→C2H6+I2
5)Из
алкенов

6) Восстановление галогенпроизводных алканов. CH3Cl+H2→(p,pt)→CH4+HCl
