
- •Щелочные металлы и их соединения.
- •Металлы iia группы.
- •Алюминий. Соединения алюминия.
- •Железо. Соединения железа.
- •Цинк. Соединения цинка.
- •Соединения цинка (соединения цинка ядовиты).
- •Медь и соединения меди.
- •Марганец. Соединения марганца.
- •Хром. Соединения хрома.
- •Соли хрома (III)
- •Соли (карбонаты, гидрокарбонаты).
- •Азот. Соединения азота.
- •Фосфор. Соединения фосфора.
- •Дигидрофосфаты.
- •Сера. Соединения серы.
- •Галогены.
- •Йод. Соединения йода.
Марганец. Соединения марганца.
Mn + S = MnS 3Mn + 2P = Mn3P2 3Mn + N2 = Mn3N2
Mn + Cl2 = MnCl2 2Mn + Si = Mn2Si
При взаимодействии с кислородом марганец образует оксид марганца (IV):
Mn + O2 = MnO2 4Mn + 3O2 = 2Mn2O3 2Mn + O2 = 2MnO
При нагревании марганец взаимодействует с водой: Mn + 2H2O (пар) Mn(OH)2 + H2
В электрохимическом ряду напряжений марганец находится до водорода, поэтому легко растворяется в кислотах, образуя соли марганца (II): Mn + H2SO4 = MnSO4 + H2
С концентрированной серной кислотой марганец реагирует при нагревании:
Mn + 2H2SO4(конц.) MnSO4 + SO2 + 2H2O
С азотной кислотой при обычных условиях:
Mn + 4HNO3 (конц.) = Mn(NO3)2 + 2NO2 + 2H2O 3Mn + 8HNO3 (разб..) = 3Mn(NO3)2 + 2NO + 4H2O
Растворы щелочей на марганец практически не действуют, но он реагирует с щелочными расплавами окислителей, образуя манганаты (VI): Mn + KClO3 + 2KOH K2MnO4 + KCl + H2O
Марганец может восстанавливать оксиды многих металлов.
3Mn + Fe2O3 = 3MnO + 2Fe 5Mn + Nb2O5 = 5MnO + 2Nb
Оксиды. Марганец образует ряд оксидов, кислотно-основные свойства которых зависят от степени окисления Mn
Mn+2O Mn+4O2 Mn2+7O7
основный амфотерный кислотный
Оксид марганца (II) получают восстановлением других оксидов марганца водородом или оксидом углерода (II): MnO2 + Н2 MnO + H2O MnO2 + CO MnO + CO2
Основные свойства оксида марганца (II) проявляются в их взаимодействии с кислотами и кислотными оксидами:
MnO + 2HCl = MnCl2 + H2O MnO + SiO2 = MnSiO3 MnO + N2O5 = Mn(NO3)2
MnO + Н2 = Mn + H2O 3MnO + 2Al = 2Mn + Al2O3 2MnO + O2 = 2MnO2
3MnO + 2KClO3 + 6KOH = 3K2MnO4 + 2KCl + 3H2O
В лаборатории оксид марганца (IV) можно получить термическим разложением солей, окислением низших или восстановлением высших соединений марганца: Mn(NO3)2 MnO2 + 2NO2 Mn(NO3)2 + PbO2 MnO2 + Pb(NO3)2 2KMnO4 + 8MnSO4 + 2H2O = 5MnO2 + K2SO4+ 2H2SO4
При растворении MnO2 в соляной кислоте образуется хлорид марганца (II) и выделяется хлор:
4HCl + MnO2 = MnCl2 + 2H2O + Cl2↑
При нагревании в концентрированной серной кислоте MnO2 образует сульфат марганца (II) с выделением кислорода: 2MnO2 + 2H2SO4 = 2MnSO4 + O2 + 2H2O
Кислотные свойства MnO2 проявляются при сплавлении с щелочами без доступа воздуха:
MnO2 + 2KOH K2MnO4 + 2H2O
Оксид марганца (IV) в зависимости от условий реакции и веществ, с которыми он взаимодействует, проявляет либо окислительные, либо восстановительные свойства:
3MnO2 + 3K2CO3 + KClO3 = 3K2MnO4 + KCl + 3CO2 NaClO3 + 3MnO2 + 6NaOH = 3Na2MnO4 + NaCl + 3H2O
MnO2 + H2SO4 + H2O2 = MnSO4 + O2 + 2H2O MnO2 + H2SO4 + KNO2 = MnSO4 + KNO3 + H2O
MnO2 + 2H2SO4 + 2FeSO4 = Fe2(SO4)3 + MnSO4 + 2H2O MnO2 + SO2 = MnSO4
MnO2 + 2Fe(NO3)2 + 4HNO3 = Mn(NO3)2 + 2Fe(NO3)3 + 2H2O
Оксид марганца (VII) неустойчивое соединение, при слабом нагревании разлагается на оксид марганца (IV) и кислород: 2Mn2O7 4MnO2 + 3O2
Получить оксид марганца (VII) можно действием концентрированной серной кислоты на кристаллический перманганат калия: 2KMnO4 + H2SO4 = K2SO4 + Mn2O7 + H2O
Оксид марганца (VII) – кислотный оксид, который взаимодействует с основными оксидами и основаниями:
Mn2O7 + СaO = Ca(MnO4)2 Mn2O7 + 2KOH = 2KMnO4 + H2O
При взаимодействии с водой он образует марганцевую кислоту: Mn2O7 + H2O = 2HMnO4
Гидроксиды. Марганец образует ряд гидроксидов, кислотно-основные свойства которых зависят от степени окисления марганца.
Mn+2(OН)2 Mn+4(OН)4 НMn+7O4
основный амфотерный кислотный
Основные свойства гидроксида марганца (II) проявляются во взаимодействии с кислотами и кислотными оксидами: Mn(OН)2 + 2HCl = MnCl2 + 2H2O Mn(OH)2 + SO3 = MnSO4
Гидроксид марганца (II) на воздухе быстро темнеет, окисляясь в гидроксид марганца (IV):
2Mn(OH)2 + O2 + 2H2O → 2Mn(OH)4
Восстановительные свойства у соединений марганца (II) преобладают.
2Mn(OH)2 + 5KBrO + 2KOH = 2KMnO4 + 5KBr + 3H2O Мn(OH)2 + H2O2 = MnO2 + 2H2O Mn(OH)2 + Br2 = MnO2 + 2HBr 2Mn(OH)2 + Ca(ClO)2 = 2MnO2 + CaCl2 + 2H2O
Гидроксид марганца (VII) – марганцевая кислота (HMnO4).
HMnO4 устойчива лишь в растворах с концентрацией не более 20%. При больших концентрациях, она разлагается с выделением кислорода: 4HMnO4 = 4MnO2 + 2H2O + 3O2
Это сильная кислота, в водном растворе она практически полностью диссоциирована:HMnO4 → H+ + MnO4─
Соединения марганца (VII) сильные окислители:
3PH3 + 8HMnO4 = 8MnO2 + 3H3PO4 + 4H2O 3H2S + 2HMnO4 = 2MnO2 + 3S + 4H2O
Соли. MnSO4 + H2O2 + 2NaOH = MnO2 + Na2SO4 + 2H2O
MnSO4+NaClO+2NaOH=MnO2+ NaCl+Na2SO4+H2O 2Mn(NO3)2+5PbO2+6HNO3=2HMnO4+5Pb(NO3)2+ 2H2O
Соли марганца (VII). 2KMnO4 → MnO2 + K2MnO4 + O2↑ 2KMnO4 + H2SO4 = K2SO4 + H2O + Mn2O7
Перманганат калия – сильный окислитель. В зависимости от рН среды KMnO4 (точнее, ион MnO4─) может восстанавливаться до различной степени окисления.
H+ Mn2+ (бесцветный раствор)


KMnO4 (MnO4─) H2O MnO2 (бурый осадок)
OH─ MnO42─ (раствор зеленого цвета)
2KMnO4 + 5H2O2 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
10KI + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O
2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O
2KMnO4 + 10FeSO4 + 18H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 18H2O
KMnO4 + 5FeCl2 + 4H2SO4 = 3FeCl3 + MnSO4 + Fe2(SO4)3 + KCl + 4H2O
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
2KMnO4 + 2NН3 = 2MnO2 + N2 + 2КОН + 2H2O
2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
2KMnO4 + 3KNO2 + H2O = 3KNO3 + 2MnO2 + 2KOH
2KMnO4 + 5Na2SO3 + 2KOH = 2K2MnO4 + 5Na2SO4 + H2O
3KMnO4 + Al + 4KOH = 3K2MnO4 + K[Al(OH)4]
Свойства соединений марганца (VI): K2MnO4 + 2KI + H2O = MnO2 + I2 + 4KOH
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl 3K2MnO4 + HСl = 2KMnO4 + MnO2 + 4KCl + 2H2O
1. Нитрат марганца (II) прокалили, к полученному твердому бурому веществу прилили концентрированную хлороводородную кислоту. Выделившийся газ пропустили через сероводородную кислоту. Образовавшийся раствор образует осадок с хлоридом бария.
2. Бурый осадок, полученный при взаимодействии сульфита натрия с водным раствором перманганата калия, отфильтровали и обработали концентрированной серной кислотой. Выделяющийся газ при нагревании реагирует с алюминием, а образующееся вещество – с раствором соляной кислоты.
3. Твердое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился.
4.
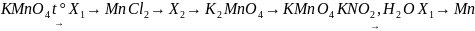
Mn(NO3)2 MnO2 + 2NO2 МnO2 + 4HCl = MnCl2 + Cl2 ↑ + 2H2 4Cl2 + H2S + 4H2O 8HCl + H2SO4 H2SO4 + BaCl2 = BaSO4 + 2HCl
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH 4MnO2 + 6H2SO4(конц.)= 2Mn2(SO4)3 + O2↑+ 6H2O 3O2 + 4Al = 2Al2O3 Al2O3 + 6HCl = 2AlCl3 + 3H2O
3) 2P + 3PCl5 = 5PCl3 PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
4)2KMnO4 K2MnO4 + MnO2 + O2 MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl Mn(OH)2 + 4KMnO4 + 6KOH = 5K2MnO4 + 4H2O
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl 2KMnO4 + 3KNO3 + H2O = 2MnO2 + 3KNO2 + 2KOH
3MnO2 + 4Al 3Mn + 2Al2O3
