
- •1.2. Пересчитайте содержание названных в пункте 1.1 ионов из миллиграммов на литр в миллиграмм-эквиваленты на литр. Эта форма является предпочтительней по ряду причин, главные из которых следующие:
- •1.3. Определите сумму катионов (σк) и анионов (σа) в миллиграмм-эквивалентной форме. Результаты запишите во вторую вертикальную колонку таблицы 4.
- •2.8. Оценка воды по пригодности для хозяйственно-питьевого водоснабжения. Оценка представлена в форме таблицы, в которой объединены данные госТа и условия упражнения.
- •Характеристика классов воды
- •Для заметок
- •Литература
Министерство сельского хозяйства Российской Федерации
Департамент научно-технологической политики и образования
Федеральное государственное бюджетное
образовательное учреждение высшего образования
Волгоградский государственный аграрный университет
Эколого-мелиоративный факультет
Кафедра «Мелиорация земель и КИВР»
М.В. Мазепа
О.А. Соловьева
М.В. Ратанов
«Состав подземных вод»
для проведения практических занятий
по дисциплине
«Почвоведение, геология и гидрогеология»
Волгоград
Волгоградский ГАУ
|
УДК 556.3
ББК 26.35
М-54
Рецензент - доцент кафедры «Мелиорация земель и КИВР» Волгоградский ГАУ, кандидат сельскохозяйственных наук Е.В.Ушакова
М-54 Методические указания «Состав подземных вод» для проведения практических занятий по дисциплине «Почвоведение, геология и гидрогеология» / М.В. Мазепа, О.А. Соловьева, М.В. Ратанов. - Волгоград: ФГБОУ ВО Волгоградский ГАУ, 2017. - 36 с.
Для подготовки бакалавров заочной формы обучения по направлению подготовки 21.03.02 «Землеустройство и кадастры».
В данном указании содержатся курс учебных занятий с теоретическим обоснованием и подробной методикой выполнения каждой работы.
Работы сопровождаются расчетными формулами и оформляются в та6личном и графическом виде.
УДК 556.3
ББК 26.35
Рекомендовано методической комиссией эколого-мелиоративного факультета ФГБОУ ВО Волгоградский ГАУ от 16 января 2017 г., протокол №6.
|
© ФГБОУ ВО Волгоградский ГАУ, 2017 |
|
© Мазепа М.В., Соловьева О.А., Ратанов М.В., 2017 |
Работа представляет собой обработку и анализ полученных данных химического состава подземных вод.
Состав подземных вод определяется длительностью процессов формирования вод какого-либо водоносного горизонта. К таким процессам относятся: растворение и выщелачивание, испарение, конденсация, ионный обмен, поглощение и выделение газов, деятельность организмов, смещение вод разного состава. В результате этих процессов подземные воды становятся сложными, непостоянными во времени растворами, в которых все встречающие вещества можно разделить на пять групп микрокомпонентов: группы диссоциированных соединений, коллоидных соединений, органических веществ, газов и группу микрокомпонентов, включая радиоактивные элементы. Следует знать наиболее распространённые вещества каждой группы, в каких единицах выражается их содержание.
Для диссоциированных соединений изучить способы изображения их на диаграммах (прямоугольнике, круге, квадрате, треугольнике), а также в виде условных записей (формула солевого состава, формула М.Г. Курлова).
Иметь представление о зависимости ионного состава воды от общей минерализации, знать классификацию подземных вод по общей минерализации и химическому составу (классификации О.А. Алекина).
Состав подземных вод и их состояние определяют свойства, которые следует учитывать при использовании подземных вод в различных целях. Питьевая вода оценивается по органолептическим показателям, химическому и бактерологическому составу. Использование воды лимитируется величиной общей минерализации и общей жёсткости, содержанием в воде отдельных компонентов.
Работа выполняется на отдельных листах формата А-4. При выполнении заданий следует оставлять поля для замечаний и отметок преподавателя, проверяющего работу.
В процессе работы студенты пересчитывают результаты химического анализа данных из ионной в миллиграмм-эквивалентную и процент-эквивалентную форму, используя результаты сокращённого анализа грунтовых вод (табл. 1).
1.1. Содержание ионов натрия и калия (вместе), кальция магния, хлорида, сульфата и гидрокарбоната, выраженное в мг/л, записывается в таблицу 2. В процессе обработки сокращённого химического анализа натрий и калий определяются совместно.
Таблица 1 - Состав подземных вод
№ варианта |
сухой остаток, мг/л |
Содержание ионов, мг/л |
РН
|
Свободная, СО2 мг/л |
Жесткость, мг- экв/л |
|||||||||
СL- |
SO42- |
HCO3- |
NO2- |
NO3- |
Na++ K+ |
Mg2+ |
Ca2+ |
NH4+ |
общая |
устранимая |
||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
0 |
279 |
3,9 |
28,0 |
231,8 |
- |
4,2 |
23,7 |
5,8 |
61,1 |
- |
7,0 |
30,8 |
3,53 |
3,53 |
1 |
632,0 |
3,7 |
309,4 |
61,0 |
0,01 |
5,5 |
63,2 |
- |
97,4 |
- |
6,5 |
4.4 |
4.84 |
1,00 |
2 |
4056,0 |
414,1 |
2279,7 |
73,2 |
- |
5,5 |
49,7 |
170,1 |
503,8 |
- |
6,4 |
17,6 |
39,14 |
1,20 |
3 |
170,0 |
4,9 |
16,5 |
128,1 |
- |
5,5 |
17,2 |
10,4 |
21,0 |
0,2 |
6,8 |
19,8 |
2,10 |
2,10 |
4 |
336,0 |
12,3 |
46,5 |
12,2 |
- |
|
5,1 |
5,2 |
255,5 |
- |
5,9 |
3,8 |
13,1 |
0,20 |
5 |
337,0 |
774,0 |
1400,0 |
140,3 |
- |
- |
724,6 |
162,5 |
168,7 |
- |
6,8 |
20,8 |
21,77 |
2,30 |
6 |
421,4 |
24,1 |
49,4 |
231,8 |
- |
- |
95,2 |
9,9 |
10,2 |
- |
7,3 |
30,6 |
3,80 |
3,80 |
7 |
1130 |
501,0 |
54,0 |
165,0 |
- |
- |
333,0 |
33,0 |
38,0 |
- |
7,3 |
18,4 |
4,60 |
2,70 |
8 |
2353 |
810,0 |
800,0 |
866,0 |
- |
- |
560,0 |
52,0 |
52,0 |
- |
8,1 |
10,0 |
6,86 |
6,86 |
9 |
246,0 |
82,1 |
28,0 |
219,6 |
- |
4,2 |
13,8 |
6,9 |
62,9 |
- |
6,4 |
30,8 |
3,71 |
3,60 |
10 |
164,0 |
6,0 |
36,2 |
115,9 |
- |
5,6 |
33,1 |
8,6 |
15,2 |
- |
6,8 |
40,0 |
1,90 |
1,90 |
11 |
320,0 |
15,9 |
74,1 |
195,2 |
- |
6,9 |
47,6 |
13,2 |
42,9 |
- |
7,2 |
13,2 |
3,23 |
3,20 |
12 |
453,0 |
23,1 |
3,3 |
323,3 |
- |
- |
16,0 |
31,2 |
49,2 |
- |
7,3 |
16,5 |
5,02 |
5,20 |
13 |
395,0 |
96,0 |
38,0 |
146,0 |
- |
- |
71,0 |
18,0 |
26,0 |
- |
7,0 |
20,4 |
2,77 |
2,39 |
14 |
500,3 |
14,2 |
70,4 |
286,8 |
- |
- |
66,0 |
26,8 |
36,1 |
- |
8,4 |
30,2 |
4,70 |
4,70 |
15 |
186,0 |
6,4 |
8,0 |
97,6 |
- |
- |
10,1 |
9,7 |
14,0 |
- |
7,4 |
17,8 |
1.49 |
1,49 |
16 |
536,9 |
14,5 |
27,9 |
366,6 |
- |
- |
7,4 |
36,5 |
76,0 |
- |
7,8 |
21,7 |
6,79 |
6,79 |
17 |
440,6 |
16,0 |
0,6 |
213,5 |
- |
- |
19,3 |
20,1 |
70,1 |
- |
7,6 |
25,4 |
5,15 |
3,50 |
18 |
242,0 |
8,2 |
12,8 |
152,5 |
- |
- |
6,4 |
9,2 |
41,0 |
- |
7,1 |
15,2 |
2,79 |
2,50 |
Таблица 2 – Состав воды с записью исходных данных и выполненными расчетами
|
Ионы |
мг/л |
мг-экв/л |
%-экв |
КАТИОНЫ |
Ма + + К + |
105,7 |
4,6 |
27 |
Mg2+ |
122.9 |
10,1 |
60 |
|
Ca2+ |
44,1 |
2,.2 |
13 |
|
Fe3+ |
- |
- |
- |
|
Сумма |
272,7 |
16,9 |
100 |
|
АНИОНЫ |
CL- |
212,.8 |
6,0 |
38 |
SO42- |
307,7 |
6,4 |
36 |
|
HCO3- |
268,.3 |
4,4 |
26 |
|
CO32- |
- |
- |
- |
|
Сумма |
788,8 |
16,8 |
100 |
|
Общая сумма |
1061,5 |
- |
|
1.2. Пересчитайте содержание названных в пункте 1.1 ионов из миллиграммов на литр в миллиграмм-эквиваленты на литр. Эта форма является предпочтительней по ряду причин, главные из которых следующие:
а) только по миллиграмм - эквивалентному содержанию ионов допустимо классифицирование воды, т.е. определение, какого иона присутствует больше;
б) в миллиграмм-эквивалентной форме суммы катионов и анионов должны быть одинаковы, что облегчает контроль результатов химического анализа.
Для пересчета ионов из мг/л в мг-экв/л воспользуйтесь переводными коэффициентами (К), приведенными в таблице 3, и следующим тождеством мг/л∙к = мг-экв/л
Таблица 3
Катионы |
К |
Анионы |
К |
Ма+ + К + |
0,0435 (для суммы) |
CL- |
0,0282 |
Са2+ |
0,0499 |
HCO3- |
0,0164 |
Мg2+ |
0,0822 |
SO42- |
0,0208 |
- |
- |
NO3- |
0,016 |
1.3. Определите сумму катионов (σк) и анионов (σа) в миллиграмм-эквивалентной форме. Результаты запишите во вторую вертикальную колонку таблицы 4.
Таблица 4
|
Ионы |
мг/л |
мг-экв/л |
%-экв |
КАТИОНЫ |
Ма + + К + |
105,7 |
4,6 |
27 |
Mg2+ |
122,9 |
10,1 |
60 |
|
Ca2+ |
44,1 |
2,2 |
13 |
|
Fe3+ |
- |
- |
- |
|
Сумма |
272,7 |
16,9 |
100 |
|
АНИОНЫ |
CL- |
212,8 |
6,0 |
38 |
SO42- |
307,7 |
6,4 |
36 |
|
HCO3- |
268,3 |
4,4 |
26 |
|
CO32- |
- |
- |
- |
|
Сумма |
788,8 |
16,8 |
100 |
|
Общая сумма |
1061,5 |
- |
|
Заметьте, что суммы катионов и анионов (мг-/экв/л) равны, или незначительно различаются, так как некоторые ионы (Fe3 + Co32- и другие) не учитывались. Если суммы катионов и анионов различаются более чем на 5 %, ищите ошибку в расчётах, или она появилась при переписывании данных. В данном примере отношение меньше пяти процентов, следовательно, результат можно считать удовлетворительным.
![]() ,
,
1.4. Переведите содержание ионов в процент-эквивалентную форму (%-экв). Для этого суммы катионов и анионов по отдельности принимаются за 100 %-экв и вычисляется процентное содержание каждого катиона и аниона (табл.4). Расчеты проводят с точностью до целых, проводя округления всех численных значений после запятой. Если содержание двух ионов одинаково, точность следует повысить и определить содержание какого из них больше. Результаты записываются в третью вертикальную колонку таблицы 4. Проверьте, дают ли полученные слагаемые в сумме 100 %-экв.
1.5. Заполните диаграмму химического состава воды (рис.2) отдельно по катионам и анионам. Содержание ионов в % - экв форме откладывается последовательно снизу вверх нарастающим итогом, в результате чего верхняя граница последнего сектора совпадает с отметкой 100%. Последовательность нанесения содержания ионов на диаграмму (снизу вверх) следующая: CL-; SO42-; HCO3-; (Na + + K+) Mg2+; Са2+. Участки диаграммы для анионов рекомендуется раскрасить в принятые стандартные цвета - для СГ - красный, 804 2 - желтый, НС03- - синий. Для катионов участки диаграммы рекомендуется заштриховать для (Na + +К+) - наклонно (справа на лево), Мg 2+ вертикально, Са 2+ - горизонтально. На рисунке 1 диаграмма заполнена для примера, рассмотренного ранее в таблице 2.
-
Са2+
HCO3-
100%
80%
60%
40%
20%
0%
Mg 2+
SO42-
CL-
Na + + К+
Рисунок 1- Диаграмма химического состава воды.
Распространенная ошибка заключается в том, что откладывают содержание очередного иона от нулевого основания вместо верхней границы очередного иона, в результате чего диаграмма заполняется не полностью.
1.6. Составьте формулу Курлова и солевого состава исследуемой воды. Формула Курлова является одним из способов выражения результата химического анализа воды, иногда ее называют паспортом воды. Она представляет собой псевдодробь, в числителе которой в убывающем порядке записывают содержание анионов, а в знаменателе катионов, процент - эквивалентное содержание которых равно или превышает 10 % -экв. Перед псевдодробью указывается последовательно содержание микрокомпонентов в (мг/л), газов в (мг/л), величина минерализации М в (г/л). За псевдодробью записывают величину рН, температуру Т°С, дебиту (м3/сут).
Пример записи формулы Курлова
![]() CD
CD
Индексы, записанные вслед за символами ионов, показывают их процент - эквивалентное содержание.
По сравнению с формулой Курлова формула солевого состава сложнее, она включает в себя содержание всех микрокомпонентов, всех ионов, анионов и катионов, независимо от их процентного содержания.
Запишите название воды по ионному составу, приведенному в формуле Курлова. В название воды по формуле Курлова и солевого состава включаются все ионы, содержание которых равно, или превышает 25 %. Состав воды называется в возрастающем порядке ионов от подчиненных к преобладающим ионам, сначала по анионам, затем по катионам. Для приведенного примера название воды будет следующим: гидрокарбонатно-сульфатно-хлоридная, натриево-магниевая. Главным ионам в названии соответствуют полные прилагательные (хлоридная), второстепенным - краткие (гидрокарбонатно-сульфатно). Так как калий рассматривается совместно с натрием (см.1.1.), то в формуле Курлова и солевого состава записывается лишь его символ (Na+ + K+), а в название воды он не входит.
1.7. Нанесите результаты анализа на графики-треугольники Ферре (рис. 2). Графики-треугольники представляют собой системы координат, связывающие на плоскости три переменные – процентное содержание трёх катионов и трёх анионов, и служат на практике для нанесения на них результатов массовых анализов воды с целью выяснения закономерностей изменения химического состава природных вод. Каждый вершине треугольника приписан определённый ион, причём сама вершина соответствует 100 % -экв значению данного иона. Линия, проведённая параллельно противолежащему основанию, соответствует определённому, в интервале от 0 % -экв до 100 % - экв значению рассматриваемого иона.
Аналогичным образом двум другим ионам соответствует две другие вершины, их противолежащие основания и линии, параллельные этим основаниям.
Для изображения результата анализа на треугольнике наносятся три линии, обозначающие содержание каждого иона. Для нахождения положения каждой линии следует отсчитать необходимое количество процентов - эквивалентов от основания в сторону вершины рассматриваемого иона. Все три линии пересекаются в одной точке.
Распространённая ошибка заключается в том, что содержание иона отсчитывают не от противолежащего, а от прилежащего основания, в результате чего линии дают две – три точки пересечения либо вообще не пересекаются.
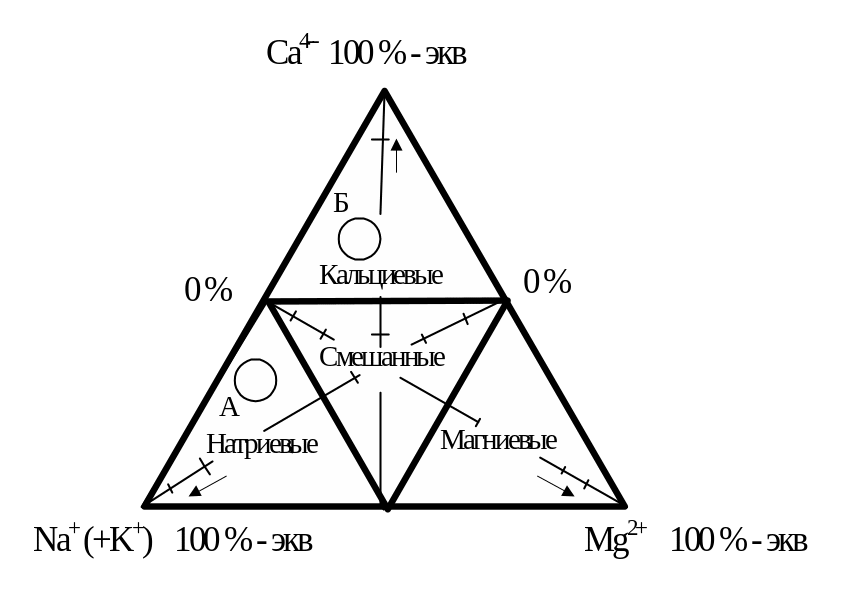
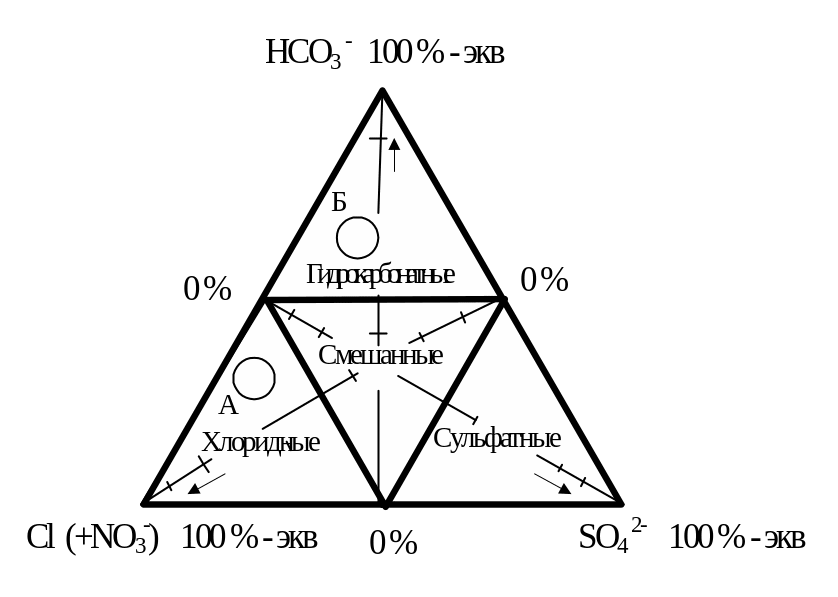
Рисунок 2 – Графики–треугольники Ферре: а) график–треугольник катионного состава; б) график-треугольник анионного состава.
1.8.
На диаграмме – квадрате учитываются
основные анионы и катионы (рис. 3). Он
представляет собой квадрат разделенный
по оси х и оси у на десять равных частей,
таким образом внутри большого квадрата
слева направо расположена шкала для
суммы (Са2+
+ Мg2+),
по нижней стороне квадрата справа налево
– шкала для суммы (Na + К). По боковым
сторонам квадрата находится шкалы для
анионов: справа, снизу вверх для (![]() +
+ ![]() ).
Слева, сверху вниз – шкала для (
).
Слева, сверху вниз – шкала для (![]() + CL). Один анализ изображается на диаграмме
– квадрате в виде точки. Эта точка
находится на пересечении двух прямых
линий – вертикальной, положение которой
в квадрате определяется содержанием
катионов, и горизонтальной, определяемой
по содержанию в мг-экв % анионов.
+ CL). Один анализ изображается на диаграмме
– квадрате в виде точки. Эта точка
находится на пересечении двух прямых
линий – вертикальной, положение которой
в квадрате определяется содержанием
катионов, и горизонтальной, определяемой
по содержанию в мг-экв % анионов.
Точка пересечения обоих линий попадает в маленький квадрат со своим номером, который и присваивается исследуемой воде.
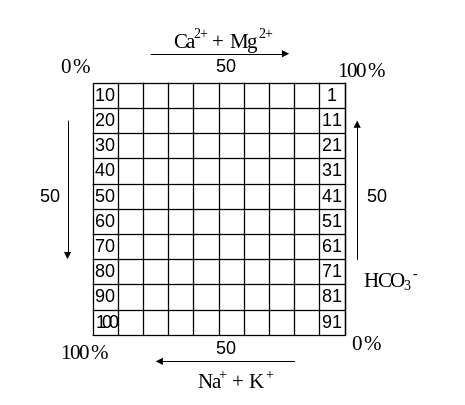
Рисунок 3 – Диаграмма-квадрат.
2. Оцените воду по минерализации (сухому остатку). Для этого воспользуйтесь таблицей 5 (классификацией ГОСТ 17403-72, или классификацией В.И. Вернадского).
Пример 2.1. Оценка воды по общей минерализации. В данном упражнении минерализация равна 1061 мг/л = 1.061 г/л Вывод - вода солоноватая.
Таблица 5 – Классификация природных вод по минерализации.
Вода |
ГОСТ 17403-72 г/л |
По Вернадскому В.И., г/л |
ультрапресная |
|
до 0,2 |
пресная |
до 1 |
0,2-1 |
солоноватая |
1-25 |
слабо 1-3 |
солоноватая |
1-25 |
сильно 3-10 |
соленая |
25-50 |
10-35 |
рассол |
более 50 |
более 35 |
Оцените воду по величине общей жесткости, воспользовавшись данными таблицы 6.
Таблица 6 – Классификация природных вод по общей жесткости.
Градации |
Немецкие градусы |
мг-экв/л |
воды очень мягкие |
<4,2 |
<1,5 |
воды мягкие |
4,2-8,4 |
1,5-3,0 |
воды умеренно жесткие |
8,5-16,8 |
3,0-6,0 |
воды жесткие |
19,6-25,2 |
6,0-9,0 |
воды очень жесткие |
>25 |
>9,0 |
Жесткостью называются свойства воды, которые ей придают присутствующие в ней ионы Са2+; Мg2+; Fе2+ некоторые другие катионы. Количественно общая жесткость оценивается по сумме содержания названных ионов в мг-экв/л. Запись производится следующим образом:
rСа2+ + rМg2+ - общая жесткость (мг-экв/л). Буква r, стоящая перед символами ионов означает, что следует складывать численные значения содержания ионов, взятые в мг - экв/л.
Пример 2.2. Оценка воды по общей жесткости. В данной работе
rСа2+ + rМg2+ =2,2 +10,1 = 12,3 мг-экв/л. Вывод - вода очень жесткая.
Пример 2.3. Определите величину устранимой (карбонатной) жесткости. При кипячении часть ионов Са 2+ и Мg2+ соединяется с равным им (в эквивалентно форме) количеством иона , в результате чего образуется накипь. Эта часть ионов Са 2+ и Мg 2+ называется устранимой жесткостью.
Она определяется по содержанию в воде гидрокарбонат-иона- r (мг-экв/л) и поэтому также называется карбонатной.
В данной работе устранимая (карбонатная) жесткость равна; r НСО =4,4 мг-экв/л.
Пример 2.4. Определите величину неустранимой (постоянной) жесткости. При кипячении ионы Са2+ + Мg2+ реагируют с ионами с образованием СаС03, МgСОз. При полном расходовании иона остающиеся ионы Са2+ + Мg2+ придают воде неустранимую (постоянную) жесткость. Численно эта жесткость определяется разностью: rСа2+ + rМg2+ - = неустранимая жесткость (мг-экв/л).
Если получающийся результат отрицателен, в ответе следует записать О мг-экв/л. Это означает, что содержание гидрокарбонат-иона больше содержания кальция и магния и этих ионов в воде после кипячения не остается.
В данном упражнении неустранимая (постоянная) жесткость равна:
rСа2+ + rМg2+ - НСОз = 2,2 + 10,1-4.4 = 7,9 мг-экв/л.
Пример 2.5. Оцените реакцию воды по величине рН. Классификация воды по рН: Вода сильнокислая - рН до 1,9, кислая 1,9 <рН<4,1, слабокислая 4,1 <рН < 7, нейтральная рН = 7, слабощелочная 7<рН< 8,3, щелочная 8,3 <рН<10,3, сильнощелочная рН> 10,3.
Оценка реакции воды по величине рН. В данном упражнении рН = 6,9. Вывод - реакция слабокислая.
Пример 2.6.Оцените воду по классификации О.А.Алекина. По этой классификации природные воды делятся на классы по преобладающим анионам, на группы по преобладающим катионам и на виды по соотношениям ионов. Название образуется так же, как и по формуле Курлова - см.п. 1.6.
Для определения преобладающего иона сравнивается их содержание в эквивалентной и процентной форме. Каждая группа целится на четыре типа, определяемые следующими неравенствами (мг-экв/л):
I. r ≥ rСа2+ + rМg2+
II. r <rСа2++rМg2+≤r +r
III. rСа2++ rМg2+> r +r
IV. r =0
Распространенные ошибки - вывод о принадлежности рассматриваемой воды одновременно к двум типам; вывод о том, что воду нельзя отнести ни к одному из типов.
Как можно видеть, данные три неравенства являются непересекающимися, но составляют полное множество. Из этого следует, что одно (и только одно) неравенство обязательно выполнится, то есть вода относится к какому-либо определенному типу.
При выполнении работы требуется определить класс, группу и тип воды, записать номер типа, неравенство в символах и в числах, подставив значения из условий упражнения.
Оценка воды по классификации О.А.Алекина.
Класс - гидрокарбонатно-сульфатно-хлоридный;
Группа - натриево-магниевая;
Тип - III rСа2+ + rМg2+> r + r
2,2 + 10,1 > 4,4 + 6,4 (мг-экв/л).
Ниже приводится сокращенная запись оценки воды приведенного анализа по классификации Алекина. В скобках записан класс воды (С,С1,S) , как показатель степени записана ее группа (Са, Мg), а как основание логарифма ее тип (III).
(С,С1,S)ΙΙΙ(Ca,Mg)
2.7. Оцените воду по агрессивности в отношении бетона. Агрессивность - это разрушающее воздействие воды на строительный материал подземной части сооружений. Не следует думать, что вследствие агрессивности происходит разрушение бетона по всему объему - нет, происходит лишь увеличение количества и общего объема пустот, что может отрицательно сказаться на состоянии всего сооружения. В таблице 7 перечислены встречающиеся в отношении бетона виды агрессивности.
При выполнении работы требуется рассмотреть каждый вид агрессивности, записать условие агрессивности, сравнить его с исходными данными задания и сделать вывод о возможной агрессивности воды.
Распространённая ошибка - учащиеся принимают за символ углекислого газа С02 символ карбонат-иона СО3 2-.
Пример (приводится по условиям, рассмотренным в таблице 2):
rМg2+ = 122,9 мг/л; rСа2+ = 44,1 мг/л; rСL- = 212,8 мг/л; r =307,7 мг/л;
r = 268,3 мг/л = 4,4 мг-экв/л; рН = 6,9;
rСО2 = 4,8 мг/л).
2.7. Оценка воды по агрессивности в отношении бетона:
а) сульфатная агрессивность имеет место, если r -> 250 мг/л. В данном случае r -= 307,7 мг/л. Вывод - агрессивность есть.
Таблица 7 – Агрессивность воды
(по СНиП-П-28-73* с упрощениями)
Виды агрессивности |
Условия агрессивности |
Процессы происходящие в бетоне |
Сульфатная |
r >250 мг/л |
В результате химических реакций происходит накопление в трещинах бетона сульфатных соединений с последующим механическим разрушением бетона. |
Магнезиальная |
rМg2+>2000 мг/л |
Обменные реакции, формирование в бетоне коллоидных соединений Mg(ОН)2, понижающих прочность бетона. |
Выщелачивающая |
r <1,5 мг-экв/л |
Частичное растворение Са(ОН)2, входящего в состав бетона. |
Общекислотная |
рН<7 |
Частичное растворение Са(ОН)2, входящего в состав бетона. |
Углекислая |
rСО2>Х (мг/л), где Х=а Са+в. Коэффициенты а и в берутся из таблицы 8. Значение Са2+ подставляется в мг/л.
|
Частичное растворение СаСО3, входящего в состав бетона. |
СНиП-П-28- 73 - строительные нормы и правила. Защита строительных конструкций от коррозии. Госстрой СССР, М.:Стройиздат,1980
б) магнезиальная агрессивность имеет место, если rМg2+ > 2000 мг/л. В данном случае rМg2+= 122,9 мг/л. Вывод - агрессивности нет.
в) выщелачивающая агрессивность имеет место, если rНСО3-<1,5 мг-экв/л. В данном случае rНСО3-= 4,4 мг-экв/л. Вывод - агрессивности нет.
г) общекислотная агрессивность имеет место, если рН < 7. В данном случае рН=6,9. Вывод - агрессивность есть.
д) углекислая агрессивность имеет место, если выполняется соотношение rСQ 2 > X (мг/л), где Х=аСа 2++ в ( мг/л).
а и в находим по таблице 8 на основании того, что rНСО3-= 4,4 мг-экв/л, а гСL- + SO42- = 212,8 + 307,7 = 520,5 мг/л, принимаем а = 0,19; в = 23; тогда X = 0,19 х 44,1 + 23 = 31,4мг/л;
гСО2 = 4,8 мг/л, следовательно,
гСО2 < X , так как 4,8 < 31,4 (мг/л).
Вывод - агрессивности нет.
Оцените воду по пригодности для хозяйственного и питьевого водоснабжения. Оценка дается на основании сравнения данных задания с нормативными данными ГОСТа (таблица 9). Данные ГОСТа здесь приводятся не полные, так как в задании рассматриваются лишь немногие компоненты подземных вод. Пригодной вода считается при условии ее пригодности по всем показателям, приведенным в ГОСТе.
Таблица 8 – Значение коэффициентов а и в.
Гидрокарбонатная щелочность
r |
Суммарное содержание ионов Сl и , мг/л |
||||||
Немецкие градусы |
мг-экв/л |
0-200 |
201-400 |
401-600 |
|||
а |
в |
а |
в |
а |
в |
||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
4 |
1,4 |
0,01 |
16 |
0,01 |
17 |
0 |
17 |
5 |
1,8 |
0,04 |
17 |
0,04 |
18 |
0,03 |
18 |
6 |
2,1 |
0,07 |
19 |
0,08 |
19 |
0,05 |
18 |
7 |
2,5 |
0,10 |
21 |
0,08 |
20 |
0,07 |
19 |
8 |
2,9 |
0,13 |
23 |
0,11 |
21 |
0,09 |
19 |
9 |
3,2 |
0,16 |
25 |
0,14 |
22 |
0,11 |
20 |
10 |
3,6 |
0,20 |
27 |
0,17 |
23 |
0,14 |
21 |
11 |
4 |
0,24 |
29 |
0,20 |
24 |
0,16 |
22 |
12 |
4,3 |
0,28 |
32 |
0,24 |
26 |
0,19 |
23 |
13 |
4,7 |
0,32 |
34 |
0,28 |
27 |
0,22 |
24 |
14 |
5 |
0,36 |
37 |
0,32 |
29 |
0,25 |
26 |
15 |
5,4 |
0,40 |
39 |
0,36 |
30 |
0,29 |
27 |
16 |
5,7 |
0,44 |
41 |
0,40 |
32 |
0,32 |
28 |
17 |
6,1 |
0,48 |
43 |
0,44 |
34 |
0,36 |
30 |
18 |
6,4 |
0,54 |
46 |
0,47 |
37 |
0,40 |
32 |
19 |
6,8 |
0,61 |
48 |
0,51 |
39 |
0,44 |
33 |
20 |
7,1 |
0,67 |
51 |
0,55 |
41 |
0,48 |
35 |
21 |
7,5 |
0,74 |
53 |
0,60 |
43 |
0,53 |
37 |
22 |
7,8 |
0,81 |
55 |
0,65 |
45 |
0,58 |
38 |
23 |
8,2 |
0,88 |
58 |
0,70 |
47 |
0,63 |
40 |
24 |
8,6 |
0,96 |
60 |
0,76 |
49 |
0,68 |
42 |
25 |
9 |
1,04 |
63 |
0,81 |
51 |
0,73 |
44 |
продолжение таблицы 8
Гидрокарбонатная щелочность r ) |
Суммарное содержание ионов Сl и , мг/л |
||||||
Немецкие градусы |
мг-экв/л |
601-800 |
801-1000 |
более 1000 |
|||
а |
в |
а |
в |
а |
в |
||
1 |
2 |
9 |
10 |
11 |
12 |
13 |
14 |
4 |
1,4 |
0 |
17 |
0 |
17 |
0 |
17 |
5 |
1,8 |
0,02 |
18 |
0,02 |
18 |
0,02 |
18 |
6 |
2,1 |
0,04 |
18 |
0,04 |
18 |
0,04 |
18 |
7 |
2,5 |
0,06 |
18 |
0,06 |
18 |
0,06 |
18 |
8 |
2,9 |
0,08 |
18 |
0,07 |
18 |
0,07 |
18 |
9 |
3,2 |
0,1 |
19 |
0,09 |
18 |
0,08 |
18 |
10 |
3,6 |
0,12 |
19 |
0,11 |
18 |
0,10 |
18 |
11 |
4 |
0,15 |
20 |
0,13 |
19 |
0,12 |
19 |
12 |
4,3 |
0,17 |
21 |
0,16 |
20 |
0,14 |
20 |
13 |
4,7 |
0,20 |
22 |
0,19 |
21 |
0,17 |
21 |
14 |
5 |
0,23 |
23 |
0,22 |
22 |
0,19 |
22 |
15 |
5,4 |
0,26 |
24 |
0,24 |
32 |
0,22 |
23 |
16 |
5,7 |
0,29 |
25 |
0,27 |
24 |
0,25 |
24 |
17 |
6,1 |
0,33 |
26 |
0,30 |
25 |
0,28 |
25 |
18 |
6,4 |
0,36 |
28 |
0,33 |
27 |
0,31 |
27 |
19 |
6,8 |
0,40 |
30 |
0,37 |
29 |
0,34 |
28 |
20 |
7,1 |
0,44 |
31 |
0,41 |
30 |
38 |
29 |
21 |
7,5 |
0,48 |
33 |
0,45 |
31 |
0,41 |
31 |
22 |
7,8 |
0,53 |
34 |
0,49 |
33 |
0,44 |
32 |
23 |
8,2 |
0,58 |
35 |
0,53 |
34 |
0,48 |
33 |
24 |
8,6 |
0,63 |
37 |
0,57 |
36 |
0,52 |
35 |
25 |
9 |
0,67 |
39 |
00,61 |
38 |
0,56 |
37 |
