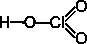- •Федеральное агентство по образованию
- •Имени первого Президента России б.Н. Ельцина»
- •Оглавление
- •Комплексные соединения
- •Классификация комплексных соединений
- •Диссоциация комплексных соединений
- •Окислительно-восстановительные реакции с участием комплексных соединений
- •1.4.1.Правила написания уравнений химических реакций с участием комплексных соединений
- •Разрушение комплексных ионов
- •1.5 Задания к разделу 1
- •II. Обзор свойсв неметаллов
- •2.1. Введение
- •2.1.1. Строение и физические свойства простых веществ
- •2.2. Подгруппа III а (бор)
- •2.2.1.Физические свойства.
- •2.2.2.Химические свойства.
- •2.2.3. Нахождение в природе
- •2.2.4. Получение
- •2.2.5. Соединения бора
- •2.2.6. Применение
- •2.2 Подгруппа IV-a
- •2.3. Углерод
- •2.3.1. Алмаз
- •2.3.2. Графит
- •2.3.3. Карбин
- •2.3.4. Химические свойства углерода
- •Окислительные свойства углерода подтверждают реакции:
- •Химические свойства
- •2.3.6. Оксид углерода (IV) сo2
- •Химические свойства
- •2.2.7. Угольная кислота и её соли Структурна формула угольной кислоты h2co3:
- •2.4. Кремний
- •Аллотропия
- •Химические свойства
- •2.4.1. Силан SiH4
- •2.4.2. Оксид кремния (IV) (SiO2)n
- •2.4.3. Кремниевые кислоты
- •2.5 Подгруппа V-a Общая характеристика элементов главной подгруппы V группы (подгруппы азота)
- •Химические свойства
- •2.5.1. Азот
- •Получение
- •Химические свойства
- •Азотная кислота - сильный окислитель:
- •2 .5.5. Фосфор и его соединения
- •Химические свойства Фосфор реагирует:
- •Получение: Окисление фосфора при недостатке кислорода:
- •Химические свойства
- •Получение:
- •Химические свойства
- •Кислород
- •Способы получения
- •Химические свойства
- •Озон o3
- •Получение:
- •Сульфиды
- •So2 (сернистый ангидрид; сернистый газ)
- •So3 (серный ангидрид)
- •Элементы VII –а группы. Общая характеристика
- •Получение
- •Получение
- •Соединения хлора Хлористый водород Физические свойства
- •Химические свойства
- •Получение
- •Получение
- •Хлорная кислота:
- •Получение
- •Бромистый водород hBr Физические свойства
- •Получение
- •Химические свойства
- •Иод и его соединения
- •Получение
- •Получение
- •Кислородные кислоты йода
- •Получение
- •Положение металлов в периодической таблице
- •Общие свойства металлов. Виды кристаллических решеток
- •Общие физические свойства
- •Общие химические свойства металлов
- •Подгруппа железа Свойства элементов подгруппы железа
- •Получение металлов подгруппы железа
- •Железо и его соединения Химические свойства
- •Соединения железа((II) Гидроксид железа (II)- Fе(oh)2
- •Кобальт и его соединения
- •Гидроксид кобальта (II)
- •Никель и его соединения
- •Подгруппа марганца Побочная подгруппа VII группы Свойства элементов подгруппы марганца
- •Физические свойства: Серебристо-белые, тугоплавкие металлы. Химические свойства
- •Подгруппа хрома Подгруппа хрома - побочная подгруппа VI группы Свойства элементов подгруппы хрома
- •Соединения хрома Соединения хрома (п)
- •Соединения хрома(111)
- •Соединения хрома (VI)
- •Подгруппа ванадия Подгруппа ванадия - побочная подгруппа V группы Свойства элементов подгруппы ванадия
- •Химические свойства
- •Оксиды ванадия
- •Ванадиевые кислоты, основания и соли
- •Ниобий и его соединения Получение
- •Химические свойства
- •Оксиды ниобия, кислоты и их соли
- •Тантал и его соединения
- •Подгруппа титана Подгруппа титана - побочная подгруппаI V группы Свойства элементов подгруппы титана
- •Получение
- •Химические свойства титана, циркония гафния
- •Соединения подгруппы титана. Химические свойства.
- •Подгруппа цинка Свойства элементов II группы побочной подгруппы (подгруппы цинка)
- •Физические свойства
- •Химические свойства
- •Цинк и его соединения
- •Кадмий и его соединения
- •Ртуть и ее соединения
- •Подгруппа меди Подгруппа меди – побочная подгруппа I группы Свойства элементов подгруппы меди
- •Соединения одновалентной меди
- •Соединения меди (п)
- •Серебро и его соединения
- •Золото и его соединения
- •Подгруппа германия
- •Получение
- •Свойства элементов подгруппы германия
- •Соединения германия, олова, свинца
- •Подгруппа алюминия Свойства элементов подгруппы алюминия
- •Физические свойства
- •Химические свойства
- •Применение
- •Оксид алюминия Al2o3
- •Получение
- •Гидроксид алюминия Al(oh)3 Получение
- •Вопросы для самоконтроля
- •Тема 2: «Химия элементов»
- •Тема 2a: «Металлы»
- •Тема 2б: «Неметаллы»
- •Библиографический список
Соединения хлора Хлористый водород Физические свойства
Бесцветный газ с резким запахом, ядовитый, тяжелее воздуха, хорошо растворим в воде (1: 400). tпл. = -114ºC, tкип. = -85°С.
Получение
Синтетический способ (промышленный): H2 + Cl2 → 2HCl;
Гидросульфатный способ (лабораторный):
NaCl(тв.) + H2SO4(конц.) → NaHSO4 + HCl↑
Химические свойства
Раствор HCl в воде - соляная кислота - сильная кислота:
HCl → H+ + Cl-
Реагирует:
с металлами, стоящими в ряду напряжений до водорода:
2Al + 6HCl → 2AlCl3 + 3H2↑;
с оксидами металлов: MgO + 2HCl → MgCl2 + H2O;
с основаниями и аммиаком: HCl + KOH → KCl + H2O;
3HCl + Al(OH)3 → AlCl3 + 3H2O; HCl + NH3 →NH4Cl;
с солями: CaCO3 + 2HCl → CaCl2 + H2O + CO2↑;
HCl + AgNO3 → AgCl↓ + HNO3
Образование белого осадка хлорида серебра, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl- в растворе.
Хлориды металлов - соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями:
2Fe + 3Cl2 → 2FeCl3; Mg + 2HCl → MgCl2 + H2↑;
CaO + 2HCl → CaCl2 + H2O; Ba(OH)2 + 2HCl → BaCl2 + 2H2O;
Pb(NO3)2 + 2HCl → PbCl2↓ + 2HNO3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ ХЛОРА
Хлорноватистая кислота HCl+1O
H–O–Cl
Физические свойства
Существует только в виде разбавленных водных растворов.
Получение
Получают растворением хлора в воде: Cl2 + H2O ↔ HCl + HClO
Химические свойства
HClO - слабая кислота и сильный окислитель:
Разлагается, выделяя атомарный кислород:
HClO –на свету→HCl + O↑;
Со щелочами образует соли – гипохлориты:
HClO + KOH → KClO + H2O;
HClO - сильный окислитель:
2HI + HClO → I2 + HCl + H2O
Хлористая кислота HCl+3O2
H–O–Cl=O
Физические свойства: существует только в водных растворах.
Получение
Образуется при взаимодействии пероксида водорода с оксидом хлора (IV), который получают из бертоллетовой соли и щавелевой кислоты в среде H2SO4: 2KClO3 + H2C2O4 + H2SO4 → K2SO4 + 2CO2↑ + 2СlO2↑ + 2H2O;
2ClO2 + H2O2 → 2HClO2 + O2↑
Химические свойства
HClO2 - слабая кислота и сильный окислитель; соли хлористой кислоты – хлориты получают взаимодействием кислоты со щелочью:
HClO2 + KOH → KClO2 + H2O
Кислота диспропорционирует согласно уравнению:
4HClO2 → HCl + HClO3 + 2ClO2↑ + H2O
Хлорноватая кислота HCl+5O3
|
Физические свойства:
Устойчива только в водных растворах.
Получение
Получают действием на соли хлористой кислоты серной кислотой:
Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4↓
Химические свойства
HClO3 - Сильная кислота и сильный окислитель; соли хлорноватой кислоты - хлораты: 6P + 5HClO3 → 3P2O5 + 5HCl;
HClO3 + KOH → KClO3 + H2O
KClO3 - Бертоллетова соль; ее получают при пропускании хлора через подогретый (40ºC) раствор KOH:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
Бертоллетову соль используют в качестве окислителя; при нагревании она разлагается: 4KClO3 –без кат→ KCl + 3KClO4; 2KClO3 –MnO2 кат→ 2KCl + 3O2↑
Хлорная кислота HCl+7O4
|
Физические свойства:
Бесцветная жидкость, t°кип. = 25ºC, t°пл.= -101ºC.