
- •38. При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа ЕеS.
- •58. Определите, при какой температуре начнется реакция восстановления Fe3o4, протекающая по уравнению:
- •99. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора?
- •116. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
- •159. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий - никелевого аккумулятора?
- •203. Какие соединения называют аминами? Составьте схему поликонденсации адипиновой кислоты и гексаметилендиамина. Назовите образовавшийся полимер.
- •«Государственный аграрный университет северного зауралья»
- •Контрольная работа по химии
5.Что такое сродство к электрону? В каких единицах оно измеряется? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента.
Сродство к электрону – это энтальпия, поглощаемая 1 моль электронов для появления ионов данного элемента. Сродство к электрону измеряется в кДж/моль. Окислительная активность неметаллов (способность принимать электроны) в группе с увеличением по-рядкового номера элементов уменьшается, потому что с ростом заряда элемента растёт и радиус атома. Всё это приводит к уменьшению сродства к электрону у атомов элементов данной группы. Например, атомы фтора и хлора соответственно имеют следующие электронные конфигурации (Не)2s22p5 (r = 0,072нм) и (Ne)3s23p5 (r = 0,099нм). Атому фтора будет легче присоединять электрон, чем атому хлора.
В периодах окислительная активность неметаллов будет увеличиваться с увеличением порядкового номера элемента, так как будет уменьшаться радиус атомов с увеличением заряда ядра. Например, атом серы и хлора имеет следующие электронные конфигурации (Ne)3s23p4; (Ne)3s23p5. Имея семь электронов на внешнем энергетическом уровне, больше на один, чем атом серы и, соответственно больший радиус заряд ядра, чем у атома серы. Поэтому атом хлора будет иметь меньший размер атома (r = 0,099нм), чем атом серы (r = 0,104нм). Исходя из этого, атом хлора будет легче присоединять электроны, чем атом серы, т. е. хлор будет проявлять окислительные способности, чем сера.
38. При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа ЕеS.
Решение:
Уравнение реакции имеет вид:
6,3х 11,31 кДж
Fe + S = FeS; ∆H0
55,845х х кДж
Вычислим теплоту образования сульфида железа EeS из пропорции:
6,3г / (-11,31 кДж) = 55,845г / х;
х = (-11,31 * 55,845) / 6,3 = -100,26 кДж/моль.
Ответ: -100,26 кДж/моль.
58. Определите, при какой температуре начнется реакция восстановления Fe3o4, протекающая по уравнению:
Fe3 O4 (к) + СО (г) = ЗFеО (к) + СO2 (г); ∆Н = +34,55 кДж.
Решение:
Уравнение реакции имеет вид:
Fe3O4 (к) + СО (г) =ЗFеО (к) + СO2 (г); ∆Н = +34,55 кДж.
Значения
∆ 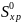 находим из соотношений:
находим из соотношений:
∆
=
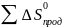 -
-
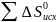
Значения находим из специальных таблиц, получим:
∆ = 3S0 (FeО) + S0 (СО2) – [S0 (Fe3O4) + S0 (СО)]; ∆ = [3(54,0) + (213,65) – (146,4 +197,91) = +31,34 Дж/моль . К.
Найдём температуру, при которой ∆G = 0:
0 = ∆H0 - T ∆S0;
∆H0 = T ∆S0;
Т = ∆H0 / ∆S0 = 34,55 / 0,3134 = 1102,4 К.
Следовательно, при температуре 1102,4 K начнется реакция восстановления Fe3O4. Иногда эту температуру называют температурой начала реакции.
Ответ: 1102,4 К.
79. Почему при изменении давления смещается равновесие системы N2 + 3Н2 ↔ 2NH3 и, не смещается равновесие системы N2 + O2 2NO? Ответ мотивируйте на основании расчета скорости и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
Решение:
а) Уравнение реакции:
N2 + 3Н2 ↔ 2NH3.
Из уравнения реакции следует, что реакция протекает с уменьшением объёма в системе (из 4 моль газообразных веществ образуется 2 моль газообразного вещества). Поэтому при изменении давления в системе будут наблюдаться смещение равновесия. Если повысить давление в данной системе, то, согласно принципу Ле Шателье, равновесие сместится вправо, в сторону уменьшения объёма. При смещении равновесия в системе вправо скорость прямой реакции будет больше скорости обратной реакции:
![]() пр
>
обр
или
пр
= k[N2]
[H2]3 >
обр
= k[NH3]2.
пр
>
обр
или
пр
= k[N2]
[H2]3 >
обр
= k[NH3]2.
Если же давление в системе уменьшить, то равновесие системы сместится влево, в сторону увеличения объёма, то при смещении равновесия влево скорость прямой реакции будет меньше, чем скорость прямой:
νʹпр < νʹ обр или (νʹпр = k[N2] [H2]3 )< (νʹобр = k[NH3]2).
б) Уравнение реакции:
N2 + O2 ↔ 2NO..
Из уравнения реакции следует, что при протекание реакции не сопровождается изменением объёма, реакция протекает без изменения числа молей газообразных веществ. Поэтому изменение давления в системе не приведёт к смещению равновесия, поэтому скорости прямой и обратной реакции будут равны:
νʹпр = νʹобр = или (νʹпр k[N2] [О2]) = (νʹобр = k[NО]2).
