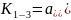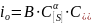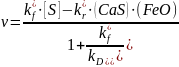- •А.М. Панфилов, н.С. Семенова, а.В. Климов Версия одиннадцатая Теория металлургических процессов
- •Оглавление
- •Введение
- •1 Организация работ в лабораторном практикуме по теории металлургических процессов
- •1.1 Общие сведения
- •1.2 Оценка результатов лабораторных работ в системе брс
- •1.3 Рекомендации по обработке результатов измерений и оформлению отчета
- •1.3.1 Построение графиков
- •1.3.2 Сглаживание экспериментальных данных
- •1.3.3 Численное дифференцирование функции, заданной набором дискретных точек
- •1.3.4 Расчет скоростей химических реакций
- •1.3.5 Численное интегрирование экспериментальных данных. Вычисление тепловых эффектов
- •1.3.6 Определение методом наименьших квадратов коэффициентов полинома, аппроксимирующего некоторый набор данных
- •1.3.7 Представление результатов
- •2 Описание лабораторных работ
- •2.1 Изучение кинетики высокотемпературного окисления железа (Работа № 13)
- •2.1.1 Общие закономерности окисления железа
- •2.1.2 Описание установки и порядок проведения опытов
- •2.1.3 Обработка и представление результатов измерений
- •Контрольные вопросы
- •2.2 Изучение температурной зависимости удельной электропроводности оксидных расплавов (Работа № 14)
- •2.2.1 Общие сведения о природе электрической проводимости шлаков
- •2.2.2 Описание установки и методики измерений
- •2.2.3 Порядок выполнения работы
- •2.2.4 Обработка и представление результатов измерений
- •Контрольные вопросы
- •2.3 Исследование кинетики десульфурации металла шлаком на имитационной модели (Работа № 15)
- •2.3.1 Общие сведения о кинетике десульфурации металла шлаком
- •2.3.2 Порядок проведения работы
- •2.3.3 Обработка и представление результатов измерений
- •Контрольные вопросы
- •2.4 Термографическое изучение процессов диссоциации природных карбонатов (Работа № 16)
- •2.4.1 Общие закономерности диссоциации карбонатов
- •2.4.2 Схема установки и методика проведения работы
- •2.4.3 Обработка и представление результатов измерений
- •Контрольные вопросы
- •2.5 Изучение температурной зависимости вязкости оксидных расплавов (Работа № 17)
- •2.5.1 Природа вязкого сопротивления оксидных расплавов
- •2.5.2 Описание установки и методика измерений вязкости
- •2.5.3 Порядок проведения работы
- •2.5.4 Обработка и представление результатов измерений
- •Контрольные вопросы
- •2.6 Восстановление марганца из оксидного расплава в сталь (Работа №18)
- •2.6.1 Общие закономерности электрохимического взаимодействия металла и шлака
- •2.6.2 Модель процесса – алгоритм работы программы имитационного моделирования
- •2.6.3 Порядок проведения работы
- •2.6.4 Обработка и представление результатов измерений
- •Контрольные вопросы
- •2.7 Изучение диссоциации доломита методом дифференциального термического анализа (Работа № 21)
- •2.7.1 Особенности процесса диссоциации доломита
- •2.7.2 Схема установки и методика проведения работы
- •2.7.3 Обработка и представление результатов измерений
- •Контрольные вопросы
- •2.8 Исследование сплавов свинец-олово методом дта (Работа № 22)
- •2.8.1 Особенности процесса плавления кристаллического раствора
- •2.8.2 Схема установки и методика проведения работы
- •2.8.3 Обработка и представление результатов измерений
- •Контрольные вопросы
- •Список литературы
Контрольные вопросы
Что называют удельной электропроводностью?
Какие частицы обуславливают электропроводность шлаков?
Каков характер температурной зависимости электропроводности металлов и оксидных расплавов?
От чего зависит постоянная ячейки и как ее определить?
Почему для определения
 нужно использовать переменный ток?
нужно использовать переменный ток?Как зависит от температуры энергия активации электропроводности?
Какие датчики и приборы используются в лабораторной установке? Какие физические величины они позволяют регистрировать?
Какие графики (в каких координатах) должны быть представлены по результатам работы?
Какие физико-химические величины должны быть получены после обработки первичных данных?
Определитесь, какие измерения проводятся перед опытом, какие величины регистрируются в ходе опыта, какие данные относятся к первичной информации, какой обработке она подвергается и какая при этом получается информация.
2.3 Исследование кинетики десульфурации металла шлаком на имитационной модели (Работа № 15)
2.3.1 Общие сведения о кинетике десульфурации металла шлаком
Примеси серы в стали, в количествах свыше 0.005 мас. %, существенно снижают ее механические, электротехнические, антикоррозийные и другие свойства, ухудшают свариваемость металла, приводят к появлению красно и хладноломкости. Поэтому процесс десульфурации стали, особенно эффективно протекающий со шлаком, имеет большое значение для качественной металлургии.
Исследование кинетических закономерностей реакции, выявления ее механизма и режима протекания необходимо для эффективного управления скоростью десульфурации, т.к. в реальных условиях металлургических агрегатов равновесное распределение серы между металлом и шлаком обычно не достигается.
В отличие от большинства других примесей в стали переход серы из металла в шлак является процессом восстановительным, а не окислительным
1. [S] +2e = (S2–).
Это означает, что для непрерывного протекания катодного процесса, приводящего к накоплению положительных зарядов на металле, необходим одновременный переход других частиц, способных отдавать электроны в металлическую фазу. Такими сопутствующими анодными процессами могут быть окисление анионов кислорода шлака или частиц железа, углерода, марганца, кремния и других примесей металла в зависимости от состава стали.
2. (O2–) = [O] + 2e,
3. [Fe] = (Fe2+) + 2e,
4. [C] + (O2–) = CO + 2e,
5. [Mn] = (Mn2+) +2e.
В совокупности катодный и какой-либо один анодный процесс позволяет записать стехиометрическое уравнение реакции десульфурации в следующем виде, например:
6. (CaO) + [S] = (CaS) + [O], H = 33 кДж/моль,
7. [Fe] + [S] +(CaO)= (FeO) + (CaS). H = – 92 кДж/моль.
Здесь дополнительно приведены приближенные значения тепловых эффектов реакций в области температур, при которых проводится моделирование.
Соответствующие выражения для констант равновесия имеют вид
|
(15.1) |
|
(15.2) |
Очевидно, выбранные в качестве примера процессы и подобные им могут происходить одновременно. Из соотношения (15.1) следует, что степень десульфурации металла при постоянной температуре, т.е. постоянном значении константы равновесия, увеличивается, например, с ростом концентрации свободного иона кислорода (О2–) в оксидном расплаве. Действительно, рост активности иона кислорода в знаменателе должен компенсироваться убылью другого сомножителя – активности серы, чтобы соответствовать неизменному значению константы равновесия. Известно, что содержание свободных ионов кислорода увеличивается при использовании высокоосновных, богатых оксидом кальция шлаков. Именно такие шлаки используют для десульфурации выплавленной стали. Анализируя соотношение (15.2) можно заключить, что содержание ионов железа (Fe2+) в оксидном расплаве должно быть минимальным, т.е. шлаки должны содержать минимальное количество оксидов железа. Присутствие в металле раскислителей (Mn, Si, Al, C) также повышает полноту десульфурации стали за счёт уменьшения содержания (Fe2+) и [O].
Отметим, что реакция 6 сопровождается поглощением тепла, а реакция 7 – выделением. О том, какая из реакций получает наибольшее развитие, можно судить просто по изменению температуры в агрегате, пока не включено перемешивающее устройство.
При кинетическом описании десульфурации следует в первую очередь учитывать следующие стадии процесса:
доставку частиц серы из объема металла к границе со шлаком, реализующуюся сначала за счет конвективной диффузии, а непосредственно вблизи границы раздела металл–шлак – молекулярной диффузии;
электрохимический акт присоединения электронов к атомам серы и образование анионов S2–, являющийся адсорбционно-химическим актом;
отвод анионов серы в объем шлака, за счет молекулярной, а затем конвективной диффузии.
Аналогичные стадии характерны и для анодных этапов, с участием атомов Fe, Mn, Si или анионов O2–. Каждая из стадий вносит свой вклад в общее сопротивление процесса десульфурации. Движущей силой потока частиц через ряд указанных сопротивлений является разность их электрохимических потенциалов в неравновесной системе металл–шлак или пропорциональная ей разность фактического и равновесного электродных потенциалов на границе раздела фаз, называемая перенапряжением.
Скорость процесса, состоящего из ряда последовательных стадий, контролируется этапом с наибольшим сопротивлением. Такой этап называют лимитирующим. Скорость зависит от характеристик лимитирующего этапа. Характеристики других последовательных этапов не имеют значения, пока не произойдет смена лимитирующего этапа. В ходе смены лимитирующего этапа скорость процесса одновременно определяется характеристиками обоих этапов. В этом случае говорят, что реакция происходит в смешанном режиме. Все реальные процессы, строго говоря, происходят в смешанном режиме, но торможение какого-то этапа может быть заметно больше остальных.
В зависимости от механизма протекания лимитирующего этапа говорят о диффузионном или кинетическом режиме реакции. Сопротивление каждого этапа существенно зависит от природы и свойств системы, в частности, концентраций реагентов, температуры. Так, например, скорость электрохимического акта восстановления серы определяется величиной тока обмена
|
(15.3) |
где В – экспоненциальная функция температуры, C[S] и C(S2–) – концентрации серы в металле и шлаке, α – коэффициент переноса.
Скорость этапа доставки серы к границе фаз определяется предельным током диффузии этих частиц
|
(15.4) |
где D[S] – коэффициент диффузии серы, зависящий от температуры, β – конвективная постоянная, определяемая интенсивностью конвекции в расплаве, она пропорциональна квадратному корню из линейной скорости конвективных потоков в жидкости.
Имеющиеся экспериментальные данные свидетельствуют, что в обычных условиях конвекции расплавов электрохимический акт разряда ионов серы протекает относительно быстро, т.е. десульфурация тормозится в основном диффузией частиц в металле или шлаке. Однако с увеличением концентрации серы в металле диффузионные затруднения уменьшаются и режим процесса может измениться на кинетический. Этому способствуют также добавки углерода в железо, т.к. разряд ионов кислорода на границе углеродистый металл – шлак происходит со значительным кинетическим торможением.
Следует иметь в виду, что электрохимические представления о взаимодействии металлов с электролитами позволяют уточнить механизм процессов, понять в деталях происходящие явления. В то же время простые уравнения формальной кинетики в полной мере сохраняют свою справедливость. В частности, для грубого анализа результатов эксперимента, полученных со значительными погрешностями, уравнение для скорости реакции 7 может быть записано в простейшем виде с использованием концентраций реагентов в принятых единицах:
|
(15.5) |
где kf и kr – константы скорости прямой и обратной реакции. Значки «ω» указывают, что в уравнение входят неизвестные нам концентрации реагентов в поверхностном слое. Поскольку в реакции 7 стехиометрические множители при всех реагентах равны единице, их количества в ходе протекания процесса будут меняться на одинаковое число молей. Для тех реагентов, содержание которых невелико, такое изменение приведет к существенному, возможно многократному, изменению концентрации. Напротив, концентрации реагентов, содержание которых в системе велико – железo в металлической фазе и оксид кальция в шлаковой фазе, практически не изменятся. Концентрации таких компонентов можно включить в константу скорости.
Содержания остальных реагентов – серы (CaS) и железа (FeO) в щлаке и серы в металле, достаточно мало, чтобы их можно было считать компонентами бесконечно разбавленного раствора. В этом случае поверхностные концентрации пропорциональны концентрациям в ближайших к поверхности слоях, так называемым «приповерхностным» концентрациям и коэффициенты пропорциональности имеет смысл также включить в константы скорости.
В свою очередь, приповерхностные концентрации, которые мы обозначим индексом «s» можно выразить через известные объемные концентрации, скорость процесса в целом (v) и предельные скорости по каждому диффузионному этапу (vп):
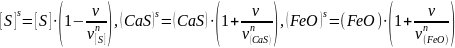
Предельные скорости диффузии выражаются уравнениями вида;

Здесь kDi включает конвективную постоянную (β), коэффициент диффузии (Di) и коэффициент пропорциональности между концентрациями, выраженными в молях на кубометр и массовых процентах для бесконечно разбавленных растворов.
После несложных преобразований, справедливых, если для диффузии ионов серы и железа в шлаке выполняется условие v < vп, приходим к следующему выражению:
|
(15.6) |
Очевидно, что в кинетическом режиме все слагаемые в знаменателе пренебрежимо малы по сравнению с единицей и уравнение легко поддается анализу. Применение метода наименьших квадратов к совокупности результатов позволяет раздельно оценить значения констант скоростей прямой (k*f) и обратной (k*r) реакций. Обратите внимание, что по физическому смыслу константа скорости существенно положительная величина. Невыполнение этого условия свидетельствует о том, что пренебрежение слагаемыми в знаменателе выражения (15.6) некорректно и скорость процесса в значительной мере определяется диффузионными затруднениями.