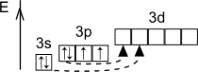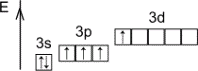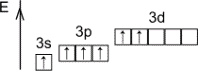- •Строение атома серы
- •Химические свойства серы
- •Сероводород
- •Качественная реакция на сероводород и растворимые сульфиды - образование темно-коричневого (почти черного) осадка PbS:
- •So2 (сернистый ангидрид; сернистый газ). Сернистая кислота
- •Оксид серы (VI) (серный ангидрид).
- •Серная кислота h2so4
- •Химические свойства концентрированной серной кислоты
- •Качественная реакция на сульфат-ион:
Сера
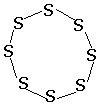
Сера – твердое (н.у.), хрупкое вещество желтого цвета, в воде не растворяется, диэлектрик. Для простого вещества серы известны три аллотропные модификации: ромбическая моноклинная и пластическая. Две первые модификации (они имеют общее название – кристаллическая сера) имеют молекулярное строение (состав S8), их кристаллы отличаются взаимной ориентацией циклических молекул S8, большую плотность имеет сера ромбическая. Сера пластическая – аморфна, полимер, в состав ее цепеобразных макромолекул может входить от 20 до миллиона атомов серы. В кристаллах и неводных растворах сера состоит (как правило) из молекул S8, пластическую серу можно получить быстрым охлаждением расплавленной кристаллической серы.
Сера в природе встречается как в самородном виде, так и в составе различных минералов и горных пород:
ZnS – цинковая обманка
FeS2 – пирит (серный или железный колчедан)
HgS – киноварь
PbS – свинцовый блеск
CaSO4 ∙2H2O – гипс
Na2SO4∙10H2O – мирабилит (глауберова соль)
MgSO4∙7H2O - горькая или английская соль.
Строение атома серы
Размещение электронов по уровням и подуровням
|
Основное состояние 1s22s22p63s23p4 |
|
Размещение электронов по орбиталям (последний слой) |
Степень окисления |
Валентность |
|
+2, -2 |
В основном состоянии II |
|
+4 |
Первое возбуждённое состояние IV |
|
+6 |
Второе возбуждённое состояние VI |
Ромбическая (a - сера) - S8 t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
|
Моноклинная (b - сера) - S8 темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую. |
Пластическая Sn коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую. |
|
|
|
Химические свойства серы
Взаимодействующее вещество |
Уравнение реакции |
Уравнение реакции |
Простые вещества |
||
Металлы |
Fe + S = FeS 2Al + 3S = Al2S3 Cu + S = CuS |
Сера окисляет многие металлы (кроме Au и Pt), причем Cu и Hg – уже при комнатной температуре. Образуются сульфиды. |
Неметаллы (кроме благородных газов, азота и йода) |
S + H2 ↔ H2S 2S + C = CS2 S + Cl2 = SCl2 (S2Cl2, SCl4) S + O2 = SO2 3S + 2P = P2S3 |
Во всех реакциях (кроме реакции с О2 и галогенами) сера является окислителем. |
Сложные вещества |
||
Щелочи и кислоты окислители |
S + 2H2SO4 = 3SO2 + 2H2O S + 6HNO3 = H2SO4 + 6NO2 + 2H2O 3S + 6KOH = 2K2S + K2SO3 + 3H2O |
В реакциях с кислотами сера – восстановитель; со щелочами – как окислитель, так и восстановитель. |
Получение серы
1. Промышленный метод - выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода):
2H2S + O2 = 2S + 2H2O
3. Реакция Вакенродера
2H2S + SO2 = 3S + 2H2O
Применение
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д
Вода.
Вода – жидкость (н.у.) без запаха, цвета и вкуса. Между молекулами воды образуются достаточно прочные водородные связи, поэтому многие ее физические свойства аномальны (плотность жидкой воды больше, чем льда, высокие температуры кипения и плавления, высокая теплоемкость и теплопроводность и др.)
Химические свойства воды
Взаимодействующее вещество |
Уравнение реакции |
Уравнение реакции |
Простые вещества |
||
Металлы (даже при нагревании не реагируют с металлами в ЭРНМ за водородом) |
2K + 2H2O = 2KOH + H2↑ 2Al + 6H2O = 2Al(OH)3 + 3H2↑ Mg + 2H2O = Mg(OH)2 + H2↑ Zn + H2O = ZnO + H2↑ 3Fe + 4H2O = Fe3O4 + 4H2O↑ |
При обычных условиях с образованием Н2 и гидроксидов вода реагирует со щелочными и щелочноземельными металлами, амальгированным алюминием, при нагревании – с магнием; другие металлы, расположенные в ЭРНМ до водорода, реагируют с водой при нагревании с образованием Н2 и оксидов |
Неметаллы |
2H2O + F2 = 4HF + O2↑ H2O + C = CO + H2 H2O + Cl2 ↔ HCl + HClO |
В реакции со фтором вода – восстановитель, с углеводом - окислитель |
Сложные вещества |
||
Многие кислотные и основные оксиды (оксиды щелочных и щелочноземельных металлов) |
K2O + H2O = 2KOH SO3 + H2O = H2SO4 N2O5 + H2O = HNO3 |
Не реагирует с SiO2, амфотерными оксидами (Al2O3, ZnO, Fe2O3, Cr2O3, BeO, MnO2), а также CuO, MgO, FeO, MnO и др. |
Многие бинарные соединения металлов |
Al4C3 = 12H2O = 4Al(OH)3 + 3CH4↑ Al2S3 + 6H2O = 2Al(OH)3 + 3H2S↑ CaC2 + 2H2O = Ca(OH)2 + C2H2↑ NaH + H2O = NaOH + H2↑ Ca3N2 + 6H2O = 3Ca(OH)2 +2NH3↑ Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3↑ Ca2Si + 4H2O = 2Ca(OH)2 + SiH4↑ |
Водой разлагаются карбиды, гидриды, нитриды, фосфиды, силициды. Образуются гидроксид металла и соответствующее летучее водородное соединение (или водород) |
Другие реакции |
||
Ряд органических веществ |
CH4 + H2O → CO + 3H2 C2H4 + H2O → C2H5OH |
|
Разлагается при электролизе |
2H2O ↔ 2H2↑ + O2↑ |
|