
- •1. Вопрос
- •4.1. Периодический закон д.И. Менделеева
- •4.2. Периодическая система д. И. Менделеева
- •2.Вопрос
- •3.Вопрос
- •4.Вопрос
- •6.Вопрос
- •7.Вопрос
- •8.Вопрос
- •9.Вопрос
- •10. Вопрос
- •11.Вопрос
- •12.Вопрос
- •4. Свойства растворов неэлектролитов
- •7.4.1. Закон Рауля
- •7.4.2. Осмотическое давление
- •13.Вопрос
- •14.Вопрос
8.Вопрос
Кинетические представления о химическом равновесии
Если при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают необратимой, протекающей до конца.
К необратимым принято относить взаимодействия между веществами, в результате которых образуются осадки, газы и малодиссоциирующие вещества.
BaCl2 + H2SO4 = Ba SO4↓ + 2HCl
Na2CO3 + 2HNO3 = Na NO3 + H2CO3 (CO2↑ + H2O)
KOH + HCl = KCl + H2O
Множество химических реакций протекает обратимо. Их особенность состоит в том, что они не идут до конца, в системе всегда остается каждое из исходных веществ. Например, реакция получения йодистого водорода
H2 + J2 ↔ 2HJ
Реакцию, протекающую вправо, называют прямой, а влево - обратной. Если в системе скорость прямой реакции V равна скорости обратной реакции V, состояние системы называется химическим равновесием. Таким образом, кинетическим условием химического равновесия является равенство
Vпр = Vобр.
Если равенство скоростей является кинетическим условием равновесия, то равенство (DG)р,т = 0 - термодинамическим условием химического равновесия. Если (DG)р,т = 0, скорость прямой реакции Vпр при данных р и Т равна скорости обратной реакции Vобр.
Неравенству (DG)р,т < 0 отвечает неравенствоVпр > Vобр, при этом самопроизвольно идет прямая реакция и в системе накапливаются продукты реакции.
Когда (DG)р,т >0, Vпр < Vобр. Самопроизвольно при этом идет обратный процесс, и концентрация продуктов реакции в системе понижается.
Химическое равновесие характеризуется постоянным и вполне определенным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия химической реакции и обозначается КC.
Для обратимой реакции, протекающей в гомогенной системе (где все вещества жидкости или газы),
аА + dB ↔ mM + nN
константа равновесия имеет вид
![]() .
.
Выражение является записью закона действующих масс для обратимых реакций. Его можно вывести исходя из кинетических представлений. По закону действующих масс при равновесии Vпр = Vобр, тогда
![]()
![]()
При заданной температуре константа равновесия химической реакции равна отношению констант скоростей прямого и обратного процессов. Константа равновесия так же, как и константы скоростей к1 и к2, зависит от природы реагентов, температуры и не зависит от исходных концентраций в системе.
Рассмотрим изменение скорости прямой и обратной реакций во времени
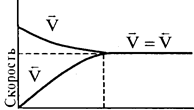
Рис. 3.5.
В начале скорость прямой реакции max, а скорость обратной реакции равна 0. По мере накопления продуктов концентрации исходных веществ уменьшаются, т.е.скорость прямой реакции уменьшаются, а скорость обратной реакции увеличивается.
В какой-то момент скорость прямой реакции равна скорости обратной реакции. При равновесии концентрации всех веществ связаны. Изменение концентрации любого вещества приводит к изменению концентрации остальных. Устанавливается новое равновесие, но КC = const.
Если в реакции участвуют газообразные вещества, то концентрации газообразных веществ в выражении могут быть сменены равновесными парциальными давлениями этих веществ:
![]()
Если обратимая реакция протекает в гетерогенной системе, то константа равновесия Кр равна отношению равновесных парциальных давлении газообразных веществ и не зависит от абсолютного и относительного количеств веществ, находящихся в конденсированном виде. КC и Кр связаны выражением:
Кр = КC ( R T ) Dn,
где Dn – изменение количества молей газообразных веществ в процессе реакции.
Величина КC показывает выход продукта. Если КC >> 1 – выход велик, если же КC << 1 – продукта мало.
