- •1. Вопрос
- •4.1. Периодический закон д.И. Менделеева
- •4.2. Периодическая система д. И. Менделеева
- •2.Вопрос
- •3.Вопрос
- •4.Вопрос
- •6.Вопрос
- •7.Вопрос
- •8.Вопрос
- •9.Вопрос
- •10. Вопрос
- •11.Вопрос
- •12.Вопрос
- •4. Свойства растворов неэлектролитов
- •7.4.1. Закон Рауля
- •7.4.2. Осмотическое давление
- •13.Вопрос
- •14.Вопрос
3.Вопрос
Атом- мельчайшая электронейтральная частица химического элемента, сохраняющая его свойства.
Атомная единица массы (а. е. м.)- 1/12 часть абсолютной массы атома углерода.
Молекула- наименьшая частица вещества, сохраняющая его химические свойства.
Относительная атомная масса элемента -число, показывающее, во сколько раз масса атома данного элемента больше 1/12 массы атома углерода.
Относительная молекулярная масса вещества -число, показывающее, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода.
Моль - количество вещества, содержащее столько же частиц (атомов, молекул или других), сколько содержится атомов углерода в 0,012 кг (12 г) углерода.
Моль - количество вещества, содержащее 6,02х 1023 молекул, атомов или других частиц.
Число na — 6,02х 1023 моль-1 называется постоянной Авогадро.
Абсолютную массу молекулывещества В можно рассчитать по уравнению: тв = Мв /NA, где Мв - молярная масса вещества В.
Эквивалентом элемента (Э) называют такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Эквивалент элемента Э можно вычислить, исходя из его атомной массы А и валентности В по формуле Э = А/В. Например, эквивалент кислорода равен 8, так как валентность кислорода всегда равна двум: Э0 = 16/2 = 8.
Масса 1 эквивалента элемента называется его эквивалентной массой.
Эквиваленты выражаются в молях, а эквивалентные массы — в г/моль.
Эквивалент не является постоянной величиной, а зависит от валентности элемента в том или ином соединении. Например, в соединениях NH3, H2S и НСl эквивалент (Э) и эквивалентная масса (тэ) азота, серы и хлора равны Э(N) - 1/3 моль; Э(S) - 1/2 моль; Э(Сl) = 1 моль и mэ(N) = 1/3 х 14 = 4,67 г/моль; mЭ(S) = 1/2 х 32 = 16 г/моль; тЭ(Cl) = 1 х 35,5 = 35,5 г/моль. В соединении SO2 сера четырёхвалентна и её эквивалентная масса равна тэ(S) = 64/4=16 г/моль.
Эквивалент оксида, основания, кислоты и соли:
Эоксида = Mоксида /(число атомов элемента х валентность элемента);
Эоснования = Моснования / кислотность основания;
Экислоты = Мкислоты / основность кислоты;
Эсоли = Мсоли /(число атомов металла х валентность металла), где М— мольная масса соединений.
Например, Э(А12О3) = 102/(2x3) = 17; Э(А1(ОН)3) = 78/3 = 26; Э(Н2S04) = 98/2 = 49; Э(А12(SО4)3) =342 /(2x3) = 57.
4.Вопрос
Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах. Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения. Появление атомной модели Бора, впервые объяснившей строение электронной оболочки, способствовало созданию представления о химической связи и её электронной природе. В соответствии с моделью Бора электроны могут занимать в атоме положения, которым отвечают определенные энергетические состояния, т. е. энергетические уровни. В 1915г. немецкий физик Коссель дал объяснение химической связи в солях, а в 1916 году американский учёный Льюис предложил трактовку химической связи в молекулах. Они исходили из представлений о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов (полного заполнения внешнего электронного слоя). Представления Косселя и Льюиса получили названия электронной теории валентности. Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней. Различают три основных типа химической связи: ковалентную, ионную, металлическую.
Таблица.Типы химической связи и их основные отличительные признаки.
Химическая связь |
Связываемые атомы |
Характер элементов |
Процесс в электронной оболочке |
Образующиеся частицы |
Кристаллическая решетка |
Характер вещества |
Примеры |
Ионная |
Атом металла и атом неметалла |
Электроположительный и электро отрицательный |
Переход валентных электронов |
Положительные и отрицательные ионы |
Ионная |
Солеобразный |
NaCl CaO NaOH |
Ковалентная |
Атомы неметаллов (реже-атомы металлов) |
Электроотрицательный реже электроположительный |
Образование общих электронных пар, заполнение молекулярных орбиталей |
Молекулы
|
Молекулярная
|
Летучий или нелетучий |
Br2 CO2C6H6 |
--------- |
Атомная |
Алмазоподоб ный |
Алмаз Si SiC |
||||
Металличес кая |
Атомы металлов |
Электроположительный |
Отдача валентных электронов |
Положительные ионы и электронный газ |
Металлическая |
Металлическая |
Металлы и сплавы |
КОВАЛЕНТНАЯ СВЯЗЬ.
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др. |
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2. Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером. |
Неоходимо ввести понятие электроотрицательность. Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
 ряд
электроотрицательностей
ряд
электроотрицательностей
Относительные электроотрицательности элементов (по Полингу)
группа |
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
||||
период |
||||||||||||
1 |
H 2,1 |
|
|
|
|
|
|
|
He - |
|||
2 |
Li 0,97 |
Be 1,47 |
B 2,01 |
C 2,50 |
N 3,07 |
O 3,5 |
F 4,10 |
|
Ne - |
|||
3 |
Na 1,01 |
Mg 1,23 |
Al 1,47 |
Si 1,74 |
P 2,1 |
S 2,6 |
Cl 2,83 |
|
Ar - |
|||
4 |
K 0,91 |
Ca 1,04 |
Sc 1,20 |
Ti 1,32 |
V 1,45 |
Cr 1,56 |
Mn 1,60 |
Fe 1,64 |
Co 1,70 |
Ni 1,75 |
|
|
Cu 1,75 |
Zn 1,66 |
Ga 1,82 |
Ge 2,02 |
As 2,20 |
Se 2,48 |
Br 2,74 |
|
Kr - |
||||
5 |
Rb 0,89 |
Sr 0,99 |
Y 1,11 |
Zr 1,22 |
Nb 1,23 |
Mo 1,30 |
Tc 1,36 |
Ru 1,42 |
Rh 1,45 |
Pd 1,35 |
|
|
Ag 1,42 |
Cd 1,46 |
In 1,49 |
Sn 1,72 |
Sb 1,82 |
Te 2,01 |
I 2,21 |
|
Xe - |
||||
6 |
Cs 0,86 |
Ba 0,97 |
La* 1,08 |
Hf 1,23 |
Ta 1,33 |
W 1,40 |
Re 1,46 |
Os 1,52 |
Ir 1,55 |
Pt 1,44 |
|
|
Au 1,42 |
Hg 1,44 |
Tl 1,44 |
Pb 1,55 |
Bi 1,67 |
Po 1,76 |
At 1,90 |
|
Rn - |
||||
7 |
Fr 0,86 |
Ra 0,97 |
Ac** 1,00 |
*Лантаноиды - 1,08 - 1,14 **Актиноиды - 1,11 - 1,20 |
||||||||
|
Элементы, стоящие левее, будут оттягивать общие электроны от элементов стоящих правее. Для наглядного изображения ковалентной связи в химических формулах используются точки ( каждая точка отвечает валентному электрону, а также черта отвечает общей электронной паре ). Пример. Связи в молекуле Cl2 можно изобразить так:
![]()
Такие записи формул равнозначны. Ковалентные связи обладают пространственной направленностью. В результате ковалентного связывания атомов образуются либо молекулы, либо атомные кристаллические решётки со строго определенным геометрическим расположением атомов. Каждому веществу соответствует своя структура. С позиции теории Бора образование ковалентной связи объясняется тенденцией атомов преобразовывать свой внешний слой в октет ( полное заполнение до 8 электронов).Оба атома представляют для образования ковалентной связи по одному неспаренному электрону, и оба электрона становятся общими. Пример. Образование молекулы хлора.
![]()
Точками обозначены электроны. При расстановке следует соблюдать правило:электроны ставятся в определённой последовательности-слева, сверху, справа,снизу по одному, затем добавляют по одному, неспаренные электроны и принимают участие в образовании связи.
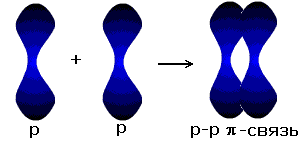
Новая электронная пара, возникшая из двух неспаренных электронов, становится общей для двух атомов хлора. Существует несколько способов образования ковалентных связей за счёт перекрывания электронных облаков.
s-s- связь |
|
s-p- связь |
|
p-p- связь |
|
p-p- связь |
|
σ - связь значительно прочнее π-связи, причём π-связь может быть только с σ-связью, За счёт этой связи образуются двойные и тройные кратные связи.
Полярные ковалентные связи образуются между атомами с разной электроотрицательностью.
За счёт смещения электронов от водорода к хлору атом хлора заряжается частично отрицательно, водорода-частично положительно, т.е. молекула станет диполем.