
- •Лекція 9. Прості та складні ефіри. Ліпіди. Мила і детергенти
- •Прості ефіри (етери) – похідні спиртів, в молекулі яких атом водню спиртової групи – он заміщений на вуглеводневий радикал. Загальна формула r–o–r1
- •Способи добування
- •3. Естери
- •Добування естерів
- •5. Ліпіди. Загальна характеристика. Номенклатура.
- •Мила та детергенти.
- •Стериди. Воски.
Лекція 9. Прості та складні ефіри. Ліпіди. Мила і детергенти
План
Визначення, ізомерія, номенклатура етерів
Добування етерів. Фізичні та хімічні властивості етерів
Визначення, ізомерія, номенклатура естерів
Добування естерів. Фізичні та хімічні властивості естерів
Ліпіди. Загальна характеристика, класифікація, номенклатура.
Способи одержання жирів. Фізичні та хімічні властивості ліпідів
Мила і детергенти. Загальна характеристика, класифікація, номенклатура
Фізико-хімічні властивості мила. Способи добування
Стериди, воски. Складні ліпіди
Вплив миючих засобів на стан навколишнього середовища
Прості ефіри (етери) – похідні спиртів, в молекулі яких атом водню спиртової групи – он заміщений на вуглеводневий радикал. Загальна формула r–o–r1
Ізомерія. Для етерів характерна ізомерія карбонового ланцюга та метамерія. Метамерія – вид ізомерії, коли два і більше ефірів мають однакову молекулярну формулу, але різну будову молекул за рахунок різних радикалів по обидва боки від кисневого «містка».
Номенклатура. Найчастіше використовують раціональну номенклатуру – назва складається з назв вуглеводневих залишків з додаванням слова «етер». За систематичною номенклатурою етери називають як вуглеводні, в молекулах яких є замісники – алкокси-(RO–) або арилоксигрупи (ArO–). За основу назви обирають вуглеводневий залишок з більшою кількістю атомів Карбону.

Способи добування
Міжмолекулярна дегідратація спирту
С2Н5ОН + СН3ОН → С2Н5–О– СН3
2. Алкілування спиртів або фенолів
С2Н5ОН + СН3Сl → С2Н5–О– СН3 + HCl
Взаємодія алкоголятів з галогеналканами
СН3Сl + С2Н5ОNa → С2Н5–О– СН3 + NaCl
Каталітичне приєднання спиртів до алкенів
![]()
Взаємодія ацетилену зі спиртами використовується для добування алкілвінілових етерів
![]() +
СН3ОН
→ СН2=СН–О–
СН3
+
СН3ОН
→ СН2=СН–О–
СН3
Фізичні властивості
Перші два члена гомологічного ряду – гази, наступні – безбарвні, леткі і горючі рідини, легші за воду. Вищі етери, починаючи з (С17Н35)2О – тверді речовини. Температури кипіння етерів нижчі, ніж температури кипіння відповідних спиртів. Це пояснюється відсутністю водневих зв’язків між їх молекулами.
Хімічні властивості
Етери – хімічно інертні речовини. Вони надзвичайно важко гідролізують, не взаємодіють з лугами, більшістю кислот.
Горіння. При взаємодії з киснем горять, можливий вибух.
Взаємодія з йодоводнем. Відбувається під час нагрівання і зумовлює розрив С–О зв’язку. Використовують для визначення будови молекули етерів.
![]()
Взаємодія з металічним натрієм під час нагрівання також зумовлюють розрив зв’язку.
С2Н5–О–СН3 + Na → С2Н5–ОNa + Na– СН3
Алкоголят
Утворення оксонієвих сполук
З сильними протонними так і з апротонними кислотами утворюють солеподібні сполуки з тривалентним позитивно зарядженим атомом кисню. Ці сполуки називають оксонієвими. Атом кисню молекули простого ефіру віддає на утворення зв’язку з протоном пару електронів і утворює з ним донорно-акцепторний зв'язок. Саме протонуванням пояснюється розчинність етерів у сильних кислотах, наприклад у концентрованій сульфатній кислоті:

5. утворення пероксидів і гідропероксидів.
Під час зберігання на світлі етери окиснюються з утворенням перекисних сполук:
R–CH2–O–R1 → R–CH–O–R1
O–OH
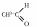 6.
гідроліз ненасичених ефірів
6.
гідроліз ненасичених ефірів
СН3–О–СН=СН2 + Н2О → СН3–ОН +
