
- •Лекція 8. Карбонові кислоти. Гетерокислоти
- •4. Окремі представники.
- •5. Дикарбонові насичені кислоти. Номенклатура. Ізомерія.
- •6. Способи добування.
- •7. Окремі представники
- •8. Ненасичені одноосновні кислоти
- •Ненасичені одноосновні кислоти з одним подвійним зв’язком
- •Двоосновні кислоти з кратними зв’язками
- •10. Ароматичні кислоти
- •12. Гідроксикислоти
- •14. Оксокислоти (альдегідо- і кетокислоти).
5. Дикарбонові насичені кислоти. Номенклатура. Ізомерія.
Двоосновними (дикарбоновими) кислотами називаються похідні вуглеводнів у яких два атоми гідрогену, що розміщені біля різних атомів Карбону, заміщені двома карбоксильними групами. Загальна формула –СnН2n(СООН)2.
Ізомерія Структурна ізомерія аліфатичних насичених двоосновних кислот зумовлена будовою карбонового ланцюга.
Номенклатура. Найбільш поширені тривіальні назви: щавлева, бурштинова, адипінова та ін.
Кислоти, в яких обидві карбоксильні групи знаходяться при одному атомі карбону, часто називаються малоновими кислотами, наприклад:
|
|
малонова кислота |
метилмалонова кислота |
Також використовують раціональну номенклатуру та номенклатуру IUPAC. За раціональною номенклатурою до назви алкану додають дикарбонова кислота. Наприклад, щавлева кислота – етандикарбонова кислота. За номенклатурою IUPAC двоосновні кислоти отримують назви від назв вуглеводнів, які містять таку кількість атомів карбону, що й кислота, з додаванням закінчення -діова і слова кислота, наприклад:
|
|
2-метилбутандіова кислота-1,4 |
2,4-диметилпентандіова кислота-2,5 |
Гомологічний ряд
№ |
формула |
Тривіальна назва |
Назва згідно з IUPAC. |
1. |
НООС–СООН |
щавлева |
етандіова |
2. |
НООС–СН2–СООН |
малонова |
пропандіова |
3. |
НООС–(СН2)2–СООН |
бурштинова |
бутандіова |
4. |
НООС–(СН2)3–СООН |
глутарова |
пентандіова |
5. |
НООС–(СН2)4–СООН |
адипінова |
гександіова |
6. |
НООС–(СН2)5–СООН |
пімелінова |
гептандіова |
7. |
НООС–(СН2)6–СООН |
пробкова |
октандіова |
6. Способи добування.
Двоосновні насичені карбонові кислоти поширені у природі, містяться в багатьох рослинах, овочах, фруктах, коренеплодах. Вони є проміжними продуктами обміну ( наприклад, янтарна в циклі Кребса) або кінцевими (щавлева в щавлі).
Загальні способи добування двоосновних кислот у багатьох випадках подібні до способів добування одноосновних кислот. Так, їх можна добути окисленням гліколів або діальдегідів, омиленням нітрилів і т.д.
1. Окислення двоатомних первинних спиртів (гліколей). Етиленгліколь при окисленні утворює щавлеву кислоту:
 .
.
2. Окислення діальдегідів. Наприклад, гліоксаль при окисленні утворює щавлеву кислоту:
 .
.
Омилення динітрилів:
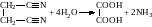 .
.
4. Синтези з ацетооцтовим і малоновим ефірами. Для добування двоосновних кислот, як і для одноосновних, можуть служити вихідними матеріалами ацетооцтовий ефір, малоновий ефір і його гомологи.
Фізичні властивості. Всі двоосновні насичені кислоти являють собою кристалічні речовини, добре розчинні у воді. Кислоти з парним числом атомів Карбону мають вищі температури плавлення, ніж кислоти з непарним. Розчинність у воді кислот з парним числом атомів карбону значно нижча, ніж розчинність кислот з непарним числом.
Хімічні властивості. Всі двоосновні кислоти більш сильні, ніж одноосновні з тим же числом атомів карбону. Зі зростанням числа карбонових атомів, а також збільшенням відстані між карбоксильними групами кислоти стають дедалі слабшими.
Загальні хімічні властивості двоосновних кислот відповідають таким властивостям одноосновних кислот. Маючи дві карбоксильні групи, вони утворюють два ряди солей (кислі й середні), амідів (неповні й повні) та інших похідних.
Тільки для двоосновних кислот характерні такі реакції:
1. Щавлева та малонова кислоти, а також гомологи останньої при нагріванні легко розкладаються з виділенням СО2 та одноосновних кислот:
 ,
,
 .
.
2. Двоосновні кислоти, в яких карбоксильні групи перебувають в положенні 1,4 та 1,5 (янтарна, глутарова) при нагріванні легко втрачають одну молекулу води і дають циклічні ангідриди, які важко сполучаються знову з водою:
 .
.




