
- •2.Сформулируйте первый закон Гиббса-Коновалова. Проиллюстрируйте его с помощью диаграмм состояния системы с идеальными растворами и неидеальной азеотропной системы.
- •20.В каких случаях и с какой целью можно применять перегонку веществ с водяным паром? Приведите выражение, определяющее выход вещества в дистилляте на единицу массы пара.
- •1.Термодинам.Константа диссоц-и и степень диссоц-и электролита, зависимость этих хар-к от различ.Факторов.Изм-ся ли назв.Величины для уксус.К-ты в вод.Р-ре, если в р-р добавить ацетат натрия?
- •2.Константа диссоциации и степень диссоциации слабого электролита. Изм.Ли конст. Дис-и и степ.Дис. Бенз.К-ты в вод.Р-ре, если в р-р ввести сильную к-ту.
- •3.Вывод и анализ з-на разведения Оствальда для эл-та валентного типа 1:1.Влияние конц.И темп. На конст.Дис-ции и степ.Дис.Эл-тов.
- •4.Сформул-те основ.Полож.Теории эл.Дис.Аррениуса.Константа дис.,степ.Дис. Наз-те осн.Причины,вызыв.Дис. Растворенных в-в на ионы в р-ре.От каких факторов зависит α?
- •5.Сильные и слабые электролиты.Колич-ые хар-ки дис-ции. Α,Кд. Зав-ть этих величин от природы раств-ля, конц, темп.
- •6.Проводники эл.Тока I и iIрода.Уд.Моляр.И эквив.Электрич.Проводимости,связь м/у ними. Зав-ть уд.И моляр. Электрич.Проводимостей от конц-и.
- •12.Числа переноса ионов в р-ре данного эл-та,их связь с эл-ой пров-тью ионов.Эстафет.Механизм переноса эл-го тока ионами гидроксила.
- •13.Что означает термин»уд.Эл.Пр-ть»?Размер-ть.Нар-те схем-ки график зависимости уд.Эл.Пров-ти от конц-ии.Объясните вид представ.Завис-ти в обл-ти малых,ср,и выс.Конц.
- •14.Молек.Эл.Провод-ть р-ров эл-тов,понятие,ед. Изм.Зав-ть мол.Эл.Пров-ти от c,t,и природы р-ля.Объясните хар-р зав-ти для слаб.И сил.Эл-тов.
- •15.Моляр.И экв.Пров-ть р-ров эл-тов.Связь моляр.Эл-ой проводимости с абс.Скоростями,движения(подвижностями) ионов. Коэф.Эл-ой пров-ти.
- •23.Методы определения молярной электрической проводимости растворов слабых и сильных электролитов при бесконечном разведении.
- •29.Основные положения теории Дебая-Хюккеля. Зависимость коэффициента активности иона от ионной силы раствора. Предельный закон Дебая-Хюккеля.
- •30.Активность и коэффициент активности. Связь между активностью электролита и средними ионными: моляльностью, активностью и коэффициентом активности для электролита валентного типа «(дан тип)».
- •44.Электрохимическая форма уравнения Гиббса-Гельмгольца. Зависимость эдс гальванического элемента от температуры. Температурный коэффициент эдс.
- •58.Химические гальванические элементы, основные типы, примеры. Применение измерений эдс для определения тепловых эффектов и энтропий химических реакций, самопроизвольно протекающих в элементах.
- •60.Химические цепи с переносом. Уравнение Нернста для расчёта эдс гальванического элемента составленного из газового и окислительно-восстановительного электродов. Влияние рН на эдс элемента.
- •74.Предложите гальванический элемент, с помощью которого можно определить и для реакции (дано уравнение). Какие данные необходимо получить для расчета указанных термодинамических функций.
1.Для двухкомпонентной системы с идеальными растворами изобразите схематически изотермическое сечение диаграммы состояния (P-x(y)-диаграмму кипения при T=const). Укажите фазовые поля (области) диаграммы. Запишите уравнение линии жидкости и назовите входящие в него величины. Пар считайте идеальным газом.
2.Сформулируйте первый закон Гиббса-Коновалова. Проиллюстрируйте его с помощью диаграмм состояния системы с идеальными растворами и неидеальной азеотропной системы.
Первом закон Коновалова: Насыщенный пар по сравнению с равновесным раствором обогащён тем компонентом, температура кипения которого ниже.
Идеальный раствор:
 азеотропы(неидеальный):
азеотропы(неидеальный):

3.Изобразите схематически T-x(y)-диаграмму кипения (при P=const) двухкомпонентной азеотропной системы с положительными отклонениями от идеальности. Дайте краткую характеристику диаграммы (назовите фазовые поля, линии, характерные точки). Изобразите соответствующий график зависимости равновесного состава пара от состава жидкости.
Азеотропные смеси – смеси, на диаграммах состояния (раствор – пар) которых имеется максимум или минимум. Здесь низкокипящий азеотроп.
Положительное отклонение от идеальности:

Можно выделить только азеотроп, в кубовом остатке будет находится компонент, присутствующий в избытке по отношению к азеотропу.

График зависимости состава пара от состава жидкости

4.Изобразите схематически T-x(y)-диаграмму кипения (при P=const) двухкомпонентной азеотропной системы с отрицательными отклонениями от идеальности. Дайте краткую характеристику диаграммы (назовите фазовые поля, линии, характерные точки). Изобразите соответствующий график зависимости равновесного состава пара от состава жидкости.
Здесь высококипящий азеотроп. Отрицательное отклонение от идеальности.
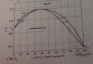
Можно выделить в форме дистиллята, образующегося при конденсации пара, тот компонент, который находится в избытке по отношению к азеотропу. Сам азеотроп останется в кубовом остатке.
5.Изобразите схематически P-x(y)-диаграмму кипения (при T=const) двухкомпонентной азеотропной системы с положительными отклонениями от идеальности. Дайте краткую характеристику диаграммы (назовите фазовые поля, линии, характерные точки). Изобразите соответствующий график зависимости равновесного состава пара от состава жидкости.
Положительное отклонение от идеальности:
Можно выделить только азеотроп, в кубовом остатке будет находится компонент, присутствующий в избытке по отношению к азеотропу.

График зависимости состава пара от состава жидкости
6.Изобразите схематически P-x(y)-диаграмму кипения (при T=const) двухкомпонентной азеотропной системы с отрицательными отклонениями от идеальности. Дайте краткую характеристику диаграммы (назовите фазовые поля, линии, характерные точки). Изобразите соответствующий график зависимости равновесного состава пара от состава жидкости.
Здесь высококипящий азеотроп. Отрицательное отклонение от идеальности.
Можно выделить в форме дистиллята, образующегося при конденсации пара, тот компонент, который находится в избытке по отношению к азеотропу. Сам азеотроп останется в кубовом остатке.
7.Изобразите схематически диаграммы кипения P-x(y) (при T=const) и T-x(y) (при P=const) для азеотропной системы с отрицательными отклонениями от идеальности. Приведите наименования всех линий, фазовых полей и характерных точек этих диаграмм. Проиллюстрируйте применение правила фаз Гиббса к представленным диаграммам.
Здесь высококипящий азеотроп. Отрицательное отклонение от идеальности.
Можно выделить в форме дистиллята, образующегося при конденсации пара, тот компонент, который находится в избытке по отношению к азеотропу. Сам азеотроп останется в кубовом остатке.
Правило фаз: Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только температура и давление, равно числу независимых компонентов (kн), минус число фаз (Ф) плюс 2: С = kн – Ф + 2
8.Изобразите схематически диаграммы кипения P-x(y) (при T=const) и T-x(y) (при P=const) для азеотропной системы с положительными отклонениями от идеальности. Приведите наименования всех линий, фазовых полей и характерных точек этих диаграмм. Проиллюстрируйте применение правила фаз Гиббса к представленным диаграммам.
Положительное отклонение от идеальности:
Можно выделить только азеотроп, в кубовом остатке будет находится компонент, присутствующий в избытке по отношению к азеотропу.
Правило фаз: Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только температура и давление, равно числу независимых компонентов (kн), минус число фаз (Ф) плюс 2: С = kн – Ф + 2
9.Сформулируйте второй закон Гиббса-Коновалова и проиллюстрируйте его примером одной из диаграмм состояния в координатах P-x(y) (при T=const) и T-x(y) (при P=const). Изобразите график, представляющий зависимость равновесного состава пара от состава жидкой фазы.

В точках, соответствующих минимуму или максимуму, состав пара совпадает с составом жидкости (второй закон Коновалова) – здесь точка азеотропа
1 0.Выведите
уравнение, называемое правилом рычага,
назовите входящие в него величины.
Проиллюстрируйте графически правило
рычага на примере P-x(y)-диаграммы (при
T=const) состояния системы, в которой
сосуществуют идеальные растворы в
жидкой и паровой фазах.
0.Выведите
уравнение, называемое правилом рычага,
назовите входящие в него величины.
Проиллюстрируйте графически правило
рычага на примере P-x(y)-диаграммы (при
T=const) состояния системы, в которой
сосуществуют идеальные растворы в
жидкой и паровой фазах.
Состав фаз, находящихся в равновесии, определяется правилом рычага: если одна фаза при изменении параметров системы разлагается на две другие фазы, то количественное соотношение образующихся фаз будет обратно пропорционально длинам отрезков от точки состава исходной фазы до точек состава образующихся фаз
Для кипения:
Произведение
массы жидкой фазы на плечо, соединяющее
точку опоры (а)
с линией жидкости, равно произведению
массы пара, на плечо, соединяющее точку
(а)
с линией пара
![]()
Если известна общая масса системы m, то, используя правило рычага, можно найти массы сосуществующих фаз. Выразим массу пара через общую массу системы и массу жидкости:
![]()
Правило рычага в этом случае примет вид:
![]()
Определив по диаграмме размер отрезков ab и ac, можно найти массу жидкости, а затем и массу пара в двухфазной области. Правило рычага используют только в двухфазной области!
11.Проиллюстрируйте (посредством системы стрелок) на диаграмме «температура-состав» ход равновесного процесса изобарного нагревания бинарного жидкого раствора (T-x(y)-диаграмма при P=const). Укажите температуры начала и окончания фазового превращения, а также составы исчезающей и образующейся фаз. Приведите описание на примере конкретной бинарной закрытой системы (диаграмму выберите в справочнике).

12.Нарисуйте диаграмму фазового равновесия Т-х(y) (P=const) для системы с высококипящим азеотропом. Какие отклонения от идеальности характерны для подобных систем? Изобразите схематически (с помощью системы стрелок) как изменяется фазовый состав системы при переходе из состояния жидкости в состояние пара для двух растворов, один из которых отвечает составу азеотропа, а другой обогащен более летучим компонентом по сравнению с азеотропной смесью. Укажите температуры начала и окончания фазовых превращений, а также составы исчезающей и образующейся фаз. Что может быть выделено в дистилляте при ректификации выбранных жидких смесей и что останется в кубовом остатке?
Можно выделить в форме дистиллята, образующегося при конденсации пара, тот компонент, который находится в избытке по отношению к азеотропу. Сам азеотроп останется в кубовом остатке.
13.Нарисуйте диаграмму фазового равновесия Т-х(y) (P=const) для системы с низкокипящим азеотропом. Какие отклонения от идеальности характерны для подобных систем? Изобразите схематически (с помощью системы стрелок) как изменяется фазовый состав системы при переходе из состояния пара в состояние жидкости для двух растворов, один из которых отвечает составу азеотропа, а другой обогащен более летучим компонентом по сравнению с азеотропной смесью. Укажите температуры начала и
окончания фазовых превращений, а также составы исчезающей и образующейся фаз. Что может быть выделено в дистилляте при ректификации выбранных жидких растворов и что останется в кубовом остатке?
Положительное отклонение от идеальности:

Можно выделить только азеотроп, в кубовом остатке будет находится компонент, присутствующий в избытке по отношению к азеотропу.
17.Диаграмма состояния двухкомпонентной системы А-В характеризуется максимумом на кривых «температура-состав» при постоянном давлении. Компонент А является менее летучим, чем вещество В. Схематически изобразите названную диаграмму. Укажите составы дистиллята и кубового остатка при ректификации жидкой смеси, которая более богата компонентом А по сравнению с азеотропной смесью. Какие отклонения от идеальности растворов проявляются в данной системе? Приведите необходимые пояснения.
18.Запишите уравнение, выражающее правило рычага, и назовите входящие в него величины. Проиллюстрируйте его примером T-x(y)-диаграммы кипения (при P=const) двухкомпонентной системы (диаграмму выберите в справочнике). Укажите температуру, до которой необходимо нагреть систему выбранного состава для того, чтобы мольные количества жидкой и паровой фаз были бы одинаковы.
19.Запишите уравнение, выражающее правило рычага, и назовите входящие в него величины. Проиллюстрируйте его примером диаграммы взаимной растворимости двух ограниченно растворимых друг в друге жидкостей (диаграмму выберите в справочнике).
Состав фаз, находящихся в равновесии, определяется правилом рычага: если одна фаза при изменении параметров системы разлагается на две другие фазы, то количественное соотношение образующихся фаз будет обратно пропорционально длинам отрезков от точки состава исходной фазы до точек состава образующихся фаз
Для кипения:
Произведение массы жидкой фазы на плечо, соединяющее точку опоры (а) с линией жидкости, равно произведению массы пара, на плечо, соединяющее точку (а) с линией пара
Если известна общая масса системы m, то, используя правило рычага, можно найти массы сосуществующих фаз. Выразим массу пара через общую массу системы и массу жидкости:
Правило рычага в этом случае примет вид:
Определив по диаграмме размер отрезков ab и ac, можно найти массу жидкости, а затем и массу пара в двухфазной области. Правило рычага используют только в двухфазной области!
