
- •Химическая кинетика
- •Формальная кинетика
- •2. По обратимости
- •4. В зависимости от фазового состава реакционной смеси.
- •5. Кинетическая классификация на основании понятий
- •Кинетика простых необратимых реакций
- •2. Интегральные методы определения порядка реакции
- •3. Дифференциальные методы Вант-Гоффа
- •Сложные реакции
- •Принцип независимости (сосуществования) отдельных стадий
- •Типы сложных реакций.
- •Предельные случаи протекания последовательной реакции
- •Лимитирующая стадия последовательной реакции
- •Зависимость для вещества а
- •Зависимость скорости химической реакции от температуры
- •2. Определение
ЛЕКЦИИ ПО ФИЗИЧЕСКОЙ ХИМИИ – 3 курс, II часть
Химическая кинетика
Введение.
Химическая термодинамика отвечает на вопрос о принципиальной возможности и направлении химического процесса и устанавливает возможный его результат, т.е. природу продуктов реакции и соотношение между ними по завершении процесса. Другими словами, химическая термодинамика определяет равновесное состояние, к которому стремится анализируемая система (
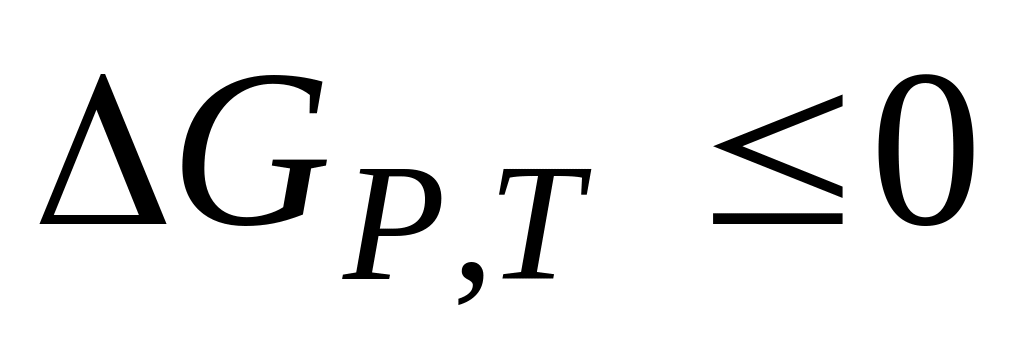 ).
).Однако термодинамическая возможность химической реакции еще не означает, что она будет реально протекать на практике.
Пример:
гремучая смесь,
![]() .
.
а)
![]() ,
самопроизвольный процесс
,
самопроизвольный процесс
б)
практическое отсутствие реакции при
![]() .
.
в)
изменение скорости взаимодействия
![]() и
и
![]() при введении катализатора (губчатой
при введении катализатора (губчатой
![]() ).
).
Указанный пример показывает недостаточность только термодинамического подхода при изучении химических процессов. Термодинамика, оперирующая лишь сведениями о начальном и конечном состоянии системы, не в состоянии ничего сказать о фактической реализуемости термодинамически возможного процесса, т.е. о том как быстро, за какое время он будет осуществлен.
4. Вопросами скоростей занимается раздел Химическая кинетика.
Химическая кинетика – наука о скоростях химических превращений, факторах, определяющих эти скорости, и механизме протекания реакций.
5. Содержание раздела “Химическая кинетика”.
формальная кинетика,
теории кинетики,
цепные и фотохимические реакции,
реакции в растворах
гетерогенная кинетика,
катализ
Формальная кинетика
Определение.
Формальная кинетика – раздел химической кинетики, занимающийся формальным количественным (макроскопическим) описанием скоростей химических превращений на основе экспериментальных данных без рассмотрения механизма протекающих процессов.
Основные понятия химической кинетики.
Скорость химической реакции.
а) Определение – изменение количества реагирующего вещества
в
единицу времени в единице объема:
![]() .
.
б)
![]()
в)
скорость р-ции, определенная по разным
реагентам, различна
![]()
г)
Общий случай,
![]()
![]()
![]()
![]() ,
т.к.
,
т.к.
![]()
Основной постулат химической кинетики.
а)
Определение:
![]()
![]()
б)
Константа скорости (удельная скорость)
реакции,
![]() .
.
3. Порядок реакции.
а)
Частные
![]() и общий порядки
и общий порядки
![]() реакции.
реакции.
б) Порядок реакции и стехиометрические коэффициенты,
Общий
случай:
![]()
в) Численные значения порядка реакции.
4. Молекулярность реакции.
а)
Определение. Число частиц, принимающих
участие в элементарном акте химического
взаимодействия. Элементарный акт хим.
взаимодействия (![]() )
– непосредственное превращение исходных
веществ в продукты реакции в одну стадию.
)
– непосредственное превращение исходных
веществ в продукты реакции в одну стадию.
б) Численные значения молекулярности реакции.
5. Различие понятий порядок и молекулярность реакции.
а) молекулярность – вполне определенный физический смысл, порядок, порядок – формальное понятие
б) понятие молекулярности неприменимо к сложным реакциям
в) целые значения для молекулярности, любые – для порядка.
Классификация химических реакций
1. По природе частиц, принимающих участие в химическом акте
(молекулярные, ионные, радикальные и т.д.). Основные типы частиц: молекулы, атомы, ионы, радикалы, комплексные частицы.
