
- •11. Строение алканов
- •2. Систематическая номенклатура Правила систематической номенклатуры:
- •2. Затем эту цепь нумеруем с того конца, к которому ближе расположен заместитель (радикал). Заместители перечисляем по алфавиту.
- •19. Способы получения алкенов
- •21. Реакция полимеризации. Полиэтилен
- •22. Особенности степени полимеризации:
- •25. Натуральный и синтетический каучуки
- •28.Получение алкинов
- •29.Физические свойства алкинов.
- •Химические свойства алкинов.
- •43. Гликоли и глицерины-Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-он), соединённых с углеводородным радикалом
- •48. Изомерия альдегидов и кетонов
- •55. Одноосновные предельные карбоновые кислоты
- •56.Номенклатура
- •57. Гомологический ряд
- •59. Химические свойства карбоновых кислот.
- •68.Углеводы классификация: можно разделить на три группы:
- •75. Крахмал
- •Физические свойства
- •Химические свойства
- •Применение
- •76. Целлюлоза, или клетчатка
- •Физические свойства
- •Состав и строение
- •Химические свойства. Применение целлюлозы
- •78.Гидролиз клетчатки
48. Изомерия альдегидов и кетонов
Для альдегидов и кетонов характерна структурная изомерия. Изомерия альдегидов: изомерия углеродного скелета, начиная с С4

межклассовая изомерия с кетонами, начиная с С3
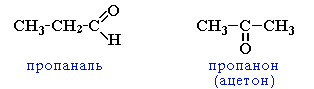
циклическими оксидами (с С2)
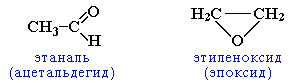
непредельными спиртами и простыми эфирами (с С3)
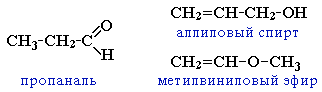
Изомерия кетонов:
углеродного скелета (c C5)
![]()
положения карбонильной группы (c C5)
![]()
межклассовая изомерия (аналогично альдегидам).
Алгоритм составления названий альдегидов
Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода альдегидной группы.
Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода альдегидной группы.
Назовите соединение по алгоритму для углеводородов.
В конце названия допишите суффикс -аль.
48.Химические
свойства
Химические свойства альдегидов и кетонов
в значительной степени обусловлены
наличием в их молекулах сильно полярной
карбонильной группы (связь ![]() поляризована
в сторону атома кислорода). Чем больше
частичный заряд (
поляризована
в сторону атома кислорода). Чем больше
частичный заряд (![]() +)
на атоме углерода этой группы, тем выше
активность соединения.
+)
на атоме углерода этой группы, тем выше
активность соединения.
Горение: 2CH3CHO + 5O2
 4CO2 +
4H2O
2CH3COCH3 +
9O2
6CO2 +
6H2O
4CO2 +
4H2O
2CH3COCH3 +
9O2
6CO2 +
6H2O
Присоединение
(по двойной связи карбонильной группы).
В
ряду HCHO
RCHO
RCOR'
склонность к реакциям присоединения
уменьшается. Это связано с наличием и
числом углеводородных радикалов,
связанных с атомом углерода карбонильной
группы.
а) Гидрирование (восстановление
водородом): HCHO
+ H2 ![]() CH3OH
CH3—CO—CH3 +
H2
CH3—CH(OH)—CH3
CH3OH
CH3—CO—CH3 +
H2
CH3—CH(OH)—CH3
Из альдегидов при этом получаются первичные спирты, а из кетонов - вторичные. Окисление:
CH3CHO
+ Ag2O ![]() 2Ag
2Ag![]() +
CH3COOH
(реакция "серебряного зеркала" -
качественная реакция)
HCHO + 2Cu(OH)2
2H2O
+ Cu2O
+
HCOOH (образуется красный осадок -
качественная реакция)
+
CH3COOH
(реакция "серебряного зеркала" -
качественная реакция)
HCHO + 2Cu(OH)2
2H2O
+ Cu2O
+
HCOOH (образуется красный осадок -
качественная реакция)
Кетоны
слабыми окислителями не окисляются.
Замещение атомов водорода в углеводородном
радикале (замещение происходит
в ![]() -положение,
т. е. замещается атом водорода у 2-го
атома углерода):
-положение,
т. е. замещается атом водорода у 2-го
атома углерода):
49. Номенклатура альдегидов и кетонов Систематические названия альдегидов строят по названию соответствующего углеводорода и добавлением суффикса -аль. Нумерацию цепи начинают с карбонильного атома углерода.Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
Формула |
Название |
|
систематическое |
тривиальное |
|
H2C=O |
Метаналь |
муравьиный альдегид (формальдегид) |
CH3CH=O |
Этаналь |
уксусный альдегид (ацетальдегид) |
(CH3)2CHCH=O |
2-метил-пропаналь |
Изомасляныйальдегид |
CH3CH=CHCH=O |
бутен-2-аль |
кротоновый альдегид |
Систематические названия кетонов несложного строения производят от названий радикалов (в порядке увеличения) с добавлением слова кетон (радикально-функциональная номенклатура ). Например:
CH3–CO–CH3 - диметилкетон (ацетон); CH3CH2CH2–CO–CH3 - метилпропилкетон.
В общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе (заместительная номенклатура). Примеры: CH3–CO–CH3 - пропанон (ацетон); CH3CH2CH2–CO–CH3 - пентанон-2; CH2=CH–CH2–CO–CH3 - пентен-4-он-2.
50. ОКСОСОЕДИНЕНИЯ - это органические соединения, содержащие группу СО (карбонил) ; следовательно - к оксосоединениям относятся альдегиды, кетоны, альдегидо- и кетонокислоты и др. соединения, содержащие кетогруппу СО. ПРИМЕНЕНИЕ Метаналь (муравьиный альдегид) CH2=O получение фенолформальдегидных смол; получение мочевино- формальдегидных (карбамидных) смол; полиоксиметиленовые полимеры; синтез лекарственных средств (уротропин); дезинфицирующее средство; консервант биологических препаратов (благодаря способности свертывать белок). Этаналь (уксусный альдегид, ацетальдегид) СН3СН=О производство уксусной кислоты; органический синтез. Ацетон СН3-СО-СН3 растворитель лаков, красок, ацетатов целлюлозы; сырье для синтеза различных органических веществ.
51.КАРБОНОВЫЕ КИСЛОТЫ – органические соединения, содержащие одну или несколько карбоксильных групп –СООН. По числу этих групп различают моно-, ди, три- и тетракарбоновые кислоты (большее число групп –СООН в одной молекуле встречается редко). Карбоновые кислоты могут быть алифатическими – с нормальной и разветвленной цепью, циклическими и ароматическими, предельными и непредельными, содержать атомы галогенов и различные функциональные группы: ОН (оксикислоты), NH2 (аминокислоты), СО (кетокислоты) и т.д. Многие карбоновые кислоты в свободном состоянии, а также в виде различных производных (солей, эфиров) широко распространены в природе и играют важнейшую роль в жизнедеятельности растений и животных. Карбоновыми кислотами называются соединения, содержащие карбоксильную группу
![]() 52.
Классификация. По
числу карбоксильных групп карбоновые
кислоты делят на монокарбоновые, или
одноосновные (одна группа -СООН),
дикарбоновые, или двухосновные (две
группы -СООН) и т.д. В зависимости от
строения углеводородного радикала,
с которым связана карбоксильная группа,
карбоновые кислоты бывают алифатическими
(например, уксусная или акриловая),
алициклическими (например,
циклогексанкарбоновая) или ароматическими
(бензойная, фталевая). В таблице указаны
некоторые представители карбоновых
кислот.
52.
Классификация. По
числу карбоксильных групп карбоновые
кислоты делят на монокарбоновые, или
одноосновные (одна группа -СООН),
дикарбоновые, или двухосновные (две
группы -СООН) и т.д. В зависимости от
строения углеводородного радикала,
с которым связана карбоксильная группа,
карбоновые кислоты бывают алифатическими
(например, уксусная или акриловая),
алициклическими (например,
циклогексанкарбоновая) или ароматическими
(бензойная, фталевая). В таблице указаны
некоторые представители карбоновых
кислот.
 Если
в углеводородном радикале карбоновых
кислот атом (атомы) водорода замещен на
другие функциональные группы, то такие
кислоты называются гетерофункционапьными.
Среди них различают галогенкарбоновые
(например, CH2Cl—COOH),
нитро-кислоты (например, NO2—С6Н4СООН),
аминокислоты, оксикислоты (например,
молочная СН3—СН(ОН)—СООН)
и др. Карбоновые кислоты с числом атомов
углерода выше 6 называют высшими (жирными)
кислотами. Название "жирные" эти
кислоты получили потому, что большинство
из них могут быть выделены из жиров.
Если
в углеводородном радикале карбоновых
кислот атом (атомы) водорода замещен на
другие функциональные группы, то такие
кислоты называются гетерофункционапьными.
Среди них различают галогенкарбоновые
(например, CH2Cl—COOH),
нитро-кислоты (например, NO2—С6Н4СООН),
аминокислоты, оксикислоты (например,
молочная СН3—СН(ОН)—СООН)
и др. Карбоновые кислоты с числом атомов
углерода выше 6 называют высшими (жирными)
кислотами. Название "жирные" эти
кислоты получили потому, что большинство
из них могут быть выделены из жиров.
53. Строение. Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О-Н ослабляется:
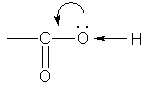
В свою очередь, группа ОН "гасит" положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Полезно подчеркнуть следующее важное обстоятельство, часто ускользающее от внимания читателей: карбоновые кислоты не единственный (хотя и самый многочисленный) класс органических веществ, обладающих кислотными свойствами. Очень сильными органическими кислотами являются сульфокислоты — органические соединения, содержащие сульфогруппу —SО3Н (например, метансульфокислота СН3SО3Н). Особенно важное значение имеют сульфокислоты ароматического ряда и их производные. Они являются промежуточными продуктами для синтеза различных органических веществ ( например, получение фенолов из сульфокислот ).
54. Номенклатура. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая кислота. Низшие карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная, масляная и др. Углеводородную цепь нумеруют начиная с атома углерода карбоксильной группы, например:
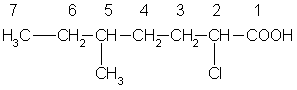 2-хлор-5-метилгептановая
кислота
2-хлор-5-метилгептановая
кислота
CH3—CH=CH—COOH бутен-2-овая кислота
Часто карбоксильную группу рассматривают как заместитель в молекуле углеводорода. При этом в названии употребляют словосочетание "карбоновая кислота" и в нумерацию атомов углерода цепи атом углерода карбоксильной группы не включают:
9 8 СН3(СН2)7СН=СН(СН2)7СООН
Гептадецен-8-карбоновая (олеиновая) кислота
Названия дикарбоновых кислот производят от названия соответствующего углеводорода с добавлением суффикса "диовая" и слова "кислота". Например, этандиовая (щавелевая) кислота (НООС-СООН). При рассмотрении карбоксильной группы как заместителя, название двухосновной кислоты производят от названия углеводородного радикала с добавлением словосочетания "дикарбоновая кислота". Например, малоновую кислоту (НООС-СН2-СООН) называют метандикарбоновой кислотой.
