
- •11. Строение алканов
- •2. Систематическая номенклатура Правила систематической номенклатуры:
- •2. Затем эту цепь нумеруем с того конца, к которому ближе расположен заместитель (радикал). Заместители перечисляем по алфавиту.
- •19. Способы получения алкенов
- •21. Реакция полимеризации. Полиэтилен
- •22. Особенности степени полимеризации:
- •25. Натуральный и синтетический каучуки
- •28.Получение алкинов
- •29.Физические свойства алкинов.
- •Химические свойства алкинов.
- •43. Гликоли и глицерины-Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-он), соединённых с углеводородным радикалом
- •48. Изомерия альдегидов и кетонов
- •55. Одноосновные предельные карбоновые кислоты
- •56.Номенклатура
- •57. Гомологический ряд
- •59. Химические свойства карбоновых кислот.
- •68.Углеводы классификация: можно разделить на три группы:
- •75. Крахмал
- •Физические свойства
- •Химические свойства
- •Применение
- •76. Целлюлоза, или клетчатка
- •Физические свойства
- •Состав и строение
- •Химические свойства. Применение целлюлозы
- •78.Гидролиз клетчатки
19. Способы получения алкенов
– крекинг
алканов C8H18 ––> C4H8 +
C4H10;
(термический крекинг при
400-700 oС)
октан бутен
бутан
–
дегидрирование алканов C4H10 ––>
C4H8 +
H2;
(t,
Ni)
бутан бутен
водород
– дегидрогалогенирование
галогеналканов C4H9Cl
+ KOH ––> C4H8 +
KCl + H2O;
хлорбутан гидроксид бутен
хлорид
вода
калия
калия
–
дегидрогалогенирование дигалогеналканов 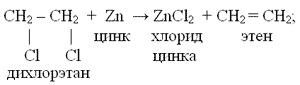 –
дегидратация спиртов С2Н5ОН
––> С2Н4 +
Н2О
(при нагревании в присутствии
концентрированной серной кислоты)
При
реакиях дегидрирования, дегидратации,
дегидрогалогенирования и дегалогенирования
нужно помнить, что водород отрывается
от менее гидрогенизированных атомов
углерода (правило Зайцева, 1875 г.)
–
дегидратация спиртов С2Н5ОН
––> С2Н4 +
Н2О
(при нагревании в присутствии
концентрированной серной кислоты)
При
реакиях дегидрирования, дегидратации,
дегидрогалогенирования и дегалогенирования
нужно помнить, что водород отрывается
от менее гидрогенизированных атомов
углерода (правило Зайцева, 1875 г.)
20.
Химические
свойства алкенов Наличие
в молекулах этиленовых углеводородов
двойной углерод – углеродной связи
обуславливает следующие особенности
этих соединений: – наличие двойной
связи позволяет отнести алкены к
ненасыщенным соединениям. Превращение
их в насыщенные только в результате
реакций присоединения-основной чертой
химического поведения олефинов; –
двойная связь представляет собой
значительную концентрацию электронной
плотности, поэтому реакции присоединения
носят электрофильный характер;
–
двойная связь состоит из одной ![]() -
и одной
-
и одной ![]() -связи,
которая достаточно легко поляризуется.
-связи,
которая достаточно легко поляризуется.

Уравнения реакций, характеризующих химические свойства алкенов
а) Реакции присоединения
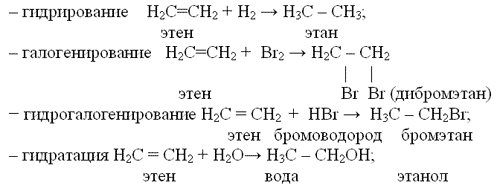 а)
если алкены и реагент – неполярные
соединения, то
-связь
разрывается с образованием свободного
радикала:
а)
если алкены и реагент – неполярные
соединения, то
-связь
разрывается с образованием свободного
радикала:
H2C
= CH2 +
H : H
––> [H2C·
– CH2·]
+ [H·]
+ [H·]
б) если алкен и реагент – полярные
соединения, то разрыв
-связи
приводит к образование ионов:
![]()
в) при соединении по месту разрыва -связи реагентов, содержащих в составе молекулы атомы водорода, водород всегда присоединяется к более гидрированному атому углерода (правило Морковникова, 1869 г.).
– реакция полимеризации nCH2 = CH2 ––> n – CH2 – CH2 –– > (– CH2 – CH2 –)n этен полиэтилен
21. Реакция полимеризации. Полиэтилен
Особенности реакции полимеризации:
1) полимеризация – это последовательное соединение одинаковых молекул в более крупные;
2) реакции полимеризации особенно характерны для непредельных соединений:
а) из этилена образуется высокомолекулярное вещество – полиэтилен;
б) соединение молекул этилена происходит по месту разрыва двойной связи:
![]()
Сокращенно уравнение этой реакции записывается так:
nСН2=СН2 -> (-СН2-СН2-)n;
3) к концам таких молекул (макромолекул) присоединяются какие-нибудь свободные атомы или радикалы (например, атомы водорода из этилена);
4) продукт реакции полимеризации называется полимером (от греческого поли – много, мерос – часть);
5) исходное вещество, которое вступает в реакцию полимеризации, называется мономером.
Особенности полимера.
1. Полимер – это соединение с высокой молекулярной массой, молекула которого состоит из большого числа повторяющихся группировок, которые имеют одинаковое строение.
2. Эти группировки называются элементарными звеньями и структурными единицами.
Степень полимеризации (обозначается n) – это число элементарных звеньев, которые повторяются в макромолекуле.
В зависимости от степени полимеризации из одних и тех же мономеров можно получать вещества с различными свойствами.
Полиэтилен (РЕ) получают полимеризацией газа этилена при высоком и низком давлении. Полиэтилен, получаемый при высоком давлении называется полиэтилен высокого давления , получают его полимеризацией этилена в автоклавном или трубчатом реакторе. При низком давлении на комплексных металлоорганических катализаторах в суспензии или газовой фазе получают полиэтилен низкого давления PEHD (или высокой плотности HDPE). Различными способами получают и другие модификации полиэтилена (линейный, высокомолекулярный, сверхвысокомолекулярный полиэтилен и т.д.), отличающиеся более высокими эксплуатационными характеристиками. Полиэтилен высокого давления имеет большую мягкость и пластичность, чем полиэтилен низкого давления, поэтому применяют его в основном в ротационном формовании и литье, например, для производства упаковочного материала. Полиэтилен низкого давления более прочный материал- для изготовления резервуаров объемом до 250м3.
Физические свойства полиэтилена ПНД (HDPE). Полиэтилен HDPE представляет собой твердый материал, с воскообразной на ощупь поверхностью. HDPE обладает высокой вязкостью, гибкостью, растяжимостью и эластичностью. Материал легче воды. Материал также обладает хорошими диэлектрическими свойствами, а стойкость к радиоактивным излучениям одна из самых высоких среди полимерных материалов. Полиэтилен физиологически безвреден и годен к контакту с пищевыми продуктами.
