
- •11. Строение алканов
- •2. Систематическая номенклатура Правила систематической номенклатуры:
- •2. Затем эту цепь нумеруем с того конца, к которому ближе расположен заместитель (радикал). Заместители перечисляем по алфавиту.
- •19. Способы получения алкенов
- •21. Реакция полимеризации. Полиэтилен
- •22. Особенности степени полимеризации:
- •25. Натуральный и синтетический каучуки
- •28.Получение алкинов
- •29.Физические свойства алкинов.
- •Химические свойства алкинов.
- •43. Гликоли и глицерины-Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-он), соединённых с углеводородным радикалом
- •48. Изомерия альдегидов и кетонов
- •55. Одноосновные предельные карбоновые кислоты
- •56.Номенклатура
- •57. Гомологический ряд
- •59. Химические свойства карбоновых кислот.
- •68.Углеводы классификация: можно разделить на три группы:
- •75. Крахмал
- •Физические свойства
- •Химические свойства
- •Применение
- •76. Целлюлоза, или клетчатка
- •Физические свойства
- •Состав и строение
- •Химические свойства. Применение целлюлозы
- •78.Гидролиз клетчатки
78.Гидролиз клетчатки
Гидролиз клетчатки. Древесные опилки, желательно еловые, просушите в сушильном шкафу при температуре 105-110 °С до постоянного веса. Затем поместите 25 г сухих опилок в большую колбу и прилейте в нее 175 мл 55-процентного раствора серной кислоты (уд. вес 1,45). Жидкость кипятите в течение одного часа. Во время нагревания колбу встряхните несколько раз (осторожно). Через час в колбу налейте 1,5 л воды и продолжайте кипятить 2-2,5 часа. Происходит следующая реакция: (С6Н10О5)n + nH2O = nС6Н12O6. Когда жидкость остынет, фильтруйте через ткань. Фильтрат нейтрализуйте известковым молоком до тех пор, пока лакмус не даст отрицательную реакцию на кислоту. Определите при помощи жидкости Фелинга наличие глюкозы в полученном растворе. Для получения кристаллического сахара требуется обработать во много раз большее количество древесных опилок.
79. АМИНЫ – класс соединений, представляющий собой органические производные аммиака, в котором один, два или три атома водорода замещены органическими группами. Отличительный признак – наличие фрагмента R–N<, где R – органическая группа. В зависимости от числа органических групп, связанных с атомом азота, различают: первичные амины – одна органическая группа у азота RNH2 вторичные амины – две органических группы у азота R2NH, органические группы могут быть различными R'R"NH третичные амины – три органических группы у азота R3N или R'R"R"'N По типу органической группы, связанной с азотом, различают алифатические СH3 – N< и ароматические С6H5 – N< амины, возможны и смешанные варианты. По числу аминогрупп в молекуле амины делят на моноамины СH3 – NН2, диамины H2N(СH2)2NН2, триамины и т.д. Номенклатура аминов. к названию органических групп, связанных с азотом, добавляют слово «амин», при этом группы упоминают в алфавитном порядке, например, СН3NHС3Н7 – метилпропиламин, СН3N(С6Н5)2 – метилдифениламин. Правила допускают также составлять название, взяв за основу углеводород, в котором аминогруппу рассматривают как заместитель. В таком случае ее положение указывают с помощью числового индекса: С5Н3С4Н2С3Н(NН2)С2Н2С1Н3 – 3-аминопентан (верхние числовые индексы синего цвета указывают порядок нумерации атомов С). Для некоторых аминов сохранились тривиальные (упрощенные) названия: С6Н5NH2 – анилин (название по правилам номенклатуры – фениламин).
Физические свойства аминов. Первые представители ряда аминов – метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N и этиламин C2H5NH2 – при комнатной температуре газообразные, далее при увеличении числа атомов амины становятся жидкостями, а при увеличении длины цепи до 10 атомов С – кристаллическими веществами. Растворимость аминов в воде убывает по мере увеличения длины цепи и при возрастании числа органических групп, связанных с азотом (переход к вторичным и третичным аминам). Запах аминов напоминает запах аммиака, высшие (с большими R) амины практически лишены запаха. Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н).

Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
![]()
При обычной температуре только низшие жирные амины CH3NH2, (CH3)2NH, (CH3)3N – газы (с запахом аммиака), средние амины – жидкости с резким запахом гниющей рыбы, высшие – твердые вещества без запаха.
Амины способны к образованию водородных связей с водой:
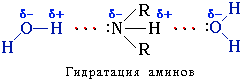 Поэтому
низшие амины хорошо растворимы в воде.
С увеличением числа и размеров
углеводородных радикалов растворимость
аминов в воде уменьшается, т.к. увеличиваются
пространственные препятствия образованию
водородных связей. Ароматические амины
– бесцветные жидкости и твердые вещества
с неприятным запахом, в воде практически
не растворяются.
Поэтому
низшие амины хорошо растворимы в воде.
С увеличением числа и размеров
углеводородных радикалов растворимость
аминов в воде уменьшается, т.к. увеличиваются
пространственные препятствия образованию
водородных связей. Ароматические амины
– бесцветные жидкости и твердые вещества
с неприятным запахом, в воде практически
не растворяются.
Химические свойства аминов Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
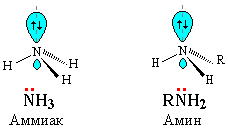
Поэтому амины подобно аммиаку проявляют свойства оснований.
Свойства аминов как оснований (акцепторов протонов) 1. Водные растворы алифатических аминов проявляют щелочную реакцию, т.к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
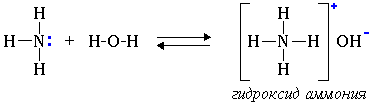
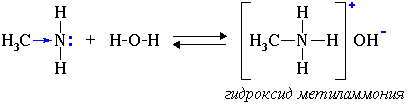
Связь
протона с амином, как и с аммиаком,
образуется по донорно-акцепторному
механизму за счет неподеленной электронной
пары атома азота. Алифатические амины
– более сильные основания, чем аммиак,
т.к. алкильные радикалы увеличивают
электронную плотность на атоме азота
за счет +I-эффекта.
По этой причине электронная пара атома
азота удерживается менее прочно и легче
взаимодействует с протоном. 2. Взаимодействуя
с кислотами, амины образуют соли:
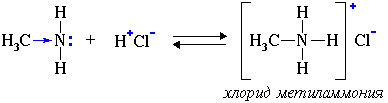
Соли
аминов – твердые вещества, хорошо
растворимые в воде. При нагревании
щелочи вытесняют из них амины:
![]()
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его p-электронами.
II. Окисление аминов Амины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они способны воспламеняться от открытого пламени. 4СH3NH2 + 9O2 ® 4CO2 + 10H2O + 2N2
III. Взаимодействие с азотистой кислотой Азотистая кислота HNO2 – неустойчивое соединение. Поэтому она используется только в момент выделения. Образуется HNO2, как все слабые кислоты, действием на ее соль (нитрит) сильной кислотой: KNO2 + HCl - НNO2 + KCl или NO2- + H+ - НNO2
Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов.
Первичные алифатические амины c HNO2 образуют спирты:
R-NH2 + HNO2 ® R-OH + N2 + H2O
Первичные ароматические амины при повышенной температуре реагируют аналогично, образуя фенолы.
Вторичные амины (алифатические и ароматические) под действием HNO2 превращаются в нитрозосоединения (вещества с характерным запахом) * Реакция с третичными аминами приводит к образованию неустойчивых солей и не имеет практического значения.
Применение Амины - промежут. продукты в производстве красителей, пестицидов, полимеров (в т.ч. полиамидов и полиуретанов), ингибиторов коррозии, ПАВ, флотореагентов, абсорбентов, лек. ср-в (напр., сульфамидных препаратов), ускорителей вулканизации, антиоксидантов и др. Алифатические амины поражают нервную систему, вызывают нарушения проницаемости стенок кровеносных сосудов и клеточных мембран, ф-ций печени и развитие дистрофии. Ароматические амины вызывают образование метгемоглобина, угнетающего центр, нервную систему. Нек-рые ароматич. А - канцерогены, вызывающие рак мочевого пузыря у человека (напр., бета-нафтиламин, бензидин, 4-аминобифенил).
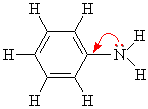
80. Анилин (фениламин) C5H5NH2 – представитель класса ароматических аминов, в которых аминогруппа связана напрямую с бензольным кольцом.
Строение анилина. Неподеленная пара атома азота реагирует с π-системой бензольного кольца. Взаимодействие можно представить так:
 На
атоме азота появляется частично
положительный заряд, и основные свойства
понижаются. А в бензольном кольце,
наоборот, электронная плототность
повышается, и наиболее сильно в орто- и
пара- положениях:
На
атоме азота появляется частично
положительный заряд, и основные свойства
понижаются. А в бензольном кольце,
наоборот, электронная плототность
повышается, и наиболее сильно в орто- и
пара- положениях:
 Физические
свойства анилина.
Физические
свойства анилина.
Анилин – бесцветная маслянистая жидкость, немного тяжелее воды, мало растворимы в воде, но хорошо – в этиловом спирте и в бензоле.
Химические
свойства анилина.
Анилин
является более слабым основанием, чем
алифатические амины, т.к. электронная
пара азота частично смещена в бензольное
кольцо.
Анилин
вступает в реакцию с сильными кислотами,
образуя соли фениламмония, которые
растворимы в воде, но нерастворимы в
неполярных органических растворителях:![]() 2.
Анилин вступает в реакции электрофильного
замещения в безольном кольце. Аминогруппа
направляет замещение в орто- и пара-
положения. Анилин легко бромируется,
при этом выпадает белый осадок:
2.
Анилин вступает в реакции электрофильного
замещения в безольном кольце. Аминогруппа
направляет замещение в орто- и пара-
положения. Анилин легко бромируется,
при этом выпадает белый осадок:

3.
С концентрированной азотной
кислотой анилин
взаимодействует со взрывом. На время
реакции можно защитить аминогруппу
(превратить ее в амидную перед нитрованием),
а после нитрования гидролизовать амид
с образованием исходной аминогруппы:
3.
При взаимодействии с азотистой
кислотой образуются
соли диазония: ![]()
4. Анилин легко подвергается окислению, темнее при хранении. Если на анилин действовать хлорной известью, то водный раствор анилин окрашивается в интенсивный фиолетовый цвет. Это реакция является качественной.
Применение анилина.
Анилин используют преимущественно для синтеза лекарственных средств и красителей:

Одним из важнейших направлений применения анилина остается производство красителей. Свыше 160 красителей получено на основе анилина и еще большее количество - из его производных [467]. Важнейшие красители, получаемые из анилина: азокрасители (анилиновый желтый, хризоидин, хризои - дин Р, жирорастворимый оранжевый, пигмент коричневый.

