
- •11. Строение алканов
- •2. Систематическая номенклатура Правила систематической номенклатуры:
- •2. Затем эту цепь нумеруем с того конца, к которому ближе расположен заместитель (радикал). Заместители перечисляем по алфавиту.
- •19. Способы получения алкенов
- •21. Реакция полимеризации. Полиэтилен
- •22. Особенности степени полимеризации:
- •25. Натуральный и синтетический каучуки
- •28.Получение алкинов
- •29.Физические свойства алкинов.
- •Химические свойства алкинов.
- •43. Гликоли и глицерины-Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-он), соединённых с углеводородным радикалом
- •48. Изомерия альдегидов и кетонов
- •55. Одноосновные предельные карбоновые кислоты
- •56.Номенклатура
- •57. Гомологический ряд
- •59. Химические свойства карбоновых кислот.
- •68.Углеводы классификация: можно разделить на три группы:
- •75. Крахмал
- •Физические свойства
- •Химические свойства
- •Применение
- •76. Целлюлоза, или клетчатка
- •Физические свойства
- •Состав и строение
- •Химические свойства. Применение целлюлозы
- •78.Гидролиз клетчатки
1. Органические вещества в своем составе наряду с другими элементами всегда содержат углерод. Изучение соединений углерода – их строения, химических превращений – и составляет предмет органической химии. Вещества органические и неорганические. Всостав органических веществ чаще всего входят водород, кислород и азот, сравнительно реже – сера, фосфор, галогены и другие элементы. Из всех химических элементов только углерод образует большое число органических соединений. Орган. в-ва содержатся во всех растительных и животных организмах, входят в состав нашей пищи, служат материалом для изготовления одежды, образуют различные виды топлива, используются нами в качестве лекарств, красителей, средств защиты урожая и т. д. Резкой грани между органическими и неорганическими веществами не существует. Оксиды углерода, угольная кислота, ее соли и некоторые другие вещества по наличию в них углерода должны считаться органическими, но по свойствам они близки к неорганическим соединениям и изучаются в неорганической химии. Наши \ предки применяли природные красители для окраски тканей, использовали в качестве продуктов питания растительные масла, животные жиры, тростниковый сахар, получали уксус брожением спиртовых жидкостей. Осуществляются синтезы самых сложных органических веществ – белков. Познавательной задачей современной органической химии является глубокое изучение процессов, происходящих в клетках организмов на молекулярном уровне, выяснение механизмов, которые составляют материальную основу явлений жизни.
2. . Валентность – это количество ковалентных связей, которое образует атом в соединении с ковалентной связью. Валентность атома химического элемента не может быть выше полного числа орбиталей на внешнем уровне этого элемента. Например: У атома азота на внешнем втором уровне 1s и 3p орбитали, всего 4орбитали, следовательно, максимально возможная валентность равна IV.
2
а) Гибридизация атома углерода
сопровождается его возбуждением и
переносом электрона с 2s-
на 2р-орбиталь.
Схематически:
![]()
Гибридизация АО - это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей одинаковой формы и энергии.
sp3-
гибридизация тетраэдрическая Одна s-
и три р-орбитали
смешиваются, и образуются четыре равноценные
по форме и энергии sp3-гибридные
орбитали.
![]() (рис
1)
(рис
1)
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра.
Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
sp2-
плоскостно-тригональная
Одна s-
и две p-орбитали
смешиваются, и образуются три равноценные sp2-гибридные
орбитали , расположенные в одной плоскости
под углом 120° (выделены синим цветом).
Они могут образовывать три σ-связи.
Третья р-орбиталь
остается негибридизованной и ориентируется
перпендикулярно плоскости расположения
гибридных орбиталей. Эта р-орбиталь
участвует в образовании π-связи.
![]()
Линейная
Одна
s- и одна р-орбиталь смешиваются, образуя
две равноценные sp-орбитали , расположенные
под углом 180, т.е. на одной оси.
![]()
Гибридные sp-орбитали
участвуют в образовании двух σ-связей
. Две р-орбитали
не гибридизованы и расположены во
взаимно перпендикулярных плоскостях.
Эти p -орбитали
образуют в соединениях две π-связи.
![]() Образование связей атомом углерода
сопровождается его гибридизацией:
Образование связей атомом углерода
сопровождается его гибридизацией:
sp3- Гибридизация атома углерода в молекуле, если он связан с 4-мя атомами, sp2- Гибридизация атома углерода при связях с 3-мя атомами sp - Гибридизация атома углерода, если он образует связи с 2-мя атомами.
3. Теория строения органических соединений A. M. Бутлерова, сформулированная ученым в 1861г., включает в себя следующие положения: 1 Атомы расположены в молекулах не хаотично, а соединены друг с другом в определенной последовательности, в соответствии с их валентностью. 2. Химические свойства веществ зависят не только от качественного или количественного состава, но и от химического строения молекул. 3. Атомы или группы атомов в молекулах взаимно влияют друг на друга, непосредственно или посредством других атомов. Соединения, у которых один и тот же состав, но различный порядок связи атомов в молекуле, называются изомерами. Явление изомерии - также одна из причин многообразия органических соединений.
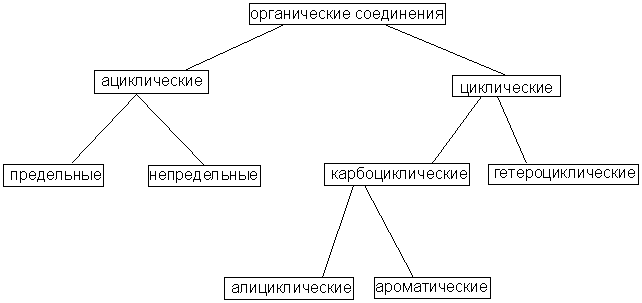
4.Все органические соединения в зависимости от природы углеродного скелета можно разделить на ациклические и циклические. Ациклические (нециклические, цепные) соединения называют также жирными или алифатическими. Эти названия связаны с тем, что одними из первых хорошо изученных соединений такого типа были природные жиры. Среди ациклических соединений различают предельные, например:
CH3 — CH3 Этан |
|
|
||||||||||||||||||||||||||||||||||||||||||
и непредельные, например:
CH2 = CH2 |
CH ≡ CH |
|
|||||||||||||||
этилен |
Ацетилен |
изопрен |
Среди циклических соединений обычно выделяют карбо-циклические, молекулы которых содержат кольца из углеродных атомов, и гетероциклические, кольца которых содержат кроме углерода атомы других элементов (кислорода, серы, азота и др.). Карбоциклические соединения подразделяются на алициклические (предельные и непредельные), похожие по свойствам на алифатические, и ароматические, которые содержат бензольные кольца.
Примеры
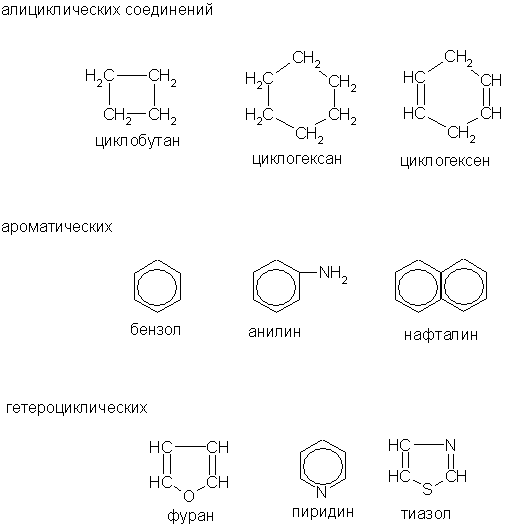
Рассмотренную классификацию органических соединений можно представить в виде краткой схемы:
5. Тривиальная (историческая) номенклатура — первая номенклатура, возникшая в начале развития органической химии. Органическим соединениям давали случайные названия по источнику получения (щавелевая кислота, яблочная кислота, ванилин), цвету или запаху (ароматические соединения), реже — по химическим свойствам (парафины). Многие такие названия применяются до сих пор. Например: толуол, уксусная кислота, масляная кислота, и другие. Рациональная номенклатура — по этой номенклатуре за основу наименования соединения обычно принимают название наиболее простого (чаще всего первого) члена гомологического ряда. Все остальные соединения рассматриваются как производные этого соединения, образованные замещением в нем атомов водорода углеводородными или иными радикалами (например: триметилуксусный альдегид, метиламин, хлоруксусная кислота). В настоящее время применяется в случаях, когда она дает особенно наглядное представление о соединении. Систематическая номенклатура — номенклатура IUPAC — международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия функций (заместителей) и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать единственно правильную структурную формулу. В заместительной номенклатуре основой названия служит один углеводородный фрагмент, а другие рассматриваются как заместители водорода (например, (C6H5)3CH – трифенилметан). В радикало- функциональной номенклатуре в основе названия лежит название характеристической функциональной группы, определяющей химический класс соединения, к которому присоединяют наименование органического радикала, например: C2H5OH — этиловый спирт;C2H5Cl — этилхлорид. В соединительной номенклатуре название составляют из нескольких равноправных частей (например, C6H5–C6H5 бифенил) или добавляя обозначения присоединенных атомов к названию основной структуры (например, 1,2,3,4-тетрагидронафталин стиролдихлорид). Заменительную номенклатуру применяют при наличии неуглеродных атомов (гетероатомов) в молекулярной цепи: корни латинских названий этих атомов с окончанием “а” (а- номенклатура) присоединяют к названиям всей структуры, которая получилась бы, если бы вместо гетероатомов был углерод (например, CH3–O–CH2–CH2–NH–CH2–CH2–S–CH3 2-окса-8-тиа-5-азанонан).
6. Изомерами называются вещества одинакового состава (т.е. имеющие одинаковую суммарную формулу), но обладающие различными физическими и химическими свойствами. Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле, стерео-изомеры — расположением атомов в пространстве при одинаковом порядке связей между ними. Разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию). Структурная изомерия Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Молекулярной формуле С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С5Н12 возможны три изомера: пентан, изо-пентан и неопентан.
 С
увеличением числа атомов углерода в
молекуле число изомеров быстро растет.
Для углеводорода С10Н22 их уже 75, а для
углеводорода С20Н44 — 366 319.Изомерия
положения обусловлена различным
положением кратной связи, заместителя,
функциональной группы при одинаковом
углеродном скелете молекулы:
С
увеличением числа атомов углерода в
молекуле число изомеров быстро растет.
Для углеводорода С10Н22 их уже 75, а для
углеводорода С20Н44 — 366 319.Изомерия
положения обусловлена различным
положением кратной связи, заместителя,
функциональной группы при одинаковом
углеродном скелете молекулы:
И
 зомерия
различных классов органических соединений
(межклассовая изомерия) обусловлена
различным положением и сочетанием
атомов в молекулах веществ, имеющих
одинаковую молекулярную формулу, но
принадлежащих разным классам. Так,
молекулярной формуле С6В12 соответствует
ненасыщенный углеводород гексен-1
циклический углеводород циклогексан:
зомерия
различных классов органических соединений
(межклассовая изомерия) обусловлена
различным положением и сочетанием
атомов в молекулах веществ, имеющих
одинаковую молекулярную формулу, но
принадлежащих разным классам. Так,
молекулярной формуле С6В12 соответствует
ненасыщенный углеводород гексен-1
циклический углеводород циклогексан:

Изомеры
этого типа содержат различные
функциональные группы и относятся к
разным классам веществ. Поэтому они
отличаются по физическим и химическим
свойствам значительно больше, чем
изомеры углеродного скелета или изомеры
положения. Пространственная изомерия
Пространственная изомерия подразделяется
на два вида: геометрическую и оптическую.
Геометрическая изомерия характерна
для соединений, содержащих двойные
связи, и циклических соединений. Так
как свободное вращение атомов вокруг
двойной связи или в цикле невозможно,
заместители могут располагаться либо
по одну сторону плоскости двойной связи
или цикла (цис-положение), либо по разные
стороны (транс-положение). Обозначения
цис- и транс- обычно относят к паре
одинаковых заместителей.
 Оптическая изомерия возникает, если
молекула несовместима со своим
изображением в зеркале. Это возможно,
когда у атома углерода в молекуле четыре
различных заместителя. Примером такой
молекулы является молекула
а-аминопропионовой кислоты (а-аланин)
СН3СН(КН2)СООН.
Оптическая изомерия возникает, если
молекула несовместима со своим
изображением в зеркале. Это возможно,
когда у атома углерода в молекуле четыре
различных заместителя. Примером такой
молекулы является молекула
а-аминопропионовой кислоты (а-аланин)
СН3СН(КН2)СООН.
7. Образование молекул происходит за счет химической связи. 1. Ковалентная неполярная связь возникает при образовании общих электронных пар и при перекрывании электронных облаков, равномерно расположенных между ядрами одноименных атомов. Она наблюдается в таких веществах как, алмаз, сера. Такие вещества обладают высокими диэлектрическими свойствами.2. Ковалентная полярная (гомеополярная) связь возникает между атомами разных элементов. Возникающая область перекрывания электронных облаков смещена к более электроотрицательному элементу. Этот вид связи распространен в соединениях, имеющих связи C-O, C-H и другие. Длина связи зависит от размера атомов и количества связей. В зависимости от числа валентных электронов и числа образующихся связей молекулы имеют определенную форму или структуру. 3. Ионная связь характеризуется притяжением положительных и отрицательных ионов между собой. Обычно она возникает между металлами и неметаллами. Типичные ионные связи в соединениях – NaCl. 4. Донорно–акцепторная связь. атомы примесей некоторых элементов отдают по одному электрону в кристаллическую решетку основного элемента. Такие атомы называются донорами, а атомы, которые захватывают электроны из основного элемента, называются акцепторами, они имеют малую энергию связи с электронами. Поэтому доноры являются поставщиками электронов в зону проводимости, создавая проводимость n- типа, а акцепторы –в валентную зону, проводимость p- типа. Примером веществ, в которых наблюдается донорно–акцепторная связь, служат элементы IV группы периодической системы, например, германий с донорной примесью мышьяка и акцепторной примесью индия. 5. Металлическая связь возникает в металлах. Их большинство в периодической системе. Они имеют кристаллическое строение. 6. Межмолекулярная связь (силы Ван-дер-Ваальса). Характеризуется как силой притяжения молекул в веществе между собой, так и силой их отталкивания. При этом образуются молярные структуры (мицеллы, фибриллы, глобулы, микрокристаллы) за счет притяжения между низкомолекулярными и особенно высокомолекулярными молекулами, что имеет большое значение для свойств (прочность, твердость, эластичность, прозрачность, влагопроницаемость). Энергия Ван-дер-Ваальсовых взаимодействий невысока: от 10 до 60 кДж/моль. Силы Ван-дер-Ваальса проявляются при взаимодействии молекул с насыщенными связями H2, O2, N2, CH4, Ar, Ne. Разновидности межмолекулярной связи.а) Водородная связь – связь между атомом водорода, соединенным ковалентной связью с каким либо атомом в одной молекуле и более электроотрицательным атомом (фтором, хлором и др.) в другой молекуле. б) Ориентационное взаимодействие наблюдается у дипольных (полярных ) молекул, притягивающихся друг к другу при сближении разноименных по заряду концов диполей. в) Индукционное притяжение наблюдается также у полярных молекул. г) Дисперсионное взаимодействие. В любой молекуле возникают флуктуации (случайное отклонение от среднего значения) электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул и происходит взаимное притяжение.
8.Реакции в органической химии классифицируют по изменению, происходящему с органическим веществом – субстратом. Химические реакции в органической химии можно классифицировать по различным признакам:
1. По типу химического превращения:




2. по способу разрыва связи:


Кроме приведенных типов реакций, встречаются и другие: окисление, пиролиз, конденсация, восстановление.

В настоящее время известен ряд классификаций экстракционных процессов, в основу которых положены разные признаки экстракционных систем взаимодействие экстрагируемого вещества с органическим растворителем, характер диссоциации вещества в водной и органической фазах, состояние вещества в водном растворе. Экстракционные процессы классифицируют по типу используемого реагента 1) экстракция нейтральными реагентами (растворителями), 2) экстракция реагентами кислотного характера, 3) экстракция реагентами основного характера по типу соединений, переходящих в органическую фазу 1) несольватированные молекулярные соединения, 2) сольватированные нейтральные смешанные комплексы, 3) комплексные кислоты, 4) внешнесферные комплексы. Состав соединения в органической фазе будет зависеть от природы экстрагируемого вещества.
9. Реакционная способность органических соединений определяется прочностью химических связей или, иными словами, количеством энергии, затрачиваемой на разрыв этих связей. Мерой прочности химической связи является энергия связи. Изучая реакционную способность химики обычно сравнивают скорость какой-либо реакции, например, реакции нитрования или бромирования. Для того, чтобы сравнить поведение вещества при реакциях электрофильного и нуклеофильного замещения водорода, приходится воспользоваться разными химическими реакциями, которые приводят каждый раз к неодинаковому изменению строения молекулы. В немногих случаях удается осуществить реакции, при которых проявляется как нуклеофильная, так и электрофильная реакционная способность одного и того же вещества. При рассмотрении реакционной способности представляют органическую молекулу X-R-Z, состоящей из двух частей: реакционного центра Z, и заместителя X-R, остающегося неизменным при переходе от реагентов к продуктам. Важными аспектами являются их кислотные и основные свойства. Эти свойства часто обусловливают существование большинства органических биомолекул в условиях организма в ионном состоянии. Перенос протона, например между атомами кислорода, азота и серы, наблюдается в ходе многих биохимических реакций. На реакционную способность соединений большое влияние оказывает структура этих соединений. Эти структурные эффекты могут быть полярными ( или индуктивными), резонансными или стерическими. Проявление этих эффектов и их влияние на реакционную способность зависит от механизма реакции. Для правильной электронной трактовки реакционной способности необходимо знать возможный характер ионизации атомов в молекулах этих соединений. Различия в свойствах органических соединений и их аналогов - кремнийорганических соединений - обусловлены особенностями кремния. Кремний является элементом 4 группы 2 периода и занимает среднее положение между типичным металлоидом углеродом и металлами 4 группы. Атомы кремния не образуют, как углерод, устойчивых двойных или тройных связей между собой и с атомами углерода.
10. Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле СnН2n+2. В молекулах алканов все атомы углерода находятся в состоянии sр3-гибридизации(все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109°28')
 Вокруг
одинарной углерод-углеродной связи
молекулы алканов могут приобретать
разнообразную форму. В развернутом
состоянии имеют зигзагообразную форму
с углами при атомах углерода,
близких к тетраэдрическому (109°280,
например в молекуле н-пентана.
Все
связи в молекулах алканов одинарные.
Перекрывание происходит по оси,
соединяющей ядра атомов, т. е. это Þ-связи.
Связи углерод—углерод являются
неполярными и плохо поляризуемыми.
Электронная плотность немного смещена
в сторону более электроотрицательного
атома углерода, т. е. связь С—Н является
слабополярной.
Отсутствие
в молекулах предельных углеводородов
полярных связей приводит к тому, что
они плохо растворяются в воде, не вступают
во взаимодействие с заряженными частицами
(ионами). Наиболее характерными для
алканов являются реакции, протекающие
с участием свободных радикалов.
Вокруг
одинарной углерод-углеродной связи
молекулы алканов могут приобретать
разнообразную форму. В развернутом
состоянии имеют зигзагообразную форму
с углами при атомах углерода,
близких к тетраэдрическому (109°280,
например в молекуле н-пентана.
Все
связи в молекулах алканов одинарные.
Перекрывание происходит по оси,
соединяющей ядра атомов, т. е. это Þ-связи.
Связи углерод—углерод являются
неполярными и плохо поляризуемыми.
Электронная плотность немного смещена
в сторону более электроотрицательного
атома углерода, т. е. связь С—Н является
слабополярной.
Отсутствие
в молекулах предельных углеводородов
полярных связей приводит к тому, что
они плохо растворяются в воде, не вступают
во взаимодействие с заряженными частицами
(ионами). Наиболее характерными для
алканов являются реакции, протекающие
с участием свободных радикалов.
11. Строение алканов
Химическое строение простейших алканов – метана, этана и пропана – показывают их структурные формулы. Из этих формул видно, что в алканах имеются два типа химических связей:
С–С и С–Н.
Связь С–С является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности. Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью электронных формул:

Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности. Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации. Насыщенный атом углерода в алканах связан с четырьмя другими атомами, его состояние соответствует sp3-гибридизации: каждая из четырех sp3-гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp3-АО другого атома углерода, образуя σ-связи С-Н или С-С.

Четыре
σ-связи углерода направлены в пространстве
под углом 109о28',
что соответствует наименьшему отталкиванию
электронов. Поэтому молекула простейшего
представителя алканов – метана СН4 –
имеет форму тетраэдра, в центре которого
находится атом углерода, а в вершинах
– атомы водорода:
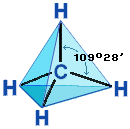 Валентный угол Н-С-Н равен
109о28'. Пространственное
строение метана можно показать с помощью
объемных (масштабных) и шаростержневых
моделей.
Валентный угол Н-С-Н равен
109о28'. Пространственное
строение метана можно показать с помощью
объемных (масштабных) и шаростержневых
моделей.
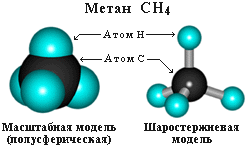
|
|
|
Для записи удобно использовать пространственную (стереохимическую) формулу.
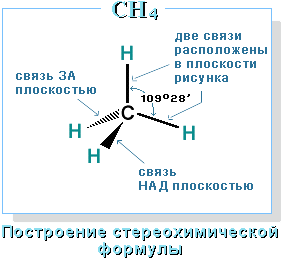
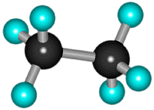
В
молекуле следующего гомолога –
этана С2Н6 –
два тетраэдрических sp3-атома
углерода образуют более сложную
пространственную конструкцию:
 Для молекул алканов, содержащих свыше
2-х атомов углерода, характерны изогнутые
формы. Это можно показать на
примере н-бутана или н-пентана:
Для молекул алканов, содержащих свыше
2-х атомов углерода, характерны изогнутые
формы. Это можно показать на
примере н-бутана или н-пентана:
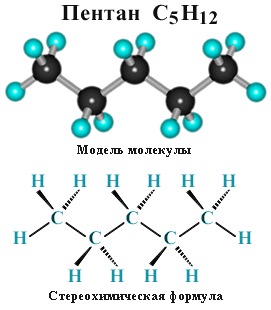
12. Гомологический ряд алканов Алканы представляют собой ряд родственных соединений с однотипной структурой, в котором каждый последующий член отличается от предыдущего на постоянную группу атомов (-CH2-). Такая последовательность соединений называется гомологическим рядом , отдельные члены этого ряда – гомологами, а группа атомов, на которую различаются соседние гомологи, – гомологической разностью. Гомологический ряд алканов легко составить, прибавляя каждый раз к предыдущей цепочке новый атом углерода и дополняя его оставшиеся валентности до 4-х атомами водорода. CH4 или Н-СН2-Н – первый член гомологического ряда – метан (содержит 1 атом C); CH3-CH3 или Н-СН2-СН2-Н – 2-й гомолог – этан (2 атома С). Суффикс -ан является характерным для названия всех алканов. Начиная с пятого гомолога, название алкана образуется из греческого числительного и суффикса -ан: пентан С5Н12, гексан С6Н14, гептан С7Н16, октан и т.д. Гомологи отличаются молекулярной массой, и физическими характеристиками. С ростом молекулярной массы в гомологическом ряду наблюдается закономерное изменение физических свойств гомологов : повышаются температуры кипения и плавления, увеличивается плотность. Алканы от СН4 до С4Н10– газы, от С5Н12 до С17Н36 – жидкости, далее – твердые вещества. Имея одинаковый качественный состав и однотипные химические связи, гомологи обладают сходными химическими свойствами. Поэтому, зная химические свойства одного из членов гомологического ряда, можно предсказать химическое поведение и других членов этого ряда. Для получения гомологов используются общие методы синтеза. Свою номенклатуру имеют радикалы (углеводородные радикалы)
Алкан - ан СnH2n+2 |
Радикал (R) – ил СnH2n+1 |
||
ФОРМУЛА |
НАЗВАНИЕ |
ФОРМУЛА |
НАЗВАНИЕ |
|
метан |
|
Метил |
Число одинаковых заместителей указывают при помощи множительных приставок: два – «ди», три – «три», четыре – «тетра» и тд.
13. 1. По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода — метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово "метан":
