
- •1. Раствор как гомогенная система. Растворитель, растворенное вещество. Концентрированные и разбавленные растворы.
- •4. Химический эквивалент, закон эквивалентов.
- •Следствия:
- •Механизм действия.
- •Гемоглобиновый буфер
- •Фосфатный буфер
- •Белковый буфер
- •22. Кислотно-основное равновесие.
- •23. Основные показатели кор.
- •24. Возможные причины и типы нарушения кор организма.
- •41. Основные понятия термодинамики. Интенсивные и экстенсивные параметры. Функция состояния. Внутренняя энергия. Работа и теплота - две формы передачи энергии.
- •Закон Гесса:
- •Дописать!!!!
- •Роль осмоса и осмотического давления в биологических системах:
- •Правило Панетта и Фаянса:
- •110. Седиментационная и агрегативная устиойчивость коллоидных систем.
- •Степень коагуляции α:
Дописать!!!!
72. Перечислите коллигативные свойства растворов.
Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества.
К коллигативным свойствам растворов относят:
1) Понижение давления насыщенного пара растворителя над раствором.
2) Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) Осмотическое давление – давление, которое нужно приложить к раствору, чтобы прекратить осмос.
73. Какой раствор называется идеальным.
Идеальный раствор - раствор, образование которого не сопровождается химическим взаимодействием, изменением объёма и тепловым эффектом (∆Нсмеш. = 0)
Для идеальных растворов выполняются законы Рауля.
74. Сформулируйте первый закон Рауля.
Первый з-н Рауля:
Давление пара, содержащего нелетучее растворенное вещество, прямо пропорционально молярной доле растворителя.
po - p=∆p
po
-
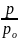 = X2
или т.к. Х1
+
Х2
=
1
p1
=
pox1
= X2
или т.к. Х1
+
Х2
=
1
p1
=
pox1
pо - давление насыщенного пара чистого растворителя при данной температуре
p - давление насыщенного пара растворителя над раствором раствора
X1 и X2 – соответственно мольные доли растворителя и растворённого вещества.
Насыщенный пар - пар, находящийся в равновесии с жидкостью.
Давление такого пара po называется давлением(упругостью) насыщенного пара.
75. Сформулируйте второй закон Рауля.
Второй з-н Рауля:
Повышение температуры кипения или понижение температуры отвердевания разбавленных растворов неэлектролитов пропорциональны числу частиц растворённого вещества и не зависят от его природы.
∆Ткип = Еb ∆Тзам = Кb
Е, К – коэффициенты пропорциональности
Е – эбуллиоскопическая константа, завис. от природы растворителя. Для воды Е = 0,516
К – криоскопическая константа, завис. от природы растворителя. Для воды К = 1,86
b – моляльность раствора (кол-во растворённого вещ-ва на кг растворителя.
76. Приведите основные формулы для расчета молярной массы.
ΔТкип=
Е ∙
 или M2
= E ∙
или M2
= E ∙

ΔТзам
= К ∙
или M2
= K ∙

77. Что такое осмос.
Осмос:
Самопроизвольный переход воды (растворителя) через полупроницаемую перегородку в раствор.
Или
Процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации раствора. Растворитель из разбавленного раствора переходит в концентрированный, который при этом разбавляется. Процесс идёт в сторону выравнивания концентраций. Молекулы растворённого вещества переходить через полупроницаемую перегородку не могут.
78. Сформулируйте закон Закон Вант-Гоффа.
З-н Вант-Гоффа:
Осмотическое давление разбавленного раствора неэлектролита равно тому давлению, которое производило бы растворённое вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объём, равный объёму раствора.
πосм = СRT
79. Что называется осмотическим давлением.
Осмотическое давление(π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
1. В разбавленных растворах неэлектролита при данной температуре осмотическое давление прямо пропорционально концентрации πосм = К1С
2. При одной и той же концентрации С (моль/л) осмотическое давление разбавленного раствора прямо пропорционально абсолютной температуре πосм= К2С
80. Что называется экзоосмосом и эндоосмосом.
Экзосмос – это движение растворителя из осмотической ячейки в окружающую среду.
Экзосмос имеет место, если клетка оказывается в гипертонической среде. Явление экзосмоса наблюдается, например, при посыпании ягод или фруктов сахаром, а овощей, мяса, рыбы – солью. При этом происходит консервирование продуктов питания благодаря уничтожению микроорганизмов вследствии их плазмолиза.
Эндосмос – это движение растворителя из окружающей среды в осмотическую ячейку.
Эндосмос имеет место, если клетка оказывается в гипотонической среде.
Эндосмос является причиной гемолиза (гематолиза) – разрушения эритороцитов крови с выделением в окружающую среду гемоглобина. В норме гемолиз завершает жизненный цикл эритроцитов (приблизительно 125 суток) и происходит в организме человека и животных непрерывно.
Гемолиз – Набухание и разрыв оболочки эритроцитов (эндоосмос)
Тургор – упругость клетки
81. Роль осмоса и осмотического давления в биологических системах.
