
- •1. Раствор как гомогенная система. Растворитель, растворенное вещество. Концентрированные и разбавленные растворы.
- •4. Химический эквивалент, закон эквивалентов.
- •Следствия:
- •Механизм действия.
- •Гемоглобиновый буфер
- •Фосфатный буфер
- •Белковый буфер
- •22. Кислотно-основное равновесие.
- •23. Основные показатели кор.
- •24. Возможные причины и типы нарушения кор организма.
- •41. Основные понятия термодинамики. Интенсивные и экстенсивные параметры. Функция состояния. Внутренняя энергия. Работа и теплота - две формы передачи энергии.
- •Закон Гесса:
- •Дописать!!!!
- •Роль осмоса и осмотического давления в биологических системах:
- •Правило Панетта и Фаянса:
- •110. Седиментационная и агрегативная устиойчивость коллоидных систем.
- •Степень коагуляции α:
1. Раствор как гомогенная система. Растворитель, растворенное вещество. Концентрированные и разбавленные растворы.
Растворы - гомогенные (однородные) системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия.
Вещества, составляющие раствор, называют компонентами реакции.
Растворитель - компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения.
Растворённое вещество - Компонент раствора, который присутствует в меньшем или незначительном количестве
Концентрированные растворы - содержание растворенного вещества соизмеримо с содержанием растворителя.
Разбавленные растворы - содержание растворенного вещества мало по сравнению с содержанием растворителя.
Иногда растворы определяют как дисперсные системы. При этом растворитель, в котором распределено вещество, называется дисперсной средой, а частицы растворенного вещества - дисперсной фазой. По степени дисперсности различают: грубодисперсные системы: взвеси( >100нм), коллоидные р-ры: кровь, лимфа, слюна и т.д.(1-100нм), истинные р-ры: р-р соли в воде(1нм)
3. Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, молярная концентрация эквивалента (или нормальная концентрация), массовая концентрация (или титр).
ω [%]- массовая доля (процентная) концентрация, показывает сколько грамм растворённого вещества содержится в 100 г раствора.
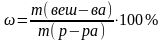
CМ [ моль/л или М ]– молярная концентрация, показывает какое количество молей растворённого вещества содержится в одном литре раствора.

СN [моль-экв /л или N ] – нормальная (эквивалентная) концентрация показывает количество эквивалентов растворённого вещества в одном литре раствора.
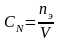
T. t – титрованная концентрация (титр) показывает сколько грамм растворённого вещества содержится в одном мл раствора.

где m (в-ва) – масса вещества в г, V – объём р-ра в мл.
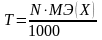
где N – нормальная концентрация, МЭ (Х) – моль-эквивалент вещества (частиц) Х.
4. Химический эквивалент, закон эквивалентов.
Эквивалентом – такое количество вещества, которое взаимодействует с одним моль атомов водорода или замещает его в соединениях. Обозначается Э (Х) и выражается в молях.
Эквивалент в большинстве случаев – величина переменная и определяется для каждой реакции.
Закон эквивалентов: Вещества взаимодействуют и получаются в массовых количествах прямо пропорционально их эквивалентам.
Математическое выражение этого закона:
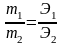
m1 и m2 – массы вешеств, Э1 и Э2 – эквиваленты веществ.
Пропорция не изменится, если поменять местами m2 с Э1, тогда получим:


где nЭ – количество эквивалентов (моль-эквивалентов).
Следствия:
1. Объёмы реагирующих растворов обратно пропорциональны их нормальным концентрациям:
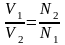 или
V1
· N1
= V2
· N2
или
V1
· N1
= V2
· N2
2. Объёмы исходного и того же разбавленного растворов обратно пропорциональны их нормальным или молярным концентрациям:
V1 · N1 = V2 · N2 V1 · M1 = V2 · M2
nЭ = V· N
nЭ – количество моль-эквивалентов (МЭ), V – объём раствора в л, N – нормальная концентрация, мэ/л.
5. Эквивалентная масса вещества, еѐ связь с молярной массой, фактор эквивалентности. Правила расчѐта фактора эквивалентности для различных классов неорганических соединений.
Эквивалентная масса(моль-эквивалент) - Масса одного эквивалента вещества. Обозначается МЭ (Х) и выражается в г/моль.
Способы выражения моль-эквивалента:
1)
МЭ
кислоты =

2)
МЭ
основания =
3)
МЭ
соли
=
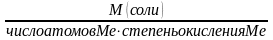
14. Какие растворы называются буферными растворами Классификация буферных растворов.
Буферными растворы – растворы , сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания.
Классификация буферных растворов:
Кислотные т.е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa - ацетатный буфер
Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер
15. Механизм буферного действия. механизм действия буферных систем, их взаимосвязь и роль в поддержании кислотно-основного состояния организма
Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
При добавлении небольшого количества хлороводородной кислоты, ионы Н+ связываются с имеющимся в растворе сопряженным основанием СН3СОО- в слабый электролит СН3СООН.
CH3COO ‾ +H + ↔ CH3COOH (1)
Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным.
При добавлении кислоты к буферу рН определяется по формуле:
рН
= рК + ℓg
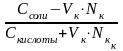
При добавлении к буферу небольшого количества щелочи протекает реакция её с СН3СООН. Молекулы уксусной кислоты будут реагировать с гидроксид-ионами с образованием Н2О и СН3СОО ‾:
CH3COOН + OH ‾ ↔ CH3COO ‾ + H2O (2)
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В. Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется. рН остаётся постоянным.
При добавлении щелочи рН определяется по формуле:
рН
= рК + ℓg
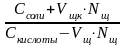
При разбавлении буфера рН также не меняется, т.к. константа диссоциации и соотношение компонентов при этом остаются неизменными.
16. Уравнение Гендерсона – Гассельбаха для определения рН и рОН протолитических буферных растворов.
Уравнение Гендерсона – Гассельбаха:
рН
= рК + ℓg
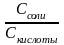 pOH
= pK + ℓg
pOH
= pK + ℓg

где рК = -ℓg КД.
17. Факторы, влияющие на рН и рОН буферных растворов.
рН буфера зависит от константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера.
рН буфера будет наибольшим при соотношении компонентов равным единице.
18. Буферная ѐмкость. Зона буферного действия.
Буферная ёмкость раствора(B) – это способность буферной системы противодействовать изменению рН среды.
Буферная ёмкость раствора(B) – выражается количеством моль-эквивалентов сильной к-ты или щёлочи, которое следует добавить к одному литру буфера, чтобы сместить рН на 1.
В
=

В – буферная ёмкость,
nЭ – количество моль-эквивалента сильной кислоты или щелочи,
рНН – начальное значение рН ( до добавления кислоты или щелочи)
рНК – конечное значение рН (после добавления кислоты или щелочи)
ΔрН – изменение рН.
На практике буферная ёмкость рассчитывается по формуле:
В
=

V – объём кислоты или щелочи,
N – эквивалентная концентрация кислоты или щелочи,
Vбуф.- объём буферного раствора,
Δ рН – изменение рН.
Зона буферного действия – интервал значений рН, выше и ниже которого буферное действие прекращается.
рН = рК ± 1 рК = - lgKд
19. Количественное определение буферной ёмкости.
На практике буферная ёмкость рассчитывается по формуле:
В =
V – объём кислоты или щелочи,
N – эквивалентная концентрация кислоты или щелочи,
Vбуф.- объём буферного раствора,
Δ рН – изменение рН.
20. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая и протеиновая.
Бикарбонатный буфер.
Он составляет 53 % буферной ёмкости и представлен:
Н2СО3
NaHCO3 Соотношение 1 : 20
Бикарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продукт его взаимодействия с кислотами СО2 – быстро выводится через легкие. Помимо плазмы, эта буферная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани.
