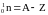Задача 1.
Сколько молей и молекул содержится в 8.4 л газообразного сероводорода при при н.у.? Какова масса этого объема сероводорода? Дано:
V (H2S)= 8.4 л
Найти:
n, N-?
Решение:
а)Количество вещества определяем по формуле:
 ,
,
где Vm – молярный объем, 22,4 л/моль

б) Определяем число молекул:
N(H2S) = n (H2S)· NА,
где NА – число Авогадро
N(H2S) = 0,375 моль · 6,02· 10 23 моль-1 = 2,26 · 10 23 молекул
Задача 21.
Укажите
число протонов, электронов и нейтронов
в атомах изотопов элемента
 .
Составьте электронную формулу атома
элемента и подчеркните в формуле
валентные электроны. Укажите, к какому
электронному семейству относится данный
элемент. Распределите электронов в
атоме в нормальном (невозбужденном)
состоянии.
.
Составьте электронную формулу атома
элемента и подчеркните в формуле
валентные электроны. Укажите, к какому
электронному семейству относится данный
элемент. Распределите электронов в
атоме в нормальном (невозбужденном)
состоянии.
Ответ:
Изотоп |
Протоны
|
Электроны
|
Нейтроны
|
|
17 |
17 |
18 |
|
17 |
17 |
20 |
Хлор находится в 3 периоде и 7 группе, главной подгруппе. На последнем 3 энергетическом уровне имеет 7 валентных электронов. Хлор – р–элемент.



Задача 31.
Составьте формулы оксидов и гидроксидов элементов III периода ПСЭ, отвечающие их высшей степени окисления. Как изменяется химический характер этих соединений при переходе от натрия к хлору?
Ответ:
Элемент |
Оксид |
Гидроксид |
Пример |
Na |
Na2O основный |
NaOH основный |
Na2O + CO2 = Na2CO3 NaOH + HCl =NaCl +H2O |
Mg |
MgO основный |
Mg(OH)2 основный |
MgO+ SO3 = MgSO4 Mg(OH)2 + H2SO4 = MgSO4 + 2H2O |
Al |
Al2O3 амфотерный |
Al(OH)3 амфотерный |
Al2O3 + K2O = 2KAlO2 Al(OH)3 + 3HNO3 = Al(NO3)3 +3H2O Al(OH)3 + NaOH = Na[Al(OH)4] |
Si |
SiO2 кислотный |
H2SiO3 кислотный |
SiO2+ Na2O =Na2SiO3
|
P |
P2O5 кислотный |
H3PO4 кислотный |
P2O5+ 3H2O= 2H3PO4 H3PO4 +3KOH = K3PO4 +3H2O |
S |
SO3 кислотный |
H2SO4 кислотный |
SO3+ СаО = СаSO4 H2SO4+ 2NaOH = Na2SO4 +2H2O |
Cl |
Cl2O7 кислотный |
HClO4 кислотный |
Cl2O7+ H2O= 2HClO4 HClO4 + KOH = KClO4+H2O |
При переходе от натрия к хлору основные свойства ослабевают, а кислотные увеличиваются
Задача 51.
Разложение оксида азота (I) протекает по уравнению 2N2O = 2N2 + O2. Константа скорости данной реакции при некоторой температуре равна 4∙10−4, начальная концентрация N2O равна 2 моль/л. Определите скорость реакции в начальный момент времени и в момент времени, когда разложится 70 % N2O. Дано:
k = 4∙10−4
C0 (N2O) = 2 моль/л
W(N2O) = 70% = 0,7
Найти:
υ0 –?
Решение:
Согласно закону действия масс, скорость реакции прямо пропорциональна концентрации реагирующего вещества, взятой в степени, равной его стехиометрическому коэффициенту в уравнении реакции.
Определим скорость реакции в начальный момент времени:
υ = k· С02(N2O) = 4∙10−4∙ 22 = 1,6∙10–3
Определим скорость реакции в момент времени, когда разложится 70 % N2O.
Рассчитаем концентрацию вещества, которое осталось после разложения 70%: 100% – 70 % = 30% или 0,3
C (N2O) = C0 (N2O)· W(N2O) = 2 моль/л·0,3 = 0,6 моль/л,
тогда скорость реакции υ = k· С2(N2O) = 4∙10−4∙ 0,62 = 1,4∙10–4