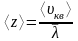- •2.3 Практическое занятие №3
- •Примеры решения задач
- •Задачи для решения на занятии
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •Рекомендуемая литература
- •2.4 Практическое занятие №4
- •Примеры решения задач
- •Задачи для решения на занятии
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •Рекомендуемая литература
2.3 Практическое занятие №3
Тема: Молекулярно - кинетическая теория идеальных газов
Цель: обобщение и систематизация знаний, умений по данной теме; формирование практических навыков при решении задач; развитие интереса к изучению физики
Краткие теоретические сведения
Таблица 2.3 – Основные законы и формулы
Физические законы переменные |
Формулы |
Число ν молей вещества, m – масса, μ – молярная масса |
|
Масса m0 одной молекулы газа, NA – число Авогадро |
|
Число молекул N в некоторой массе т газа |
|
Закон Дальтона для смеси газов: где р – давление смеси газов; рn – давление n – го компонента смеси (парциальное давление); n – число компонентов смеси. |
|
Основное уравнение молекулярно – кинетической теории газов: где
р – давление газа; m0
– масса одной молекулы;
|
|
Средняя кинетическая энергия Ек теплового движения молекул газа; i – число степеней свободы, k – постоянная Больцмана |
|
Формула связывающая давление газа и среднюю кинетическую энергию поступательного движения молекул: |
|
Уравнение Менделеева – Клапейрона, р – давление, V – объём, R – универсальная газовая постоянная, Т - температура |
|
Уравнение Клапейрона(уравнение состояния газа): |
|
Изопроцессы: 1)изотермический процесс m = const, Т= const; 2) изобарный процесс m = const,р= const; 3) изохорный процесс m = const,V= const; |
1)
2)
3)
|
Зависимость давления газа от концентрации и температуры: |
|
Скорости молекул: 1) средняя квадратичная скорость молекул; 2) наиболее вероятная скорость молекул; 3) средняя арифметическая скорость молекул. |
1)
2)
3)
|
Средняя длина свободного пробега молекулы где d – эффективный диаметр молекул водорода; n – концентрация молекул |
|
Среднее число столкновений за единицу времени, где
|
|
Примеры решения задач
1.Найти массу атомов: 1) водорода; 2) гелия. 3) молекулы СО2
Дано:
1) водород (Н2)
2) гелия (Не)
3) молекулы СО2
Найти:
1) m0 (Н2) – ?,
2) m0 (Не) – ?,
3) m0 (СО2) – ?
Решение
Молярная масса газа
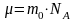 ,
,
где m0 – масса атома, NA – число Авогадро, отсюда
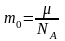 .
.
Пользуясь таблицей Менделеева, определим молярные массы вещества
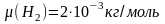 ,
,
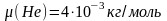 ,
,
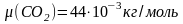 .
.
Вычислим
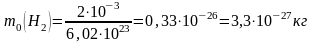 ,
,
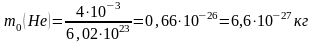 ,
,
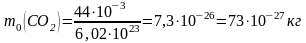 .
.
Ответ:
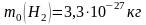 ,
,
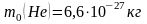 ,
,
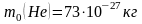
2. Какова средняя кинетическая энергия молекулы газа, если его давление равно 5.104 Па, а в объеме 12 л содержится 6.1024 молекул?
Дано:
р=5.104 Па
V=12 л=12·10-3м3
N=6·1024
Найти:
Ek=?
Решение:
Из основного уравнения молекулярно-кинетической теории
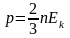
где - концентрация. Тогда
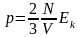 ,
,
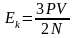 ,
,
 ,
,
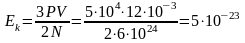 Дж
Дж
Ответ:
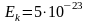 Дж
Дж
3 Определите массу газа, объем которого 5 м3, давление 3 атм, а средняя квадратичная скорость молекул 1500 м/с.
Дано:
V=5 м3,
Р=3 атм = 3·105Па,
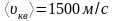 .
.
Найти:
m– ?
Решение
Средняя квадратичная скорость молекул
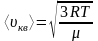 , (1)
, (1)
где R – универсальная газовая постоянная, T – термодинамическая температура, μ – молярная масса газа.
Возведем к квадрат уравнение (1) получим:
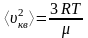 . (2)
. (2)
Изуравнение Менделеева – Клапейрона
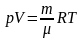 ,
,
или
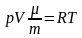 (3)
(3)
Подставим уравнение (3) в (2)
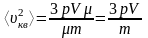 ,
,
отсюда
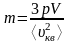 ,
,
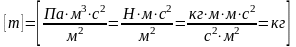 ,
,
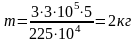
Ответ:
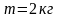 .
.
3. Газ при температуре t=150С и давлении р= 200 кПа имеет плотность ρ = 0,34 кг/м3. Найти молярную массу μ газа.
Дано:
t=150С, Т=273+15=288 К,
р= 200 кПа=2·105Па,
ρ = 0,34 кг/м3.
Найти:
μ – ?
Решение
Из уравнения Менделеева – Клапейрона
,
где V – объем газа, R – универсальная газовая постоянная,
 .
.
Плотность газа
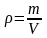 ,
,
Тогда
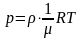 ,
,
отсюда
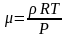 ,
,
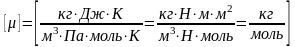 ,
,
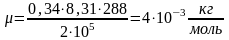 .
.
Ответ:
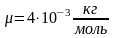
4. Какой объем занимает смесь азота массой 2 кг и гелия массой 1 кг при нормальных условиях. Чему равна молярная масса смеси?
Дано:
m1 = 2 кг,
m2 = 1 кг,
Т = 273К,
р = 105Па,
μ1(N2)=28·10-3кг/моль,
μ2(Не) = 4·10-3кг/моль.
Найти:
V– ?
μ– ?
Решение
Объем смеси газов
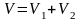 ,
,
где V1 – объем азота, V2 – объем гелия.
Объемы газов найдем из уравнения Менделеева – Клапейрона:
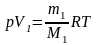 ,
,
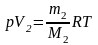 ,
,
отсюда
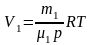 ,
,
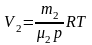 ,
,
где R – универсальная газовая постоянная, р – давление газа, Т – термодинамическая температура, тогда
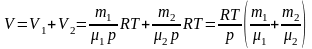 ,
,
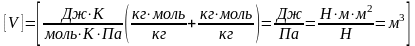 ,
,
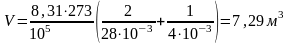 .
.
Молярная масса смеси μ есть отношение массы смеси m к количеству вещества смеси ν,т.е
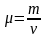 .
.
Масса
смеси равна сумме масс компонентов
смеси m=m1+m2.
Количество вещества смеси равно сумме
количеств вещества компонентов. Подставив
в формулу
,
выражения m=m1+m2
и
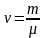 ,
получим
,
получим
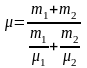 ,
,
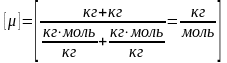 ,
,
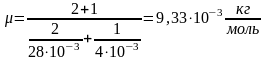
Ответ:
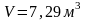 ,
,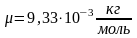 .
.
5. Баллон ёмкостью 10 л содержит водород массой 1 г. Найти среднюю длину свободного пробега молекул.
Дано:
Н2
d=0,28·10-9м
V=10 л=0,01м3
m=1 г=10-3кг
Найти:
λ=?
Решение:
Средняя длина свободного пробега молекулы
, (1)
где d – эффективный диаметр молекул водорода; n – концентрация молекул.
Так как
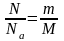
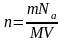
М=0,002 кг/моль – молярная масса водорода, Na=6,022·1023 – число Авогадро.
Тогда,
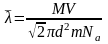
Вычислим:
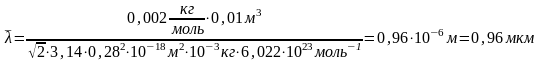
Ответ:
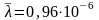 м=0,96мкм
м=0,96мкм
6.
Определить среднее число соударений в
секунду
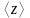 и длину свободного пробега молекул
водорода при температуре t
= 270С
и давлении Р = 1·10-3
мм.рт.ст.
и длину свободного пробега молекул
водорода при температуре t
= 270С
и давлении Р = 1·10-3
мм.рт.ст.
Дано:
t = 270С,
Р = 1·10-3 мм.рт.ст. = 133,3·10-3 Па,
d = 0,23·10-9 м,
М(Н2) = 2·10-3 кг/моль
Найти:
– ?,
–?
Решение
Средняя длина свободного пробега молекулы
, (1)
где d – эффективный диаметр молекул водорода; n – концентрация молекул.
Из основного уравнения молекулярно – кинетической теории
,
имеем
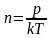 , (2)
, (2)
где p – давление, k – постоянная Больцмана, T – термодинамическая температур.,
Т = 273+27 = 300 К
Тогда, с учетом (2), выражение (1) можно записать в виде
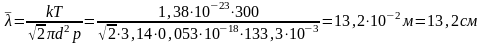 .
.
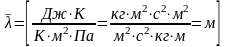
С другой стороны длина свободного пробега
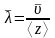 , (3)
, (3)
где
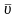 –
средняя арифметическая скорость
молекул,
– среднее число столкновений за единицу
времени,
–
средняя арифметическая скорость
молекул,
– среднее число столкновений за единицу
времени,
Из выражения (3)
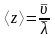 . (4)
. (4)
Средняя арифметическая скорость вычисляется по формуле
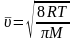 , (5)
, (5)
где R – универсальная газовая постоянная, T– термодинамическая температура, M – молярная масса водорода.
Таким образом, с учетом (5) запишем выражение (4)
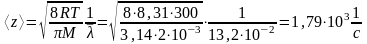
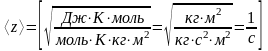
Ответ:
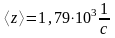 ;
;
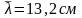

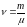
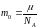
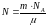
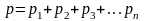
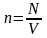 - концентрация молекул, число молекул
в единице объема,
- концентрация молекул, число молекул
в единице объема,
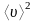 -
средняя квадратичная скорость молекул
-
средняя квадратичная скорость молекул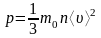
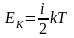
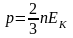
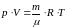
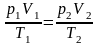
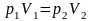 ;
;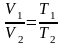 ;
;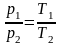
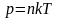
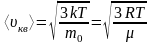 ;
;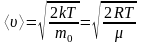 ;
;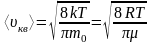
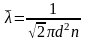
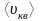 - средняя арифметическая скорость
молекул,
- средняя арифметическая скорость
молекул,
 - средняя длина свободного пробега
молекулы
- средняя длина свободного пробега
молекулы