
4724 Основы электрохимической термодинамики
.pdf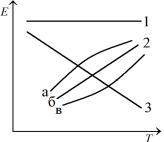
61
Рис. 9. Зависимость ЭДС гальванического элемента от температуры:
|
E |
0 |
|
E |
0 : а – rCp 0 , б – rCp |
0 , в – rCp |
0 |
|
E |
0 |
1– |
|
, 2 – |
|
, 3 – |
|
|||||
|
T p |
|
|
T p |
|
|
|
|
T p |
|
Вид зависимостей, отвечающих кривым 2 (рис. 9), устанавливается
|
2E |
||
по знаку 2-й производной ЭДС по температуре |
|
2 |
: |
|
T |
|
|
|
|
p |
|
|
2E |
|
1 |
rS |
|
1 |
|
rCp |
|
|
|||
|
|
2 |
|
|
|
|
|
|
|
, |
(4.17) |
||
|
|
|
|
|
|||||||||
|
T |
|
|
|
|
zF T |
|
|
|||||
|
|
p |
|
zF |
T p |
|
|
|
|||||
т.е. по знаку изменения теплоемкости ( rCp ) химической реакции протекающей в гальваническом элементе:
а) rCp 0: выпуклая кривая б) rCp 0 : прямая линия в) rCp 0 : вогнутая кривая
Очевидно, что рассмотренные три типа кривых (2а, 2б, 2в) могут иметь место не только для элементов с положительным, но и отрицательным температурным коэффициентом ЭДС.
Величины температурного коэффициента ЭДС невелики и обычно лежат в пределах 10 5 &10 3 B/ K . Для ряда гальванических элементов они приведены в табл. 3.
62
Таблица 3
Температурные коэффициенты ЭДС различных гальванических элементов
Гальванический |
E, B |
|
E |
10 |
4 |
|
B |
|
|
|
|
|
, |
|
|
||
|
|
|
|
|||||
элемент |
|
|
T p |
|
|
|
K |
|
Zn | ZnCl2(c 0,555M ) | AgCl | Ag |
1,0150 |
|
4,02 |
|
|
|
||
|
|
|
|
|
|
|
|
|
Pb | PbI2 | KI(a 1,0) | AgI | Ag |
0,2107 |
|
1,38 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tl | TlClO4(c 0,1M ) | Tl(Hg)(xTl 0,085) | Pt |
0,0710 |
|
+1,80 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ag | AgCl | KCl(a 1) | Cl2 | Pt |
1,1401 |
|
+1,85 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.4. Влияние давления на ЭДС гальванического элемента
Дифференцируя уравнение (4.4) по давлению при T const |
получа- |
|||
ем уравнение зависимости ЭДС гальванического элемента от давления: |
||||
|
E |
|
V |
(4.18) |
|
|
r |
||
|
p T |
|
zF |
|
где rV – изменение объема в ходе химической реакции, протекающей в гальваническом элементе.
Из уравнения (4.18) вытекает, что характер влияния давления на
ЭДС гальванического элемента определяется знаком rV :
r |
то |
|
|
0 и ЭДС гальванического элемента рас- |
1) если V 0, |
|
E |
||
|
|
|
p |
|
|
|
|
T |
|
тет с увеличением давления в системе, |
||||
2) |
r |
|
|
0 и ЭДС падает с ростом давления, |
если V 0 , то |
E |
|||
|
|
|
p |
|
|
|
|
T |
|
3) |
r |
|
|
= 0 и ЭДС не зависит от давления. |
если V 0, то |
|
E |
||
|
|
|
p |
|
|
|
|
T |
|
63
Очевидно, что влияние давления на ЭДС будет существенно только для гальванических элементов с газовыми электродами, поскольку лишь в этом случае изменение объема ( rV ) в ходе реакции, протекающей в гальваническом элементе, может быть существенным.
Для элементов, которые составлены из электродов, включающих вещества в конденсированных фазах, влияние давления на ЭДС незначительно и лежит в пределах 10 6 10 7 B/ атм, т.е. даже при изменении давления на 1000 атм изменение ЭДС не превышает 1мB ( E 0,001 B ).
4.4. Термодинамический анализ работы гальванического элемента
Термодинамические соотношения, позволяющие провести термодинамический анализ работы гальванического элемента вытекают из уравнений Гиббса–Гельмгольца:
|
rG |
(4.19) |
rG r H T rS r H T |
|
|
|
T p |
|
При подстановке выражений (4.4), (4.15) и (4.16) в (4.19) получим:
|
E |
zFE r H zFT |
|
|
T p |
или |
|
|
|
E |
r H |
|
E |
zF |
T |
|
|
|
|
T p |
(4.20)
(4.21)
Уравнения (4.20) и (4.21), которые связывают электрическую работу
(Wэл zFE ) или ЭДС электрохимической цепи с тепловым эффектом хи-
|
E |
, |
мической реакции ( r H ) и температурным коэффициентом ЭДС |
|
|
|
T p |
|
называют электрохимической формой уравнений Гиббса–Гельмгольца.
64
В уравнении (4.20) r H характеризует тепловой эффект реакции
при ее необратимом протекании в условиях p const , а выражение |
|
||
|
E |
T rS Q |
(4.22) |
zFT |
|
||
|
T p |
|
|
представляет собой теплоту обратимо протекающей химической реакции.
Проанализируем работу гальванического элемента. Прежде всего необходимо отметить, что электрическая работа гальванического элемента не обязательно равна тепловому эффекту химической реакции ( r H ). В
соответствии с характером зависимости ЭДС гальванического элемента от температуры можно выделить следующие три случая.
|
E |
0 . ЭДС элемента не зависит от температуры и тогда: |
1) |
|
|
|
T p |
|
|
|
Wэл zFE rH |
Очевидно, такой элемент будет вырабатывать электрическую энергию, т.е. производить положительную электрическую работу только при условии, что химическая реакция, протекающая в гальваническом элементе, является экзотермической ( rH 0 ). Электрическая работа в данном случае точно равняется тепловому эффекту химической реакции. При этом работа гальванического элемента не сопровождается обменом теплотой с окружающей средой.
|
E |
0 . ЭДС элемента падает с увеличением температуры, а |
2) |
|
|
|
T p |
|
электрическая работа меньше энтальпии химической реакции:
Wэл zFE rH
Если температурный коэффициент ЭДС отрицателен, то электрическая энергия может быть получена, как и в предыдущем случае, только при условии, что химическая реакция, протекающая в гальваническом элемен-
65
те, является экзотермической ( rH 0 ). При этом лишь часть энергии химической реакции превращается в электрическую работу, другая же ее
|
E |
, выделяется в окружающую среду. Тогда, |
часть, а именно Q zFT |
|
|
|
T p |
|
в условиях теплоизоляции или плохого теплообмена, гальванический элемент при работе будет нагреваться. Данная электрохимическая цепь будет
функционировать лишь при условии, что rH |
|
E |
, т.е. тепло- |
zFT |
|
||
|
|
T p |
|
вой эффект химической реакции, протекающей в гальваническом элементе, должен быть больше потерь тепла в окружающую среду. Такой режим осуществляется для большинства электрохимических цепей, например, для первых двух приведенных в табл. 3.
3)0. ЭДС элемента возрастает с увеличением температуры,
T p
аэлектрическая работа больше величины теплового эффекта реакции:E
Wэл zFE rH
Поскольку температурный коэффициент ЭДС положителен, то
rS 0, а значит, гальванический элемент работает с поглощением тепла из окружающей среды. Если элемент изолирован от окружающей среды, то
впроцессе работы он будет охлаждаться.
Врассматриваемых условиях электрическая энергия в гальваническом элементе может быть получена при протекании в нем как экзотермической, так и эндотермической реакции.
а) rH 0 . Если реакция экзотермическая, то электрическая работа
совершается и за счет убыли энтальпии реакции ( rH 0 ), и за счет эн-
E
тропийного члена zFT , т.е. тепла заимствованного извне. Таким
T p
66
образом, электрическая работа оказывается больше величины теплового эффекта протекающей в нем химической реакции:
Wэл zFE rH
Примером электрохимической системы подобного типа может служить медно-свинцовый гальванический элемент:
|
|
Pb | Pb(CH3COO)2 || Cu(CH3COO)2 | Cu |
||
|
E |
3,85 10 4 |
B |
|
для которого |
|
|
. |
|
|
||||
|
T p |
K |
||
На возможность создания элементов, в которых получаемая электрическая работа оказывалась бы больше теплового эффекта реакции впервые указали французские исследователи П. Фавр и Ф. Рауль. Следует отметить, что поскольку работа по рассмотренной схеме отвечает протеканию реакций с возрастанием энтропии, то это, в первую очередь, должны быть гальванические элементы, в которых реакции идут с выделением газообразных веществ.
б) rH 0 . Электрическая работа гальванического элемента в данных условиях не может совершаться посредством использования химической энергии реакции, а производится исключительно за счет поглощения тепла из окружающей среды:
эл |
zFE zFT |
|
|
W |
|
E |
|
|
|
T p |
|
в) rH 0. Гальванический элемент может вырабатывать электриче-
скую энергию и в случае эндотермической реакции, но лишь при условии:
|
H |
|
|
E |
|
|
|||
|
|
zFT |
|
|
|
|
|
|
T p |
|
|
Тогда часть тепла, поглощаемого из окружающей среды, затрачивается на совершение электрической работы, другая его часть идет на увеличение энтальпии системы.
67
5. КЛАССИФИКАЦИЯ ОБРАТИМЫХ ЭЛЕКТРОДОВ
Согласно термодинамической классификации выделяют следующие основные типы электродов:
–электроды 1-го рода
–электроды 2-го рода
–электроды 3-го рода
–газовые электроды
–окислительно-восстановительные электроды.
Следует, однако, заметить, что единой классификации электродов в настоящее время не существует и приведенная здесь классификация обратимых электродов не является общепринятой. Отдельную группу составляют мембранные (ионообменные) электроды.
5.1.Электроды 1-го рода
Кобратимым электродам 1-го рода обычно относят электрохимические системы, состоящие из металла (неметалла), помещенного в раствор, содержащий ионы того же металла (неметалла). Такие электрохимические системы называют электродами, обратимыми по катиону (аниону).
Электроды 1-го рода, обратимые по катиону
Условное обозначение электрода 1-го рода, обратимого по катиону,
Mz | M. На поверхности металла M одновременно протекают два проти-
воположных процесса: восстановление катионов Mz из раствора и окисление атомов металла. В равновесных условиях скорости обоих процессов равны. Электродная полуреакция записывается следующим образом:
Mz z e M
В качестве примера рассмотрим вывод уравнения Нернста для электрода 1-го рода, обратимого по катиону (эти электроды также называют
68
ионно-металллическими). Составим электрохимическую цепь из данного электрода и стандартного водородного:
Pt | H2 ( pH2 1атм) | H (aH 1)|| Mz (M A )| M | Pt
Электродные полуреакции, протекающие на электродах элемента,
могут быть представлены уравнениями:
на правом электроде (восстановление):
Mz ze M
на левом электроде (окисление):
1 H2 H
 e 2
e 2
Поскольку число электронов, участвующих в процессах на обоих электродах должно быть одинаково, то уравнение полуреакции, протека-
ющей на водородном электроде, должно быть умножено на величину z .
Суммарное уравнение реакции, протекающей в элементе, имеет вид:
Mz z H2 M  z H 2
z H 2
Далее вывод уравнения Нернста аналогичен рассмотренному для гальванического элемента (см. разд. 4.2).
Запишем уравнение изотермы Вант-Гоффа для окислительно-восста-
новительной реакции (А):
|
k |
|
|
|
|
|
|
|
|
|
|
z |
|||
|
|
|
|
|
|
|
|
|
|
aM aH |
|
||||
G RT ln Kо RT ln П a i |
RT ln Kо RT ln |
|
|||||||||||||
|
|||||||||||||||
|
i 1 i |
|
|
|
|
|
|
|
|
|
a |
z az / 2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
M |
H2 |
||
Объединяя последнее уравнение с (4.4) получим: |
|
|
|
||||||||||||
|
RT |
о |
|
RT |
|
a |
M |
az |
|
|
|
||||
EMz / M |
|
|
|
H |
|
|
|
||||||||
|
ln K |
|
|
ln |
|
|
|
|
|
(5.1) |
|||||
zF |
|
zF |
a |
|
z az 2 |
|
|||||||||
|
|
|
|
|
|
|
M |
|
H2 |
|
|
|
|||
Активность ионов водорода в растворе электролита aH 1. Актив-
ность газообразного водорода по определению выражается формулой:

69
aH2 fHo2 , f
где fH2 фугитивность газообразного водорода, f o фугитивность газа в
стандартном состоянии ( f о po 1атм).
При невысоких давлениях фугитивность практически совпадает с давлением газа. Тогда:
a |
pH |
p |
|
pH2 |
+ p |
(атм), |
(5.2) |
H2 |
p |
H2 |
|
1атм |
H2 |
|
|
|
|
|
|
|
|
где p |
pH2 |
– относительное давление газообразного водорода (без- |
|
||
H2 |
po |
|
размерная величина).
Из (5.2) вытекает, что активность газа численно совпадает с давлени-
ем, если оно выражено в атм. Тогда, если давление водорода |
pH2 =1атм, |
||||||
то активность aH2 1. |
|
|
|
|
|
|
|
С учетом изложенного уравнение (5.1) принимет вид: |
|
||||||
EMz / M |
RT |
ln K o |
RT |
ln |
aM |
|
(5.3) |
|
|
aMz |
|||||
|
zF |
|
zF |
|
|||
В стандартном состоянии активность каждого участника электрохи-
мического процесса на электроде равна единице: aM 1, aMz 1, тогда:
Eo |
z |
|
|
RT |
ln Ko , |
(5.4) |
/ M |
|
|||||
M |
|
|
zF |
|
||
где Eo стандартный электродный потенциал, K o – стандартная констан-
та равновесия реакции (А). |
|
|
|
|
|
|
|
|
||
Подставляя (5.4) в уравнение (5.3) будем иметь: |
|
|||||||||
E |
z |
/ M |
Eo |
/ M |
|
RT |
ln |
aM |
, |
(5.5) |
|
|
|||||||||
M |
|
Mz |
|
zF |
aMz |
|
||||
|
|
|
|
|
|
|
||||

70
Принимая во внимание, что активность чистой конденсированной фазы aM 1, получаем:
E |
z |
/ M |
Eo |
|
RT |
ln a |
z |
|
(5.6) |
|
|||||||||
M |
|
Mz / M |
|
zF M |
|
|
|||
При 298 K и переходе к десятичным логарифмам уравнение (5.6) |
|||||||||
преобразуется к виду: |
|
|
|
|
|
|
|
|
|
E |
z |
/ M |
Eo |
|
0,059 |
lg a |
z |
|
, |
(5.7) |
|
z |
|||||||||||
M |
|
Mz / M |
|
M |
|
|
|
где z z , т.е. число электронов, переносимых в электродной полуреак-
ции, совпадает с зарядовым числом потенциалопределяющего катиона.
Из уравнений (5.6) и (5.7) видно, что потенциал электрода 1-го рода зависит от активности лишь одного определенного сорта ионов. Ионы, не-
посредственно определяющие величину электродного потенциала, полу-
чили название потенциалопределяющих.
Приведем несколько примеров электродов 1-го рода, обратимых по
катиону. |
|
, Медный электрод: Cu2+ | Cu или |
CuSO4 | Cu , |
электродная полуреакция: |
|
Cu2 2e Cu , |
z z 2 , |
|
|
уравнение Нернста: |
|
E |
2 |
|
|
Eo 2 |
|
|
RT |
ln a |
|
2 , |
Eо |
2 |
0,337 B |
||
/ Cu |
/ Cu |
2F |
|
||||||||||||
Cu |
|
Cu |
|
|
Cu |
|
Cu |
|
/ Cu |
||||||
, Серебряный электрод: Ag | Ag или AgNO | Ag |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
электродная полуреакция: |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
Ag e |
Ag , |
z z 1 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
уравнение Нернста: |
|
|
|
|
|
|
|
|
|
|
|
||||
E |
|
|
|
Eo |
|
|
RT |
ln a |
, |
Eо |
|
0,799 B |
|||
|
|Ag |
|Ag |
|
|
|||||||||||
Ag |
|
Ag |
|
|
F |
Ag |
|
|
Ag |
/ Ag |
|||||
