
Лаба КЭФ
.pdf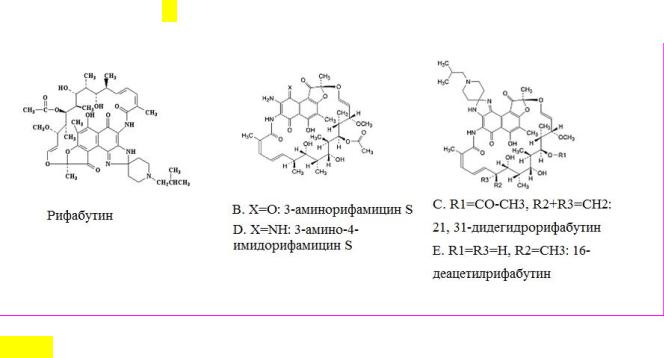
ПРАКТИЧЕСКИЕ РАБОТЫ
Работа 1. Изучение влияния кислотности водного раствора на ионное состояние молекулы рифабутина методом капиллярного электрофореза
Рифабутин – полусинтетический антибиотик, обладающий широким спектром антибактериального действия, активный в отношении многих грамположительных и грамотрицательных бактерий, в том числе в отношении
M. tuberculosis.
Химическая формула молекулы рифабутина и его родственных примесей представлена на рис.1.
Рис. 1. Химическая формула молекулы РБ и его родственных примесей
Молекула рифабутина имеет несколько центров ионизации, что определяет ее электрофоретическое поведение. Изменение заряда частицы рифабутина при изменении кислотности среды влияет на скорость миграции частицы в капилляре. Константы кислотности молекулы рифабутина составляют: рКа1 = 4,0-5,0, рКа2 = 6,5-7,5 и рКа3 = 9,7-11.
В сильнокислой среде электрофоретическая подвижность частицы рифабутина остается постоянной и не изменяется до достижения значения рН
≈ 4. В данной области рН РБ существует в виде дикатиона (рКа азота имидазольной группы - 4,0-5,0). При дальнейшем повышении рН (диапазон рН от 4 до 8) происходит депротонирование азота имидазольной группы. Это приводит к уменьшению положительного заряда катиона рифабутина,
следствием этого является уменьшение его электрофоретической подвижности. При рН около 8 электрофоретическая подвижность частицы совпадает со скоростью ЭОП: в этой области происходит отщепление протона от гидроксильной группы в остатке нафталина (рКа=6,5-7,5) и образуется цвиттер-ион рифабутина. Далее, по мере увеличения щелочности раствора, на частице рифабутина появляется и увеличивается отрицательный заряд. В этой области рН происходит депротонирование азота пиперидиновой группы молекулы (рКа=9,7-11).
Цель лабораторной работы: изучить зависимость электрофоретического поведения молекулы антибиотика рифабутина от кислотности ведущего электролита, используя метод капиллярного электрофореза.
Для этого следует получить электрофореграммы рифабутина при различных значениях рН ведущего электролита и сделать выводы о знаке заряда соответствующих ионных форм молекулы.
Используемое оборудование и условия КЭ
Оборудование. В эксперименте по КЭ используется система капиллярного электрофореза «Капель 105М» («Люмэкс», Россия), оборудованная спектрофотометрическим детектором и кварцевым капилляром (внутренний диаметр 75 мм, эффективная длина 50 см, общая длина 60 см). Применяется программное обеспечение «Эльфоран» («Люмэкс», Россия).
Для измерения рН растворов используют рН-метр со стеклянным универсальным электродом.
Растворы центрифугируют с использованием лабораторной центрифуги
MiniSpin, Eppendorf.
Весы аналитические.
Посуда: колбы мерные, 100 мл и 25 мл; стаканчики стеклянные, 25 мл; пипетки и дозаторы, пластиковые пробирки 1,5 мл, флаконы стеклянные пенициллиновые.
Реагенты и растворы:
Растворы для промывки капилляра: 1н HCl и 0,5 н NaOH
Рабочий раствор рифабутина в спирте этиловом (5 мг в мл). 0,1% водный раствор ДМСО – метка ЭОП
Сухие соли для приготовления ведущих электролитов: NaH2PO4· H2O и Na2HPO4 · 2H2O.
Условия КЭ: капилляр термостатировать при 25°С;
напряжение, подаваемое на капилляр +20 кВ;
длина волны детектирования 214 нм;
ввод пробы гидродинамический (30 мБар, 5 секунд).
Выполнение работы
Промывка и кондиционирование капилляра
Включают прибор. После автотестирования прибора управляющей программой задают температуру термостата 25°С. Перед началом работы проводят промывку капилляра последовательно водой, 1н HCl, водой, 0,5 н NaOH, водой. Длительность каждой промывки - 5 минут. Для этого по 500
мкл каждого из растворов отбирают в отдельную пробирку, используя дозатор. После этого от пробирок ножницами отрезают крышки и устанавливают пробирки с растворами в карусель автосемплера прибора в соответствии со следующим порядком:
Слева: в гнездо 6 – пробирка в раствором 1н HCl, в гнездо 7 – пробирка с дистиллированной водой, в гнездо 8 – пробирка с раствором 0,5 н NaOH.
Справа: в гнездо 7 – пробирка с дистиллированной водой, в гнезда 8 и 9
вставляют пустые пробирки для слива.
После составления программы промывки, запускают ее и приступают к приготовлению растворов ведущих электролитов.
Приготовление буферных растворов для заполнения капилляра
Для заполнения капилляра необходимо приготовить четыре фосфатных буферных раствора (ведущий электролит) с различной кислотностью и одинаковой молярной концентрацией – 0,05М. Кислотность растворов должна лежать в интервале значения от рН 4 до рН 9,5. В двух мерных колбах объемом по 100 мл готовят два водных раствора с концентрациями 0,05 М из солей: NaH2PO4· H2O и Na2HPO4 · 2H2O. Необходимые для приготовления растворов навески солей взвешивают в сухих пенициллиновых флаконах на аналитических весах. После перенесения навесок в колбы объем колб до меток доводят дистиллированной водой и содержимое колб хорошо перемешивают.
Измеряют рН приготовленных растворов, используя рН-метр, и полученные значения записывают на колбах. Растворы с нужными значениями рН готовят в стеклянных стаканчиках, смешивая на магнитной мешалке два приготовленных раствора, и следят за кислотностью смешиваемого раствора с помощью рН-метра. Стремятся к тому, чтобы в итоге иметь четыре раствора,
кислотность которых приблизительно соответствовала следующим значениям рН: 4,7; 5,6; 8,0: 9,5. При необходимости до нужного значения рН смешиваемого на магнитной мешалке раствора можно довести растворами
NaOH (0,5M) или HCl (1M), добавляя их аккуратно по каплям.
Перед заполнения ими капилляр все буферные растворы следует дегазировать центрифугированием. Для этого каждым из четырех приготовленных растворов заполняют по 3 пробирки. Объем растворов в каждой пробирке –
500 мкл. Следует точно дозатором отмерять объем растворов для того, чтоб центрифуга была заполнена равномерно. Все пробирки устанавливают в центрифугу, соблюдая симметрию их расстановки на центрифужной
платформе. Далее включают программу центрифугирования при 12000
об/мин, 5 мин.
После окончания программы три пробирки с первым из растворов (самый щелочной) устанавливают в карусель автосемплера установки КЭ: две слева
(в 9 и 10 гнездо), одну справа в 10 гнездо.
Приготовление анализируемой пробы рифабутина и проведение КЭ
В пробирку дозатором вносят 10 мкл рабочего раствора рифабутина и 10 мкл
0,1% водного раствора ДМСО. Добавляют 480 мкл дистиллированной воды
(так, чтоб общий объем раствора в пробирке соответствовал 500 мкл) и
тщательно перемешивают полученный раствор в пробирке, предварительно закрыв ее крышкой. Далее ножницами отрезают крышку от пробирки с пробой и пробирку вставляют в гнездо «1» левого отделения автосемплера прибора «Капель».
После того, как все необходимые для кондиционирования капилляра и проведения анализа растворы установлены в устройство автосемплера,
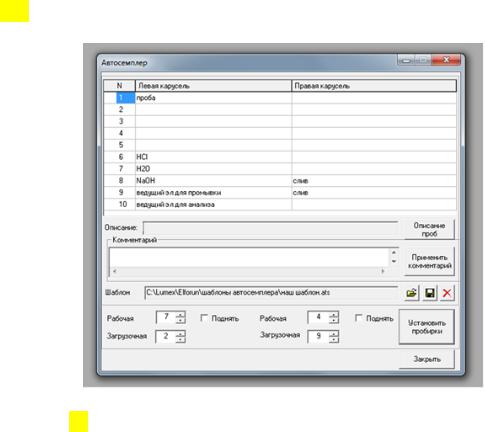
заполнение автосемплера должно соответствовать схеме, представленной на рис___.
Рис.___Схема установки пробирок в автосемплер системы КЭ
Далее необходимо составить программу анализа. В программу анализа вносят этапы промывки и кондиционирования капилляра, отбор проб и условия анализа. Время анализа для первого (самого щелочного) раствора ведущего электролита устанавливают 8 минут. Анализ останавливают, если на ЭФГ появился второй пик. Полученная ЭФГ сохраняется в папке, предварительно указанной в программе анализа. После получения первой ЭФГ меняют пробирки с буферными растворами и проводят анализ пробы рифабутина с новым раствором ведущего электролита. Следует иметь в виду, что, чем кислее используемый раствор ведущего электролита, тем медленнее ЭОП и время выхода пиков увеличивается. Таким образом, анализ повторяют со всеми буферными смесями, меняя каждый раз пробирки с буферными растворами в автосемплере. В ходе выполнения анализа следят за порядком появления пиков. На каждой ЭФГ должно быть по 2 пика. Возможен случай,
когда пики не будут достаточно разрешены.
После выполнения четырех анализов и получения ЭФГ нормального качества открывают все полученные ЭФГ в одном пакете. Сопоставляя времена выхода пиков рифабутина и метки ЭОП и последовательность их выхода, делают вывод об изменении заряда ионной формы RB в зависимости от кислотности раствора ведущего электролита.
Все полученные в ходе выполнения ЭФГ вклеивают в лабораторный журнал. Выводы о ионном состоянии молекулы рифабутина при различных рН и участии в равновесии различных ионных групп молекулы обосновывают,
используя значения ступенчатых констант кислотности рифабутина.
Работа 2. Определение кофеина и теобромина в водном
экстракте чая (кофе) методом мицеллярной
электрокинетической хроматографии
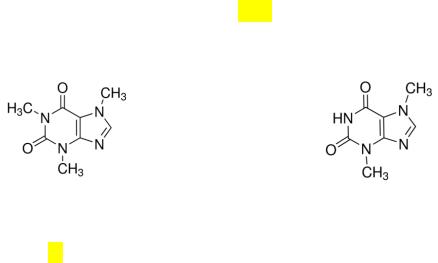
Кофеин и теобромин являются алкалоидами пуринового ряда, их структурные формулы приведены на рис.___.
Кофеин, М = 194,19 |
Теобромин, М = 180,16 |
Рис. 1. Структурные формулы кофеина и теобромина
Обе молекулы остаются нейтральными в широком диапазоне рН водных растворов. По этой причине количественное определение этих веществ методом КЭ выполняют с применением мицеллярной электрокинетической хроматографии. В буферный раствор ведущего электролита добавляют анионный ПАВ (додецилсульфат натрия (ДДС)) в концентрации,
превышающей критическую концентрацию мицеллообразования (ККМ).
Попадая в капилляре в мицеллярную среду, молекулы алкалоидов включаются в отрицательно заряженные мицеллы ДДС, образуя так называемую псевдостационарную мицеллярную фазу. Отрицательный поверхностный заряд мицелл обеспечивают регистрацию пиков алкалоидов в анионной области на электрофореграмме (ЭФГ).
Цель лабораторной работы: Определить содержание кофеина и теобромина в водном экстракте чая (или кофе).
Для этого следует:
-приготовить двухкомпонентные градуировочные растворы, содержащие кофеин и теобромин в различных концентрациях;
-приготовить раствор ведущего электролита;
-получить ЭФГ градуировочных растворов и провести калибровку по кофеину и теобромину;
-приготовить водный экстракт чая (или кофе), получить его ЭФГ и определить количественное содержание кофеина и теобромина в водном экстракте с использованием построенных градуировочных графиков.
Используемое оборудование и условия КЭ
Оборудование. В эксперименте по КЭФ используется система капиллярного электрофореза «Капель 105М» («Люмэкс», Россия), оборудованная спектрофотометрическим детектором и кварцевым капилляром (внутренний диаметр 75 мм, эффективная длина 50 см, общая длина 60 см). Применяется программноеобеспечение «Эльфоран» («Люмэкс», Россия).
Растворы центрифугируют с использованием лабораторной центрифуги
MiniSpin, Eppendorf.
Весы аналитические.
Посуда: колбы мерные, 100 мл и 25 мл; стаканчики стеклянные, 25 мл; пипетки и дозаторы, пластиковые пробирки 1,5 мл, флаконы стеклянные пенициллиновые.
Реагенты и растворы:
Растворы для промывки капилляра: 1н HCl и 0,5 н NaOH.
Сухие соли для приготовления ведущих электролитов: Na2B4O7·10 H2O и ДДСН (С12Н25SO4Na).
Условия КЭ: капилляр термостатировать при 25°С;
напряжение, подаваемое на капилляр +25 кВ;
длина волны детектирования 254 нм;
ввод пробы гидродинамический (30 мБар, 5 секунд).

После каждого анализа капилляр промывают рабочим буферным раствором в течение 3 минут.
Выполнение работы
Промывка и кондиционирование капилляра
Включают прибор. Проводят промывку капилляра (см. стр___).
Приготовление буферного раствора для заполнения капилляра
Состав буферного раствора для заполнения капилляра: 20мМ водный раствор тетрабората натрия + 40 мМ додедилсульфата натрия. Раствор готовят в мерной колбе объемом 25 мл. Необходимые для приготовления навески веществ взвешивают в пенициллиновых флаконах на аналитических весах и вносят в мерную колбу, доводят дистиллированной водой объем раствора в колбе до метки и перемешивают его до полного растворения компонентов.
Далее, буферным раствором заполняют 3 пробирки типа «Эпендорф», внося дозатором в каждую по 500 мкл раствора. Перед применением буферные растворы следует дегазировать центрифугированием при 12000 об/мин, 20°С, 5 мин (центрифуга Eppendorf). Следует помнить, что в центрифугу можно устанавливать пробирки только так, чтоб они уравновешивали друг друга.
После центрифугирования пробирки устанавливают в карусель автосемплера:
две слева (в 9 и 10 гнездо), одну справа в 10 гнездо.
Приготовление градуировочных растворов
Необходимо приготовить 3 двухкомпонентне градуировочных раствора,
содержание кофенина и теобромина в них приведено в таблице___.
Содержание кофеина и теобромина в градуировочных растворах Таблица___.
Компонент |
|
концентрация, мкг/мл |
||
|
|
|
|
|
|
Смесь 1 |
|
Смесь 2 |
Смесь 3 |
|
|
|
|
|
теобромин |
200 |
|
20 |
2 |
|
|
|
|
|
кофеин |
200 |
|
20 |
2 |
|
|
|
|
|
Раствор смеси 1 готовят по точным навескам компонентов в мерной колбе объемом 100 мл. Необходимые навески теобромина и кофеина взвешивают на аналитических весах в сухих пенициллиновых флаконах с точностью до четвертого знака после запятой. Смесь 2 и 3 готовят последовательным разбавлением из раствора смеси 1. Теобромин необходимо растворять в горячей воде. При приготовлении раствора смеси 1 сначала в мерную колбу количественно переносят взвешенную навеску теобромина и заполняют колбу на 2/3 ее объема горячей дистиллированной водой (70-80 С). Добиваются полного растворения теобромина, перемешивая раствор в колбе круговыми движениями. После этого в колбу вносят нужную навеску кофеина и после охлаждения раствора в колбе до комнатной температуры доводят объем в колбе до метки, закрывают пробкой и хорошо перемешивают раствор.
Смеси 2 и 3 готовят разбавлением смеси 1, не забывая хорошо перемешать приготовленные растворы. Далее приготовленные растворы отбирают дозатором (по 500 мкл) и вносят в пробирки «Эппендорф». Отрезают ножницами крышки пробирок и вставляют пробирки с градуировочными смесями в гнезда автосемплера слева (в грезда 1, 2 и 3).
Приготовление анализируемых проб чая или кофе и проведение КЭ
Чай (Кофе). Взвешенную на аналитических весах навеску чая (кофе),
необходимую для приготовления чашки напитка, переносят в мерный стакан
изаливают кипящей дистиллированной водой. Раствор в стакане перемешивают, используя магнитную мешалку. После охлаждения раствора отбирают по 1 мл раствора в пробирки («Эпендорф») дозатором. Необходимо помнить, что в центрифугу можно устанавливать пробирки только таким образом, чтоб они друг друга уравновешивали. Растворы в пробирках центрифугируют при 12000 об/мин, 20°С, 5 мин. При необходимости проводят повторное центрифугирование. Для этого из отцентрифугированной первый раз пробирки аккуратно дозатором отбирают 500 мкл надосадочной жидкости
ипереносят ее в чистую пробирку для повторного центрифугирования.
