
Лекция №1. Введение. Основы биофармации
Основные определения технологии лекарственных форм. Классификация лекарственных форм. Этапы создания лекарственных препаратов. Основы биофармации.
Основные определения технологии лекарственных форм.
Технология лекарственных форм – наука о теоретических основах и производственных процессах переработки лекарственных средств в лекарственные препараты путем придания им определенной лекарственной формы.
На схеме 1 упрощенно представлен процесс создания лекарственных препаратов.


Схема 1. Связь основных понятий в технологии лекарственных форм
Классификация ЛФ.
Существует множество классификаций для ЛФ, в основу которых положены различные принципы: агрегатное состояние, пути введения, дисперсионные среды, деление на дозы, по типу высвобождения активного вещества и др.
На схеме 2 перечислены некоторые ЛФ в соответствии с классификацией по агрегатному состоянию. Такое деление является качественным.
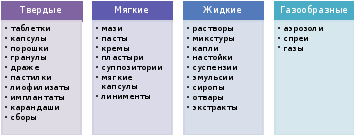
Схема 2. Классификация ЛФ по агрегатному состоянию
Количественное деление осуществляется в классификации по дозировке препаратов (схема 3). Препараты, относящиеся к группе смешанного типа, могут быть как в дозированной, так и недозированной форме.

Схема 3. Классификация ЛФ по дозировке
На схеме 4 представлена классификация ЛФ в зависимости от пути введения

Схема 4. Классификация ЛФ в зависимости от пути введения
Этапы создания ЛП. Доклинические и клинические испытания
Разработка лекарства – сложный, длительный и дорогостоящий процесс. Фармацевтическая индустрия является мощной инновационной отраслью экономики с годовым оборотом более 300 млрд. долларов США. При этом в год создается 20-30 новых ЛВ. Цикл разработки ЛС имеет продолжительность 10-15 лет. Информация доклинических и клинических исследований I-III фаз составляет регистрационное досье, необходимое для получения разрешения вывода препарата на рынок.
Доклинические испытания (4-5 лет), прежде всего, направлены на исследование фармакологических и токсических свойств, позволяют предварительно оценить эффективность и безопасность ЛС и составляют значительную часть досье, предоставляемого для регистрации. Также в цикл доклинических испытаний входит определение биологической мишени ЛС, предварительное изучение фармакокинетики и фармакодинамики на различных биологических моделях, нахождение оптимальной структуры (или структур), подвергающихся дальнейшим исследованиям с целью выявления безопасного и эффективного соединения для проведения клинических испытаний (т.н. соединение-кандидат). Испытания проводятся на клеточных культурах и животных.
Клинические испытания (5-10 лет) проводятся с участием людей и направлены на получение данных о безопасности и эффективности препарата, или для расширения возможных показаний к применению уже одобренного ЛП. Испытания включают 4 стадии:
I фаза: здоровые добровольцы (если сильнодействующее ЛС, испытания проводятся на пациентах с заболеванием). Цель: изучение факрмакокинетики и фармакодинамики, предварительная оценка безопасности
IIA фаза: пробные исследования – определение чувствительности различных групп пациентов к разным дозам препарата. Оценка безопасности, эффективности, переносимости.
IIВ фаза: регулируемые исследования – определение доз для III фазы
II фаза проводится обязательно с наличием группы контроля (плацебо или «золотой стандарт»).
III фаза: Двойное слепое рандомизированное контролируемое испытание. Проводится с целью подтверждения данных, полученных при проведении II фазы, изучается дозозависимый эффект препаратов, проводятся испытания среди большой группы пациентов с заболеванием разной степени тяжести, а также исследование некоторых наиболее вероятных лекарственных комбинаций.
IIIВ фаза – для расширения возможного спектра применения ЛП
IV фаза – пострегистрационные исследования. Цель: сбор информации, не полученной в ходе клинических испытаний. Информация может быть полезна для повышения безопасности и эффективности препарата, а также политики реализации препарата на рынке. Если в ходе IV фазы выявлено, что препарат небезопасен для широкого круга потребителей, он может быть отозван из продажи.
Основы биофармации
Биофармация (БФ), являясь самостоятельной дисциплиной в комплексе фармацевтических наук, одновременно выступает как теоретическая основа технологии ЛФ. Основная задача БФ – изучение действия ЛП и их эффективности в зависимости от фармацевтических факторов.
Отличительной особенностью БФ по сравнению с фармакологией является то, что БФ не уделяет внимание вопросу изучения механизмов действия ЛП: исследуются исключительно переменные факторы, влияющие на фармакокинетику и фармакодинамику.
К фармацевтическим факторам относятся:
-
Химические свойства ЛВ (кислотно-основные взаимодействия, липофильность, комплексообразование и др.)
-
Агрегатное состояние ЛП и физическое состояние ЛВ (пористость, распределение частиц по размерам, поверхностный заряд и др.)
-
Качественный и количественный состав вспомогательных веществ (многофакторный подбор оптимального состава для той или иной ЛФ)
-
Взаимное влияние различных ЛП при одновременном приеме (ускорение/замедление фармакокинетических параметров, различные реакции, в том числе летальный исход).
-
Конкретный вид ЛФ и пути ее введения (биодоступность)
-
Точная дозировка, обеспечивающая необходимые уровни ЛВ в биожидкостях организма при должном уровне безопасности
-
Фармацевтическая технология (стабильность и качество ЛФ, скорость высвобождения вещества из ЛФ, в целом влияющие на эффективность)
Фармакокинетика – раздел фармакологии, изучающий кинетические аспекты изменения ЛВ в ходе физических, химических и биологических процессов в организме.
Любой препарат проходит следующие стадии изменения:
-
Либерация – высвобождение из ЛФ
-
Абсорбция – всасывание ЛВ, интеграция в биологические жидкости
-
Распределение – транспортировка ЛВ к различным органам и тканям по кровеносной системе.
-
Метаболизм (биотрансформация) – химическое изменение ЛВ в организме
-
Элиминация (экскреция) – выведение метаболитов, а также неизмененных ЛВ, из организма.
Важной характеристикой для БФ является параметр биодоступности (БД), выражаемый формулой:
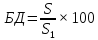
физическим смыслом которой является доля ЛВ, поступившего в кровоток из определенной ЛФ. 100% БД обладает стандартная ЛФ, применимая для в/в введения. Таким образом, БД – мера способности ЛВ доходить до требуемого места действия в неизменном виде, и определяющая оптимальную дозировку. На БД влияют те же фармацевтические факторы, что и в целом на БФ.
Относительная БД, как правило, измеряемая для одного пути введения, определяется, если происходят изменения в технологии изготовления, если ЛП имеют различных производителей, а также для разных ЛФ.
Еще одним параметром, имеющим важное значение в изучении БФ, является биоэквивалентность (БЭ) – степень подобия двух препаратов в отношении их концентрации в крови и тканях организма.
Наиболее важные фармакокинетические параметры (рис. 1) в изучении БЭ препаратов:
-
Максимум концентрации ЛВ в крови (Сmax)
Связанный с показателем параметр: минимальная эффективная концентрация (МЭК). Препараты, для которых Сmax не достигает МЭК, не оказывают терапевтического действия.
-
Время достижения Сmax (tmax)
Отражает скорость всасывания и скорость наступления терапевтического эффекта. Чем меньше tmax, тем быстрее наступает действие.
-
Площадь под фармакокинетической кривой (AUC)
При равенстве площадей препараты являются биоэквивалентными.

Рис. 1. Фармакокинетические кривые
Определение БЭ, как метод, позволяет сделать обоснованные выводы о качестве, эффективности и безопасности препаратов на основании малого количества информации в очень сжатые сроки (быстрее, чем при полном цикле клинических испытаний). Грубая сравнительная оценка нескольких препаратов.
