
- •Система свертывания. Крови
- •Выделяют три фазы гемокоагуляцин и одну постк-оагулпииошгую фазу:
- •1.Образование протромбнназы. В зависимости от механизма первой фазы различают внешнюю и внутреннюю системы свертывания крови.
- •Фибринолитическая система
- •Участие тромбоцитов в гемостазе
- •Гемостатическая функция сосудистой стенки
- •Лабораторная диагностика нарушений в системе гемостаза
Фибринолитическая система
Фибрин не имеет постоянных функций в организме и через некоторое время исчезает. Фибринолиз – это расщепление фибрина (фибриногена) на растворимые фрагменты небольших размеров( пептиды). В организме существует два вида естественного литического действия на фибрнин: ферментативный, осуществляемый в основном плазмином, а также ферментами лейкоцитов, тромбоцитов и эритроцитов, непосредственно расщепляющих фибрин; неферментативный, осуществляемый комплексными соединениями гепарина со специфическими белками крови, а также адреналином, норадреналином, серотонином и другими агентам (лизируют лишь нестабилизированный фибрин).
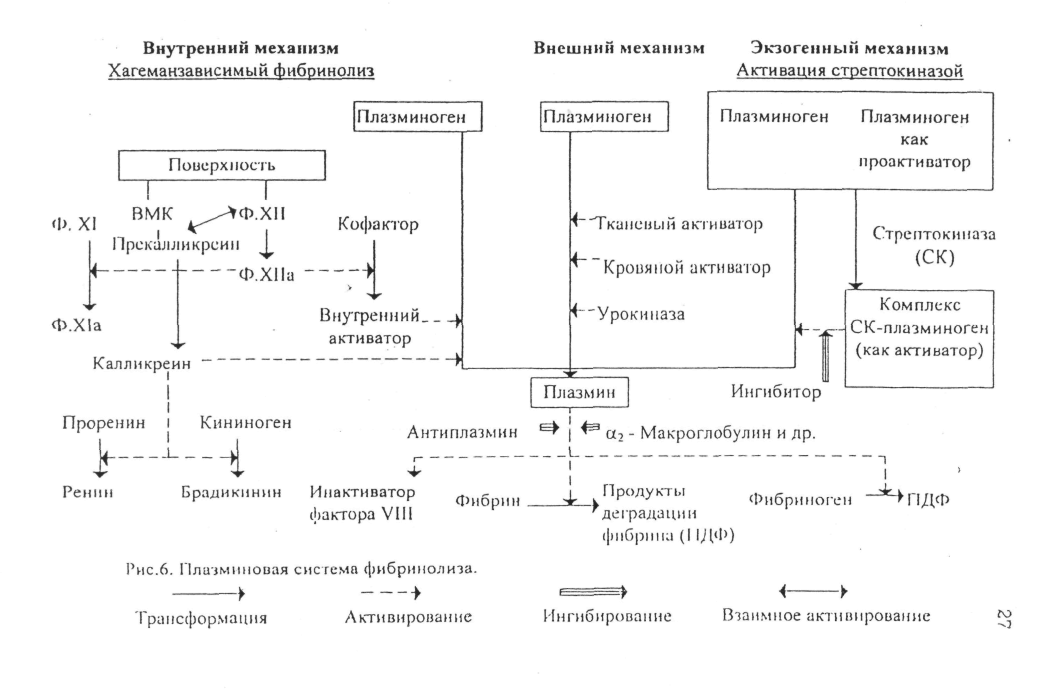 Главным
физиологическим ферментом, ответственным
за фибринолиз, является протеолитический
фермент плазмин (фибринолизин), а реакции,
определяющие его активности, носят
название плазминовой (фибринолитической)
системы. Плазминовая
система
(рис.6) – основное звено фибринолиза. В
плазминовую систему входят: плазмин и
его профермент – плазминоген; активаторы
плазминогена, проактиваторы плазминогена,
ингибиторы плазмина и ингибиторы
активаторов плазминогена.
Главным
физиологическим ферментом, ответственным
за фибринолиз, является протеолитический
фермент плазмин (фибринолизин), а реакции,
определяющие его активности, носят
название плазминовой (фибринолитической)
системы. Плазминовая
система
(рис.6) – основное звено фибринолиза. В
плазминовую систему входят: плазмин и
его профермент – плазминоген; активаторы
плазминогена, проактиваторы плазминогена,
ингибиторы плазмина и ингибиторы
активаторов плазминогена.
Плазминоген – неактивный предшественник плазмина – одноцепочечный гликопротеин, синтезируемый в печени, костном мозге, почках. В тканях и кровотоке находится в виде двух молекулярных форм: неактивного плазминогена с N-концевой глутаминовой кислотой (глу-плазминоген) и плазминогена, подвергнутого ограниченному протеолизу (частично активированный плазминоген) с концевым лизином, метионнном или валином (лиз-плазминоген). Последний приблизительно в 15-20 раз быстрее трансформируется в плазмин и имеет большую тропность к фибрину.
Под действием активаторов плазминоген быстро превращается в плазмин - сериновую протеиназу расщепляющую лизил-аргининовые и лизил-лизиновые связи в белковых субстратах, главным образом в фибрине и фибриногене (циркулирующий свободный плазмин способен также гидролизовать факторы V и VIII свертывающей системы крови, факторы комплемента, различные полипептидные гормоны). При активировании плазминогена в его молекуле гидролизуется пептидная связь арг 56°- вал56' (рис.7), и молекула из одноцепочечной превращается в двухцепочечную молекулу плазмина. Тяжелая (А) цепь (м.м. 60000) плазмина является М-концевой, легкая (В) цепь (м.м. 25000) — С-концевой. В-цепь содержит обычный для сериновых протеиназ активный центр, имеющий остатки серима, гистидина и аспарагиновой кислоты. В А-цепи плазмина, также как и в молекуле плазминогена, имеется пять близких по аминокислотной последовательности петлеобразных участков кринглов (содержат по 80 аминокислотных остатков, скрепленных тремя дисульфидными связями), называемых лизинсвязывающими участками (ЛСУ). ЛСУ ответственны за взаимодействие плазминогена (плазмина) с фибрином (фибриногеном), а также с физиологическим ингибитором плазмина — α2-антиплазмином.
Активаторы плазминогена (АПГ) — высокоспецифичные сериновые протеиназы регуляторного типа. Существует большое количество АЛГ, которые присутствуют в крови, других биологических жидкостях и тканях организма человека. Физиологические активаторы плазминогена классифицируются в зависимости от источника получения на тканевые (органные), сосудистые, тканевый активатор плазминогена, плазменные, кровяные, активатор из мочи — урокиназа; АПГ, выделяемые культурами раковых и трансформированных онкогенами клеток. Практически все АПГ продуцируются в виде проферментов (проактиваторов плазминогена).

Активирование плазминогена осуществляется несколькими путями: внешним — под действием активаторов тканей, крови, сосудистой стенки, которые высвобождаются в кровь под влиянием различных факторов; внутренним — при участии свойственных крови белков — фактора Хагемана, прекалликреина, высокомолекулярного кининогена: экзогенным— введение в организм активаторов плазминогена (стрептокиназа и созданные на ее основе препараты, урокиназа, комплекс стрептокиназа — лиз-плазминоген; тканевый активатор плазмнногена, получаемый методом генной инженерии, и другие препараты) с терапевтической целью.
Внутренний путь активации фибринолиза (Хагеманзависимый фибринолиз) инициируется фактором Хагемана (ф.ХII) плазмы крови. После фиксации фактора XII и комплекса из таких белков, как высокомолекулярный кининоген-прекалликреин, на чужеродной или измененной поверхности (коллаген или др.), комплекс ВМК-прекалликреин, находившийся в неактивном состоянии, подвергается ограниченному протеолизу с образованием калликреина и высокомолекулярного кининогена без кинина и брадикинина, а фактор Хагемана активируется (ф.ХIIа). Фактор ХIIа после промежуточной активации кофактором может комплексоваться с этим кофактором и превращать плазминоген в плазмин. Свободный калликреин также является прямым активатором плазминогена.
Хагеманзависимый фибринолиз протекает наиболее быстро и активируется с запуском реакций образования протромбиназы по внутреннему механизму и носит срочный характер. Его основное назначение — очищение сосудистого русла от фибриновых сгустков, образующихся в процессе внутрисосудистого свертывания крови. Хагеманзависимый фибринолнз осуществляется и с участием АПГ. содержащихся в форменных элементах крови.
Внешний путь активации фибрииолизд имеет превалирующее функциональное значение, стимулируется различными тканевыми активаторами плазминогена. Важнейший из них — тканевый активатор плазмнногена (тАПГ) — синтезируется эндотелиальными клетками кровеносных сосудов и по мере надобности расходуется на активацию фибринолиза. Секреция тАПГ эндотелиоцитами происходит не только при тромбозе сосудов, но и при сжатии манжеткой, при физических нагрузках, под влиянием вазоактивных веществ (адреналина, норадреналина) и некоторых лекарственных препаратов. Этот активатор и его ингибиторы осуществляют постоянно действующую регуляцию фибринолитической активности. На долю тАПГ приходится 85% внешней фибринолитической активности крови.
По структуре и механизму действия к тАПГ близки содержащиеся в разных тканях другие активаторы фибринолиза, которые поступают в кровь при повреждении тканей (травмы, деструкция тканей, акушерская патология и другие). Особое место среди тканевых (органных) факторов фибринолиза занимает продуцируемая почечной тканью и эпителием мочевыводящих путей, урокиназа,, большая часть которой выделяется с мочой. (Известно две формы урокиназы (УК) из мочи: УК 1 (м.м.ЗЗООО) и УК II (м.м.54000). УК 1 активирует глу-плазминоген в 2,5-5 раз медленнее, чем УКII, а ферментативное действие обеих форм на лиз-плазминоген одинаково.) Урокиназа обеспечивает около 10-15% внешней фибринолитической активности крови. Урокиназа способна проникать внутрь тромба и там катализировать превращение плазминогена в плазмин, разрушая таким образом тромб не только снаружи, но и изнутри.
Кровяные активаторы плазминогена содержатся в клетках крови (эритроцитах, тромбоцитах и лейкоцитах ) и высвобождаются при их активации и разрушении, а также при тромбообразовании, особенно индуцированном эндотоксином.
Из экзогенных активаторов наиболее изучена стрептокиназа — неферментный белок (м.м.47000), продуцируемый β-гемолитическим стрептококком и в обычных условиях отсутствующий в крови. Стрептокиназа, как и деказа, целиаза, авелизин и другие, не обладают самостоятельной ферментативной активностью по отношению к плазмину, но соединяясь с плазминогеном, они образуют комплекс, инициирующий превращение плазминогена в плазмин. Таким образом стрептокиназа активирует плазминоген, связанный с фибриновым сгустком, также как и плазминоген в растворимой фазе, что сопровождается образованием свободного плазмина. При стрептококковой инфекции возможно образование стрептокиназы в большом количестве, что может приводить к усиленному фибринолизу (фибриногенолизу) и развитию геморрагического диатеза.
Превращение плазминогена в плазмин, также как и сам процесс лизиса фибриновых сгустков, происходит не в жидкой, а в твердой фазе фибрина, где сорбируется плазминоген и его активаторы.
Схематично взаимодействие фибрин(оген)а с плазминогеном представлено на рисунке (рис.8). Сгустки фибрина избирательно адсорбируют и удерживают плазминоген. Последний имеется в качестве примеси и в фибриногене, но при переходе его в фибрин сродство к плазминогену сильно возрастает. Лизиновые участки (ЛУ) расположены в центральной части молекулы фибрин(оген)а — в домене Е. Взаимодействие плазминогена с фибин(оген)ом происходит за счет специфического соединения ЛСУ с ЛУ. Более сильное по сравнению с фибриногеном сродство фибрина к плазминогену указывает на то, что в молекуле фибрина ЛУ в большей степени экспонированы (выставлены на поверхность). Свойство присоединяться посредством ЛСУ к нескольким молекулам фибрина присуще и плазмину.

Такая поливалентность имеет большой биологический смысл, так как позволяет молекуле плазмина действовать на новые интактные молекулы фибрина, оставаясь связанной с субстратом и избегая при этом перехода о раствор и инактивации при контакте с α2-антиплазмином. Вместе о плазминогеном сгусток фибрина специфически связывает активаторы плазминогена. Тканевые активаторы плазминогена имеют низкую каталитическую активность в отсутствие фибрина и активируются при связывании с фибрином. Активаторы тканевого типа, за исключением урокиназы, имеют более высокое сродство к фибрину в сравнении с фибриногеном, что объясняет преимущественный фибринолиз и в очень слабой степени фибриногенолиз. Одновременное присутствие плазминогена и его активаторов на поверхности фибрина обеспечивает естественное формирование плазмина и фибрин расщепляется на мелкие фрагменты, то есть растворимые продукты деградации фибрина (ПДФ).
Катаболизм фибрин(оген)а осуществляется в определенной последовательности (рис.9). На самой ранней и быстро заканчивающейся стадии от С-конца Аα- цепи фибрина (фибриногена) отщепляются несколько пептидов нестабильной структуры (пептиды Б и С) и стабильный пептид А (м.м.20000) с образованием фрагмента X (м.м.240000) (если этот фрагмент образуется из фибриногена, то он всегда свертывается тромбином). Затем происходит формирование фрагмента У (м.м. 155000), являющегося несимметричным продуктом деградации и образующимся за счет освобождения фрагмента Д (м.м. 85000). Фрагменты X и У являются ранними продуктами деградации фибрина (фибриногена). Фрагмент У в свою очередь распадается на фрагмент Е (м.м.50000) и второй фрагмент Д, являющимися конечными (поздними) продуктами фибрино(гено)лиза. Более мелкие ПДФ быстрее удаляются из кровотока, фиксируясь на уровне ретикулоэндотелиальной системы. Различные ПДФ проявляют антикоагулянтные, антиполимеризационные, антиагрегационные и другие свойства.
Определение ранних и поздних ПДФ проводят для ранней диагностики изменений фибринолитической активности, стадий ДВС-синдромов, дифференциации первичного и вторичного фибринолиза.
Ни плазмии, ми активатор плазминогена не могут оставаться связанными с ПДФ и они выходят в плазму, где инактивируются естественными ингибиторами.
Ингибиторы фибринолиза являются неотъемлемым компонентом фибринолитической системы. Ингибирование фибринолиза осуществляется на каждом этапе активации этого процесса. Основные физиологические ингибиторы фибринолиза подразделяют на ингибиторы плазмина и ингибиторы активаторов плазминогена. Нередко один и тот же ингибитор способен инактивировать и активатор плазминогена, и плазмин.
Ингибиторы плазмина (антиплазмины). Антиплазминовым свойством обладают , по меньшей мере, шесть агентов: α2-антнплазмин, α2-макроглобулнн, α2-антнтрипсин, антитромбии III, С1-инактиватор, интер-α2 антитрипсин.
Важнейшим физиологическим ингибитором плазмина является антиплазмин (α2-АП),— гликопротеин (м.м. 67000), синтезирующийся в гепатоцитах. Хотя на α2-АП приходится всего 2,2% общей антиплазминовой активности плазмы, он является наиболее мощным и быстродействующим ингибитором плазмина. α2-АП, имеющий ЛУ, вызывает необратимое ингибирование плазмина, связываясь с плазмином на уровне ЛСУ. Если ЛСУ плазмина заняты на связывание с фибрином, α2-АП в очень слабой степени способен нейтрализовать плазмин на поверхности фибрина. 3 циркулирующей крови свободного .плазмина нет, так как α2-АП связывает и инактивирует даже его следовые количества, быстро прекращая фибринолиз за пределами сгустков фибрина. Поэтому фибриноген, который для свободного плазмина является наилучшим субстратом, сохраняется в крови интактным. В случае тотальной активации плазминогена, например при введении внутривенно активаторов плазминогена в больших дозах для осуществления терапевтического тромболиза, а2-АП не может нейтрализовать более чем 70% образовавшегося плазмина и в циркулирующей крови может появляться свободный плазмин, что, в свою очередь, может сопровождаться фибриногенолизом и, следовательно, кровотечением, часто возникающим при фибринолитической терапии. а2-АП способен также связывать трипсин, калликреин, фактор Ха, урокиназу_, тАПГ и, следовательно, вмешиваться в процесс как на ранних, так и на поздних этапах фибринолиза, а также тормозить процесс свертывания крови.
Другим функционально важным ингибитором плазмина является , α2-макро-глобулин ( α2-МГ) — гликопротеин с молекулярной массой 725000, который в отличие от а2-АП реагирует с плазмином относительно медленно,
но его емкость велика. Поэтому при наличии больших количеств плазмина и исчерпании запаса α2-АП задачу инактивации выполняет α2-МГ. α2-МГ ингибирует и плазмин, связанный с фибрином. Он связывается в комплекс с ферментом и вызывает частичный протеолиз плазмина, который не затрагивает активный центр фермента. В комплексе с α2-МГ плазмин сохраняет большую часть фибринолитической активности, но полностью теряет фибриногенолитическую активность. α2-МГ может связываться с внутренней поверхностью эндотелиального слоя кровеносных сосудов, что позволяет сделать предположение об участии этого белка в регуляции протеолиза на стенке кровеносных сосудов.
α1-Антитрипсин, антитромбин III и его комплекс с гепарином, как и другие ингибиторы, in vivo обычно играют ограниченную роль в качестве ингибиторов плазмина. Их значение возрастает, только когда концентрации а2. антиплазмина и α2 -макроглобулина снижены.
Ингибиторы активаторов плазминогена (антиактиваторы). Неспособность тканевого активатора плазминогена вызвать активацию плазминогена в жидкой фазе обусловлена и большим избытком антиактиваторов, с которым он образует комплекс. Это ингибирование активаторов плазминогена обратимо и для диссоциации комплекса активатор-антиактиватор необходима твердая фаза в виде фибринового сгустка. Выделяют четыре типа естественных тканевых ингибиторов активаторов плазминогсна (ПАИ). Ингибитор I типа (ПАИ-1) найден в эндотелии, плазме, тромбоцитах и гепатоцитах. На его долю приходится 60% антиактиваторной активности. Ингибитор II типа (ПАИ-2), получивший название плацентарного, синтезируется не только в плаценте, но и макрофагами и моноцитами; он чрезвычайно быстро связывает активатор плазминогена урокиназного типа, но не способен нейтрализовать проурокиназу. Ингибитор III типа (ПАИ-З)обнаружен в плазме. Ингибитор IV типа (ПАИ-4), или никсинпротеаза, синтезируется ,фибробластамн и напоминает ингибитор трипсиноподобных протеаз. Повышенное образование антиактиваторов плазминогена может быть причиной снижения фибринолитической активности крови.
Различные искусственные ингибиторы фибринолиза нашли применение в клинической практике как гемостатические средства. Наиболее широко используются такие лекарственные препараты как эпсилон-амннокапроновая кислота (ЭАКК) и амбен (блокируют активный центр активатора плазминогена и препятствуют образованию плазмина); трасилол, контрикал, гордокс (непосредственно ингибируют плазмин).
В условиях нормы активаторная и ингибиторная функции фибринолитической системы находятся в динамическом равновесии. Локальное или системное снижение фибринолитической активности приводит к тромбозам. С другой стороны, чрезмерное повышение фибринолитической активности может сопровождаться кровотечениями.
