
- •Общая и неорганическая химия
- •Раздел I. Теоретические основы общей химии
- •1. Введение. Атомо-молекулярное учение. Основные законы химии
- •Предмет химии
- •Основные понятия химии. Основные положения атомо-молекулярной теории
- •Основные законы химии
- •Степени окисления элементов
- •Классификация и номенклатура неорганических соединений
- •Гидроксиды: основания и кислоты
- •Галогенангидриды
- •2. Строение атома. Периодический закон и периодическая система элементов менделеева
- •Модель атома Бора
- •Корпускулярно-волновой дуализм микрочастиц
- •Квантовые числа, их физический смысл
- •Возможные энергетические состояния электрона в атоме водорода
- •Распределение электронов по уровням и подуровням в многоэлектронных атомах
- •Периодическая система и электронная структура атомов
- •Структура периодической системы
- •3.Химическая связь
- •Характеристики химической связи
- •Механизм образования химической связи с позиций метода валентных связей (мвс)
- •Кратность связи. Направленность связи. Гибридизация
- •Электрические и магнитные свойства молекул
- •Ионная и водородная связь
- •Метод молекулярных орбиталей (ммо)
- •Металлическая связь
- •Агрегатное состояние вещества. Кристаллическое состояние. Кристаллические решетки
Степени окисления элементов
Степень окисления – это условный заряд атома в молекуле, вычисленный согласно предположению о том, что молекула состоит только из ионов.
При определении степени окисления исходят из того, что степень окисления водорода в соединениях +1, а кислорода –2 (исключения: 1) гидриды активных металлов МеН, где степень окисления водорода -1; 2) пероксид водорода и его производные, в которых степень окисления кислорода -1; 3) фторид кислорода ОF2, где степень окисления кислорода +2). Степень окисления других элементов определяют, исходя из того, что алгебраическая сумма всех степеней окисления в молекуле должна быть равна 0.
Элементы, как правило, имеют различное число степеней окисления, но выделяют наиболее устойчивые, т.е. часто встречающиеся. Устойчивые степени окисления элементов можно определить с помощью периодической системы Менделеева:
- для элементов I – III групп они положительны и равны номеру группы;
- для элементов главных подгрупп IV – VI групп степени окисления изменяются от положительной, равной номеру группы, до отрицательной, рассчитанной по разности (8 – номер группы). Промежуточные положительные степени окисления вычисляются как разность между номером группы и числом 2. При этом: для висмута наиболее устойчивая степень окисления +3;
- для галогенов устойчивыми являются степени окисления от +7 до -1 и промежуточные, отличающиеся на две единицы.
Для фтора существует только одна степень окисления -1.
Для элементов побочных подгрупп нет простой связи между устойчивой степенью окисления и номером группы. Устойчивые степени окисления таких элементов надо запомнить:
Cr (+6 и +3); Mn (+7, +6, +4, -2); Fe, Co, Ni (+3 и +2); Cu (+2 и +1); Ag (+1); Au (+3 и +2); Zn (+2); Cd (+2); Hg (+2 и +1).
Степень окисления часто не совпадает с валентностью. Чтобы определить валентность, надо строить графическую формулу.
Классификация и номенклатура неорганических соединений
Основными классами неорганических соединений являются оксиды, гидроксиды и соли.
К неосновным классам относятся галогенангидриды, пероксиды и другие.
Оксиды
Это соединения, состоящие из двух элементов, один из которых кислород. При этом атомы кислорода связаны только с атомами другого элемента и не имеют связей между собой.
Оксиды образуют все элементы, кроме инертных газов.
Графические формулы оксидов: Э-О-Э; Э=О; О=Э-О-Э=О; О=Э=О.
Оксиды делят на солеобразующие и несолеобразующие. Последних мало, это те оксиды, которые не взаимодействуют с основаниями и не образуют солей, например NO, N2O, SiO.
Солеобразующие оксиды делят на основные, кислотные и амфотерные.
Основные оксиды – это такие, гидраты которых являются основаниями. Основные оксиды образуют соли с кислотами или кислотными оксидами, оксиды щелочных и щелочноземельных металлов взаимодействуют с водой, например:
BaO + H2O = Ba(OH)2;
FeO + 2HCl = FeCl2 + H2O.
Кислотные оксиды – это такие, гидраты которых являются кислотами. Кислотные оксиды образуют соли с основаниями или основными оксидами. Большинство кислотных оксидов реагируют с водой с образованием кислот. Например:
SO3 + H2O = H2SO4;
SO2 + 2NaOH = Na2SO3 + H2O;
SiO2 + FeO = FeSiO3.
Амфотерные оксиды – это оксиды, которые, в зависимости от условий, проявляют и кислотные и основные свойства, т.е. образуют соли и с кислотами и с основаниями (с кислотными и основными оксидами). С водой амфотерные оксиды непосредственно не реагируют.
К амфотерным оксидам относятся ZnO, Al2O3, Cr2O3 и другие:
ZnO + 2NaOH = Na2ZnO2 + H2O;
ZnO + 2HCl = ZnCl2 + H2O.
Характер оксида определяется положением образующего элемента в периодической системе. Для элементов главных подгрупп границей, разделяющей элементы, образующие кислотные оксиды, и элементы, образующие основные оксиды, являются элементы, все оксиды которых амфотерны и расположены на диагонали-вертикали Be – Al – Ge – Sn – Pb:
I II III IV V VI VII VIII
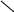 Be
Be
Э
 лементы
Al
Элементы
с кислотными оксидами
лементы
Al
Элементы
с кислотными оксидами
с
 Ga
Ge
As
Ga
Ge
As
о сновными In Sn Sb высшие оксиды Э2О5 амфотерны
оксидами ↑ Pb Bi –образует основной оксид Bi2O3
оксиды
Ga и In амфотерны
Элементы побочных подгрупп так же образуют амфотерные оксиды, например, Au2O3, MnO2.
Если элемент образует оксиды в разных степенях окисления, то оксиды, соответствующие высшим степеням окисления, являются кислотными; низшим – основными, а промежуточным степеням окисления – могут быть амфотерными. Например, MnO – основной оксид; MnO2 – амфотерный; MnO3 и Mn2O7 - кислотные.
По международной номенклатуре название оксида строится так: слово «оксид» - название элемента, его образующего, в родительном падеже – степень окисления элемента в скобках (если элементу соответствует несколько оксидов). Например:
FeO – оксид железа (II);
Fe2O3 – оксид железа (III);
NO – оксид азота (II);
N2O5 – оксид азота (V).
