
- •На чем основаны потенциометрические методы анализа?
- •2. Какая зависимость выражается уравнением Нернста?
- •3. Какие функции выполняют индикаторные электроды и какие электроды сравнения?
- •4. Как устроен стеклянный электрод? Как с его помощью определяют рН раствора? Какие достоинства и недостатки он имеет?
- •5. В чем сущность и области применения методов прямой потенциометрии?
- •6. В каких координатах строят кривые потенциометрического титрования?
- •7. По какому закону изменяется сила тока в ходе прямого кулонометрического определения?
- •8. Каковы преимущества кулонометрического анализа при контролируемой силе тока?
- •9. Измерение какого свойства лежит в основе кондуктометрического анализа?
- •10. Как практически определяют концентрацию методом прямой кондуктометрии?
- •11. На чем основан поляриметрический метод анализа?
- •12. Чем характеризуется кулонометрия?
- •13. Области применения кондуктометрии.
- •14. Основные типы ионоселективных электродов.
- •15. В чем различие методов прямой кулонометрии и кулонометрического титрования?
- •16. Что лежит в основе полярографического метода анализа?
- •17. Разновидности полярографии?
- •18. Какой ток называется предельным (диффузионным)?
- •19. Сущность амперометрического титрования
- •21. Основные виды электродов и их предназначение.
- •22. В чем отличие прямой и косвенной кондуктометрии?
5. В чем сущность и области применения методов прямой потенциометрии?
Прямая потенциометрия основана на непосредственном измерении потенциала индикаторного электрода и вычислении активности потенциалопределяющих ионов по уравнению Нернста. Прямой потенциометрический метод часто называют ионометрическим методом анализа (ионометрией).
Метод применяется для определения концентрации водородных ионов или рН растворов. Ионометрия – удобный, простой и экспрессный современный метод: продолжительность анализа определяется временем подготовки пробы (на измерение тратится не более 2 минут).
В методе ионометрии предварительно, пользуясь растворами с известной концентрацией, градуируют электрод (опытным путем определяют зависимость его потенциала от концентрации потенциал-определяющего иона). Затем измеряют потенциал раствора с неизвестной концентрацией определяемого иона и по градуировочному графику находят его содержание.
Ионоселективные электроды позволяют
измерять концентрации ионов до
 М
в растворе. При этом необходимый для
определения объем раствора составляет
не более 0.1 мл.
М
в растворе. При этом необходимый для
определения объем раствора составляет
не более 0.1 мл.
6. В каких координатах строят кривые потенциометрического титрования?
Крива́я титрова́ния — графическое изображение зависимости определяемой в ходе титрования величины от объёма добавленного стандартного раствора титранта. Построение кривых проводится в инструментальных методаханалитической химии, где отсутствует возможность визуального определения точки эквивалентности (например, по индикатору).
Кривые
потенциометрического титрования
строятся в координатах Е от Vтитр
(интегральная кривая), ∆Е от ∆V
(дифференциальная кривая по первой
производной) ,
 от
от
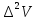 (дифференциальная кривая по второй
производной) и ∆V/∆Е от V(метод Грана).
(дифференциальная кривая по второй
производной) и ∆V/∆Е от V(метод Грана).
Ординатой (осью Y) в графике зависимости является параметр, который фиксируется (pH, напряжение, температура раствора и так далее), а абсциссой(независимой переменной, осью X) — количество добавленного титранта. Иногда абсциссой выступает степень оттитрованности (обозначается τ или f) — соотношение количества вещества титранта к количеству определяемого вещества. Это показатель может использоваться или в виде абсолютного значения, или же в процентах.
Если в ходе титрования фиксированные значения меняются на несколько порядков, для удобства применяют построение логарифмических зависимостей — величину A на оси Y представляют в виде -lg A (аналогично pH, который является логарифмом -lg H+). Логарифмические кривые характерны для кислотно-основных и окислительно-восстановительных титрований.
7. По какому закону изменяется сила тока в ходе прямого кулонометрического определения?
В прямой кулонометрии определяемое вещество реагирует непосредственно на поверхности электрода, поэтому этот метод пригоден для определения только электроактивных веществ. Расчеты, проводимые при применении прямой кулонометрии, не отличаются сложностью. В их основе лежат законы Фарадея, которые формулируются следующим образом:
-
Масса вещества, выделившегося на электроде, прямо пропорциональна количеству электричества Q, прошедшего через электролит.
-
Массы различных веществ, выделенных или растворенных при прохождении одного и того же количества электричества, пропорциональны их электрохимическим эквивалентам.
Суть законов Фарадея заключается в том, что для превращения 1 грамм-эквивалента любого вещества необходимо пропустить через раствор одно и то же количество электричества. Эта величина, равная 96487 Кл/моль, была названа впоследствии постоянной Фарадея — F.

Величину прошедшего количества электричества Q находят методом интегрирования или (для кулонометрии при постоянном токе) путем умножения силы тока на время.
