
- •На чем основаны потенциометрические методы анализа?
- •2. Какая зависимость выражается уравнением Нернста?
- •3. Какие функции выполняют индикаторные электроды и какие электроды сравнения?
- •4. Как устроен стеклянный электрод? Как с его помощью определяют рН раствора? Какие достоинства и недостатки он имеет?
- •5. В чем сущность и области применения методов прямой потенциометрии?
- •6. В каких координатах строят кривые потенциометрического титрования?
- •7. По какому закону изменяется сила тока в ходе прямого кулонометрического определения?
- •8. Каковы преимущества кулонометрического анализа при контролируемой силе тока?
- •9. Измерение какого свойства лежит в основе кондуктометрического анализа?
- •10. Как практически определяют концентрацию методом прямой кондуктометрии?
- •11. На чем основан поляриметрический метод анализа?
- •12. Чем характеризуется кулонометрия?
- •13. Области применения кондуктометрии.
- •14. Основные типы ионоселективных электродов.
- •15. В чем различие методов прямой кулонометрии и кулонометрического титрования?
- •16. Что лежит в основе полярографического метода анализа?
- •17. Разновидности полярографии?
- •18. Какой ток называется предельным (диффузионным)?
- •19. Сущность амперометрического титрования
- •21. Основные виды электродов и их предназначение.
- •22. В чем отличие прямой и косвенной кондуктометрии?
Контрольные вопросы
-
На чем основаны потенциометрические методы анализа?
Потенциометрический метод анализа основан на измерении потенциалов электродов, погруженных в титруемый раствор.
2. Какая зависимость выражается уравнением Нернста?
Нернст открыл закон, устанавливающий зависимость между электродвижущей силой (разностью потенциалов) и ионной концентрацией.
Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура.
Уравнению Нернста подчиняются только обратимые окислительно- восстановительные системы в состоянии равновесия.
Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов.
Для реакции, записанной в сторону окисления, выражение записывается в виде:

где E0 - стандартный электродный потенциал,
R - газовая постоянная,
T - абсолютная температура,
n - число электронов, участвующих в электродном процессе,
F - постоянная Фарадея (96500 Кл/моль),
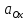 и
и
 - произведения концентраций (активностей)
веществ, принимающих участие в
соответствующей полуреакции в окисленной
(Ox) и восстановленной (Red) формах.
- произведения концентраций (активностей)
веществ, принимающих участие в
соответствующей полуреакции в окисленной
(Ox) и восстановленной (Red) формах.
3. Какие функции выполняют индикаторные электроды и какие электроды сравнения?
Индикаторный электрод чувствителен к изменению концентрации определяемого иона, поэтому по его потенциалу можно измерить концентрацию анализируемого компонента. Так как измерить абсолютное значение потенциала нельзя, то потенциал индикаторного электрода определяется по значению ЭДС, между индикаторным электродом и электродом сравнения. Электрод сравнения выполняет функцию эталона. Его потенциал известен и остается постоянным на протяжении всего анализа.
Равновесный потенциал индикаторного электрода зависит от активности (концентрации) определяемого компонента в соответствии с функцией, выражаемой уравнением Нернста. На потенциал электрода сравнения активность анализируемого компонента влияние не оказывает
Индикаторный электрод должен быть обратимым, неполяризуемым, химически устойчивым по отношению к контактирующему с ним раствору. Конструкция электрода должна быть простой, а время установления равновесного потенциала минимальным.
Электрод сравнения должен быть химически устойчивым, неполяризуемым , и должен иметь простую конструкцию . Потенциал электрода должен быть стабильным, легко воспроизводимым и не зависеть от состава анализируемого раствора.
4. Как устроен стеклянный электрод? Как с его помощью определяют рН раствора? Какие достоинства и недостатки он имеет?

Стеклянный электрод. Наиболее часто изготавливается в виде стеклянной трубки, на конце которой тонкостенный шарик из стекла специального состава (рис. 6.4).
Внутрь шарика наливают какой-либо буферный раствор и помещают электрод с устойчивым потенциалом (пример: каломельный или хлор серебряный). Вследствие способности стекла обменивать ионы натрия на ионы водорода из раствора, на внутренней и наружной поверхности стеклянного шарика устанавливается ионное равновесие, которое определяет потенциал. Величина потенциала имеет линейную зависимость от pH раствора и не зависит от присутствия окислителей и восстановителей;
Достоинства стеклянных электродов: простота конструкции, высокая чувствительность, хорошая воспроизводимость и стабильность результатов, устойчивость к высоким температурам, действию окислителей, восстановителей.
Недостатками стеклянных электродов являются хрупкость и высокое сопротивление.
