
- •Билет № 1
- •1. Атрезия пищевода. Трахеопищеводный свищ. Клиника. Современные принципы диагностики и лечения.
- •2. Ущемленные грыжи: паховые грыжи. Клиника. Диагностика. Дифференциальная диагностика. Методы оперативного лечения.
- •3. Кривошея. Клиника. Диагностика. Возрастные показания оперативного лечения, прогноз.
- •Билет №2
- •1. Ахалазия пищевода.Халазиякардии. Клиника. Современные принципы диагностики и лечения.
- •2. Пилоростеноз: этиология, патогенез, клиника Дифференциальная диагностика пилоростеноза, лечение
- •3. Раны и раневая инфекция. Гнойная рана. Фазы раневого процесса. Методы дренирования ран.
- •Билет №3
- •1. Дивертикул пищевода.Удвоение пищевода. Клиника. Современные принципы диагностики и лечения.
- •2. Аноректальные пороки развития. Диагностика, рентгенодиагностика. Методы оперативного лечения в зависимости от форм атрезии заднего прохода и прямой кишки.
- •3. Системные заболевания скелета. Классификация, диагностика, принципы и методы хирургического лечения. Реабилитация, диспансеризация.
- •Билет №4
- •1. Врожденные диафрагмальные грыжи. Классификация. Клиника. Диагностика, лечение.
- •2. Болезнь Гиршпрунга. Этиология, классификация, клинические формы. Диагностика, лечение.
- •3. Анаэробная инфекция у детей. Этиология. Клиника. Диагностика. Лечение.
- •Билет №5
- •Признаки острого аппендицита у детей
- •Диагностика острого аппендицита у детей
- •Лечение острого аппендицита у детей
- •Вторично-хронический остеомиелит
- •Клиника вторично-хронического остеомиелита
- •Диагностика вторично-хронического остеомиелита
- •Первично-хронический остеомиелит
- •Клиника первично-хронического остеомиелита
- •Лечение хронического остеомиелита
- •Билет №6
- •Классификация остеохондропатий у детей
- •Болезнь Легга-Кальве-Пертеса
- •Билет №7
- •Признаки острого аппендицита у детей
- •Диагностика острого аппендицита у детей
- •Лечение острого аппендицита у детей
- •Билет №8
- •Симптомы аппендикулярного инфильтрата
- •Диагностика аппендикулярного инфильтрата
- •Лечение аппендикулярного инфильтрата
- •Классификация бактериальных деструкций легких
- •Этиология и патогенез бактериальных деструкций легких
- •Клиника бактериальных деструкций легких
- •Пиоторакс
- •Пиопневмоторакс
- •Пневмоторакс
- •Перикардит
- •Лечения бактериальных деструкций легких
- •1) Кишечная непроходимость
- •Клиническая картина
- •Виды кишечной непроходимости
- •Механизм развития
- •Верхняя кишечная непроходимость
- •Лечение кишечной непроходимости
- •Классификация атрезии кишечника
- •Диагностика атрезии кишечника
- •Лечение атрезии кишечника
- •Лечение[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •Классификация бактериальных деструкций легких
- •Этиология и патогенез бактериальных деструкций легких
- •Клиника бактериальных деструкций легких
- •Пиоторакс
- •Пиопневмоторакс
- •Пневмоторакс
- •Перикардит
- •Лечения бактериальных деструкций легких
- •13 Билет
- •Классификация бактериальных деструкций легких
- •Этиология и патогенез бактериальных деструкций легких
- •Клиника бактериальных деструкций легких
- •Пиоторакс
- •Пиопневмоторакс
- •Пневмоторакс
- •Перикардит
- •Лечения бактериальных деструкций легких
- •14 Билет
- •Симптомы и диагностика копростаза
- •2) Пельвиоперитонит
- •Этиопатогенез пельвиоперитонита
- •Симптомы пельвиоперитонита
- •Диагностика пельвиоперитонита
- •Лечение пельвиоперитонита
- •Симптомы врожденного вывиха бедра
- •Лечение врожденного вывиха бедра
- •15 Билет
- •Патогенез сндрома Ледда
- •Клиника сндрома Ледда
- •Рентгенологическая диагностика сндрома Ледда
- •Лечение сндрома Ледда Дооперационное ведение
- •Хирургическое лечение
- •Содержание
- •Классификация[править | править вики-текст]
- •Симптомы и течение[править | править вики-текст]
- •Распознавание[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •16 Билет
- •Этиология инвагинаций кишечника
- •Патогенез инвагинаций кишечника
- •Классификация инвагинаций кишечника
- •Клиника инвагинаций кишечника
- •Диагностика инвагинаций кишечника
- •Лечение инвагинаций кишечника Консервативное
- •Оперативное
- •Межкишечный абсцесс
- •Причины формирования межкишечного абсцесса
- •Симптомы межкишечного абсцесса
- •Диагностика межкишечного абсцесса
- •Лечение межкишечного абсцесса
- •Поддиафрагмальный абсцесс
- •Причины поддиафрагмального абсцесса
- •Симптомы поддиафрагмального абсцесса
- •Диагностика поддиафрагмального абсцесса
- •Лечение поддиафрагмального абсцесса
- •Бсцесс дугласова пространства
- •Абсцесс дугласова пространства
- •Причины абсцесса дугласова пространства
- •Симптомы абсцесса дугласова пространства
- •Диагностика абсцесса дугласова пространства
- •Лечение абсцесса дугласова пространства
- •Симптомы врожденного вывиха бедра
- •Лечение врожденного вывиха бедра
- •17 Билет
- •Этиология инвагинаций кишечника
- •Патогенез инвагинаций кишечника
- •Классификация инвагинаций кишечника
- •Клиника инвагинаций кишечника
- •Диагностика инвагинаций кишечника
- •Лечение инвагинаций кишечника Консервативное
- •Оперативное
- •2) Кровотечения из верхних отделов пищеварительного тракта
- •Содержание
- •Классификация[править | править вики-текст]
- •Симптомы и течение[править | править вики-текст]
- •Распознавание[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •18 Билет
- •Этиология инвагинаций кишечника
- •Патогенез инвагинаций кишечника
- •Классификация инвагинаций кишечника
- •Клиника инвагинаций кишечника
- •Диагностика инвагинаций кишечника
- •Лечение инвагинаций кишечника Консервативное
- •Оперативное
- •2) Кровотечения из верхних отделов пищеварительного тракта
- •Содержание
- •Терминология[править | править вики-текст]
- •Классификация[править | править вики-текст]
- •Сколиотическая болезнь[править | править вики-текст] Этиология[править | править вики-текст]
- •Виды сколиоза[править | править вики-текст]
- •Диагностика[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •Консервативная терапия[править | править вики-текст]
- •Хирургическое лечение[править | править вики-текст]
- •19 Билет
- •2) Портальная гипертензия
- •Разделение портальной гипертензии на паренхиматозную и непаренхиматозную формы позволяет лучше понять физиологические последствия заболевания.
- •Венозная фаза верхнебрыжеечной артериографии при внепеченочной портальной гипертензии.
- •Венозная фаза верхнсбрыжсечной артериографии при циррозе печени.
- •3) Повреждения селезенки
- •20 Билет
- •2) Аномалии почек
- •Гемолитико - уремический синдром.
- •Содержание
- •Терминология[править | править вики-текст]
- •Классификация[править | править вики-текст]
- •Сколиотическая болезнь[править | править вики-текст] Этиология[править | править вики-текст]
- •Виды сколиоза[править | править вики-текст]
- •Диагностика[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •Консервативная терапия[править | править вики-текст]
- •Хирургическое лечение[править | править вики-текст]
- •21 Билет
- •Симптомы ущемленной паховой грыжи (признаки)
- •Ущемленная паховая грыжа – диагностика
- •Неотложная помощь при ущемлении паховой грыжи
- •Лечение ущемленной паховой грыжи
- •Пупочная грыжа у ребенка. Симптомы и лечение
- •Симптомы пупочной грыжи у детей
- •Причины появления пупочной грыжи у детей.
- •Как чувствует себя ребенок с пупочной грыжей
- •Чем может помочь ребенку врач
- •Лечение пупочной грыжи у детей Что делать, если у ребенка диагностировали грыжу?
- •Методика проведения массажа и лечебной гимнастики при пупочной грыже у детей
- •Массаж области пупка - подробная методика выполнения
- •Примерный комплекс лечебного массажа и гимнастики при пупочной грыже для детей в возрасте до 4 месяцев
- •Хирургическое лечение пупочной грыжи
- •Можно ли "заговорить" грыжу?
- •Народные средства лечения грыжи
- •Профилактика пупочной грыжи
- •2) Сращение почек
- •Сращение почек
- •Причины сращения почек
- •Варианты сращения почек
- •Симптомы сращения почек
- •Диагностика сращения почек
- •Лечение сращения почек
- •Поликистоз почек у взрослых
- •Медуллярная губчатая почка
- •Простая киста почки
- •3) Кишечная непроходимость Общая характеристика заболевания
- •Симптомы кишечной непроходимости
- •Спаечная кишечная непроходимость
- •Острая кишечная непроходимость у детей
- •Диагностика и лечение заболевания
- •2) Перекрестная дистопия почки
- •3) Кишечная непроходимость
- •Клиническая картина
- •Виды кишечной непроходимости
- •Механизм развития
- •Верхняя кишечная непроходимость
- •Лечение кишечной непроходимости
- •Причины водянки яичка у новорожденного ребенка
- •Причины острой водянки яичка
- •Симптомы водянки яичка у детей
- •Обследование ребенка с водянкой яичка
- •Лечение водянки яичка
- •Осложнения водянки яичка у детей
- •2) Пупочная грыжа у ребенка. Симптомы и лечение
- •Симптомы пупочной грыжи у детей
- •Причины появления пупочной грыжи у детей.
- •Как чувствует себя ребенок с пупочной грыжей
- •Чем может помочь ребенку врач
- •Лечение пупочной грыжи у детей Что делать, если у ребенка диагностировали грыжу?
- •Методика проведения массажа и лечебной гимнастики при пупочной грыже у детей
- •Массаж области пупка - подробная методика выполнения
- •Примерный комплекс лечебного массажа и гимнастики при пупочной грыже для детей в возрасте до 4 месяцев
- •Хирургическое лечение пупочной грыжи
- •Можно ли "заговорить" грыжу?
- •Народные средства лечения грыжи
- •Профилактика пупочной грыжи
- •Врожденные свищи пупка: неполные свищи пупка (аномалия развития желточного и мочевого протока) дифференциально-диагностические критерии. Сроки и показания к оперативному лечению.
- •Гидронефроз. Эмбриогенез, классификация, клиника, методы исследования. Дифференциально-диагностические критерии. Сроки и показания к оперативному лечению.
- •Методы санации брюшной полости при перитоните, особенности у детей.
- •1.Аномалия развития опускания яичка - крипторхизм. Сроки и показания к оперативному лечению.
- •2.Нейромышечная дисплазия мочеточников. Эмбриогенез, классификация, клиника. Методы исследования, дифф.-диагностические критерии. Сроки и показания к оперативному лечению.
- •3.Особенности переломов костей у детей. Классификации, клиника, диагностика.
- •Острые заболевания яичка. Клиника. Методы диагностики и лечения.
- •2.Аномалии почек: удвоение почек и мочеточников. Диагностика, рентгенодиагностика. Критерии дифференциальной диагностики. Показания к оперативному лечению.
- •3.Дивертикул пищевода.Удвоение пищевода. Врожденный короткий пищевод. Клиника. Современные принципы диагностики и лечения.
- •Билет №28
- •Паховые грыжи: дифференциально-диагностические критерии. Сроки и показания к оперативному лечению.
- •2.Мочекаменная болезнь. Дифференциально-диагностические критерии мочекаменной болезни: камни почек, мочеточников, уретры. Показания к оперативному и консервативному лечению.
- •3.Врожденный вывих бедра. Клиника и диагностика у детей до 1 года жизни.
- •1. Атрезия ануса и прямой кишки: клиника, диагностика, лечение
- •Симптомы острого паранефрита
- •Диагностика острого паранефрита
- •Лечение острого паранефрита
- •Этиология инвагинаций кишечника
- •Патогенез инвагинаций кишечника
- •Классификация инвагинаций кишечника
- •Клиника инвагинаций кишечника
- •Диагностика инвагинаций кишечника
- •Лечение инвагинаций кишечника Консервативное
- •Оперативное
- •3) Гнойная хирургическая инфекция
- •2) Гнойная хирургическая инфекция
- •33 Билет
- •34 Билет
- •Лечение
- •Восстановительный период
- •3) Травма почки у детей
- •Классификация травм почки у детей
- •Симптомы травмы почки у детей
- •Диагностика травмы почки у детей
- •Лечение травмы почки у детей
- •35 Билет
- •2)Симптомы фурункулеза у детей
- •Диагностика фурункулеза
- •Осложнения фурункулеза
- •Лечение хронического остеомиелита
- •36 Билет
- •2) Классификация переломовывиха костей предплечья
- •ПереломовывихМонтеджа
- •ПереломовывихГалеацци
- •Диагностика Карбункула:
- •Лечение Карбункула:
- •Билет №37
- •Врожденные пороки развития пищевода. Этиология. Патогенез. Методы диагностики.
- •1111Пороки развития пищевода. Причины. Симптомы. Диагностика.
- •Переломы в области локтевого сустава. Классификация. Клиника, диагностика.
- •Флегмона новорожденных. Клиника и патоморфологические изменение. Диагностика. Возможные осложнения. Общее и местное лечение.
- •Билет №38
- •Врожденная кишечная непроходимость. Этиология, классификация .
- •3 Переломы в области локтевого сустава. Методы консервативного и оперативного лечения.
- •Билет №39
- •2 Омфалиты у детей. Этиология. Классификация. Клинические проявления. Диагностика. Консервативное и оперативное лечение. Возможные осложнения.
- •Переломы костей таза у детей. Классификация. Клиника. Диагностика. Лечение.
- •2 Противошоковые мероприятия при осложненных переломах костей таза.
- •Мастит и мастопатия новорожденных. Клиника. Диагностика. Лечение.
- •42 Билет
- •43 Билет
- •44 Билет
- •3. См 43 билет (2)
- •Билет №45
- •Билет №46
- •Классификация остеомиелита
- •Острый гематогенный остеомиелит
- •Этиология острого гематогенного остеомиелита
- •Клиника острого гематогенного остеомиелита
- •Диагностика острого гематогенного остеомиелита
- •Осложнения острого остеомиелита
- •Лечение острого остеомиелита
- •Билет №47
- •1. Лечение остеомиелита у детей
- •Причины гидронефроза у детей
- •Классификация гидронефроза
- •Патогенез гидронефроза
- •Клиническая картина гидронефроза
- •Диагностика гидронефроза у детей
- •Узи признаки гидронефроза
- •Внутривенная урография при гидронефрозе
- •Лечение гидронефроза – оперативное
- •Билет №48
- •Вторично-хронический остеомиелит Клиника вторично-хронического остеомиелита
- •Диагностика вторично-хронического остеомиелита
- •Первично-хронический остеомиелит Клиника первично-хронического остеомиелита
- •Лечение хронического остеомиелита
- •Симптомы первичного хронического остеомиелита
- •Диагноз
- •Лечение первичного хронического остеомиелита
- •2) Травма почки (повреждение)
- •Закрытая травма почки
- •Открытая травма (ранение) почки
- •Cимптомы
- •Диагностика
- •Лечение
- •Признаки острого аппендицита у детей
- •Диагностика острого аппендицита у детей
- •Лечение острого аппендицита у детей
- •3) Эпифизарный остеомиелит (симптомы)
Инфузионная терапия, коррекция гомеостаза, коррекция нарушений свертывающей системы крови, нормализация центральной и периферической гемодинамики, специфическая иммунотерапия (антистафилококковый, анти-синегнойной гамма-глобулин, анатоксин, бактериофаг, плазма), витаминотерапия, а при тяжелых случаях - УФО крови, гемосорбция - мероприятия патогенетической терапии. При легочно-плевральных формах БДЛ лечебная техника направлена на устранение внутриплеврально напряжения, санацию плевральной полости, достижение полного расправления легкого. Показания к хирургическому (радикального) лечение БДЛ в остром периоде в настоящее время являются: кровотечения (легочно-плевральные, внутриплеврально) и возникновение прогрессирующей медиастинальной эмфиземы, не поддающийся лечению дренированием средостения.
14 Билет
1) Копростаз (каловый застой) — это состояние, при котором просвет содержащейся в грыжевом мешке толстой кишки закупоривается каловыми массами, вызывая нарушение ее проходимости. Появлению копростаза способствует снижение двигательной активности кишечника, что чаще встречается у тучных больных, ведущих малоподвижный образ жизни, страдающих запорами, при невправимых грыжах.
Симптомы и диагностика копростаза
Копростаз развивается медленно. Симптомы данного осложнения проявляются по мере заполнения толстой кишки каловыми массами. Грыжевое выпячивание постепенно увеличивается в размерах, малоболезненное, тестоватой консистенции, незначительно напряжено. Симптом кашлевого толчка определяется, периодически появляется рвота. Общее состояние больных изменяется незначительно. Перекрытие просвета кишечника неполное. Прогрессирование копростаза осложняется каловым ущемлением.
Причинами обтурационной непроходимости у детей чаще всего являются копростаз, реже — опухоль, аскариды.
Копростаз — закупорка кишечника плотными каловыми массами — встречается у детей в любом возрасте. Причиной ее могут быть вялая функция кишечника у ослабленных детей, а также порок развития мышц передней брюшной стенки, сопровождающийся атонией органов брюшной полости. Часто развитию копростаза способствуют аномалии и пороки развития толстой кишки (мега-долихоколон, болезнь Гиршпрунга, врожденное и рубцовое сужение прямой кишки).
Клиническая картина обтурационной непроходимости
В анамнезе всегда имеются указания на ранние запоры. Стул, как правило, удается получить только после очистительной клизмы. Неправильный режим питания и недостаточный уход за ребенком приводят к каловым завалам, образованию каловых камней, которые в ряде случаев принимают за опухоль брюшной полости. При полной обтурации кишечного просвета состояние ребенка ухудшается, нарастает вздутие живота, появляется рвота, развиваются явления интоксикации.
Провести дифференциальную диагностику между копростазом и опухолью кишечника помогает консистенция опухолевидного образования, которая при копростазе имеет тестоватый характер. Положителен симптом «ямки», остающейся при надавливании. В сомнительных случаях применяют контрастное рентгенологическое исследование, во время которого контрастная смесь обтекает каловый камень со всех сторон и тень его ясно контурируется. Лечение обтурационной непроходимости
Необходимо настойчивое применение повторных клизм с 1 % раствором поваренной соли комнатной температуры. Если обычные клизмы не помогают, делают повторно сифонные клизмы до полного размывания каловых масс и восстановления проходимости кишечника. Неправильная техника сифонных клизм может привести к тяжелым осложнениям, так как при размывании слежавшихся каловых масс теплым физиологическим раствором начинается всасывание жидкости и развивается тяжелая каловая интоксикация, сопровождающаяся резким ухудшением состояния, вплоть до отека мозга.
Помимо сифонных клизм, назначают диету, богатую клетчаткой, растительное или вазелиновое масло внутрь, легкие послабляющие средства, курс электростимуляции кишечника (аппаратом «амплипульс») в 15—20 сеансов.
После ликвидации копростаза производят контрастное исследование кишечного тракта.
Глистная непроходимость в последние годы практически не встречается. Причиной закупорки в описанных наблюдениях являлся клубок аскарид, остановившихся у илеоцекального клапана. Если консервативными мероприятиями (сифонные клизмы) устранить непроходимость не удается, прибегают к оперативному вмешательству. После операции назначают противоглистное лечение.
2) Пельвиоперитонит
Пельвиоперитонит — местный ограниченный перитонит, возникающий вторично вследствие инфицирования брюшины малого таза при серозном или гнойном сальпингите и гнойных тубовариальных образованиях, пиоваре, пиосальпинксе.
Этиопатогенез пельвиоперитонита
Возбудителями пельвиоперитонита чаще всего бывает гонококк, микробные ассоциации, включающие аэробную и анаэробную флору, хламидии, микоплазмы. К факторам, способствующим проникновению инфекции в полость малого таза, относятся перфорация матки, гидро- и пертубация маточных труб, метросальпингография, введение в полость матки химических веществ для прерывания беременности. Выделяют серозно-фибринозный и гнойный пельвиоперитонит. Воспалительная реакция в острой стадии характеризуется расстройством микроциркуляции, повышением проницаемости сосудов, появлением серозного экссудата, выходом из сосудистого русла альбумина, фибриногена, форменных элементов (лейкодиапедез). В очаге поражения накапливается гистамин, кинины, серотонин, органические кислоты, повышается концентрация водородных и гидроксильных ионов. В эндотелии брюшины возникают дистрофические процессы. По мере стихания острой воспалительной реакции происходит отграничение воспалительного процесса спайками между органами малого таза и сальником, кишечником, мочевым пузырём. При гнойном пельвиоперитоните экссудат накапливается в пря-мокишечно-маточном пространстве с образованием абсцесса дугласова пространства, который может вскрыться в прямую кишку или в брюшную полость с развитием распространённого перитонита.
Симптомы пельвиоперитонита
При пельвиоперитоните возникает резкая боль внизу живота, повышается температура тела до 38—39 °С, появляется тошнота, рвота. Пульс частый, слабого наполнения и напряжения. Язык сухой. Живот не принимает участие в акте дыхания, резко болезненный в нижних отделах, симптомы раздражения брюшины положительные, перистальтика кишечника ослаблена. Отмечается лейкоцитоз со сдвигом формулы влево, резкое увеличение СОЭ. Проведение гинекологического обследования осложняется в связи с выраженной болезненностью и напряжением мышц передней брюшной стенки.
При бимануальном исследовании возникает резкая боль при движении шейки матки, уплощение или нависание сводов влагалища в результате наличия свободной жидкости в малом тазу.
Диагностика пельвиоперитонита
1. Анамнез жизни. 2. Общее объективное обследование. 3. Гинекологическое исследование (в дугласовом пространстве определяется выпот, смещающий матку кпереди и вверх и выпячивающий заднюю часть свода). 4. Общий анализ крови (лейкоцитоз, сдвиг лейкоцитарной формулы влево, ускорение СОЭ, лимфопения). 5. Пункция брюшной полости через задний свод влагалища. 6. УЗИ органов малого таза.
Лечение пельвиоперитонита
Лечение строится аналогично общим принципам лечения острого сальпингоофорита (раздел Сальпингоофорит) и зависит от стадии пельвиоперитонита. В начальной стадии оно направлено на ограничение воспалительного процесса: постельный режим с поднятым головным концом кровати, холод на низ живота. Назначают медикаментозную терапию:
1. Антибиотики с учётом вида возбудителя и его чувствительности к антибактериальным препаратам. Чаще используют в-лактамные соединения: природные пенициллины (бензилпенициллин), полусинтетические пенициллины (оксациллин, амоксициллин, пиперациллин), цефалоспорины (цефазолин, цефалатин, цефакситин, цефотаксин, цефаперазон), монобактамы, карбопенемы. Аминогликозиды, тетрациклины, фторхинолоны (ципробай, ципрофлоксацин), макролиды, имидазолы (метронидазол, метрогил), сульфаниламиды (триметоприл, бисептол, диприл).
2. Дезинтоксикация — инфузионно-трансфузионная терапия: • 0,9 % раствор натрия хлорида; • 5—10 % раствор глюкозы с инсулином; • плазма крови и плазмозаменители: альбумин, протеин, реополиглюкин, рефортан, стабизол; • белковые гидролизаты. При выраженной интоксикации на протяжении суток вводят 2—3 л жидкости вместе с мочегонными препаратами (лазикс, фуросемид). 3. Антигистаминные препараты (димедрол, супрастин, лоратадин, фенкарол). 4. Противовоспалительные препараты (ацетилсалициловая кислота, ибупрофен, нимесулид, напроксен). 5. Витамины (аскорутин, аевит, рибофлавин, пиридоксин, фолиевая кислота). 6. Возможно ультрафиолетовое облучение крови. 7. С лечебной целью проводят пункцию брюшной полости через задний свод влагалища (пунктат отправляют на бактериологическое исследование). После отсасывания пунктата через ту же иглу другим шприцом вводят антибиотики на 0,5 % растворе новокаина, антисептики (хлоргексидин, диоксидин, хлорофиллипт). Если экссудат серозный, лечебную пункцию проводят 2 раза в неделю (всего 2-3 пункции), гнойный — через день (4—10 пункций). Эвакуацию гноя лучше проводить посредством выполнения задней кольпотомии. 8. Хирургическое лечение показано, если пельвиоперитонит протекает на фоне пиосальпинкса, пиовара, тубоовариального абсцесса.
3) Врожденный вывих бедра - это крайне запущенная степень дисплазии тазобедренного сустава и представляет собой недоразвитие тазобедренного сустава. Отсутствует правильное сочленение костей тазобедренного сустава. Головка бедренной кости выходит за пределы вертлужной впадины, в результате образуется вывих. Либо имеется предрасположенность к вывиху, что в некоторых случаях тоже рассматривают как собственно вывих сустава.
Врожденный вывих бедра у детей встречается в 5-7 случаях из 1000 новорожденных. Девочки в 3-6 раз болеют чаще мальчиков. Левый сустав поражается чаще, иногда заболевание может быть двустороннее.
Симптомы врожденного вывиха бедра
Выявить врожденный вывих бедра у детей можно только после рождения по следующим симптомам.
Ограничение отведения бедра. Ребенок лежит на спине, ножки ребенка сгибаются под углом 90 градусов в коленных и тазобедренных суставах. После чего разводятся до упора по сторонам до упора. При врожденном вывихе угол разведения ног уменьшается в сравнении с нормальным 160-180 градусов.
Симптом Маркса-Ортолани (симптом «щелчка»). Ребенок лежит на спине, ножки сгибаются в коленных и тазобедренных суставах под прямым углом. Они сводятся вместе, а затем постепенно раздвигаются по сторонам. Со стороны вывиха отчетливо слышен щелчок.
Укорочение длинны ножки ребенка со стороны вывиха. Для выявления этого симптома нужно согнуть ножки вашего ребенка в коленях и постараться прижать их к животу.
Несимметричные кожные складки на ногах. На выпрямленных ногах ребенка и спереди и сзади кожные складки должны быть относительно симметричны.
При обнаружении одного из этих четырех симптомов следует немедленно обратиться к лечащему врачу для более тщательного осмотра. Для уточнения диагноза применяют рентген и ультразвук.
Лечение врожденного вывиха бедра
Последствия врожденного вывиха бедра при отсутствии лечения могут быть довольно серьезными. Невылеченный в детстве вывих может привести к диспластическому коксартрозу во взрослом возрасте.
Чем раньше вы начнете лечение данного заболевания, тем более эффективным оно будет. Чаще всего используют традиционное лечение. Мать уже в роддоме обучают ЛФК и правильному пеленанию (ножки должны лежать свободно и максимально отводиться в стороны). Суть консервативного лечения в том, чтобы относительно зафиксировать кости тазобедренного сустава в таком положении, при котором головка бедренной кости будет находиться в центре вертлужной впадины. В таком положении головка сустава постоянно раздражает и стимулирует к отстройке недоразвитую крышку суставной впадины.
Для фиксирования ножек младенца в постоянно отведенном состоянии используют специальные ортопедические приспособления (стремена Павлика, подушка Фрейка, шина Виленского и шина Волкова). Чаще всего при лечении врожденного вывиха бедра применяют именно Стремена Павлика (изобретение чешского ортопеда Арнольда Павлика). Шина позволяет фиксировать ноги ребенка в положении разведения, при этом сохраняя подвижность ног в определенных пределах. Длительность лечения контролируется рентгеном. Длится до тех пор, пока не сформируется крышка вертлужной впадины сустава.
При лечении детей старше года используют постепенное липкопластырное вытяжение Соммервила, усовершенствованное Мау. Суть метода примерно та же – инициируется отстройка крышки вертлужной впадины.
Если консервативное лечение не дало результатов, или в случаях, когда заболевание было обнаружено поздно, применяют хирургическое вмешательство. На сегодняшний день существует большое множество различных видов операций, направленных на лечение врожденного вывиха бедра. Чаще используют внесуставные операции. При таких операциях сохраняются выработанные адаптационные механизмы и создаются благоприятные условия для дальнейшего функционирования сустава. Для лечения врожденного вывиха бедра у детей и подростков чаще используют операцию Солтера. Для лечения взрослых – надацетабулярную остеотомию таза по Хиари и прочие артропластические операции профессора А.М. Соколовского.
Правильное и своевременно начатое лечение является залогом быстрого выздоровления при врожденном вывихе бедра.
15 Билет
1) Синдром Ледда - рецидивирующая кишечная непроходимость, обусловленная заворотом "средней кишки" вокруг верхней брыжеечной артерии и высокой фиксацией слепой кишки.
Патогенез сндрома Ледда
В хирургическом смысле к среднему кишечника относятся отделы кишечника от двенадцатиперстной до середины поперечноободовои кишки. Кишечная непроходимость возникает в результате сдавления двенадцатиперстной кишки аномально фиксированной слепой кишкой с последующим заворотом среднего кишечника, имеет общую брыжейку, на 180-720 градусов против хода часовой стрелки.
Клиника сндрома Ледда
Отличается неустойчивостью проявления симптоматики. Первые признаки - рвота и срыгивания желчью у детей первых месяцев жизни. Периодически возникают приступы боли в животе, сопровождающиеся частой рвотой. В ряде случаев один из рецидивов заворота приводит к развитию острой кишечной непроходимости с прогрессирующим ухудшением состояния ребенка, вплоть до коллаптоидного состояния. Отмечаются: 1. Приступообразные сильные боли в животе. 2. Задержка стула и газов. 3. Многократная рвота. 4. Вздутие эпигастральной области и западение нижних отделов живота. 5. Пальпация - малоинформативная.
Рентгенологическая диагностика сндрома Ледда
При обзорной рентгенографии органов брюшной полости оказываются два уровня жидкости в желудке и двенадцатиперстной кишке, малое количество газа в кишечнике. При рентгенографии органов брюшной полости с контрастом (сульфатом бария) - контраст накапливается в растянутом желудке и двенадцатиперстной кишке и небольшими порциями распределяется по петлях тонкого кишечника, имеющие вид конгломерата. При ирригография - оказывается слепая кишка, фиксированная под печенью. При компьютерной томографии можно выявить заворот средней кишки вокруг общей брижовои артерии.
Лечение сндрома Ледда Дооперационное ведение
Дети с непрерывной рвотой могут быть дегидратированные на 10-15%, имеют признаки гиповолемии и гипохлоремия, что приводит к необходимости быстрой регидратации физиологическим раствором. Длительная инфузия, однако, не показана, поскольку быстрая лапаротомия чрезвычайно важна для выживания ребенка. Дополнительные меры, такие как постановка назогастрального зонда, обеспечения удовлетворительного венозного доступа и парентеральное введение антибиотиков, должны быть сделаны как можно быстрее.
Хирургическое лечение
Операция Ледда корректирует основные аномалии при мальротации с заворотом или без заворота средней кишки. Эта операция заключается в нескольких важных этапах, которые должны проводиться в правильной последовательности: 1. Евисцерация средней кишки и ревизия корня брыжейки; 2. Деротация (разворот) заворота против часовой стрелки; 3. Разрезание перитонеальных тяготел Ледда с выпрямлением двенадцатиперстной кишки параллельно правом абдоминальном канала; 4. Аппендэктомия; 5. Расположение слепой кишки в левом нижнем квадранте. При выраженном некрозе тонкой кишки операция может оказаться бесперспективной.
Если во время нормального поворота кишечника дуоденоеюнальный изгиб и слопан кишка не встанут на свое место и если, помимо этого, не произойдет нормальное прикрепление брыжейки к задней стенке живота, то брыжейка средней кишки будет фиксирована только в одной точке, а не широким основанием корня в месте a. mcscnterica sup., на которой и будет висеть вся средняя кишка. Начало средней кишки в дуоденоеюнальном изгибе и ее конец по середине поперечной толстой кишки находятся в непосредственной близости друг к другу. Вследствие этого появляется повышенная опасность заворота всей средней кишки, которая может легко перекрутиться вокруг оси своей опорной точки. Кроме того, часто случается, что слепая кишка и colon ascendens не фиксированы к задней стенке живота, что, в свою очередь, также способствует образованию заворота. Известно также, что при расстройствах вращения кишечника очень часто не сливается большой сальник с брыжейкой поперечной кишки, вследствие чего не образуется lig. gaslrolicum, в результате чего отсутствует очередное крепление, имеющие значение для фиксации кишечника, что, в свою очередь, опять увеличивает склонность к завороту (рис. 46а, б) Этот заворот, как правило, происходит по направлению движения часовой стрелки, то есть в обратном направлении, в котором при нормальных условиях происходит вращение средней кишки. Симптомы зависят от степени заворота кишечных петель, от присутствия сосудов, т. е. от наличия или отсутствия омертвения средней кишки вследствие закупорки проксимальных брыжеечных сосудов, а также наличия полной или частичной непроходимости. В более половины случаев наблюдают картину непроходимости двенадцатиперстной кишки, преимущественно полной, а только подчас частичной, которая появляется тотчас после рождения ребенка. Первое кормление часто проходит нормально, меконий отходит, но вскоре — иногда сразу или на второй день, но во всяком случае не позднее 3—4-х суток после рождения в порядке исключения — у ребенка появляется рвота, запор и боли в животе. Рвота очень сильная, часто даже фонтаном, и рвотные массы содержат желчь.
2) Перитонит у новорожденных — заболевание полиэтиологическое, причиной его может служить перфорация стенки желудочно-кишечного тракта при его пороках развития, некротическом энтероколите, а также воспалительные заболевания органов брюшной полости (например, острый аппендицит).
Бактериальное инфицирование брюшины при этом, как правило, происходит контактным путем. При сепсисе возможен также гематогенный или лимфогенный путь попадания инфекции в брюшную полость, что приводит к возникновению в ней метастатических, обычно отграниченных гнойников.
Симптомы и виды:
По степени распространения перитонит делят на разлитой и отграниченный (абсцесс).
Для перитонита , вызванного перфорацией полого органа, характерно тяжелое состояние больного: вялость, адинамия, сменяющаяся периодическим возбуждением, упорная рвота с желчью и зеленью. Кожные покровы серовато-бледного цвета, сухие, холодные. Дыхание частое, поверхностное, сердечные тоны глухие, пульс учащен до 120-130 в 1 мин, слабого наполнения, аритмичен. Характерны резкое вздутие живота, разлитая болезненность при пальпации. Перистальтика кишечника не выслушивается, печеночная тупость не определяется. Стул и газы не отходят.
При отсутствии перфорации полого органа разлитой перитонит характеризуется постепенным нарастанием симптомов интоксикации и пареза кишечника.
Диагностика и анализы:
При обзорном рентгенологическом исследовании брюшной и грудной полостей в вертикальном положении определяется свободный газ под куполом диафрагмы (пневмоперитонеум).
При отсутствии перфорации полого органа в анализе крови обнаруживают лейкоцитоз со сдвигом формулы влево, а обзорное рентгенологическое исследование указывает на наличие в брюшной полости свободной жидкости.
Лечение:
Лечение перитонита должно быть оперативным. При перфорации -ушивание отверстия в стенке органа или выведение пораженного участка кишки на переднюю брюшную стенку, тщательная санация и дренирование брюшной полости. При остром аппендиците выполняют аппендэктомию лигатурным способом.
Качество жизни:
Летальность при перитоните у новорожденных, особенно недоношенных, высокая.
3) Бронхоэктатическая болезнь — приобретённое или врожденное заболевание, характеризующееся хроническим нагноительным процессом в необратимо изменённых (расширенных, деформированных) и функционально неполноценных бронхах преимущественно нижних отделов лёгких. Причиной его не являются другие заболевания (туберкулез, абсцесс и др.). Болеют преимущественно в детском и молодом возрасте, чаще мужчины.
Содержание
[убрать]
1Классификация
2Симптомы и течение
3Распознавание
4Лечение
5Ссылки
Классификация[править | править вики-текст]
Классифицируют:
по характеру расширения бронхов (цилиндрические, мешотчатые, веретенообразные и смешанные);
по распространённости процесса (одно- и двусторонние, с указанием точной локализации по сегментам);
по клиническому течению (бронхитическая ст., ст.выраженных клинических проявлений и ст. осложнений).
Симптомы и течение[править | править вики-текст]
При обострении, чаще в весенне-осенний период, больные жалуются на кашель с гнойной мокротой, отходящей после ночного сна и в «дренажном положении», при котором мокрота лучше оттекает из поражённых бронхов; общее недомогание, повышение температуры тела. Может появиться кровохарканье, лёгочное кровотечение.Одышка при физической нагрузке, цианоз. Над лёгкими выслушиваются разнокалиберные влажные хрипы, уменьшающиеся после откашливания.
Распознавание[править | править вики-текст]
Рентгенологическое обследование показывает грубый пневмосклероз, уменьшение объёма поражённой доли лёгкого. Помогают диагнозу бронхография, бронхоскопия.
Лечение[править | править вики-текст]
Консервативное — включает в себя антибиотики, бронхолитики и средства, разжижающие мокроту, лечебную физкультуру, массаж грудной клетки. Физиотерапевтическое лечение возможно только при нормализации температуры и отсутствии кровохарканья. При ограниченных поражениях доли, сегмента лёгкого проводится хирургическое вмешательство.
Главным звеном консервативного лечения является санация бронхиального дерева, предусматривающая, с одной стороны, опорожнение последнего от гнойной мокроты, а с другой — местное воздействие антимикробными средствами на гноеродную микрофлору. Наряду с санацией путём лаважа с помощью инсталляций в поражённые бронхи через трансназальный катетер или при бронхоскопии вводится растворов антисептиков, антибиотиков, муколитических средств и т. д. существенное значение сохранили и вспомогательные средства, способствующие отхождению гнойной мокроты: так называемый постуральный дренаж, дыхательная гимнастика, вибрационный массаж грудной клетки и т. д. Большую пользу приносят правильно выбранный режим, общеукрепляющие процедуры, полноценное, богатое белками питание и т. д.
Радикальное хирургическое вмешательство не всегда показано и не может излечить всех больных бронхоэктазиями. Оптимальным возрастом для вмешательства следует считать 7-14 лет, поскольку в младшем возрасте не всегда точно удается установить объём и границы поражения [Пугачев А. Г. и др., 1970; Исаков Ю. Ф. и др., 1978, и др.].
Показания к резекции лёгких при так называемых «малых формах» следует ставить с определённой осторожностью, лишь после тщательной оценки динамики заболевания под влиянием консервативного лечения и повторных бронхографических исследований. У всех больных с достаточно выраженными и локализованными бронхоэктазиями поражённые отделы лёгкого могут быть удалены только при условии, что после резекции дыхательная функция будет обеспечиваться достаточным объёмом полноценной лёгочной ткани.
При односторонних бронхоэктазиях можно достигнуть максимального радикализма, оставив непоражённые отделы лёгкого или же, в крайнем случае, прибегнув кпневмонэктомии.
При двусторонних бронхоэктазиях с асимметричным поражением бронхиального дерева, при котором в одном из лёгких имеются небольшие расширения бронхов отдельных сегментов, допустима паллиативная резекция лёгкого на стороне большего поражения. Состояние больных после таких операций обычно существенно улучшается, и при обязательном диспансерном наблюдении и противорецидивном лечении нередко удается добиться клинического благополучия, причём изменения на неоперированной стороне, как правило, не прогрессируют.
При более или менее симметричном поражении бронхов обоих лёгких показана двусторонняя резекция, которую большинство хирургов предпочитают производить в два этапа с интервалом в 6—12 мес. Возможность такой резекции определяется объёмом неизменённой лёгочной ткани. При обширных двусторонних бронхоэктазиях с поражением верхних лёгочных сегментов оперативное лечение обычно не показано.
16 Билет
Инвагинация кишечника - смешанная форма механической кишечной непроходимости, возникающей при телескопическом внедрении проксимальной части кишки в просвет дистальной части кишечника.
Этиология инвагинаций кишечника
В большинстве случаев неизвестна. К факторам, способствующим возникновению инвагинаций, относят: нарушение режима питания, кишечные заболевания, лимфаденопатии в результате поражения аденовирусной инфекцией, травмы живота, полипы или опухоли кишечника, дивертикул Меккеля. Из анатомических причин развития инвагинаций можно выделить: патологическую подвижность слепой и подвздошной кишок, пороки развития илеоцекального клапана.
Патогенез инвагинаций кишечника
Инвагинация возникает при внезапной дискоординации кишечной перистальтики. Изначально при ущемлении рябь внедренной кишки, возникает странгуляционная кишечная непроходимость. Ущемление рябь приводит к обструкции лимфатического и венозного дренажа, отека внедренного кишечника и выхода эритроцитов из кровеносного русла путем диапедеза. Смешиваясь со слизью, усиленно продуцируется, кровянистый транссудат формирует стул в виде "малинового (смородинового) желе". Усиление отека кишки приводит к нарушению артериального кровоснабжение и возникновения гангрены кишечника. Гангрена начинается на головке инвагината и распространяется назад. В дальнейшем к странгуляционной присоединяется и обтурационная непроходимость кишечника при закрытии просвета кишечной трубки инвагината. У ребенка за счет рвоты развивается дегидратация. Ишемия и некроз кишки приводят к перфорации кишки и развития сепсиса. Некроз значительной длины кишки может привести к развитию синдрома "короткой кишки". В инвагината различают 3 цилиндра (внешний, средний, внутренний) и головку инвагината.
Классификация инвагинаций кишечника
По клиническому течению различают: 1. Острые инвагинации (98,8%). 2. Хронические инвагинации - возникновение спайкового процесса в инвагината (в результате развития воспаления) при отсутствии полного перекрытия просвета кишечника (0,7%). 3. Рецидивирующие инвагинации (0,5%). По локализации (по В. П. Портным): I. инвагинации в области илеоцекального угла-91, 3%): a) слипоободова форма - внедрение стенки слепой кишки в восходящую, подвздошная кишка пассивно втягивается, не проходя через илеоцекальный клапан; b) кпубово-подвздошно-ободочная форма - внедрение подвздошной кишки в подвздошную, затем через илеоцекальный клапан в толстую кишку: • простая форма - слепая кишка не углубляется в инвагинат; • сложная форма - слепая кишка и другие отделы толстой кишки углубляются в инвагинат с образованием части среднего цилиндра. с) подвздошно-клапанно-ободочная форма - часть подвздошной кишки у илеоцекального клапана углубляется в толстый кишечник с вовлечением толстой кишки. II. Тонко-тонкокишечная форма - 6,5%. III. Толсто-толстокишечного форма - 2,25%.
Клиника инвагинаций кишечника
Вид ребенка, больного инвагинацию, достаточно обманчив. Обычно это ребенок хорошо откормленное и не выдается больным. Напротив, у детей худых или с плохим питанием инвагинация встречается реже. Клинические проявления инвагинации, как правило, следующие: 1. Внезапное возникновение интенсивных (вплоть до болевого шока) приступообразный болей в животе, носящие периодический (периодичность в 5-30 минут) характер. Во время приступа боли ребенок бледнеет, кричит и подтягивает ноги к животу. Эти эпизоды боли продолжаются несколько секунд, в промежутках ребенок кажется спокойной или даже сонной. 2. Рвота, сначала остатками пищи. 3. Кровь в стуле или слизь, пропитанный кровью ("малиновое" или "смородиновое желе"), без примесей кала через 4-6 часов от начала заболевания. 4. Мягкоэластической умеренно подвижная опухоль - инвагинат, что прощупывается при пальпации живота. 5. Отсутствие слепой кишки в правой подвздошной области - симптом удовлетворено 6. Задержка газов и стула. 7. При ректальном исследовании иногда можно заметить или прощупать головку инвагината и выявить кровь в стуле.
Диагностика инвагинаций кишечника
1. Общий и биохимический анализы крови - не имеют определенных признаков при инвагинации, но в зависимости от длительности заболевания и связанной с ним рвоты и кровопотери могут отражать дегидратацию, анемию и / или лейкоцитоз. 2. Обзорная рентгенография - невсегда дает данные для диагноза, однако достаточно часто на рентгенограмме различаются расширенные петли тонкого кишечника, тень инвагината на фоне кишки, чаши Клойбера как признак непроходимости кишечника). 3. УЗИ - при двумерной эхографии - ехонегативни и ехопозитивни участки изображения, которые чередуются в виде концентрических колец при поперечном УЗИ), или симптом "псевдониркы" при продольном УЗИ). УЗИ лучше используется как диагностический инструмент для исключения диагноза инвагинации. 4. Компьютерная томография - часто используется для дифференциальной диагностики заболеваний, сопровождающихся болями в животе. Хотя этот метод и не применяется для диагностики инвагинации, но она может быть обнаружена случайно, при анализе данных компьютерной томографии). 5. Ирригография с воздухом как основной метод диагностики (симптомы "клешни рака", "кокарды"). Давление воздуха не должно превышать 50-60 мм рт. ст. Воздух вводится с помощью аппарата Ричардсона. При отсутствии признаков перфорации или перитонита, возможно проведение контрастной иригорафии с водорастворимыми контрастом (урографин, верографинн, Триомбраст)). 6. Колоноскопия выявляет состояние головки инвагината - возможен некроз головки. Дифференциальная диагностикапроводится с острой дизентерией, токсическим диспепсией, острым аппендицитом, пептической язвой меккелев дивертикула, острыми холециститом и панкреатитом, полипами желудочно-кишечного тракта, выпадением слизистой прямой кишки.
Лечение инвагинаций кишечника Консервативное
Применяется методика сквозного продувания под наркозом с помощью аппарата Ричардсона. Давление воздуха в прямой кишке не должен превышать 120 мм рт.вот. Контроль расправления инвагината - пальпаторно и с помощью назогастрального зонда, через который выходит воздух в стакан с жидкостью.Рецидивы инвагинации после консервативного лечения составляют около 5%. Противопоказания к консервативному лечению: 1. Подвздошно-подвздошно-ободочная форма инвагинации. 2. Кровотечение из прямой кишки. 3. Обструкция тонкой кишки на рентгенограмме. 4. Срок более 18 часов от начала заболевания. 5. У детей старше 1 года или моложе С месяцев. 6. Дегидратация более чем на 5%. 7. Рецидивирующие инвагинации. 9. Некроз головки инвагината, обнаруженный при колоноскопии.
Оперативное
Обязательна предоперационная подготовка в течение 2-3 часов. Методы хирургического лечения - лапароскопическим и путем лапаротомии. При лапаротомии, в зависимости от состояния инвагината, выполняют: 1. Дезинвагинацию с "видоювання" инвагината. 2. Дезинвагинацию с последующей резекцией кишечника и наложением анастомоза. 3. Одномоментную резекцию инвагината без его расправления. 4. Резекцию инвагината через кишку. Рецидивы инвагинации после оперативного лечения составляют около 1-4%. Летальность менее 1%.
2)
Межкишечный абсцесс – отграниченный гнойник брюшной полости, формирующийся между кишечными петлями, брюшной стенкой, брыжейкой и сальником. Клиника межкишечного абсцесса характеризуется температурой гектического характера, интоксикацией, болью в брюшной полости, иногда отеком и гиперемией передней брюшной стенки. С целью диагностики межкишечного абсцесса используют обзорную рентгенографию брюшной полости, УЗИ и КТ. Лечение межкишечного абсцесса – оперативное: лапаротомия, вскрытие и дренирование полости гнойника; обязательно проведение антибактериальной терапии. подробнее |
Межкишечный абсцесс
Причины формирования межкишечного абсцесса
Симптомы межкишечного абсцесса
Диагностика межкишечного абсцесса
Лечение межкишечного абсцесса
Прогноз и профилактика абсцессов брюшной полости
Межкишечный абсцесс - лечение в Москве
М ежкишечный
абсцесс рассматривается в гастроэнтерологии как
частный вариант абсцесса
брюшной полости.
Брыжейка поперечно-ободочной кишки
служит анатомическим барьером,
препятствующим распространению гнойника
на верхние этажи брюшной полости.
Межкишечный абсцесс нередко сочетается
с абсцессом
дугласова пространства, аппендикулярным
абсцессом.
По количеству сформировавшихся гнойных
полостей межкишечные абсцессы часто
бывают множественными.
ежкишечный
абсцесс рассматривается в гастроэнтерологии как
частный вариант абсцесса
брюшной полости.
Брыжейка поперечно-ободочной кишки
служит анатомическим барьером,
препятствующим распространению гнойника
на верхние этажи брюшной полости.
Межкишечный абсцесс нередко сочетается
с абсцессом
дугласова пространства, аппендикулярным
абсцессом.
По количеству сформировавшихся гнойных
полостей межкишечные абсцессы часто
бывают множественными.
Причины формирования межкишечного абсцесса
Чаще всего развитие межкишечных абсцессов связано с перфоративной язвой желудка или 12-перстной кишки, острым прободным аппендицитом, осложненным дивертикулитом кишечника, холециститом, раком толстого кишечника, болезнью Крона. Иногда причиной образования межкишечного абсцесса служит несостоятельность швов кишки и анастомозов. Осумкованные гнойники в межкишечном пространстве формируются как остаточные явления, сопровождающие перенесенный диффузный перитонит.
Отграничение гнойной полости образуется при склеивании брюшины с последующими сращениями между отдельными петлями тонкого или толстого кишечника, их брыжейками и сальником.
Симптомы межкишечного абсцесса
Началу клинических проявлений межкишечного абсцесса, как правило, предшествует разлитой перитонит, вызванный осложненным течением первичного заболевания. Обычно на фоне кажущегося выздоровления у пациентов вновь появляются тупые абдоминальные боли, недомогание, метеоризм, рвота, запоры. Проекция болей в животе соответствует локализации межкишечного абсцесса. При межкишечных абсцессах, расположенных близко к поверхности передней брюшной стенки, наблюдается асимметрия живота, отек и гиперемия кожи, напряжение мышц.
Вначале гнойник может не определяться, позднее он пальпируется в виде мягкого, эластического опухолевидного образования, неподвижного и болезненного, иногда с флюктуацией (зыблением) в центре. Температурная кривая приобретает гектический характер со значительными суточными колебаниями температуры тела; на этом фоне ярко выражены симптомы интоксикации. Межкишечные абсцессы могут сопровождаться явлениями механической или динамической кишечной непроходимости.
При прорыве межкишечного абсцесса в просвет кишки может наступить самоизлечение или образоваться свищ. Чаще, однако, межкишечный абсцесс прорывается в свободную брюшную полость, что приводит к образованию новых осумкованных гнойников или развитию разлитого перитонита.
Диагностика межкишечного абсцесса
Ввиду неспецифичности проявлений межкишечного абсцесса диагностика представляет определенные трудности, особенно в тех случаях, когда не удается установить причинно-следственную связь с первичным заболеванием. Основаниями для подозрения на межкишечный абсцесс должны служить недавно перенесенный перитонит или операции на брюшной полости, наличие в анамнезе неспецифического язвенного колита, дивертикулита, язвы, болезни Крона и т. д.
Изменения в периферической крови характеризуются лейкоцитозом, сдвигом формулы влево, ускорением СОЭ. При пальпации живота определяется локальное напряжение мышц живота, резкая болезненность, неподвижный патологический тугоэластический инфильтрат с размягчением в центре.
При обзорной рентгенографии брюшной полости выявляется затемнение в проекции гнойника, уровень жидкости и признаки пареза кишечника; при рентгенографии пассажа бария видна деформация петель кишечника. Окончательно вопросы диагностики межкишечного абсцесса позволяют решить УЗИ органов брюшной полости, МСКТ брюшной полости.
Лечение межкишечного абсцесса
В инфильтративной стадии проводится консервативное лечение: назначаются антибактериальные препараты, дезинтоксикационная терапия, регуляция функции ЖКТ.
После отграничения межкишечного абсцесса производится оперативное вмешательство: лапаротомия, вскрытие и дренирование гнойной полости. Послеоперационная тактика включает смену тампонов, аспирацию гноя, промывание дренажей, внутрибрюшинное введение антибиотиков. Также продолжается системная противомикробная терапия, борьба с интоксикацией, обезвоживанием, гипопротеинемией.
В случае прорыва гнойника в брюшную полость или развития кишечной непроходимости, операция проводится в экстренном порядке. В некоторых случаях может потребоваться резекция части кишки.
Поддиафрагмальный абсцесс – локальный гнойник, сформировавшийся между куполом диафрагмы и прилегающими к ней органами верхнего этажа брюшной полости (печенью, желудком и селезенкой). Поддиафрагмальный абсцесс проявляется гипертермией, слабостью, интенсивной болью в эпигастрии и подреберье, одышкой, кашлем. Диагностическое значение имеют осмотр больного, данные рентгеноскопии, УЗИ, КТ, общего анализа крови. Для полного излечения поддиафрагмального абсцесса выполняют хирургическое вскрытие и дренирование гнойника, назначают антибактериальную терапию. подробнее |
Поддиафрагмальный абсцесс
Причины поддиафрагмального абсцесса
Симптомы поддиафрагмального абсцесса
Диагностика поддиафрагмального абсцесса
Лечение поддиафрагмального абсцесса
Прогноз и профилактика поддиафрагмального абсцесса
Поддиафрагмальный абсцесс - лечение в Москве
П оддиафрагмальный
абсцесс является сравнительно редким,
но очень серьезным осложнением
гнойно-воспалительных процессов брюшной
полости. Располагается поддиафрагмальный
абсцесс преимущественно внутрибрюшинно
(между диафрагмальным листком брюшины
и прилегающими органами), редко - в
забрюшинном пространстве (между
диафрагмой и диафрагмальной брюшиной).
В зависимости от нахождения гнойника
поддиафрагмальные абсцессы разделяют
на правосторонние, левосторонние и
срединные. Чаще всего встречаются
правосторонние поддиафрагмальные
абсцессы с передневерхней локализацией.
оддиафрагмальный
абсцесс является сравнительно редким,
но очень серьезным осложнением
гнойно-воспалительных процессов брюшной
полости. Располагается поддиафрагмальный
абсцесс преимущественно внутрибрюшинно
(между диафрагмальным листком брюшины
и прилегающими органами), редко - в
забрюшинном пространстве (между
диафрагмой и диафрагмальной брюшиной).
В зависимости от нахождения гнойника
поддиафрагмальные абсцессы разделяют
на правосторонние, левосторонние и
срединные. Чаще всего встречаются
правосторонние поддиафрагмальные
абсцессы с передневерхней локализацией.
Форма поддиафрагмального абсцесса может быть различной: чаще - округлой, при сдавлении его прилежащими к диафрагме органами – плоской. Содержимое поддиафрагмального абсцесса представлено гноем, иногда с примесью газа, реже - желчных камней, песка, кала.
Поддиафрагмальный абсцесс нередко сопровождается образованием плеврального выпота, при значительном размере в той или иной степени оказывает давление и нарушает функции диафрагмы и соседних органов. Поддиафрагмальный абсцесс обычно встречается у 30-50-летних пациентов, при этом у мужчин - в 3 раза чаще, чем у женщин.
Причины поддиафрагмального абсцесса
Основная роль в возникновении поддиафрагмального абсцесса принадлежит аэробной (стафилококк, стрептококк, кишечная палочка) ианаэробной неклостридиальной микрофлоре. Причиной большинства случаев поддиафрагмального абсцесса являетсяпослеоперационный перитонит (местный или разлитой), развившийся после гастрэктомии, резекции желудка, ушивания прободной язвы желудка, спленэктомии, резекции поджелудочной железы. Развитию поддиафрагмального абсцесса способствуют возникновение обширной операционной травмы тканей, нарушение анатомических связей органов поддиафрагмального пространства, несостоятельность анастомозов, кровотечение, иммуносупрессия.
Поддиафрагмальные абсцессы могут возникать в результате торакоабдоминальных травм: открытых (огнестрельных, колотых или резаных ранений) и закрытых (ушибов, сдавления). Гематомы, скопление вытекшей крови и желчи, образовавшиеся после таких травм, нагнаиваются, осумковываются и приводят к развитию поддиафрагмального абсцесса.
Среди заболеваний, вызывающих образование поддиафрагмального абсцесса, ведущую роль играют воспалительные процессы органов брюшной полости (абсцессы печени, селезенки, острый холецистит и холангит, панкреонекроз). Реже поддиафрагмальный абсцесс осложняет течение деструктивного аппендицита, сальпингоофорита, гнойного паранефрита, простатита, нагноившейся кисты эхинококка,забрюшинных флегмон. Развитие поддиафрагмального абсцесса возможно при гнойных процессах в легких и плевре (эмпиема плевры,абсцесс легкого), остеомиелите нижних ребер и позвонков.
Распространению гнойной инфекции из очагов брюшной полости в поддиафрагмальное пространство способствуют отрицательное давление под куполом диафрагмы, создающее присасывающий эффект, перистальтика кишечника, а также ток лимфы.
Симптомы поддиафрагмального абсцесса
В начальной стадии поддиафрагмального абсцесса могут наблюдаться симптомы общего характера: слабость, потливость, озноб, ремиттирующая или интермиттирующая лихорадка, свойственные и другим абсцессам брюшной полости (межкишечному,аппендикулярному, абсцессу дугласова пространства и др.)
Для поддиафрагмального абсцесса характерно появление чувства тяжести и болей в подреберье и нижней части грудной клетки с пораженной стороны. Боли могут иметь различную интенсивность - от умеренных до острых, усиливаться при активном движении, глубоком дыхании и кашле, иррадиировать в плечо, лопатку и ключицу. Также появляется икота, одышка, мучительный сухой кашель. Дыхание учащенное и поверхностное, грудная клетка на стороне абсцесса отстает при дыхании. Больной с поддиафрагмальным абсцессом вынужден принимать полусидячее положение.
Диагностика поддиафрагмального абсцесса
Обнаружение поддиафрагмального абсцесса облегчается после его полного созревания. С целью диагностики используют данные анамнеза и осмотра больного, результаты рентгенологического, ультразвукового, лабораторного исследований, КТ.
Пальпация верхних отделов живота при поддиафрагмальном абсцессе показывает болезненность и мышечное напряжение брюшной стенки в эпигастральной области или в подреберьях. Выявляется сглаженность и расширение межреберных промежутков, выпячивание подреберной области, при правостороннем абсцессе - увеличение печени.
Если поддиафрагмальный абсцесс не содержит газ, перкуссия грудной клетки обнаруживает притупление звука выше границы печени, снижение или отсутствие подвижности нижнего края легкого. При скоплении газа в полости поддиафрагмального абсцесса выявляются участки разных тонов («перкуторная радуга»). При аускультации наблюдается изменение дыхания (от ослабленного везикулярного до бронхиального) и внезапное исчезновение дыхательных шумов на границе абсцесса.
Лабораторное исследование крови показывает изменения, характерные для любых гнойных процессов: анемию, нейтрофильный лейкоцитоз со сдвигом влево, нарастание СОЭ, наличие С-реактивного белка, диспротеинемию.
Главное значение в диагностике поддиафрагмального абсцесса отводится рентгенографии и рентгеноскопии грудной клетки. Для поддиафрагмального абсцесса характерно изменение в области ножек диафрагмы, более высокое стояние купола диафрагмы на пораженной стороне и ограничение ее подвижности (от минимальной пассивной подвижности до полной неподвижности). Скопление гноя при безгазовых поддиафрагмальных абсцессах видно как затемнение над линией диафрагмы, наличие газа – как полоса просветления с нижним горизонтальным уровнем между абсцессом и диафрагмой. Определяется выпот в плевральной полости (реактивный плеврит), снижение воздушности нижних частей легкого.
МСКТ и УЗИ брюшной полости позволяют подтвердить наличие жидкости, гноя и газа в брюшной или плевральной полости, изменение положения и состояния прилежащих внутренних органов (например, деформацию желудка, смещение продольной оси сердца и др.). Диагностическая пункция абсцесса допустима лишь во время операции.
Поддиафрагмальный абсцесс дифференцируют с язвенной болезнью желудка и двенадцатиперстной кишки, гнойным аппендицитом, заболеваниями печени и желчевыводящих путей, нагноившимся эхинококком печени.
Лечение поддиафрагмального абсцесса
Основным методом лечения поддиафрагмального абсцесса в оперативной гастроэнтерологии является хирургическое вскрытие и дренирование гнойника.
Операция по поводу поддиафрагмального абсцесса выполняется трансторакальным или трансабдоминальным доступом, что позволяет обеспечить адекватные условия для дренирования. Основной разрез иногда дополняют контрапертурой. Проводят медленное опорожнение поддиафрагмального абсцесса и ревизию его полости. Для быстрого очищения поддиафрагмального абсцесса используют метод приточно-аспирационного дренирования двухпросветными силиконовыми дренажами.
В комплексное лечение поддиафрагмального абсцесса входит антибактериальная, дезинтоксикационная, симптоматическая и общеукрепляющая терапия.
Бсцесс дугласова пространства
главная / медицинский справочник болезней / болезни органов пищеварения
|
Абсцесс дугласова пространства – инкапсулированный гнойный очаг, расположенный в маточно-прямокишечном (прямокишечно-пузырном) углублении малого таза. Клиника абсцесса дугласова пространства характеризуется неспецифическими проявлениями (интоксикацией, фебрильной температурой, ознобами) и местной симптоматикой (болью в нижних отделах живота, дизурическими явлениями, частыми позывами на дефекацию). Диагностика абсцесса малого таза включает ректальное и вагинальное (у женщин) исследование, УЗИ малого таза, КТ, пункцию гнойника через прямую кишку или задний свод влагалища. Лечение абсцесса дугласова пространства заключается в его вскрытии через прямую кишку или влагалище, дренировании и санации, проведении антибиотикотерапии. подробнее |
Абсцесс дугласова пространства
Причины абсцесса дугласова пространства
Симптомы абсцесса дугласова пространства
Диагностика абсцесса дугласова пространства
Лечение абсцесса дугласова пространства
Прогноз и профилактика абсцесса дугласова пространства
Абсцесс дугласова пространства - лечение в Москве
По данным общей хирургии, гинекологии и оперативной гастроэнтерологии абсцесс дугласова пространства встречается в 1-3% случаев (в 0,06-0,11% - после оперативных вмешательств). Абсцесс дугласова пространства является довольно частой разновидностью абсцессов брюшной полости. Инкапсулированный гнойник при данном виде абсцесса формируется в маточно-прямокишечном углублении у женщин и прямокишечно-пузырном – у мужчин.
Причины абсцесса дугласова пространства
Абсцессы малого таза всегда имеют вторичный характер. В большинстве случаев абсцесс дугласова пространства развивается на фоне деструктивной формы острого аппендицита (флегмонозного, гангренозного, перфоративного) при тазовом расположении червеобразного отростка. У женщин к формированию абсцесса малого таза могут приводить гнойные заболевания придатков (аднексит, пиосальпинкс). Реже возникновению абсцесса дугласова пространства предшествует перфорация дивертикула ободочной кишки, парапроктит, диффузные формы перитонита.
Затеканию крови, серозного или гнойного выпота в дугласово пространство способствуют анатомические особенности малого таза, куда открываются брыжеечные синусы и каналы. При недостаточно тщательной ревизии и туалете операционной раны, неадекватном дренировании и санации малого таза в наиболее глубоком месте брюшной полости – дугласовом пространстве создаются условия для формирования абсцесса.
Гноеродная микрофлора представлена неспецифическими возбудителями (стафилококками, кишечной и паракишечной палочкой,стрептококками, синегнойной палочкой и др.).
Образованию абсцесса дугласова пространства способствует снижение реактивности организма и повышение вирулентности патогенной микрофлоры.
Симптомы абсцесса дугласова пространства
Организация абсцесса дугласова пространства, как правило, происходит через 5-10 суток после операции по поводу первичного гнойного заболевания. В первую очередь появляются общие неспецифические симптомы, характеризующиеся внезапным развитием озноба, повышением температуры тела до фебрильных значений, тахикардией, тошнотой, головной болью. На этом фоне отмечаются ощущения распирания и резкие боли внизу живота, усиливающиеся при ходьбе, движениях, физиологических отправлениях.
При абсцессе дугласова пространства пациентов могут беспокоить учащенные и болезненные мочеиспускания, тенезмы, жидкий стул с примесью слизи и крови, недержание газов и кала. Обширные гнойники, окруженные массивным инфильтратом, иногда приводят к сдавлению прямой кишки, вызывая механическую кишечную непроходимость.
Дальнейшее прогрессирование абсцесса дугласова пространства может осложниться прорывом гнойника в свободную брюшную полость или полые органы - мочевой пузырь, матку, прямую кишку. Длительное течение тазового абсцесса приводит к развитиютромбофлебита тазовых вен и тромбоэмболической болезни.
Диагностика абсцесса дугласова пространства
При сборе анамнестических данных учитываются недавно перенесенные операции и заболевания, что позволяет заподозрить вероятность абсцесса дугласова пространства.
Пальпаторно определяется болезненность в области малого таза, локальное напряжение мышц, положительный симптом Щёткина — Блюмберга. При ректальном или влагалищном исследовании выявляется болезненный тугоэластический инфильтрат с размягчением и флюктуацией в центре. У женщин абсцесс дугласова пространства пальпируется выше шейки матки, определяется нависание заднего свода влагалища.
Для дифференциальной диагностики с тубоовариальным абсцессом у женщин проводится УЗИ малого таза; для исключения абсцесса предстательной железы у мужчин – УЗИ простаты. В сложно дифференцируемых случаях может потребоваться выполнение компьютерной рентгеновской томографии.
Для окончательного распознавания абсцесса дугласова пространства прибегают к диагностической пункции гнойника под ультразвуковым наведением через прямую кишку либо задний свод влагалища. Полученное гнойное содержимое подвергается бактериологическому исследованию.
Лечение абсцесса дугласова пространства
На инфильтративной стадии назначаются микроклизмы, антибиотики; после окончательного формирования абсцесса, о котором судят по размягчению инфильтрата и появлению флюктуации, производится вскрытие гнойника.
Абсцессы дугласова пространства вскрывают через стенку прямой кишки или через задний свод влагалища. Вначале выполняется пункция гнойника толстой иглой. После получения гноя, для обеспечения его свободного оттока из полости абсцесса, отверстие по ходу иглы рассекается, расширяется тупым путем, и в него устанавливается двухпросветный дренаж (или катетер с раздутой манжеткой). Проводится послеоперационная санация гнойной полости.
Для вскрытия абсцесса дугласова пространства у женщин может применяться задняя кольпотомия. При невозможности вскрытия абсцесса трансерктально или трансвагинально, используется оперативный доступ в подвздошной области с последующим введением дренажа в малый таз.
3) Врожденный вывих бедра - это крайне запущенная степень дисплазии тазобедренного сустава и представляет собой недоразвитие тазобедренного сустава. Отсутствует правильное сочленение костей тазобедренного сустава. Головка бедренной кости выходит за пределы вертлужной впадины, в результате образуется вывих. Либо имеется предрасположенность к вывиху, что в некоторых случаях тоже рассматривают как собственно вывих сустава.
Врожденный вывих бедра у детей встречается в 5-7 случаях из 1000 новорожденных. Девочки в 3-6 раз болеют чаще мальчиков. Левый сустав поражается чаще, иногда заболевание может быть двустороннее.
Симптомы врожденного вывиха бедра
Выявить врожденный вывих бедра у детей можно только после рождения по следующим симптомам.
Ограничение отведения бедра. Ребенок лежит на спине, ножки ребенка сгибаются под углом 90 градусов в коленных и тазобедренных суставах. После чего разводятся до упора по сторонам до упора. При врожденном вывихе угол разведения ног уменьшается в сравнении с нормальным 160-180 градусов.
Симптом Маркса-Ортолани (симптом «щелчка»). Ребенок лежит на спине, ножки сгибаются в коленных и тазобедренных суставах под прямым углом. Они сводятся вместе, а затем постепенно раздвигаются по сторонам. Со стороны вывиха отчетливо слышен щелчок.
Укорочение длинны ножки ребенка со стороны вывиха. Для выявления этого симптома нужно согнуть ножки вашего ребенка в коленях и постараться прижать их к животу.
Несимметричные кожные складки на ногах. На выпрямленных ногах ребенка и спереди и сзади кожные складки должны быть относительно симметричны.
При обнаружении одного из этих четырех симптомов следует немедленно обратиться к лечащему врачу для более тщательного осмотра. Для уточнения диагноза применяют рентген и ультразвук.
Лечение врожденного вывиха бедра
Последствия врожденного вывиха бедра при отсутствии лечения могут быть довольно серьезными. Невылеченный в детстве вывих может привести к диспластическому коксартрозу во взрослом возрасте.
Чем раньше вы начнете лечение данного заболевания, тем более эффективным оно будет. Чаще всего используют традиционное лечение. Мать уже в роддоме обучают ЛФК и правильному пеленанию (ножки должны лежать свободно и максимально отводиться в стороны). Суть консервативного лечения в том, чтобы относительно зафиксировать кости тазобедренного сустава в таком положении, при котором головка бедренной кости будет находиться в центре вертлужной впадины. В таком положении головка сустава постоянно раздражает и стимулирует к отстройке недоразвитую крышку суставной впадины.
Для фиксирования ножек младенца в постоянно отведенном состоянии используют специальные ортопедические приспособления (стремена Павлика, подушка Фрейка, шина Виленского и шина Волкова). Чаще всего при лечении врожденного вывиха бедра применяют именно Стремена Павлика (изобретение чешского ортопеда Арнольда Павлика). Шина позволяет фиксировать ноги ребенка в положении разведения, при этом сохраняя подвижность ног в определенных пределах. Длительность лечения контролируется рентгеном. Длится до тех пор, пока не сформируется крышка вертлужной впадины сустава.
При лечении детей старше года используют постепенное липкопластырное вытяжение Соммервила, усовершенствованное Мау. Суть метода примерно та же – инициируется отстройка крышки вертлужной впадины.
Если консервативное лечение не дало результатов, или в случаях, когда заболевание было обнаружено поздно, применяют хирургическое вмешательство. На сегодняшний день существует большое множество различных видов операций, направленных на лечение врожденного вывиха бедра. Чаще используют внесуставные операции. При таких операциях сохраняются выработанные адаптационные механизмы и создаются благоприятные условия для дальнейшего функционирования сустава. Для лечения врожденного вывиха бедра у детей и подростков чаще используют операцию Солтера. Для лечения взрослых – надацетабулярную остеотомию таза по Хиари и прочие артропластические операции профессора А.М. Соколовского.
Правильное и своевременно начатое лечение является залогом быстрого выздоровления при врожденном вывихе бедра.
17 Билет
1) Инвагинация кишечника - смешанная форма механической кишечной непроходимости, возникающей при телескопическом внедрении проксимальной части кишки в просвет дистальной части кишечника.
Этиология инвагинаций кишечника
В большинстве случаев неизвестна. К факторам, способствующим возникновению инвагинаций, относят: нарушение режима питания, кишечные заболевания, лимфаденопатии в результате поражения аденовирусной инфекцией, травмы живота, полипы или опухоли кишечника, дивертикул Меккеля. Из анатомических причин развития инвагинаций можно выделить: патологическую подвижность слепой и подвздошной кишок, пороки развития илеоцекального клапана.
Патогенез инвагинаций кишечника
Инвагинация возникает при внезапной дискоординации кишечной перистальтики. Изначально при ущемлении рябь внедренной кишки, возникает странгуляционная кишечная непроходимость. Ущемление рябь приводит к обструкции лимфатического и венозного дренажа, отека внедренного кишечника и выхода эритроцитов из кровеносного русла путем диапедеза. Смешиваясь со слизью, усиленно продуцируется, кровянистый транссудат формирует стул в виде "малинового (смородинового) желе". Усиление отека кишки приводит к нарушению артериального кровоснабжение и возникновения гангрены кишечника. Гангрена начинается на головке инвагината и распространяется назад. В дальнейшем к странгуляционной присоединяется и обтурационная непроходимость кишечника при закрытии просвета кишечной трубки инвагината. У ребенка за счет рвоты развивается дегидратация. Ишемия и некроз кишки приводят к перфорации кишки и развития сепсиса. Некроз значительной длины кишки может привести к развитию синдрома "короткой кишки". В инвагината различают 3 цилиндра (внешний, средний, внутренний) и головку инвагината.
Классификация инвагинаций кишечника
По клиническому течению различают: 1. Острые инвагинации (98,8%). 2. Хронические инвагинации - возникновение спайкового процесса в инвагината (в результате развития воспаления) при отсутствии полного перекрытия просвета кишечника (0,7%). 3. Рецидивирующие инвагинации (0,5%). По локализации (по В. П. Портным): I. инвагинации в области илеоцекального угла-91, 3%): a) слипоободова форма - внедрение стенки слепой кишки в восходящую, подвздошная кишка пассивно втягивается, не проходя через илеоцекальный клапан; b) кпубово-подвздошно-ободочная форма - внедрение подвздошной кишки в подвздошную, затем через илеоцекальный клапан в толстую кишку: • простая форма - слепая кишка не углубляется в инвагинат; • сложная форма - слепая кишка и другие отделы толстой кишки углубляются в инвагинат с образованием части среднего цилиндра. с) подвздошно-клапанно-ободочная форма - часть подвздошной кишки у илеоцекального клапана углубляется в толстый кишечник с вовлечением толстой кишки. II. Тонко-тонкокишечная форма - 6,5%. III. Толсто-толстокишечного форма - 2,25%.
Клиника инвагинаций кишечника
Вид ребенка, больного инвагинацию, достаточно обманчив. Обычно это ребенок хорошо откормленное и не выдается больным. Напротив, у детей худых или с плохим питанием инвагинация встречается реже. Клинические проявления инвагинации, как правило, следующие: 1. Внезапное возникновение интенсивных (вплоть до болевого шока) приступообразный болей в животе, носящие периодический (периодичность в 5-30 минут) характер. Во время приступа боли ребенок бледнеет, кричит и подтягивает ноги к животу. Эти эпизоды боли продолжаются несколько секунд, в промежутках ребенок кажется спокойной или даже сонной. 2. Рвота, сначала остатками пищи. 3. Кровь в стуле или слизь, пропитанный кровью ("малиновое" или "смородиновое желе"), без примесей кала через 4-6 часов от начала заболевания. 4. Мягкоэластической умеренно подвижная опухоль - инвагинат, что прощупывается при пальпации живота. 5. Отсутствие слепой кишки в правой подвздошной области - симптом удовлетворено 6. Задержка газов и стула. 7. При ректальном исследовании иногда можно заметить или прощупать головку инвагината и выявить кровь в стуле.
Диагностика инвагинаций кишечника
1. Общий и биохимический анализы крови - не имеют определенных признаков при инвагинации, но в зависимости от длительности заболевания и связанной с ним рвоты и кровопотери могут отражать дегидратацию, анемию и / или лейкоцитоз. 2. Обзорная рентгенография - невсегда дает данные для диагноза, однако достаточно часто на рентгенограмме различаются расширенные петли тонкого кишечника, тень инвагината на фоне кишки, чаши Клойбера как признак непроходимости кишечника). 3. УЗИ - при двумерной эхографии - ехонегативни и ехопозитивни участки изображения, которые чередуются в виде концентрических колец при поперечном УЗИ), или симптом "псевдониркы" при продольном УЗИ). УЗИ лучше используется как диагностический инструмент для исключения диагноза инвагинации. 4. Компьютерная томография - часто используется для дифференциальной диагностики заболеваний, сопровождающихся болями в животе. Хотя этот метод и не применяется для диагностики инвагинации, но она может быть обнаружена случайно, при анализе данных компьютерной томографии). 5. Ирригография с воздухом как основной метод диагностики (симптомы "клешни рака", "кокарды"). Давление воздуха не должно превышать 50-60 мм рт. ст. Воздух вводится с помощью аппарата Ричардсона. При отсутствии признаков перфорации или перитонита, возможно проведение контрастной иригорафии с водорастворимыми контрастом (урографин, верографинн, Триомбраст)). 6. Колоноскопия выявляет состояние головки инвагината - возможен некроз головки. Дифференциальная диагностикапроводится с острой дизентерией, токсическим диспепсией, острым аппендицитом, пептической язвой меккелев дивертикула, острыми холециститом и панкреатитом, полипами желудочно-кишечного тракта, выпадением слизистой прямой кишки.
Лечение инвагинаций кишечника Консервативное
Применяется методика сквозного продувания под наркозом с помощью аппарата Ричардсона. Давление воздуха в прямой кишке не должен превышать 120 мм рт.вот. Контроль расправления инвагината - пальпаторно и с помощью назогастрального зонда, через который выходит воздух в стакан с жидкостью.Рецидивы инвагинации после консервативного лечения составляют около 5%. Противопоказания к консервативному лечению: 1. Подвздошно-подвздошно-ободочная форма инвагинации. 2. Кровотечение из прямой кишки. 3. Обструкция тонкой кишки на рентгенограмме. 4. Срок более 18 часов от начала заболевания. 5. У детей старше 1 года или моложе С месяцев. 6. Дегидратация более чем на 5%. 7. Рецидивирующие инвагинации. 9. Некроз головки инвагината, обнаруженный при колоноскопии.
Оперативное
Обязательна предоперационная подготовка в течение 2-3 часов. Методы хирургического лечения - лапароскопическим и путем лапаротомии. При лапаротомии, в зависимости от состояния инвагината, выполняют: 1. Дезинвагинацию с "видоювання" инвагината. 2. Дезинвагинацию с последующей резекцией кишечника и наложением анастомоза. 3. Одномоментную резекцию инвагината без его расправления. 4. Резекцию инвагината через кишку. Рецидивы инвагинации после оперативного лечения составляют около 1-4%. Летальность менее 1%.
2) Кровотечения из верхних отделов пищеварительного тракта
Кровотечения из верхних отделов пищеварительного тракта чаще всего связаны с язвенной болезнью желудка или двенадцатиперстной кишки. У пожилых частота кровотечений возрастает за счет приема нестероидных противовоспалительных средств. Реже кровотечения возникают из варикозно-расширенных вен пищевода, при синдроме Мэллори-Вейсса и остром геморрагическом гастрите.
Клиническая картина определяется темпом кровотечения и объемом кровопотери.
При легкой степени кровотечения, когда потеря крови не превышает 350—400 мл, субъективных ощущений или вовсе не бывает, или они ограничиваются легкой преходящей тошнотой, сухостью во рту, слабостью, познабливанием. Больной во многих случаях может даже не обратить внимания на эти симптомы, если не появляется рвота кровью. Наиболее постоянные признаки — позыв на дефекацию и «дегтеобразный» стул. Кровопотерю, не превышающую 10% исходного объема циркулирующей крови (ОЦК), организм переносит обычно легко за счет включения механизмов саморегуляции и компенсации.
Во время и сразу после кровопотери в результате рефлекторного выброса надпочечниками катехоламинов возникает спазм периферических сосудов, что сопровождается уменьшением объема сосудистого русла и компенсацией гемодинамики, благодаря которой сохраняется достаточный кровоток в жизненно важных органах (мозг, миокард, печень). Одним из важнейших механизмов саморегуляции организма в данный момент является аутогемодилюция. Мобилизация собственной межтканевой жидкости и выброс ее в сосудистое русло приводят к восстановлению ОЦК, уменьшению вязкости крови, вымыванию застойных эритроцитов из депо и поступлению их в циркуляцию. Тем самым при относительно небольшой кровопотере создаются условия для быстрой нормализации не только центральной, но и периферической гемодинамики. Показатели крови быстро выравниваются ;я повторное исследование, как правило, не определяет существенного отклонения от нормы содержания гемоглобина, эритроцитов, тромбоцитов, гематокрита. Однако с З-4-ro дня в периферической крови увеличивается количество ретикулоцитов как результат активации эритропоэза. Положительная реакция кала на скрытую кровь после однократной кровопотери обычно сохраняется в течение двух недель, а мелена — 3-5 сут.
При большой потере крови или повторной кровопотере появляются симптомы острой постгеморрагической анемии: внезапная слабость, тошнота, потливость, шум в ушах, «мелькание мушек» перед глазами, сердцебиение, головокружение, обморочное состояние. Больной становится бледным, кожные покровы — влажными (холодный липкий пот), пульс — учащенным, малым, систолическое артериальное давление снижается. Появляется осиплость голоса, жажда, адинамия» олигурия. Необходимо иметь в виду, что перечисленные субъективные и объективные симптомы могут появиться раньше кровавой рвоты и мелены. Общее состояние больного зависит не только от величины кровопотери, но и от ее скорости. При язвенной болезни в фазе обострения кровотечения возникают довольно часто, но из-за отсутствия явных симптомов (гематомезис, мелена, анемия) они не диагностируются. «Скрытое», т.е. незначительное, кровотечение проявляется микросимптоматикой (кратковременные — обморок, потливость, жажда и др.), в основном же характеризуется положительным анализом кала на «скрытую кровь». Однако при этом для исключения ложно-положительного анализа необходимо за 3 дня до исследования исключить из рациона питания мясо и овощи, содержащие пероксидазу (репа, брюква, цветная капуста, редька, дыня), а также не употреблять аскорбиновую кислоту и НПВП.
Под влиянием указанных выше компенсаторно-приспособительных механизмов восстанавливается OЦK (обычно в течение нескольких часов), но вследствие разжижения крови развивается нормохромная гиперрегенераторная анемия, являющаяся критерием тяжести кровотечения. Однако в первые часы даже после значительной кровопотери концентрация гемоглобина и число эритроцитов остаются достаточными. Их снижение начинается к концу первых суток и особенно быстро прогрессирует на фоне лечебного введения жидкости (полиглюкин и др.). Отсутствие положительной динамики показателей эритропоэза в течение 3-5 последующих суток после кровопотери свидетельствует о продолжающемся или повторно возникшем кровотечении. Кроме того, при кровотечениях из верхних отделов ЖКТ часто присоединяется азотемия с увеличением в крови концентрации мочевины. Причиной ее обычно становится резорбция белка крови. Резорбционная азотемия имеет как диагностическое, так и прогностическое значение.
Иногда у больных определяется небольшая гипербилирубинемия, снижается уровень протромбина и альбумина крови.
На 2-й день после кровотечения может появиться резорбционная лихорадка, уменьшающаяся на фоне антибактериальной терапии и клизм.
В настоящее время при подозрении на кровотечение и даже па высоте его проводят эндоскопическое исследование, которое преследует не только диагностические, но и лечебные цели — остановку кровотечения.
Большинство кровотечений из язв при язвенной болезни останавливается спонтанно. Однако приблизительно у 20% больных наблюдаются повторные кровотечения, из-за чего многие из таких больных нуждаются в хирургическом вмешательстве. Необходимо у каждого больного с кровоточащей язвой выявлять факторы риска повторного кровотечения и предпринимать профилактические меры.
Во всех случаях при остром желудочно-кишечном кровотечении необходимо:
1. Оценить тяжесть кровотечения и жизненные ресурсы больного (состояние гемодинамики, дыхания и других жизненно важных органов и систем).
2. Установить место кровотечения.
3. Осуществлять связь с хирургом и врачом-эндоскопистом.
4. Начать медикаментозное лечение.
5. Провести соответствующие исследования.
Каждый больной с острым кровотечением из верхних отделов пищеварительного тракта оценивается по критериям возможного рецидива кровотечения и риска развития геморрагического шока. Больные с кровавой рвотой и меленой нуждаются в активном лечении до полной стабилизации клинических, эндоскопических и гематологических показателей.
Высокий риск повторного кровотечения и смерти имеют больные при наличии:
рвоты и мелены (сочетание);
свежей крови в кале;
продолжающегося кровотечения или его рецидива;
возраста свыше 60 лет или кардиореспираторных заболеваний, ухудшающих гемодинамику и функцию дыхания;
болезней, в терапии которых использовались нестероидные противовоспалительные средства;
пульса чаше 100 уд./мин.
Показаниями к проведению гемотрансфузии у этих больных являются:
1. Венозное давление ниже 100 мм вод. ст: (в норме 120— 150).
2. Прохладные (холодные) и влажные на ощупь конечности.
3. Систолическое артериальное давление менее 100 ммрт, ст. (у молодых больных возникает поздно).
К эндоскопическим признакам риска повторного кровотечения относят следующие:
1. Артериальное кровотечение (риск достигает 90%).
2. Видимый сосуд в дне язвы (риск достигает 90%).
3. Наличие свежего тромба — черная точка на дне язвы (риск достигает 30%).
4. Расширенные вены пищевода или кардиального отдела желудка (риск в 10% случаев).
Низкий риск повторного кровотечения и смерти имеют больные:
в возрасте моложе 60 лет;
с рвотой кофейной гущи без мелены;
при кровотечении, индуцированном приемом алкоголя;
при отсутствии гемодинамических расстройств (пульс менее 100 уд./мин, систолическое артериальное давление более 100 мм рт. ст., венозное давление не ниже 100 мм вод. ст., конечности теплые, потливости нет, диурез более 30 мл/ч):
при отсутствии эндоскопических признаков продолжающегося кровотечения.
При оценке состояния пациентов следует также иметь в виду предшествующие симптомы (диспепсия, рвота, падение массы тела), присутствие или отсутствие при ректальном исследовании мелены, признаки хронических заболеваний печени, прием лекарств и алкоголя.
Рвота кровью, сгустки крови в кале не всегда являются специфичными для острого кровотечения из верхних отделов пищеварительного тракта, так как они. кроме мелены, могут быть проявлением патологических процессов в тонкой и даже толстой кишке.
Рвота кровью (гематомезис) обычно возможна только тогда, когда источник кровотечения находится выше связки Трейтца (пищевод, желудок, двенадцатиперстная кишка). Контакт крови с НСl изменяет ее цвет до «кофейного». Однако при массивной кровопотере и при отсутствии полного контакта крови с НСl рвотные массы могут иметь ярко-красный или темный синевато-красный цвет. Но по цвету рвотных масс невозможно всегда и точно определить источник кровотечения.
Мелена является следствием воздействия на компоненты крови кишечной микрофлоры. Типичный стул при мелене — черный как деготь, блестящий, липкий и обычно неоформленный. Важно дифференцировать мелену от стула, связанного с приемом препаратов висмута, железа, черники, черемухи, ежевики. Псевдомеленовый стул обычно нормальной консистенции и формы.
Наличие ярко-красной крови в кале может быть связано с обильной кровопотерей из верхних отделов пищеварительного тракта и ускоренной перистальтикой, приводящей к дефекации в первые восемь часов от момента кровопотери.
Физикальное исследование проводится с учетом возможного выявления симптомов цирроза печени («печеночные ладони», «сосудистые звездочки» и др.), болезни Рандю-Уэбера-Ослера (кожные телеангиоэктазии и др.), синдрома Пейтца-Егерса (пигментные пятна на губах и видимой слизистой с полипозом тонкой кишки) и др.
Первичное исследование включает:
1. Анализ крови (гемоглобин, ретикулоциты, гематокрит, тромбоциты и др.).
2. Исследование коагуляционных свойств крови (протромбиновое время и др.).
3. Электролиты, мочевина и креатинин крови.
4. Группа крови и резус-фактор.
5. Газы крови.
6. ЭКГ.
7. Рентген грудной клетки (рентгеновский снимок брюшной полости — по особым показаниям).
Другие исследования проводятся в зависимости от предполагаемых заболеваний. Падение гемоглобина зависит от выраженности гемодилюции, в том числе вызванной инфузионной терапией. Срочная эндоскопия позволяет выявить источник кровотечения, определить, продолжается оно или остановилось, а также осуществить по показаниям гемостатические мероприятия.
Экстренные меры
1. Освободить у больного дыхательные пути и извлечь протезы.
2. Канюлировать югулярные вены.
3. Если пульс превышает 100 уд./мин, нужно ввести в/в 500 мл полиглюкина в течение 50-60 мин и при необходимости инфузии повторять.
4. При отсутствии гемодинамической стабильности начать переливание крови (уровень гемоглобина в первые часы не является достаточно информативным показателем тяжести кровотечения). Повторные гемотрансфузии проводятся до повышения уровня гемоглобина (10 г на 100 мл крови).
Препараты на основе декстрана (полиглюкин и др ) могут быть причиной гемодилюции: 1000 мл препарата снижает показатель гемоглобина в среднем на 10%. Необходимо иметь запасы крови (или эритроцитарной массы) группы О (1) резус-отрицательной (Rh-) для проведения гемотрансфузий при неотложных состояниях, характеризующихся продолжающимся кровотечением, падением систолического артериального давления ниже 100 мм рт. ст., несмотря на введение коллоидных растворов. При этом риск от гипотензии может превышать риск от потери самой крови. В этих ситуациях оправдано установление мочевого катетера для того, чтобы мониторировать состояние гемодинамики количеством выделяемой мочи. Ведение больных с кровотечением из пищеварительного тракта требует участия специалистов разного профиля.
Основанием к госпитализации больного в палату реанимации является наличие признаков массивного кровотечения: выраженная бледность кожи и слизистых оболочек, холодные конечности, пульс свыше 100 уд./мин, систолическое артериальное давление ниже 100 мм рт. ст., особенно у больных с высоким риском смерти, повторяющиеся кровотечения, низкое центральное венозное давление (меньше 100 мм вод. ст.).
Выявление места кровотечения
Если при экстренной эндоскопии не удалось установить источник кровотечения, то с этой же целью исследование повторяется после проведения неотложных мероприятий, с интервалом 12—24ч. Если повторное эндоскопическое исследование проводится в более поздние сроки, то признаки кровотечения будет обнаружить труднее. При наличии расширенных вен пищевода повторная эндоскопия проводится в первые четыре часа.
При профузном кровотечении его источник определить трудно, желудочное орошение проводить рискованно в связи с возможным разрушением уже образовавшегося тромба, и поэтому показания к повторному эндоскопическому исследованию основываются на динамическом наблюдении за больным (пульс, АД, венозное давление, диурез и. др.). Результаты наблюдения оцениваются каждые 4 ч. Коагуляционные исследования повторяются, если было проведено четыре гемотрансфузии, другие исследования крови ежедневно повторяются только у больных с высоким риском повторного кровотечения (необходимо иметь запасы крови еще в течение 48 ч).
Медикаментозная терапия
Медикаментозные средства не являются альтернативными в лечении острых кровотечений, если показана операция, но они могут способствовать остановке кровотечения и предупредить его рецидив. Эффективность медикаментозного лечения определяется многими обстоятельствами, но независимо от них оправдано назначение ранитидина (зантак), омепразола (лосек) или фамотидина (квамател). Один из них вводится в/в (зантак по 50 мг, квамател по 20 мг, лосек по 40 мг) в течение 2—5 мин 3 раза в сутки с интервалами в 8 ч до 3 сут. При этом уменьшается риск возникновения стрессовых язв и рецидива кровотечения, но не останавливается продолжающееся кровотечение. После прекращения в/в введения антисекреторного препарата при эрозивно-язвенных кровотечениях оправдано назначение его внутрь (ранитидина по 150 мг, или фамотидина по 20 мг 3 раза вдень, или омепразола по 20 мг 2 раза в день).
Эндоскопическая терапия проводится в зависимости от источника кровотечения:
1. Склеротерапия вен пищевода при их варикозном расширении.
2. Инъекция жидкого фибриногена или инстиляция жидким тромбином в зоне язвы.
3. Лазерная фотокоагуляция.
4. Диатермокоагуляция.
В силу недостаточной эффективности не рекомендуется промывание желудка ледяной водой, применение вазоконстрикторов (адреналин и др.) и антацидов. Подтвержден гемостатический эффект соматостатина при язвенных кровотечениях, омепразола и сукральфата при геморрагическом гастрите, синестрола при наследственных телеангиоэктазиях.
Соматостатин (сандостин) угнетает секрецию желудочного и панкреатического сока, снижает кровоток в органах -брюшной полости, что способствует остановке язвенного кровотечения и кровотечения из расширенных вен пищевода. Вводится в/в капельно по 250 мкг/час до наступления аффекта.
При геморрагическом гастрите омепразол назначается дважды в сутки по 20 мг с интервалами в 12 ч в сочетании с сукральфатом (12-16 г в сут.) в течение нескольких дней с последующим снижением суточной дозы омепразола до 20 мг, а сукральфата до 4 г.
Синестрол вводят в/м ежедневно по 1 мл 2%-го масляного раствора в целях профилактики повторных эпизодов кровотечений из наследственных телеангиоэктазий.
Повторные кровотечения значительно повышают риск смерти.
К признакам повторно возникшего кровотечения относят:
1. Увеличение частоты пульса (ранний и высокочувствительный признак).
2. Падение центрального венозного давления.
3. Снижение часового выделения мочи.
4. Кровавая рвота или мелена.
5. Снижение систолического артериального давления (поздний признак).
6. Бледность кожи и видимых слизистых оболочек, холодный липкий пот.
Показания к хирургическому лечению при рецидиве кровотечения зависят от диагноза и его причины. Единственным показанием к оперативному вмешательству является тяжесть продолжающегося или повторно возникшего кровотечения несмотря на адекватные лечебные мероприятия, включая гемотрансфузии (6 трансфузий лицам моложе 60 лет), эндоскопические манипуляции и адекватную медикаментозную терапию. При отсутствии повторного кровотечения обнаружение при эндоскопическом исследовании на дне язвы свежего тромба или сосуда не является показанием для операции. Такие больные нуждаются в наблюдении.
Также кровотечения из верхних отделов ЖКТ возникают при:
Расширенных венах пищевода
Синдроме Мэллори-Вейсса
Эрозии желудка и геморрагическом гастрите
Аортодуоденальной фистуле
3) Бронхоэктатическая болезнь — приобретённое или врожденное заболевание, характеризующееся хроническим нагноительным процессом в необратимо изменённых (расширенных, деформированных) и функционально неполноценных бронхах преимущественно нижних отделов лёгких. Причиной его не являются другие заболевания (туберкулез, абсцесс и др.). Болеют преимущественно в детском и молодом возрасте, чаще мужчины.
Содержание
[убрать]
1Классификация
2Симптомы и течение
3Распознавание
4Лечение
5Ссылки
Классификация[править | править вики-текст]
Классифицируют:
по характеру расширения бронхов (цилиндрические, мешотчатые, веретенообразные и смешанные);
по распространённости процесса (одно- и двусторонние, с указанием точной локализации по сегментам);
по клиническому течению (бронхитическая ст., ст.выраженных клинических проявлений и ст. осложнений).
Симптомы и течение[править | править вики-текст]
При обострении, чаще в весенне-осенний период, больные жалуются на кашель с гнойной мокротой, отходящей после ночного сна и в «дренажном положении», при котором мокрота лучше оттекает из поражённых бронхов; общее недомогание, повышение температуры тела. Может появиться кровохарканье, лёгочное кровотечение.Одышка при физической нагрузке, цианоз. Над лёгкими выслушиваются разнокалиберные влажные хрипы, уменьшающиеся после откашливания.
Распознавание[править | править вики-текст]
Рентгенологическое обследование показывает грубый пневмосклероз, уменьшение объёма поражённой доли лёгкого. Помогают диагнозу бронхография, бронхоскопия.
Лечение[править | править вики-текст]
Консервативное — включает в себя антибиотики, бронхолитики и средства, разжижающие мокроту, лечебную физкультуру, массаж грудной клетки. Физиотерапевтическое лечение возможно только при нормализации температуры и отсутствии кровохарканья. При ограниченных поражениях доли, сегмента лёгкого проводится хирургическое вмешательство.
Главным звеном консервативного лечения является санация бронхиального дерева, предусматривающая, с одной стороны, опорожнение последнего от гнойной мокроты, а с другой — местное воздействие антимикробными средствами на гноеродную микрофлору. Наряду с санацией путём лаважа с помощью инсталляций в поражённые бронхи через трансназальный катетер или при бронхоскопии вводится растворов антисептиков, антибиотиков, муколитических средств и т. д. существенное значение сохранили и вспомогательные средства, способствующие отхождению гнойной мокроты: так называемый постуральный дренаж, дыхательная гимнастика, вибрационный массаж грудной клетки и т. д. Большую пользу приносят правильно выбранный режим, общеукрепляющие процедуры, полноценное, богатое белками питание и т. д.
Радикальное хирургическое вмешательство не всегда показано и не может излечить всех больных бронхоэктазиями. Оптимальным возрастом для вмешательства следует считать 7-14 лет, поскольку в младшем возрасте не всегда точно удается установить объём и границы поражения [Пугачев А. Г. и др., 1970; Исаков Ю. Ф. и др., 1978, и др.].
Показания к резекции лёгких при так называемых «малых формах» следует ставить с определённой осторожностью, лишь после тщательной оценки динамики заболевания под влиянием консервативного лечения и повторных бронхографических исследований. У всех больных с достаточно выраженными и локализованными бронхоэктазиями поражённые отделы лёгкого могут быть удалены только при условии, что после резекции дыхательная функция будет обеспечиваться достаточным объёмом полноценной лёгочной ткани.
При односторонних бронхоэктазиях можно достигнуть максимального радикализма, оставив непоражённые отделы лёгкого или же, в крайнем случае, прибегнув кпневмонэктомии.
При двусторонних бронхоэктазиях с асимметричным поражением бронхиального дерева, при котором в одном из лёгких имеются небольшие расширения бронхов отдельных сегментов, допустима паллиативная резекция лёгкого на стороне большего поражения. Состояние больных после таких операций обычно существенно улучшается, и при обязательном диспансерном наблюдении и противорецидивном лечении нередко удается добиться клинического благополучия, причём изменения на неоперированной стороне, как правило, не прогрессируют.
При более или менее симметричном поражении бронхов обоих лёгких показана двусторонняя резекция, которую большинство хирургов предпочитают производить в два этапа с интервалом в 6—12 мес. Возможность такой резекции определяется объёмом неизменённой лёгочной ткани. При обширных двусторонних бронхоэктазиях с поражением верхних лёгочных сегментов оперативное лечение обычно не показано.
18 Билет
Инвагинация кишечника - смешанная форма механической кишечной непроходимости, возникающей при телескопическом внедрении проксимальной части кишки в просвет дистальной части кишечника.
Этиология инвагинаций кишечника
В большинстве случаев неизвестна. К факторам, способствующим возникновению инвагинаций, относят: нарушение режима питания, кишечные заболевания, лимфаденопатии в результате поражения аденовирусной инфекцией, травмы живота, полипы или опухоли кишечника, дивертикул Меккеля. Из анатомических причин развития инвагинаций можно выделить: патологическую подвижность слепой и подвздошной кишок, пороки развития илеоцекального клапана.
Патогенез инвагинаций кишечника
Инвагинация возникает при внезапной дискоординации кишечной перистальтики. Изначально при ущемлении рябь внедренной кишки, возникает странгуляционная кишечная непроходимость. Ущемление рябь приводит к обструкции лимфатического и венозного дренажа, отека внедренного кишечника и выхода эритроцитов из кровеносного русла путем диапедеза. Смешиваясь со слизью, усиленно продуцируется, кровянистый транссудат формирует стул в виде "малинового (смородинового) желе". Усиление отека кишки приводит к нарушению артериального кровоснабжение и возникновения гангрены кишечника. Гангрена начинается на головке инвагината и распространяется назад. В дальнейшем к странгуляционной присоединяется и обтурационная непроходимость кишечника при закрытии просвета кишечной трубки инвагината. У ребенка за счет рвоты развивается дегидратация. Ишемия и некроз кишки приводят к перфорации кишки и развития сепсиса. Некроз значительной длины кишки может привести к развитию синдрома "короткой кишки". В инвагината различают 3 цилиндра (внешний, средний, внутренний) и головку инвагината.
Классификация инвагинаций кишечника
По клиническому течению различают: 1. Острые инвагинации (98,8%). 2. Хронические инвагинации - возникновение спайкового процесса в инвагината (в результате развития воспаления) при отсутствии полного перекрытия просвета кишечника (0,7%). 3. Рецидивирующие инвагинации (0,5%). По локализации (по В. П. Портным): I. инвагинации в области илеоцекального угла-91, 3%): a) слипоободова форма - внедрение стенки слепой кишки в восходящую, подвздошная кишка пассивно втягивается, не проходя через илеоцекальный клапан; b) кпубово-подвздошно-ободочная форма - внедрение подвздошной кишки в подвздошную, затем через илеоцекальный клапан в толстую кишку: • простая форма - слепая кишка не углубляется в инвагинат; • сложная форма - слепая кишка и другие отделы толстой кишки углубляются в инвагинат с образованием части среднего цилиндра. с) подвздошно-клапанно-ободочная форма - часть подвздошной кишки у илеоцекального клапана углубляется в толстый кишечник с вовлечением толстой кишки. II. Тонко-тонкокишечная форма - 6,5%. III. Толсто-толстокишечного форма - 2,25%.
Клиника инвагинаций кишечника
Вид ребенка, больного инвагинацию, достаточно обманчив. Обычно это ребенок хорошо откормленное и не выдается больным. Напротив, у детей худых или с плохим питанием инвагинация встречается реже. Клинические проявления инвагинации, как правило, следующие: 1. Внезапное возникновение интенсивных (вплоть до болевого шока) приступообразный болей в животе, носящие периодический (периодичность в 5-30 минут) характер. Во время приступа боли ребенок бледнеет, кричит и подтягивает ноги к животу. Эти эпизоды боли продолжаются несколько секунд, в промежутках ребенок кажется спокойной или даже сонной. 2. Рвота, сначала остатками пищи. 3. Кровь в стуле или слизь, пропитанный кровью ("малиновое" или "смородиновое желе"), без примесей кала через 4-6 часов от начала заболевания. 4. Мягкоэластической умеренно подвижная опухоль - инвагинат, что прощупывается при пальпации живота. 5. Отсутствие слепой кишки в правой подвздошной области - симптом удовлетворено 6. Задержка газов и стула. 7. При ректальном исследовании иногда можно заметить или прощупать головку инвагината и выявить кровь в стуле.
Диагностика инвагинаций кишечника
1. Общий и биохимический анализы крови - не имеют определенных признаков при инвагинации, но в зависимости от длительности заболевания и связанной с ним рвоты и кровопотери могут отражать дегидратацию, анемию и / или лейкоцитоз. 2. Обзорная рентгенография - невсегда дает данные для диагноза, однако достаточно часто на рентгенограмме различаются расширенные петли тонкого кишечника, тень инвагината на фоне кишки, чаши Клойбера как признак непроходимости кишечника). 3. УЗИ - при двумерной эхографии - ехонегативни и ехопозитивни участки изображения, которые чередуются в виде концентрических колец при поперечном УЗИ), или симптом "псевдониркы" при продольном УЗИ). УЗИ лучше используется как диагностический инструмент для исключения диагноза инвагинации. 4. Компьютерная томография - часто используется для дифференциальной диагностики заболеваний, сопровождающихся болями в животе. Хотя этот метод и не применяется для диагностики инвагинации, но она может быть обнаружена случайно, при анализе данных компьютерной томографии). 5. Ирригография с воздухом как основной метод диагностики (симптомы "клешни рака", "кокарды"). Давление воздуха не должно превышать 50-60 мм рт. ст. Воздух вводится с помощью аппарата Ричардсона. При отсутствии признаков перфорации или перитонита, возможно проведение контрастной иригорафии с водорастворимыми контрастом (урографин, верографинн, Триомбраст)). 6. Колоноскопия выявляет состояние головки инвагината - возможен некроз головки. Дифференциальная диагностикапроводится с острой дизентерией, токсическим диспепсией, острым аппендицитом, пептической язвой меккелев дивертикула, острыми холециститом и панкреатитом, полипами желудочно-кишечного тракта, выпадением слизистой прямой кишки.
Лечение инвагинаций кишечника Консервативное
Применяется методика сквозного продувания под наркозом с помощью аппарата Ричардсона. Давление воздуха в прямой кишке не должен превышать 120 мм рт.вот. Контроль расправления инвагината - пальпаторно и с помощью назогастрального зонда, через который выходит воздух в стакан с жидкостью.Рецидивы инвагинации после консервативного лечения составляют около 5%. Противопоказания к консервативному лечению: 1. Подвздошно-подвздошно-ободочная форма инвагинации. 2. Кровотечение из прямой кишки. 3. Обструкция тонкой кишки на рентгенограмме. 4. Срок более 18 часов от начала заболевания. 5. У детей старше 1 года или моложе С месяцев. 6. Дегидратация более чем на 5%. 7. Рецидивирующие инвагинации. 9. Некроз головки инвагината, обнаруженный при колоноскопии.
Оперативное
Обязательна предоперационная подготовка в течение 2-3 часов. Методы хирургического лечения - лапароскопическим и путем лапаротомии. При лапаротомии, в зависимости от состояния инвагината, выполняют: 1. Дезинвагинацию с "видоювання" инвагината. 2. Дезинвагинацию с последующей резекцией кишечника и наложением анастомоза. 3. Одномоментную резекцию инвагината без его расправления. 4. Резекцию инвагината через кишку. Рецидивы инвагинации после оперативного лечения составляют около 1-4%. Летальность менее 1%.
2) Кровотечения из верхних отделов пищеварительного тракта
Кровотечения из верхних отделов пищеварительного тракта чаще всего связаны с язвенной болезнью желудка или двенадцатиперстной кишки. У пожилых частота кровотечений возрастает за счет приема нестероидных противовоспалительных средств. Реже кровотечения возникают из варикозно-расширенных вен пищевода, при синдроме Мэллори-Вейсса и остром геморрагическом гастрите.
Клиническая картина определяется темпом кровотечения и объемом кровопотери.
При легкой степени кровотечения, когда потеря крови не превышает 350—400 мл, субъективных ощущений или вовсе не бывает, или они ограничиваются легкой преходящей тошнотой, сухостью во рту, слабостью, познабливанием. Больной во многих случаях может даже не обратить внимания на эти симптомы, если не появляется рвота кровью. Наиболее постоянные признаки — позыв на дефекацию и «дегтеобразный» стул. Кровопотерю, не превышающую 10% исходного объема циркулирующей крови (ОЦК), организм переносит обычно легко за счет включения механизмов саморегуляции и компенсации.
Во время и сразу после кровопотери в результате рефлекторного выброса надпочечниками катехоламинов возникает спазм периферических сосудов, что сопровождается уменьшением объема сосудистого русла и компенсацией гемодинамики, благодаря которой сохраняется достаточный кровоток в жизненно важных органах (мозг, миокард, печень). Одним из важнейших механизмов саморегуляции организма в данный момент является аутогемодилюция. Мобилизация собственной межтканевой жидкости и выброс ее в сосудистое русло приводят к восстановлению ОЦК, уменьшению вязкости крови, вымыванию застойных эритроцитов из депо и поступлению их в циркуляцию. Тем самым при относительно небольшой кровопотере создаются условия для быстрой нормализации не только центральной, но и периферической гемодинамики. Показатели крови быстро выравниваются ;я повторное исследование, как правило, не определяет существенного отклонения от нормы содержания гемоглобина, эритроцитов, тромбоцитов, гематокрита. Однако с З-4-ro дня в периферической крови увеличивается количество ретикулоцитов как результат активации эритропоэза. Положительная реакция кала на скрытую кровь после однократной кровопотери обычно сохраняется в течение двух недель, а мелена — 3-5 сут.
При большой потере крови или повторной кровопотере появляются симптомы острой постгеморрагической анемии: внезапная слабость, тошнота, потливость, шум в ушах, «мелькание мушек» перед глазами, сердцебиение, головокружение, обморочное состояние. Больной становится бледным, кожные покровы — влажными (холодный липкий пот), пульс — учащенным, малым, систолическое артериальное давление снижается. Появляется осиплость голоса, жажда, адинамия» олигурия. Необходимо иметь в виду, что перечисленные субъективные и объективные симптомы могут появиться раньше кровавой рвоты и мелены. Общее состояние больного зависит не только от величины кровопотери, но и от ее скорости. При язвенной болезни в фазе обострения кровотечения возникают довольно часто, но из-за отсутствия явных симптомов (гематомезис, мелена, анемия) они не диагностируются. «Скрытое», т.е. незначительное, кровотечение проявляется микросимптоматикой (кратковременные — обморок, потливость, жажда и др.), в основном же характеризуется положительным анализом кала на «скрытую кровь». Однако при этом для исключения ложно-положительного анализа необходимо за 3 дня до исследования исключить из рациона питания мясо и овощи, содержащие пероксидазу (репа, брюква, цветная капуста, редька, дыня), а также не употреблять аскорбиновую кислоту и НПВП.
Под влиянием указанных выше компенсаторно-приспособительных механизмов восстанавливается OЦK (обычно в течение нескольких часов), но вследствие разжижения крови развивается нормохромная гиперрегенераторная анемия, являющаяся критерием тяжести кровотечения. Однако в первые часы даже после значительной кровопотери концентрация гемоглобина и число эритроцитов остаются достаточными. Их снижение начинается к концу первых суток и особенно быстро прогрессирует на фоне лечебного введения жидкости (полиглюкин и др.). Отсутствие положительной динамики показателей эритропоэза в течение 3-5 последующих суток после кровопотери свидетельствует о продолжающемся или повторно возникшем кровотечении. Кроме того, при кровотечениях из верхних отделов ЖКТ часто присоединяется азотемия с увеличением в крови концентрации мочевины. Причиной ее обычно становится резорбция белка крови. Резорбционная азотемия имеет как диагностическое, так и прогностическое значение.
Иногда у больных определяется небольшая гипербилирубинемия, снижается уровень протромбина и альбумина крови.
На 2-й день после кровотечения может появиться резорбционная лихорадка, уменьшающаяся на фоне антибактериальной терапии и клизм.
В настоящее время при подозрении на кровотечение и даже па высоте его проводят эндоскопическое исследование, которое преследует не только диагностические, но и лечебные цели — остановку кровотечения.
Большинство кровотечений из язв при язвенной болезни останавливается спонтанно. Однако приблизительно у 20% больных наблюдаются повторные кровотечения, из-за чего многие из таких больных нуждаются в хирургическом вмешательстве. Необходимо у каждого больного с кровоточащей язвой выявлять факторы риска повторного кровотечения и предпринимать профилактические меры.
Во всех случаях при остром желудочно-кишечном кровотечении необходимо:
1. Оценить тяжесть кровотечения и жизненные ресурсы больного (состояние гемодинамики, дыхания и других жизненно важных органов и систем).
2. Установить место кровотечения.
3. Осуществлять связь с хирургом и врачом-эндоскопистом.
4. Начать медикаментозное лечение.
5. Провести соответствующие исследования.
Каждый больной с острым кровотечением из верхних отделов пищеварительного тракта оценивается по критериям возможного рецидива кровотечения и риска развития геморрагического шока. Больные с кровавой рвотой и меленой нуждаются в активном лечении до полной стабилизации клинических, эндоскопических и гематологических показателей.
Высокий риск повторного кровотечения и смерти имеют больные при наличии:
рвоты и мелены (сочетание);
свежей крови в кале;
продолжающегося кровотечения или его рецидива;
возраста свыше 60 лет или кардиореспираторных заболеваний, ухудшающих гемодинамику и функцию дыхания;
болезней, в терапии которых использовались нестероидные противовоспалительные средства;
пульса чаше 100 уд./мин.
Показаниями к проведению гемотрансфузии у этих больных являются:
1. Венозное давление ниже 100 мм вод. ст: (в норме 120— 150).
2. Прохладные (холодные) и влажные на ощупь конечности.
3. Систолическое артериальное давление менее 100 ммрт, ст. (у молодых больных возникает поздно).
К эндоскопическим признакам риска повторного кровотечения относят следующие:
1. Артериальное кровотечение (риск достигает 90%).
2. Видимый сосуд в дне язвы (риск достигает 90%).
3. Наличие свежего тромба — черная точка на дне язвы (риск достигает 30%).
4. Расширенные вены пищевода или кардиального отдела желудка (риск в 10% случаев).
Низкий риск повторного кровотечения и смерти имеют больные:
в возрасте моложе 60 лет;
с рвотой кофейной гущи без мелены;
при кровотечении, индуцированном приемом алкоголя;
при отсутствии гемодинамических расстройств (пульс менее 100 уд./мин, систолическое артериальное давление более 100 мм рт. ст., венозное давление не ниже 100 мм вод. ст., конечности теплые, потливости нет, диурез более 30 мл/ч):
при отсутствии эндоскопических признаков продолжающегося кровотечения.
При оценке состояния пациентов следует также иметь в виду предшествующие симптомы (диспепсия, рвота, падение массы тела), присутствие или отсутствие при ректальном исследовании мелены, признаки хронических заболеваний печени, прием лекарств и алкоголя.
Рвота кровью, сгустки крови в кале не всегда являются специфичными для острого кровотечения из верхних отделов пищеварительного тракта, так как они. кроме мелены, могут быть проявлением патологических процессов в тонкой и даже толстой кишке.
Рвота кровью (гематомезис) обычно возможна только тогда, когда источник кровотечения находится выше связки Трейтца (пищевод, желудок, двенадцатиперстная кишка). Контакт крови с НСl изменяет ее цвет до «кофейного». Однако при массивной кровопотере и при отсутствии полного контакта крови с НСl рвотные массы могут иметь ярко-красный или темный синевато-красный цвет. Но по цвету рвотных масс невозможно всегда и точно определить источник кровотечения.
Мелена является следствием воздействия на компоненты крови кишечной микрофлоры. Типичный стул при мелене — черный как деготь, блестящий, липкий и обычно неоформленный. Важно дифференцировать мелену от стула, связанного с приемом препаратов висмута, железа, черники, черемухи, ежевики. Псевдомеленовый стул обычно нормальной консистенции и формы.
Наличие ярко-красной крови в кале может быть связано с обильной кровопотерей из верхних отделов пищеварительного тракта и ускоренной перистальтикой, приводящей к дефекации в первые восемь часов от момента кровопотери.
Физикальное исследование проводится с учетом возможного выявления симптомов цирроза печени («печеночные ладони», «сосудистые звездочки» и др.), болезни Рандю-Уэбера-Ослера (кожные телеангиоэктазии и др.), синдрома Пейтца-Егерса (пигментные пятна на губах и видимой слизистой с полипозом тонкой кишки) и др.
Первичное исследование включает:
1. Анализ крови (гемоглобин, ретикулоциты, гематокрит, тромбоциты и др.).
2. Исследование коагуляционных свойств крови (протромбиновое время и др.).
3. Электролиты, мочевина и креатинин крови.
4. Группа крови и резус-фактор.
5. Газы крови.
6. ЭКГ.
7. Рентген грудной клетки (рентгеновский снимок брюшной полости — по особым показаниям).
Другие исследования проводятся в зависимости от предполагаемых заболеваний. Падение гемоглобина зависит от выраженности гемодилюции, в том числе вызванной инфузионной терапией. Срочная эндоскопия позволяет выявить источник кровотечения, определить, продолжается оно или остановилось, а также осуществить по показаниям гемостатические мероприятия.
Экстренные меры
1. Освободить у больного дыхательные пути и извлечь протезы.
2. Канюлировать югулярные вены.
3. Если пульс превышает 100 уд./мин, нужно ввести в/в 500 мл полиглюкина в течение 50-60 мин и при необходимости инфузии повторять.
4. При отсутствии гемодинамической стабильности начать переливание крови (уровень гемоглобина в первые часы не является достаточно информативным показателем тяжести кровотечения). Повторные гемотрансфузии проводятся до повышения уровня гемоглобина (10 г на 100 мл крови).
Препараты на основе декстрана (полиглюкин и др ) могут быть причиной гемодилюции: 1000 мл препарата снижает показатель гемоглобина в среднем на 10%. Необходимо иметь запасы крови (или эритроцитарной массы) группы О (1) резус-отрицательной (Rh-) для проведения гемотрансфузий при неотложных состояниях, характеризующихся продолжающимся кровотечением, падением систолического артериального давления ниже 100 мм рт. ст., несмотря на введение коллоидных растворов. При этом риск от гипотензии может превышать риск от потери самой крови. В этих ситуациях оправдано установление мочевого катетера для того, чтобы мониторировать состояние гемодинамики количеством выделяемой мочи. Ведение больных с кровотечением из пищеварительного тракта требует участия специалистов разного профиля.
Основанием к госпитализации больного в палату реанимации является наличие признаков массивного кровотечения: выраженная бледность кожи и слизистых оболочек, холодные конечности, пульс свыше 100 уд./мин, систолическое артериальное давление ниже 100 мм рт. ст., особенно у больных с высоким риском смерти, повторяющиеся кровотечения, низкое центральное венозное давление (меньше 100 мм вод. ст.).
Выявление места кровотечения
Если при экстренной эндоскопии не удалось установить источник кровотечения, то с этой же целью исследование повторяется после проведения неотложных мероприятий, с интервалом 12—24ч. Если повторное эндоскопическое исследование проводится в более поздние сроки, то признаки кровотечения будет обнаружить труднее. При наличии расширенных вен пищевода повторная эндоскопия проводится в первые четыре часа.
При профузном кровотечении его источник определить трудно, желудочное орошение проводить рискованно в связи с возможным разрушением уже образовавшегося тромба, и поэтому показания к повторному эндоскопическому исследованию основываются на динамическом наблюдении за больным (пульс, АД, венозное давление, диурез и. др.). Результаты наблюдения оцениваются каждые 4 ч. Коагуляционные исследования повторяются, если было проведено четыре гемотрансфузии, другие исследования крови ежедневно повторяются только у больных с высоким риском повторного кровотечения (необходимо иметь запасы крови еще в течение 48 ч).
Медикаментозная терапия
Медикаментозные средства не являются альтернативными в лечении острых кровотечений, если показана операция, но они могут способствовать остановке кровотечения и предупредить его рецидив. Эффективность медикаментозного лечения определяется многими обстоятельствами, но независимо от них оправдано назначение ранитидина (зантак), омепразола (лосек) или фамотидина (квамател). Один из них вводится в/в (зантак по 50 мг, квамател по 20 мг, лосек по 40 мг) в течение 2—5 мин 3 раза в сутки с интервалами в 8 ч до 3 сут. При этом уменьшается риск возникновения стрессовых язв и рецидива кровотечения, но не останавливается продолжающееся кровотечение. После прекращения в/в введения антисекреторного препарата при эрозивно-язвенных кровотечениях оправдано назначение его внутрь (ранитидина по 150 мг, или фамотидина по 20 мг 3 раза вдень, или омепразола по 20 мг 2 раза в день).
Эндоскопическая терапия проводится в зависимости от источника кровотечения:
1. Склеротерапия вен пищевода при их варикозном расширении.
2. Инъекция жидкого фибриногена или инстиляция жидким тромбином в зоне язвы.
3. Лазерная фотокоагуляция.
4. Диатермокоагуляция.
В силу недостаточной эффективности не рекомендуется промывание желудка ледяной водой, применение вазоконстрикторов (адреналин и др.) и антацидов. Подтвержден гемостатический эффект соматостатина при язвенных кровотечениях, омепразола и сукральфата при геморрагическом гастрите, синестрола при наследственных телеангиоэктазиях.
Соматостатин (сандостин) угнетает секрецию желудочного и панкреатического сока, снижает кровоток в органах -брюшной полости, что способствует остановке язвенного кровотечения и кровотечения из расширенных вен пищевода. Вводится в/в капельно по 250 мкг/час до наступления аффекта.
При геморрагическом гастрите омепразол назначается дважды в сутки по 20 мг с интервалами в 12 ч в сочетании с сукральфатом (12-16 г в сут.) в течение нескольких дней с последующим снижением суточной дозы омепразола до 20 мг, а сукральфата до 4 г.
Синестрол вводят в/м ежедневно по 1 мл 2%-го масляного раствора в целях профилактики повторных эпизодов кровотечений из наследственных телеангиоэктазий.
Повторные кровотечения значительно повышают риск смерти.
К признакам повторно возникшего кровотечения относят:
1. Увеличение частоты пульса (ранний и высокочувствительный признак).
2. Падение центрального венозного давления.
3. Снижение часового выделения мочи.
4. Кровавая рвота или мелена.
5. Снижение систолического артериального давления (поздний признак).
6. Бледность кожи и видимых слизистых оболочек, холодный липкий пот.
Показания к хирургическому лечению при рецидиве кровотечения зависят от диагноза и его причины. Единственным показанием к оперативному вмешательству является тяжесть продолжающегося или повторно возникшего кровотечения несмотря на адекватные лечебные мероприятия, включая гемотрансфузии (6 трансфузий лицам моложе 60 лет), эндоскопические манипуляции и адекватную медикаментозную терапию. При отсутствии повторного кровотечения обнаружение при эндоскопическом исследовании на дне язвы свежего тромба или сосуда не является показанием для операции. Такие больные нуждаются в наблюдении.
Также кровотечения из верхних отделов ЖКТ возникают при:
Расширенных венах пищевода
Синдроме Мэллори-Вейсса
Эрозии желудка и геморрагическом гастрите
Аортодуоденальной фистуле
3) Сколио́з (греч. σκολιός — «кривой», лат. scoliōsis) — трёхплоскостная деформация позвоночника у человека. Искривление может быть врождённым или приобретённым.
Содержание
[убрать]
1Терминология
2Классификация
3Сколиотическая болезнь
3.1Этиология
3.2Виды сколиоза
3.3Диагностика
3.4Лечение
3.4.1Консервативная терапия
3.4.2Хирургическое лечение
3.5Сколиоз и беременность
3.6Сколиоз и армия
4См. также
5Примечания
6Ссылки
Терминология[править | править вики-текст]
Исторически сложилось, что на постсоветском пространстве сколиозом называют как любое отклонение позвоночника во фронтальной плоскости, фиксированное или не фиксированное, так и медицинский диагноз, описывающий серьезное заболевание позвоночника — т. н. «сколиотическую болезнь».
Сколиотическая болезнь — прогрессирующее (то есть ухудшающееся) диспластическое заболевание растущего позвоночника детей в возрасте от 6—15 лет, чаще девочек (в 3—6 раз)[1].
Сколиотическая болезнь — боковое искривление позвоночника с обязательной ротацией тел позвонков (торсией), характерной особенностью которого является прогрессирование деформации, связанное с возрастом и ростом ребёнка.
За пределами бывшего СССР сколиотическую болезнь называют идиопатическим сколиозом или быстропрогрессирующим сколиозом.
Классификация[править | править вики-текст]
Классификации сколиоза:
по происхождению;
по форме искривления:
С-образный сколиоз (с одной дугой искривления). S-образный сколиоз (с двумя дугами искривления). Z- образный сколиоз (с тремя дугами искривления).;
по локализации искривления;
рентгенологическая классификация (по В. Д. Чаклину):
1 степень сколиоза. Угол сколиоза 1° — 10°. 2 степень сколиоза. Угол сколиоза 11° — 25°. 3 степень сколиоза. Угол сколиоза 26° — 50°. 4 степень сколиоза. Угол сколиоза > 50°.;
по изменению степени деформации в зависимости от нагрузки на позвоночник;
по клиническому течению.
80 % сколиозов имеют неизвестное происхождение, и потому называются идиопатическими (греч. ἴδιος — собственный + πάθος — страдающий), что примерно означает «болезнь сама по себе».
За рубежом широко применяется классификация по возрасту больного на момент диагностики заболевания.
Сколиотическая болезнь[править | править вики-текст] Этиология[править | править вики-текст]
Сколиоз причисляется к деформациям периода роста. Он начинается и ухудшается (прогрессирует) в юности, во время усиленного роста тела, к примеру, в пубертатные скачки роста. Примерно в 80 % всех случаев причина возникновения искривлений неизвестна. Эти сколиозы называют идиопатическими, (что в переводе с греческого означает «неизвестной причины»). Такой сколиоз встречается у девочек в примерно 4—7 раз чаще, чем у мальчиков. Идиопатический сколиоз не имеет ничего общего с так называемым «младенческим сколиозом», который проявляется до года жизни и при котором нет аномалий развития тел отдельных позвонков (в отличие от врождённого сколиоза). «Младенческий сколиоз» может исчезать сам по себе. Идиопатический сколиоз возникает в основном в фазы ускоренного роста скелета.
Оставшиеся 20 % сколиозов возникают вследствие врождённых деформаций позвонков, как к примеру синдром Клиппеля-Файля, заболеваний нервно-мышечной системы, как например полиомиелит, заболевания соединительных тканей, обмена веществ костей, после травм и ампутаций вследствие несчастных случаев или операций по удалению злокачественных опухолей, а также у детей после операций на сердце или из-за выраженной разницы длины ног.
Виды сколиоза[править | править вики-текст]
В сложившейся мировой практике сколиозы различают по разнице во времени их проявления (манифестации) в типичные скачки роста:
инфантильными идиопатическими сколиозами называются сколиозы, появившиеся между первым и вторым годом жизни;
ювенильными идиопатическими сколиозами называются сколиозы, появившиеся между четырьмя годами и шестью;
адолесцентными (подростковыми) идиопатическими сколиозами называются сколиозы, возникающие в основном между десятью и четырнадцатью годами.
По различным локализациям искривлений различают:
торакальный сколиоз — искривление только в грудном отделе позвоночника;
люмбальный сколиоз — искривление только в поясничном отделе позвоночника;
тораколюмбальный сколиоз — одно искривление в зоне грудопоясничного перехода;
комбинированный сколиоз — двойное S-образное искривление.
Диагностика[править | править вики-текст]
В ранних стадиях искривления выявляются лучше всего тестом «в наклоне». При этом пациент наклоняется вперёд со свободно опущенными руками. Проверяющий смотрит сзади на позвоночник и отмечает асимметрию — выступающее ребро, возвышающиеся с одной стороны ребра или лопатку, искривления позвоночника. Величина искривления позвоночника измеряется с помощью рентгеновского снимка всего позвоночника стоя. Возможны и врождённые реберные деформации и деформации тел позвонков. С помощью этой информации можно отличить идиопатический и врождённый сколиоз. На рентгеновском снимке в боковой проекции можно также определить, есть ли врождённые деформации в этой плоскости или нарушения нормальных изгибов позвоночника — физиологических кифозов и лордозов.
Схема анализа рентгеновского снимка для определения угла искривления разработана американским ортопедом Дж. Коббом (англ. John Robert Cobb). Угол искривления, измеренный по рентгеновским снимкам называется «углом по Коббу». Для определения угла деформации на передне-задней рентгенограмме проводят две линии, параллельных замыкательным пластинкам нейтральных позвонков. В точке пересечения этих линий измеряют угол сколиоза.
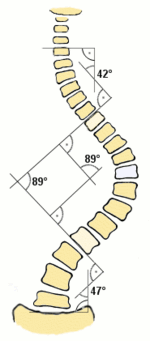
методика измерения дуги искривления по Коббу
Важно, кроме того, определить ротацию и торсию сколиоза. Ротация это остаточный разворот тел позвонков в покое относительно друг друга, а торсия — скручивание вдоль оси собственно костной ткани отдельного позвонка. Для определения торсии и ротации используется простая методика Нэша и Мо (англ. Clyde Lester Nash, John H. Moe), или более точная — Раймонди (англ. Anthony John Raimondi).
Поскольку состояние сколиотического позвоночника часто, особенно в период полового созревания, значительно ухудшается, для контроля нужно чаще использовать и безвредные нелучевые методики, например, сколиометрию по Буннеллю (англ. William P. Bunnell), трехмерное светотоптическое измерение профиля спины, трехмерное исследование позвоночника контактным или ультразвуковым сенсором, визуальный и фотоконтроль у ортопеда.
Кроме этого, для снижения дозы рентгеновского облучения применяются снимки с низким облучением, т. н. «low dose»-снимки. При них сокращено время облучения пациента и снимок подходит только для определения углов искривления. Также используется прикрытие зон молочных желез круглыми свинцовыми экранами соответственно размеру железы.
С увеличением искривления возрастает тенденция к ухудшению проблем общего состояния здоровья. Сильные сколиозы являются причиной деформации туловища и его укорочения и вместе с этим приводят к уменьшению объема грудной клетки и брюшной полости, что ведёт ограничению функции внутренних органов вплоть до сокращения срока жизни при очень сильных деформациях.
Исходя из этого, сколиозы должны регулярно наблюдаться компетентным в проблеме врачом и при прогрессировании своевременно и адекватно лечиться. При подозрении на другие (не идиопатические) причины сколиоза должна быть сделана магнитно-резонансная томография всего позвоночника.
Дополнительно к вышеназванным методикам обследований необходимы следующие мероприятия:
измерение роста стоя и сидя;
взвешивание;
измерение объема лёгких (спирометрия).
Данные мероприятия очень важны для определения тяжести искривления и назначения оптимальной терапии.
Лечение[править | править вики-текст]
В сложившейся европейской практике в соответствии с тяжестью сколиоза в качестве экономически эффективных лечебных мер применяется: специализированная антисколиозная гимнастика (гимнастика по методу Катарины Шрот или аналогичные ей «дыхательные» гимнастики), корсетотерапия различными корсетами по принципу Эббота-Шено, или операция по установке фиксирующих между собой тел позвонков металлических конструкций и аутотрансплантантов, т. н. «спондилодез» или «fusion»-закрепление.
Консервативная терапия[править | править вики-текст]
Бескровное (консервативное) эффективное лечение сколиозов в европейской практике в настоящее время представляет собой специализированную антисколиозную гимнастику по Шрот и корсетотерапию по принципу Эббота-Шено. Сколиотическое нарастание осанки (до 15°) без ротации должно лечиться специализированной гимнастикой. С 15—20° с ротацией используется гимнастика и корсеты (по крайней мере, на ночь).
Прогрессирующие сколиозы более 20—25° должны лечиться деротирующим корсетом, качественно сделанным по принципу Эббота-Шено с минимальным временем ношения 18 часов в сутки (следует стремиться к ношению корсета 23 часа в сутки, это значит, что корсет снимается только на время гигиенических процедур и гимнастику) и интенсивной гимнастики по Шрот или аналогичных. К этому, по возможности, рекомендуется стационарное лечение — интенсивная реабилитация в одной из узкоспециализированных клиник, фокусирующихся на консервативном лечении сколиоза и деформаций позвоночника.
При положительных предпосылках (высококачественный корсет с сильной первичной коррекцией дуги на рентгеновском снимке в корсете, хорошей мотивации пациента к ношению корсета и ежедневному выполнению специализированной гимнастики) можно добиться в подростковом возрасте полного исправления лишь с помощью неинвазивного лечения. Границы применения вышеназванных методов зависят от величины искривления, степени зрелости костей и от доступности и качественности проводимого лечения.
Хирургическое лечение[править | править вики-текст]

Рентгеновский снимок позвоночника в корсете после операции из заднего доступа с установленной металлической конструкцией и выполненнымспондилодезом

Рентгеновский снимок позвоночника после операции из переднего доступа. Металлическая конструкция установлена от 12-го грудного до 2-го поясничного позвонков.
Исходные (начальные) показания к операции меняются в зависимости от возраста и психологических проблем пациента, локализации и вида его искривления, школы и опыта конкретного хирурга, а также результативности доступного корсетного лечения и лежат между 45° и 70° по Коббу, если все возможности доступного консервативного лечения исчерпаны и не принесли достаточного успеха.
При поздно начавшемся (подростковом) идиопатическом сколиозе и его медленной прогрессии операция, как правило, не является необходимой с медицинской точки зрения.
При оперативном лечении позвоночник выпрямляется до определённого угла при помощи металлических стержней, что ведёт к обездвиживанию этих отделов позвоночника. Операция при сколиозе подходит прежде всего для сильных искривлений, которые больше не могут лечиться другими методами. Оперативная фиксация может предотвратить дальнейшую прогрессию и ухудшение состояния.
Оптимальный возраст, в котором исправляющие деформацию операции будут оправданы и эффективны, начинается с 13-15 лет. В противном случае за счёт активного роста костей пациента исправляющие фиксирующие системы могут привести к нежелательным последствиям.
Существуют два основных типа операций при сколиозе: операции с задним и передним доступом.
Оперативный разрез при заднем доступе находится на средней линии туловища и одном из крыльев тазовой кости. Используются различные системы металлических стержней, которые крючками или шурупами (т. н. педикулярными винтами) прикрепляются к позвоночнику и затем изменяют его кривизну на больших участках. Для лучшей стабилизации всей конструкции стержни имеют поперечные соединения (мостики). Сразу после операции теряется подвижность в зафиксированных отделах позвоночника. Это способствует впоследствии сращению тел позвонков в единый костный блок желаемой геометрии. Недостаток метода состоит в том, что позвоночник на больших участках оказывается обездвижен, и общая подвижность позвоночного аппарата ограничена, что вынуждает пациента менять привычные стереотипы движений.
При операции с передним доступом разрез делается вдоль ребер сбоку. При этом одно ребро удаляется и используется позже в размельченном виде как собственный костный материал для фиксации. Он будет вводиться в пространства между позвонками вместо удалённых дисков. После вскрытия грудной и брюшной полости позвоночник освобождается так, чтоб хирург имел свободный доступ к позвонкам и межпозвонковым дискам. Для коррекции в определённых сегментах удаляют диски и сбоку в корригируемые позвонки вводят шурупы. Их соединяют стержнем и после коррекции прикрепляют к нему. На место вынутых дисков вводят подготовленный костный материал. При современной методике операции для лучшей стабильности применяют два стержня, если это позволяет состояние позвоночника. Недостаток этой методики — вскрытие брюшной и грудной полостей. Кроме того, иногда необходимо после операции определённое время носить корсет, для закрепления достигнутого результата.
Результаты операций с передним доступом выглядят лучше в косметическом плане и функционально предпочтительнее. Операция с заднего доступа сегодня обычно не требует заключительного ношения корсета, но без дополнительной резекции реберного горба её результаты в косметическом плане недостаточны.
Общий риск осложнений операции при идиопатическом сколиозе по германским данным[источник не указан 1153 дня] определяется примерно в 5 %. Возможные осложнения — воспаления органов дыхания, ограничение дыхания, повторные кровотечения, травмы нервной системы. К примеру, в Германии считается, что в больших оперативных центрах риск определяется как очень умеренный и операции протекают относительно без осложнений.
19 Билет
Динамическая непроходимость кишечника - вид кишечной непроходимости, при которой нарушение пассажа по кишечнику обусловлено дискоординациею кишечной перистальтики или ее парезом.
Этиология динамической непроходимости кишечника
Функциональная неполноценность кишечника на фоне поражений головного мозга, сепсиса или других тяжелых соматических заболеваний.
Классификация динамической непроходимости кишечника
Паралитическая форма - обусловлена в основном гипокалиемией. Спастическая форма.
Клиника динамической непроходимости кишечника
1. Повторная рвота с примесью мелены. 2. Нарастающее вздутие живота. 3. Отсутствие стула и газов. 4. Выраженная интоксикация. 5. Мягкий живот при отсутствии перистальтики.
Диагностика динамической непроходимости кишечника
При обзорной рентгенографии брюшной полости - многочисленные небольшие чаши Клойбера, расположенные арками.
Лечение динамической непроходимости кишечника
Устранение непосредственных причин непроходимости и борьба с парезом кишечника: 1. Стимуляция перистальтики (очистительные, сифонные и гипертонические клизмы, электростимуляция кишечника, применение прозерина). 2. Устранение гипокалиемии. 3. Разгрузка желудочно-кишечного тракта (постоянный назогастральный зонд, интубация кишечника).
2) Портальная гипертензия
Портальная гипертензия (ПГ) развивается в результате одновременного взаимодействия двух факторов: повышения оттока венозной крови из портальной системы, с одной стороны, и увеличение притока крови в портальную систему — с другой.
С физиологической точки зрения следует отличать портальную гипертензию, при которой паренхима печени находится под воздействием высокого портального давления (паренхиматозная форма), от портальной гипертензии, при которой высокое портальное давление не оказывает непосредственного воздействия на паренхиму печени (непаренхиматозная форма).
Разделение портальной гипертензии на паренхиматозную и непаренхиматозную формы позволяет лучше понять физиологические последствия заболевания.

При непаренхиматозной портальной гипертензии обструкция току крови расположена до синусоидой печени. Функция печени при этом практически не нарушена, асцит и коагулопатия развиваются очень редко, кровотечение из вен кардии переносится больными относительно легко, а прогноз заболевания в целом хороший. При паренхиматозной портальной гипертензии обструкция току портальной крови расположена позади синусоидов печени. Это приводит к структурному и функциональному их повреждению и ухудшению кровоснабжения гепатоцитов. Вследствие этого нарушается синтетическая функция печени, имеется тенденция к развитию асцита, коагулопатии, труднопереносимым пищеводным кровотечениям и печеночной недостаточности.
Сопротивление току портальной крови может локализоваться над печенью, внутри нее и под печенью. С этой точки зрения все формы портальной гипертензии разделяют на надпеченочную, внутрипеченочную и внепеченочную.
Надпеченочная портальная гипертензия. Нарушение венозного оттока от печени (синдром Бадда—Хиари) может возникать в результате порока развития или тромбоза нижней полой вены или тромбоза печеночных вен. Портальная гипертензия и нарушение функции печени развиваются вследствие венозного застоя в печени.
Внутрипеченочная портальная гипертензия. Любое хроническое заболевание печени, которое приводит к фиброзу или циррозу, может стать причиной внутрипеченочной портальной гипертензии. При большинстве вариантов цирроза узлы регенерации затрудняют отток крови от синусоидов, приводя к постсинусоидальной обструкции. Наиболее частыми причинами внутрипеченочной портальной гипертензии являются постнекротический цирроз после перенесенного вирусного гепатита, атрезия желчных путей, болезнь Вильсона, дефицит альфа-1-антитрипсина и др. Как правило, развитие портальной гипертензии сопровождается признаками дисфункции печени — желтухой, асцитом, задержкой развития ребенка и др.
Портальная гипертензия при врожденном фиброзе печени развивается в результате пресинусоидального блока. При этом заболевании портальные тракты увеличиваются за счет разрастания соединительной ткани и пролиферации желчных ходов. Так как этот тип фиброза приводит к развитию пресинусоидального блока, синтезирующая функция печени остается практически неизменной.
Внепеченочная портальная гипертензия. У подавляющего числа детей эта форма портальной гипертензии является результатом непроходимости воротной вены. Почти у половины детей с внепеченочной портальной гипертензинй можно отметить в период новорожденности катетеризацию пупочном вены, омфалит, внутрибрюшные инфекции, сепсис или дегидратацию. Однако у половины детей точный этиологический фактор не может быть выявлен. Непроходимость воротной вены сопровождается развитием сети коллатералей в воротах печени, получивших название «кавернозной фансформации воротной вены».
У детей чаще встречается внепеченочная ПГ.
Клиника. Клинические проявления портальной гипертензии в значительной степени однотипны и не зависят от ее генеза. Однако при каждом заболевании можно отметить ряд особенностей, помогающих уже клинически выявить форму портальной гипертензии.
При внепеченочной портальной гипертензии первые симптомы повышения портального давления появляются в раннем детстве. К ним следует отнести увеличение живота, необъяснимую диарею, гипертермию неясного генеза, спленомегалию и появление подкожных кровоизлияний на нижних конечностях. При лабораторном исследовании крови обнаруживают признаки панцитопении со снижением числа эритроцитов, лейкоцитов и тромбоцитов ниже нормальных границ (гиперспленизм). Внезапное кровотечение из вен пищевода и кардии часто бывает самым первым проявлением внепеченочной портальной гипертензии у внешне здоровых детей. У 80% больных внепеченочной портальной гипертензией первые кровотечения появляются в первые 6 лет жизни. Изменения функциональных показателей печени, как правило, незначительны или отсутствуют. Асцит у детей с внепеченочной портальной гипертензии появляется только в первые дни после перенесенного кровотечения.
При внутрипеченочной портальной гипертензии симптомы повышения портального давления наслаиваются на клинические проявления цирроза печени и возникают через 5—7 лет после перенесенного вирусного гепатита. В клинической картине у больных с внутрипеченочной портальной гипертензии на первое место выступают симптомы поражения печени. Больные жалуются на слабость, повышенную утомляемость, исхудание, боль в животе, чувство тяжести в эпигастральной области, диспепсические явления, повышенную кровоточивость. Размеры и консистенция печени зависят от стадии заболевания. В начальных стадиях печень умеренно увеличена, плотная, поверхность ее гладкая, в поздних стадиях — обычно не увеличена, нередко даже уменьшена, очень плотная, с бугристой поверхностью. В большинстве случаев отмечается увеличение селезенки различной степени выраженности с развитием признаков гиперспленизма. При лабораторных исследованиях обнаруживают нарушение функции печени — гипербилирубинемию с преобладанием прямой фракции, уменьшение количества белка сыворотки крови со снижением альбумин-глобулинового коэффициента, ухудшение антитоксической функции печени. Однако изменение этих показателей не всегда идет параллельно развитию портальной гипертензии, что связано с большими компенсаторными возможностями печени и неспецифичностью так называемых печеночных проб. Проявления портальной гипертензии — асцит и кровотечения из вен пищевода и кардии — отмечаются, как правило, при достижении больным подросткового возраста.
Диагностика. Диагноз портальной гипертензии может быть установлен на основании ультразвукового исследования брюшной полости и допплерографии висцеральных вен. Характерными признаками внепеченочной портальной гипертензии являются кавернозная трансформация воротной вены и нормальная структура печени. При паренхиматозной портальной гипертензии печень уплотнена, воротная вена хорошо проходима. При надпеченочной портальной гипертензии отмечается непроходимость печеночных вен или нижней полой вены. При допплерографии при всех формах портальной гипертензии отмечается значительное снижение средней скорости кровотока в висцеральных венах. Для паренхиматозных форм портальной гипертензии характерен гипердинамический тип висцерального кровообращения.
При эзофагогастродуоденоскопии у детей с портальной гипертензией обнаруживаются варикозные вены пищевода и кардиального отдела желудка, а также признаки гипертензионной гастропатии. Вены пищевода и кардии являются практически единственным источником кровотечений у детей с портальной гипертензией. Кровотечения из других вен желудочно-кишечного тракта у детей встречаются исключительно редко.
В сомнительных случаях или при планировании хирургического лечения необходимо проведение висцеральной ангиографии.
Венозная фаза верхнебрыжеечной артериографии при внепеченочной портальной гипертензии.

Воротная вена представлена сетью коллатералей. Виден ретроградный ток портальной крови в вены желудка и пищевода.
Дигитальная субтракционная ангиография дает наиболее полную информацию об анатомии висцеральных вен.
Венозная фаза верхнсбрыжсечной артериографии при циррозе печени.

Воротная вена расширена. Портальный кровоток печени резко обеднен. Виден ретроградный ток крови по левой желудочной вен с в вены желудка и пищевода.
Пункционная биопсия печени показана для определения стадии цирроза или дифференциального диагноза цирроза печени с другими формами паренхиматозной портальной гипертензии.
Лечение детей с пищеводными кровотечениями в острой стадии включает: седативную терапию, назогастральный зонд для аспирации желудочного содержимого и инфузионную терапию кристаллоидными растворами и препаратами крови в объеме 50% от необходимой суточной потребности.
Идеальный способ лечения портальной гипертензии в настоящее время не разработан. Основной задачей хирургического лечения портальной гипертензии является ликвидация и предотвращение кровотечений из варикозных вен пищевода и желудка. Резко выраженная спленомегалия или выраженный гиперспленизм могут быть отдельным показанием к манипуляциям па селезенке. У детей с паренхиматозной портальной гипертензии показанием к хирургическому лечению может быть асцит, резистентный к консервативной терапии.
Методы лечения портальной гипертензии значительно отличаются в зависимости от формы портальной гипертензии, наличия и выраженности пищеводных кровотечений, а также уровня подготовки лечебного учреждения, где больной проходит курс лечения.
Современные методы оперативного лечения портальной гипертензии у детей включают выполнение различных портосистемных анастомозов или операции, непосредственно воздействующих на варикозные вены пищевода и желудка. Широкое распространение в настоящее время получила эндоскопическая склеротерапия или эндоскопическое лигирование вен пищевода и кардии. Для ликвидации спленомегалии и гиперспленизма в настоящее время используют эндоваскулярную эмболизацию паренхимы органа вместо спленэктомии. Все большую роль для лечения терминальных стадий цирроза печени играет пересадка печени.
3) Повреждения селезенки
Выделяют открытые и закрытые повреждения. Открытые повреждения могут быть
трансабдоминальными и трансторакальными, а по характеру ранящего предмета --
огнестрельными, колото-резаными и др. При этом у большинства больных отмечают
повреждение соседних органов брюшной или грудной полости -- желудка, толстой
кишки; поджелудочной железы, почки, диафрагмы, левого легкого. Клиническая
картина открытого повреждения селезенки зависит от характера самого ранения, от
характера повреждения соседних органов. На первое место выступают симптомы
внутреннего кровотечения и шока (бледность кожного покрова, тахикардия,
снижение артериального давления, снижение уровня гемоглобина и гематокрита,
ОЦК). По мере излияния крови в брюшную полость присоединяются симптомы
раздражения брюшины, а при трансторакальных ранениях -- симптомы гемоторакса. При
скоплении крови в поддиафрагмальном пространстве нередко наблюдают симптом
"ваньки-встаньки", когда больной принимает вынужденное полусидячее положение
вследствие массивного раздражения нервных рецепторов диафрагмальной брюшины.
Значительные количества излившейся крови в брюшную полость можно определить
перкуторно. Пальпаторно определяют напряжение мышц передней брюшной стенки,
положительный симптом Щеткина--Блюмберга. В связи с высокой частотой сочетания
открытой травмы селезенки с повреждениями других органов грудной и брюшной
полости клиническая картина заболевания может меняться с преобладанием тех или
иных симптомов -- внутреннего кровотечения, разрыва полого органа с развитием
разлитого перитонита, забрюшинной гематомы, шока, гемопневмоторакса и легочной
недостаточности.
Значительные трудности в диагностике могут возникнуть при изолированном
повреждении селезенки, когда нет бурной клини ческой картины кровотечения. В
такой ситуации весьма информа тивными могут оказаться экстренная лапароскопия, а
при технической невозможности ее выполнения -- лапароцентез с введением в
брюшную полость "шарящего" катетера. При этом для обнаружения крови производят
фракционное промывание брюшной полости. При получении крови по катетеру следует
думать о повреждении селезенки.
Лечение заключается в экстренном хирургическом вмешатель стве, целью которого
является надежный гемостаз и предупреждение инфицирования брюшной полости. Чаще
выполняют спленэктомию. Современные представления о многочисленных важных функ
циях селезенки значительно сузили показания к выполнению спленэктомии. При
небольших повреждениях, особенно в области одного из ее полюсов, при
поверхностных повреждениях можно применить шов селезенки с использованием для
предотвращения прорезывания швов участка большого сальника или синтетических
материалов, резекцию одного из полюсов, перевязку селезеночной артерии.
Закрытые повреждения селезенки возникают при тупой травме живота, падении с
высоты. Описаны спонтанные разрывы нормальной селезенки. Спонтанные разрывы
чаще наблюдают при различ ных заболеваниях, сопровождающихся увеличением
селезенки и изменением ее структуры (малярии, инфекционном мононуклеозе). Особое
место занимают ятрогенные случайные повреждения селезенки во время операций на
органах верхней части брюшной по лости (гастрэктомия, резекция желудка, резекция
поджелудочной железы и др ).
При тупой травме живота выделяют одномоментный и двухмо ментный разрывы
селезенки При одномоментном разрыве с самого начала имеется дефект капсулы
селезенки и в этом случае на первое место выступают симптомы внутреннего
кровотечения большей или меньшей интенсивности. При двухмоментном разрыве
вначале образуется подкапсульная гематома, без нарушения целостности капсулы и
лишь спустя некоторое время (от нескольких дней до нескольких недель) под
влиянием даже незначительной физической нагрузки возникает разрыв капсулы
селезенки с опорожнением ге матомы в брюшную полость и развитием внутреннего
кровотече ния. Такой механизм разрыва селезенки при ее закрытом поврежде нии
наблюдают почти у 15% пострадавших. В этом случае диагноз может представлять
определенные трудности Важная роль принадлежит тщательно собранному анамнезу с
выяснением факта закры той травмы живота.
Клиническая картина при тупой травме живота с повреждением селезенки, как и при
ее открытых повреждениях, зависит от соче танных травм других органов брюшной
полости. Характерными рентгенологическими признаками разрыва селезенки и
внутреннего кровотечения являются оттеснение газового пузыря желудка ме диально,
высокое стояние левого купола диафрагмы, наличие свободной жидкости между
заполненными газом петлями кишки. Примерно у 25--27% больных наблюдаются
переломы нижних ребер слева.
В диагностическом отношении наиболее ценными методами исследования являются
лапароскопия и лапароцентез с использованием "шарящего" катетера.
Лечение закрытых повреждений селезенки хирургическое. Характер вмешательства
такой же, как и при ее открытых травмах При двухмоментных разрывах селезенки
операцией выбора является спленэктомия.
20 Билет
Врожденные свищи пупка образуются в результате незаращения желточ
ного протока (ductus vitellinus) и мочевого протока (urachus). При незараще-
нии желточного протока в области пупка образуется кишечно-пупочный
свищ, из которого выделяется кишечное содержимое (полный свищ), сли-
зисто-гнойное отделяемое (неполный свищ). Иногда через полный свищ
выпадает слизистая оболочка кишки (рис. 9.3).
При н е з а р а щ е н и и м о ч е в о г о п р о т о к а в области пупка образу
ется пузырно-пупочный свищ. В этом случае моча выделяется через свищ в
области пупка, особенно при крике или плаче ребенка.
Диагностические трудности
возникают при частичном не-
заращении желточного и моче
вого протоков, так как отде
ляющие слизь и гной свищи
принимают за незаживающий
гранулирующий дефект на
месте отторжения пуповины.
От врожденных свищей
следует отличать приобретен
ный пупочный свищ, когда,
перевязывая пуповину при
грыже пупочного канатика в
лигатуру, захватывают стенку
выпавшей кишки.
Лечение. В обоих случаях
свищи иссекают, дефекты в
стенках кишки и мочевого пу
зыря ушивают.
Острые воспалительные про
цессы брюшной стенки бывают
первичными и вторичными. К
первичным относят нагноение
в подкожной жировой клетчат
ке и флегмону в области влага
лища прямой мышцы живота.
Вторичные воспалительные
процессы могут быть следст
вием перехода воспаления на
брюшную стенку (при тубер
кулезе или остеомиелите кос
тей таза, натечных абсцессах,
паранефрите и др.).
Специфические воспали
тельные процессы брюшной
стенки (актиномикоз, тубер
кулез, сифилис) встречаются
крайне редко.
Лечение. Вначале применяют
антибиотики, тепло. При по
явлении признаков нагноения
показано вскрытие гнойника.
2) Аномалии почек
врожденные пороки в развитии почек. Различают следующие возможные анатомические аномалии.
Аплазия (агенезия) почки — отсутствие почки с одной или двух сторон в связи с отсутствием ростка мочеточника от первичных почек. Клинически до заболевания единственной почки не проявляется. Устанавливается с помощью экскреторной урографии или ультразвуковой эхолокации.
Гипоплазия почки — уменьшение размеров почки. Одновременно при этом бывает и дисплазия почечной ткани, а также недоразвитие чашечно-лоханочной системы. Функция почки длительное время может быть сохранена. Однако при такой структурной аномалии всегда есть предрасположенность к развитию интерстициального нефрита или пиелонефрита, которые затем приводят к нарушению функции почки. Диагноз устанавливается на основании данных экскреторной урографии, почечной ангиографии, ультразвукового исследования почек, радиоренографии.
Удвоение почек — наличие двух и более мочеточников, отходящих от разных частей почки. При полном удвоении почки в каждой из ее половин имеется отдельная чашечно-лоханочная система, от которой отходит мочеточник, открывающийся непосредственно в мочевой пузырь или сливающийся на каком-либо уровне с другим мочеточником. Чашечно-лоханочная система в таких случаях обычно недоразвитая, имеются препятствия для оттока мочи, что предрасполагает к развитию гидронефроза, пиелонефрита, нефролитиаза и др. Диагноз помогает установить экскреторная урография, ультразвуковое исследование почек.
Дистопия почки — необычное расположение почки. Встречаются дистопии: тазовая, поясничная, подвздошная, торакальная и перекрестная. - В случае тазовой дистопии почка расположена между прямой кишкой и мочевым пузырем или прямой кишкой и маткой у женщин. При этом могут периодически нарушаться функции рядом лежащих органов. - При поясничной дистопии почка находится низко в поясничной области и легко пальпируется в подреберье. Необходимо дифференцировать С опухолью и нефроптозом. - Подвздошная дистопия — почка располагается в подвздошной ямке. Ее можно легко прощупать в нижней части живота. Дифференцируют с опухолью или кистой. - При торакальной дистопии почка обнаруживается в грудной клетке над диафрагмой. - В случае перекрестной дистопии почка смещена за среднюю линию и почти всегда сращена с почкой противоположной стороны.
Большинство дистопий встречаются редко. Наличие их может проявиться болевым синдромом в результате давления почки на рядом лежащие органы или присоединения в связи с затруднением оттока мочи таких осложнений, как пиелонефрит, гидронефроз и др. Во всех случаях дистопий диагноз устанавливается с помощью рентгенологических методов исследования (экскреторной урографии, почечной ангиографии), ультразвуковой эхотомоскопии.
Гемолитико - уремический синдром.
Чаще встречается у детей первых лет жизни, Проявляется острой гемолитической анемией, тромбоцитопенией, распространенным поражением мелких сосудов, поражением почек и острой почечной недостаточностью. Обнаруживается связь с респираторной вирусной и кишечной инфекцией.
Основным в патогенезе заболевания является микроангиопатическая гемолитическая анемия, нарушение системы гемостаза с образованием тромбов на уровне микрососудов почек и тромбоцитопении потребления. В почках кроме распространенного тромбоза мелких сосудов и клубочковых капилляров отмечаются участки некроза коркового слоя, геморрагические и ишемические инфаркты.
Клиническая картина. Заболевание у детей часто начинается с симптомов острой респираторной вирусной инфекции или желудочно-кишечных расстройств. На фоне их или через 7—8 дней после начала болезни появляются рвота, кровавый понос, боли в животе, конечностях. Развиваются признаки токсикоза и эксикоза, резко снижается диурез. Через 2—3 дня возникает анурия. Кожа становится бледно-желтушной. Резко падает число эритроцитов, гемоглобина и тромбоцитов. Моча принимает темно-коричневый цвет. В ней обнаруживается белок, измененные эритроциты, лейкоциты, цилиндры, часто фибринные сгустки (А. В. Папаян, 1978). Заболевание протекает тяжело, быстро прогрессирует. При отсутствии эффективной помощи через 8—10 дней может закончиться летально при явлениях уремии.
Лечение направлено на ликвидацию острой почечной недостаточности, поддержание водно-электролитного равновесия, уменьшение анемии, снятие судорожного синдрома. Ребенок должен быть немедленно госпитализирован. С целью уменьшения тромбозов почечных сосудов вводится гепарин в дозах 200—300 мг/кг массы тела, назначают антиагреганты (курантил). Одновременно применяют преднизолон в дозе 2—2,5 мг/кг или другие глюкокортикоиды. При острой почечной недостаточности показаны экстракорпоральный гемодиализ, гемосорбция, плазмаферез. После выведения больного из состояния острой почечной недостаточности, прекращения гемолиза и внутрисосудистого тромбообразования принимаются меры по лечению анемии, остаточных явлений со стороны почек и других органов.
3) Сколио́з (греч. σκολιός — «кривой», лат. scoliōsis) — трёхплоскостная деформация позвоночника у человека. Искривление может быть врождённым или приобретённым.
Содержание
[убрать]
1Терминология
2Классификация
3Сколиотическая болезнь
3.1Этиология
3.2Виды сколиоза
3.3Диагностика
3.4Лечение
3.4.1Консервативная терапия
3.4.2Хирургическое лечение
3.5Сколиоз и беременность
3.6Сколиоз и армия
4См. также
5Примечания
6Ссылки
Терминология[править | править вики-текст]
Исторически сложилось, что на постсоветском пространстве сколиозом называют как любое отклонение позвоночника во фронтальной плоскости, фиксированное или не фиксированное, так и медицинский диагноз, описывающий серьезное заболевание позвоночника — т. н. «сколиотическую болезнь».
Сколиотическая болезнь — прогрессирующее (то есть ухудшающееся) диспластическое заболевание растущего позвоночника детей в возрасте от 6—15 лет, чаще девочек (в 3—6 раз)[1].
Сколиотическая болезнь — боковое искривление позвоночника с обязательной ротацией тел позвонков (торсией), характерной особенностью которого является прогрессирование деформации, связанное с возрастом и ростом ребёнка.
За пределами бывшего СССР сколиотическую болезнь называют идиопатическим сколиозом или быстропрогрессирующим сколиозом.
Классификация[править | править вики-текст]
Классификации сколиоза:
по происхождению;
по форме искривления:
С-образный сколиоз (с одной дугой искривления). S-образный сколиоз (с двумя дугами искривления). Z- образный сколиоз (с тремя дугами искривления).;
по локализации искривления;
рентгенологическая классификация (по В. Д. Чаклину):
1 степень сколиоза. Угол сколиоза 1° — 10°. 2 степень сколиоза. Угол сколиоза 11° — 25°. 3 степень сколиоза. Угол сколиоза 26° — 50°. 4 степень сколиоза. Угол сколиоза > 50°.;
по изменению степени деформации в зависимости от нагрузки на позвоночник;
по клиническому течению.
80 % сколиозов имеют неизвестное происхождение, и потому называются идиопатическими (греч. ἴδιος — собственный + πάθος — страдающий), что примерно означает «болезнь сама по себе».
За рубежом широко применяется классификация по возрасту больного на момент диагностики заболевания.
Сколиотическая болезнь[править | править вики-текст] Этиология[править | править вики-текст]
Сколиоз причисляется к деформациям периода роста. Он начинается и ухудшается (прогрессирует) в юности, во время усиленного роста тела, к примеру, в пубертатные скачки роста. Примерно в 80 % всех случаев причина возникновения искривлений неизвестна. Эти сколиозы называют идиопатическими, (что в переводе с греческого означает «неизвестной причины»). Такой сколиоз встречается у девочек в примерно 4—7 раз чаще, чем у мальчиков. Идиопатический сколиоз не имеет ничего общего с так называемым «младенческим сколиозом», который проявляется до года жизни и при котором нет аномалий развития тел отдельных позвонков (в отличие от врождённого сколиоза). «Младенческий сколиоз» может исчезать сам по себе. Идиопатический сколиоз возникает в основном в фазы ускоренного роста скелета.
Оставшиеся 20 % сколиозов возникают вследствие врождённых деформаций позвонков, как к примеру синдром Клиппеля-Файля, заболеваний нервно-мышечной системы, как например полиомиелит, заболевания соединительных тканей, обмена веществ костей, после травм и ампутаций вследствие несчастных случаев или операций по удалению злокачественных опухолей, а также у детей после операций на сердце или из-за выраженной разницы длины ног.
Виды сколиоза[править | править вики-текст]
В сложившейся мировой практике сколиозы различают по разнице во времени их проявления (манифестации) в типичные скачки роста:
инфантильными идиопатическими сколиозами называются сколиозы, появившиеся между первым и вторым годом жизни;
ювенильными идиопатическими сколиозами называются сколиозы, появившиеся между четырьмя годами и шестью;
адолесцентными (подростковыми) идиопатическими сколиозами называются сколиозы, возникающие в основном между десятью и четырнадцатью годами.
По различным локализациям искривлений различают:
торакальный сколиоз — искривление только в грудном отделе позвоночника;
люмбальный сколиоз — искривление только в поясничном отделе позвоночника;
тораколюмбальный сколиоз — одно искривление в зоне грудопоясничного перехода;
комбинированный сколиоз — двойное S-образное искривление.
Диагностика[править | править вики-текст]
В ранних стадиях искривления выявляются лучше всего тестом «в наклоне». При этом пациент наклоняется вперёд со свободно опущенными руками. Проверяющий смотрит сзади на позвоночник и отмечает асимметрию — выступающее ребро, возвышающиеся с одной стороны ребра или лопатку, искривления позвоночника. Величина искривления позвоночника измеряется с помощью рентгеновского снимка всего позвоночника стоя. Возможны и врождённые реберные деформации и деформации тел позвонков. С помощью этой информации можно отличить идиопатический и врождённый сколиоз. На рентгеновском снимке в боковой проекции можно также определить, есть ли врождённые деформации в этой плоскости или нарушения нормальных изгибов позвоночника — физиологических кифозов и лордозов.
Схема анализа рентгеновского снимка для определения угла искривления разработана американским ортопедом Дж. Коббом (англ. John Robert Cobb). Угол искривления, измеренный по рентгеновским снимкам называется «углом по Коббу». Для определения угла деформации на передне-задней рентгенограмме проводят две линии, параллельных замыкательным пластинкам нейтральных позвонков. В точке пересечения этих линий измеряют угол сколиоза.
методика измерения дуги искривления по Коббу
Важно, кроме того, определить ротацию и торсию сколиоза. Ротация это остаточный разворот тел позвонков в покое относительно друг друга, а торсия — скручивание вдоль оси собственно костной ткани отдельного позвонка. Для определения торсии и ротации используется простая методика Нэша и Мо (англ. Clyde Lester Nash, John H. Moe), или более точная — Раймонди (англ. Anthony John Raimondi).
Поскольку состояние сколиотического позвоночника часто, особенно в период полового созревания, значительно ухудшается, для контроля нужно чаще использовать и безвредные нелучевые методики, например, сколиометрию по Буннеллю (англ. William P. Bunnell), трехмерное светотоптическое измерение профиля спины, трехмерное исследование позвоночника контактным или ультразвуковым сенсором, визуальный и фотоконтроль у ортопеда.
Кроме этого, для снижения дозы рентгеновского облучения применяются снимки с низким облучением, т. н. «low dose»-снимки. При них сокращено время облучения пациента и снимок подходит только для определения углов искривления. Также используется прикрытие зон молочных желез круглыми свинцовыми экранами соответственно размеру железы.
С увеличением искривления возрастает тенденция к ухудшению проблем общего состояния здоровья. Сильные сколиозы являются причиной деформации туловища и его укорочения и вместе с этим приводят к уменьшению объема грудной клетки и брюшной полости, что ведёт ограничению функции внутренних органов вплоть до сокращения срока жизни при очень сильных деформациях.
Исходя из этого, сколиозы должны регулярно наблюдаться компетентным в проблеме врачом и при прогрессировании своевременно и адекватно лечиться. При подозрении на другие (не идиопатические) причины сколиоза должна быть сделана магнитно-резонансная томография всего позвоночника.
Дополнительно к вышеназванным методикам обследований необходимы следующие мероприятия:
измерение роста стоя и сидя;
взвешивание;
измерение объема лёгких (спирометрия).
Данные мероприятия очень важны для определения тяжести искривления и назначения оптимальной терапии.
Лечение[править | править вики-текст]
В сложившейся европейской практике в соответствии с тяжестью сколиоза в качестве экономически эффективных лечебных мер применяется: специализированная антисколиозная гимнастика (гимнастика по методу Катарины Шрот или аналогичные ей «дыхательные» гимнастики), корсетотерапия различными корсетами по принципу Эббота-Шено, или операция по установке фиксирующих между собой тел позвонков металлических конструкций и аутотрансплантантов, т. н. «спондилодез» или «fusion»-закрепление.
Консервативная терапия[править | править вики-текст]
Бескровное (консервативное) эффективное лечение сколиозов в европейской практике в настоящее время представляет собой специализированную антисколиозную гимнастику по Шрот и корсетотерапию по принципу Эббота-Шено. Сколиотическое нарастание осанки (до 15°) без ротации должно лечиться специализированной гимнастикой. С 15—20° с ротацией используется гимнастика и корсеты (по крайней мере, на ночь).
Прогрессирующие сколиозы более 20—25° должны лечиться деротирующим корсетом, качественно сделанным по принципу Эббота-Шено с минимальным временем ношения 18 часов в сутки (следует стремиться к ношению корсета 23 часа в сутки, это значит, что корсет снимается только на время гигиенических процедур и гимнастику) и интенсивной гимнастики по Шрот или аналогичных. К этому, по возможности, рекомендуется стационарное лечение — интенсивная реабилитация в одной из узкоспециализированных клиник, фокусирующихся на консервативном лечении сколиоза и деформаций позвоночника.
При положительных предпосылках (высококачественный корсет с сильной первичной коррекцией дуги на рентгеновском снимке в корсете, хорошей мотивации пациента к ношению корсета и ежедневному выполнению специализированной гимнастики) можно добиться в подростковом возрасте полного исправления лишь с помощью неинвазивного лечения. Границы применения вышеназванных методов зависят от величины искривления, степени зрелости костей и от доступности и качественности проводимого лечения.
Хирургическое лечение[править | править вики-текст]
Рентгеновский снимок позвоночника в корсете после операции из заднего доступа с установленной металлической конструкцией и выполненнымспондилодезом
Рентгеновский снимок позвоночника после операции из переднего доступа. Металлическая конструкция установлена от 12-го грудного до 2-го поясничного позвонков.
Исходные (начальные) показания к операции меняются в зависимости от возраста и психологических проблем пациента, локализации и вида его искривления, школы и опыта конкретного хирурга, а также результативности доступного корсетного лечения и лежат между 45° и 70° по Коббу, если все возможности доступного консервативного лечения исчерпаны и не принесли достаточного успеха.
При поздно начавшемся (подростковом) идиопатическом сколиозе и его медленной прогрессии операция, как правило, не является необходимой с медицинской точки зрения.
При оперативном лечении позвоночник выпрямляется до определённого угла при помощи металлических стержней, что ведёт к обездвиживанию этих отделов позвоночника. Операция при сколиозе подходит прежде всего для сильных искривлений, которые больше не могут лечиться другими методами. Оперативная фиксация может предотвратить дальнейшую прогрессию и ухудшение состояния.
Оптимальный возраст, в котором исправляющие деформацию операции будут оправданы и эффективны, начинается с 13-15 лет. В противном случае за счёт активного роста костей пациента исправляющие фиксирующие системы могут привести к нежелательным последствиям.
Существуют два основных типа операций при сколиозе: операции с задним и передним доступом.
Оперативный разрез при заднем доступе находится на средней линии туловища и одном из крыльев тазовой кости. Используются различные системы металлических стержней, которые крючками или шурупами (т. н. педикулярными винтами) прикрепляются к позвоночнику и затем изменяют его кривизну на больших участках. Для лучшей стабилизации всей конструкции стержни имеют поперечные соединения (мостики). Сразу после операции теряется подвижность в зафиксированных отделах позвоночника. Это способствует впоследствии сращению тел позвонков в единый костный блок желаемой геометрии. Недостаток метода состоит в том, что позвоночник на больших участках оказывается обездвижен, и общая подвижность позвоночного аппарата ограничена, что вынуждает пациента менять привычные стереотипы движений.
При операции с передним доступом разрез делается вдоль ребер сбоку. При этом одно ребро удаляется и используется позже в размельченном виде как собственный костный материал для фиксации. Он будет вводиться в пространства между позвонками вместо удалённых дисков. После вскрытия грудной и брюшной полости позвоночник освобождается так, чтоб хирург имел свободный доступ к позвонкам и межпозвонковым дискам. Для коррекции в определённых сегментах удаляют диски и сбоку в корригируемые позвонки вводят шурупы. Их соединяют стержнем и после коррекции прикрепляют к нему. На место вынутых дисков вводят подготовленный костный материал. При современной методике операции для лучшей стабильности применяют два стержня, если это позволяет состояние позвоночника. Недостаток этой методики — вскрытие брюшной и грудной полостей. Кроме того, иногда необходимо после операции определённое время носить корсет, для закрепления достигнутого результата.
Результаты операций с передним доступом выглядят лучше в косметическом плане и функционально предпочтительнее. Операция с заднего доступа сегодня обычно не требует заключительного ношения корсета, но без дополнительной резекции реберного горба её результаты в косметическом плане недостаточны.
Общий риск осложнений операции при идиопатическом сколиозе по германским данным[источник не указан 1153 дня] определяется примерно в 5 %. Возможные осложнения — воспаления органов дыхания, ограничение дыхания, повторные кровотечения, травмы нервной системы. К примеру, в Германии считается, что в больших оперативных центрах риск определяется как очень умеренный и операции протекают относительно без осложнений.
21 Билет
Ущемленная паховая грыжа (МКБ — 10 К40.3 – К 45.8) – частое осложнение, встречающееся в 10-20% от всех случаев заболевания. При этом происходит сдавливание органов брюшной полости или брюшины в грыжевых воротах, в паховом канале. Это анатомическое пространство, в котором у женщин находится круглая связка матки, а у мужчин – семенной канатик.
Предрасполагающим моментом для появления грыж является слабость мышц паховой области, повышенные нагрузки, травмы, нередко формирование грыж во время беременности или при длительном плаче у младенцев. Ущемление паховых грыж у мужчин в зрелом возрасте происходит чаще, чем у женщин. Ущемленная паховая грыжа у детей и у новорожденных встречается с одинаковой частотой и формируется, как правило, уже во внутриутробном состоянии.
Симптомы ущемленной паховой грыжи (признаки)
Боль — явный признак ущемленной паховой грыжи. Появляется неожиданно, остро. Возникновение при физическом напряжении наиболее характерно. Нередко боль не только локализуется в месте ущемления грыжи, но и распространяется по всему животу. В первые часы ущемления возможен жидкий стул, а позднее – долгое отсутствие газов и стула.





Возможны ложные позывы к акту дефекации. Рвота является ранним признаком осложнения, а при длительном ущемлении может носить неукротимый характер. При сдавлении мочевого пузыря характерно частое и болезненное мочеиспускание. Ухудшается состояние больного: учащается сердцебиение, повышается температура, понижается артериальное давление, есть риск развития шока 1-2 степени.
Признаки ущемления паховой грыжи пропорциональны интенсивности болевого синдрома и могут развиваться очень стремительно.
Ущемленная паховая грыжа – диагностика
Установление диагноза ущемления паховой грыжи, симптомы которой приведены выше, не вызывает значительных затруднений. При осмотре пациента врач обнаруживает характерное грыжевое выпячивание в области паха справа или слева, достаточно редко с обеих сторон. Возможен отек и гиперемия в месте ущемления грыжи.
Выпячивание — резко болезненное, не вправляемое при пальпации или при меняющемся положении тела больного, напряженное.
Отрицательный симптом передачи кашлевого толчка – один из основных признаков ущемленности паховой грыжи, то есть отсутствует увеличение грыжи при покашливании или натуживании больного.
При перкуссии определяется притупление звука, но при ущемлении кишки в первые часы, преобладает тимпанит.
Если при ущемлении грыжи содержимым является яичник или маточная труба у девочек и женщин, то диагностика значительно затруднена. Боль скорее ноющего характера и не является столь интенсивной. Общее состояние пациентки вполне удовлетворительное.
За прошедшее время, яичник может полностью некротизироваться. Поэтому, при подозрении на ущемление паховой грыжи у девочек, сразу же производят хирургическое вмешательство. Клиника у детей также имеет свои особенности вследствие более интенсивного кровотока в кишечнике. Ребенок может реагировать очень бурно: сильный плач, малыш подгибает ножки или сучит ими, возможна потеря сознания.
Неотложная помощь при ущемлении паховой грыжи
При ущемленной паховой грыже неотложная помощь заключается в следующем:
при сильных болях в животе необходимо целенаправленно осмотреть пациента на наличие грыжевого выпячивания;
при подозрении на ущемление или при возникшей патологии, даже если состоялось самопроизвольное вправление грыжи, показана экстренная госпитализация больного в хирургический стационар;
опасно и недопустимо насильственно пытаться вправить ущемленную грыжу;
больным противопоказано применение ванн, обезболивающих препаратов, холода или тепла;
доставка в стационар осуществляется на носилках в лежачем на спине положении.
И, безусловно, при ущемленной паховой грыже лечение без операции, народными средствами или лазером (иногда у пациентов возникают и такие вопросы) невозможно и, более того, опасно для жизни.
Лечение ущемленной паховой грыжи

Фото: рассечение кольца
При проведении экстренной операции грыжесечения, особенность заключается в том, что главная ее цель – не пластика пахового канала, а ликвидация самого ущемления и его последствий. Всегда есть вероятность того, что часть сальника или петли кишки, находящиеся в грыжевом мешке, к моменту операции уже омертвели. Вследствие этого, при вскрытии грыжи хирургу необходимо тщательно осмотреть ее содержимое.
Далее возможны варианты:
Если петля кишечника выглядит нормальной, нет признаков омертвения, хирург производит вправление ее внутрь живота и производит пластику пахового канала.
Если видны начальные признаки некроза органа, доктор пробует восстановить жизнеспособность кишечной петли с помощью лекарственных препаратов.
Если часть сальника или кишки погибла, она иссекается.
Вскрывая грыжевой мешок, существует опасность инфицирования всей операционной раны. Поэтому во время операции применяются дополнительные меры асептики и антисептики.
Иногда для проведения резекции кишечника требуется выполнение дополнительного разреза брюшной стенки.
Срединная лапаротомия производится в следующих случаях:
выраженный спаечный процесс между петлями кишечника в брюшной полости;
резекция подвздошной кишки в терминальном отделе с наложением анастомоза;
подозрение на флегмону грыжевого мешка;
при некрозе слепой и сигмовидной кишки;
при явлениях перитонита и острой непроходимости кишечника.
При пластике пахового канала выбирают наиболее простые методы. Пластика передней стенки при врожденных и небольших косых грыжах используют способы Жирара–Спасокукоцкого–Кимбаровского или Мартынова, при прямых и сложных грыжах применяют способы Постемпского и Бассини.
Проводя операцию при ущемлении паховой грыжи у мужчин, учитывают тесную связь грыжевого мешка с элементами семенного канатика и семявыносящим протоком.
Требуются специальные навыки хирурга и деликатность техники, так как повреждение этих органов может привести к необратимым последствиям и мужскому бесплодию!
У женщин не всегда возможно определить, произошло ущемление паховой грыжи или бедренной, особенно если грыжа небольших размеров. Однако операция показана в любом случае и уже во время хирургического вмешательства определяют способ пластики грыжевых ворот.

Фото: бандаж для малых паховых грыж
Ущемленная паховая грыжа у детей обладает своими особенностями: лучшее кровоснабжение кишечных петель, большая эластичность сосудов, меньшее давление ущемляющего кольца. Поэтому иногда ущемленная грыжа у ребенка, в том числе у новорожденного, может вправиться самостоятельно. Для этого необходимо устранение беспокойства малыша, создание комфортных условий, что ведет к расслаблению мышц и снятию спазма пахового кольца.
Поэтому хирурги в течение 8-12 часов после возникшего ущемления грыжевого выпячивания у ребенка первых месяцев жизни на фоне мышечной релаксации практикуют ручное вправление грыжи. У мальчиков возможно проведение консервативной терапии: введение 1% раствора тримеперидина (0,1 мл на 1 год жизни) и 0,1% раствора атропина, назначается теплая ванна на 15-20 минут, ребенка укладывают с приподнятым тазом. Если спустя 1,5-2 часа эффекта нет – показана срочная операция.
При установлении у девочек ущемления паховой грыжи, операция должна производиться как можно в более короткие сроки. Это обусловлено возможностью попадания в грыжевой мешок яичника и маточной трубы, что может привести к некрозу содержимого и, в последующем, к бесплодию. Насильственное вправление категорически запрещается, так как возможно повреждение внутренних органов.
2) Пороки развития желчевыводящих путей. Атрезия желчных ходов. Полное или частичное отсутствие желчных ходов, относится к числу редких пороков развития и встречается один раз на 20 000 —30 000 родов. Развитие атрезии желчных ходов обусловлено особенностями их эмбрионального развития. Определенное значение могут иметь внутриутробные патологические процессы в печени (врожденный гепатит и др.).
Проявления атрезии желчных ходов типичны. Ребенок рождается с желтухой или (при атрезии внепеченочных желчных ходов) она развивается в первые 3—4 дня после рождения. Характерно постепенное нарастание желтухи. Стул обесцвечен с момента рождения. Отдельные порции стула могут быть слегка прокрашены вследствие диффузии желчных пигментов через кишечную стенку. Моча имеет цвет темного пива. Через 2—3 недели от рождения отмечается увеличение сначала печени, затем селезенки. Увеличиваются также размеры живота, расширяется сеть подкожных вен брюшной стенки. В поздних стадиях заболевания присоединяются геморрагические проявления (повышенная кровоточивость), развивается асцит (водянка). Если не проводится оперативное лечение, дети умирают от цирроза печени через 6—9 месяцев после рождения.
Диагностика врожденной атрезии желчных ходов представляет значительные трудности, обусловленные идентичностью клинических проявлений некоторых заболеваний, сопровождающихся длительной желтухой. Дифференциальный диагноз проводят с длительной физиологической желтухой новорожденного, гемолитическими желтухами, цитомегалией, токсоплазмозом, сифилисом, закупоркой желчных протоков слизистыми и желчными пробками, врожденным гепатитом. При затяжной физиологической желтухе новорожденного обычно стул избыточно окрашен за счет выделения большого количества густой желчи. Моча темная. В крови количество билирубина повышено до умеренного. Желтушность при физиологической желтухе имеет склонность к уменьшению, в то время как при атрезии желчных ходов желтушность постепенно нарастает. При выраженных формах характерна резко выраженная желтушность, состояние ребенка тяжелое. Если своевременно не произведено обменное переливание крови, развивается ядерная желтуха.
Наибольшие трудности представляет дифференциальная диагностика врожденной атрезии желчных ходов, закупорки желчных ходов слизистыми или желчными пробками и врожденного гепатита. Клинические проявления этих заболеваний, а также изменения билирубинового обмена при них в значительной степени идентичны. Врожденный гепатит диагностируется с помощью специальных методов исследования.
Лечение. При закупорке желчных ходов слизистыми и желчными пробками вводят через рот, а лучше через зонд в двенадцатиперстную кишку по 5 мл 25%-го раствора сернокислой магнезии 3 раза в день в течение 2—3 дней. Сокращение желчного пузыря под действием магнезии приводит к выталкиванию желчных пробок, и ребенок выздоравливает. При атрезии желчных ходов лечение оперативное. Результаты операции находятся в прямой зависимости от формы атрезии и сроков вмешательства. Наилучшие результаты удается получить в первые 2 месяца жизни ребенка.
3) Дивертикул Меккеля — это так называемый аномальный мешок или сумка, которая развивается на слабом месте в кишечнике. Недуг еще известен, как выпячивание. В результате процесса старения у человека могут развиваться различные типы дивертикулов, однако существуют также случаи, когда человек уже рождается с присутствующим дивертикулом в кишечнике. Это состояние называется выпячиванием Меккеля или дивертикулом Меккеля.
В большинстве случаев выпячивание Меккеля развивается между 5 и 7 неделями роста плода. Поскольку эти условия присутствуют при рождении, то этот тип заболевания классифицируется как врожденный тип. Выпячивание Меккеля является довольно распространенным заболеванием, проявляется преимущественно у одного из пятидесяти человек.
Однако очень часто этот тип заболевания не поддается диагностике и некоторые люди с выпячиванием никогда не имеют четко выраженных симптомов. В большинстве случаев пациенты ошибочно принимают этот дивертикулит за другие нарушения, такие как аппендицит (воспаление червеобразного отростка) или язвенной болезни (боль в слизистой оболочке желудка).
Симптомы дивертикула Меккеля
Симптомы дивертикула Меккеля тесно связаны с типом выпячивания, на основе которого и сформировался данный тип дивертикула. В 95 процентов пациентов в данном случае, выпячивание, которое развивается, состоит из клеток кишечника.
В результате, дивертикул функционирует как нормальная часть кишечника. Этот тип заболевания способен не вызывать никаких симптомов и чтобы его определить, нужно провести ряд специализированных тестов, так как обычная диагностика его не распознает, или способна обнаружит симптомы которые маскируют настоящий дивертикул под другое заболевание. В других случаях, этот недуг может быть образован из клеток желудка или поджелудочной железы.
Когда выпячивание происходит уже как часть кишечника, этот недуг способен функционировать по-разному и это может привести к значительному проявлению симптомов, в том числе:
блокировка кишечника;
кровотечение в кишечнике, что приводит к стуле с кровотечением;
воспалительные процессы в кишечнике;
боль или дискомфорт, которая колеблется от легкой до тяжелой стадии;
анемия;
лихорадка в результате воспалительного процесса;
рвота;
запор или нарушения стула у больного.
Симптомы, которые проявляются, часто напрямую связаны с возрастом пациента, когда выпячивание Меккеля было диагностировано. Например, у детей с присутствующим дивертикулитом, скорее всего, доминирует блокировка в кишечнике. Кишечные кровотечения и кровавый стул чаще встречаются у детей старшего возраста. В большинстве случаев болезнь Меккеля оказывается и рассматривается в возрасте до 10 лет. Другие случаи, как правило, диагностируется уже в подростковом возрасте.
Выпячивание Меккеля способно вызвать спорадические (нерегулярные) симптомы. Когда это происходит, кровь в стуле можно проявляться в течение нескольких дней. Затем это сопровождается периодом нормального стула (без крови). Такие неравномерные и нерегулярные симптомы значительно усложняют возможность проведения диагностических тестов.
В редких случаях, чрезмерное кровотечение из дивертикула Меккеля может иметь постоянный характер. Стойкое кровотечение может в конечном итоге привести к железодефицитной анемии, которая может быть первым признаком проблемы. В этой ситуации, выпячивание может стать опасным для жизни. Если это все-таки произошло, то необходимо провести операционное вмешательство для удаления дивертикула.
Диагностирование дивертикула Меккеля
 Выпячивание
Меккеля редко диагностируется при
отсутствии осложнений. Основным тестом
на выявление данного заболевания
является анализ крови при основном
симптоме, таком как кровотечение. Анализ
крови сможет определить наличие низкого
уровня красных кровяных клеток. Это
поможет врачу также определить наличие
дивертикула, если кровотечение происходит
в кишечнике.
Выпячивание
Меккеля редко диагностируется при
отсутствии осложнений. Основным тестом
на выявление данного заболевания
является анализ крови при основном
симптоме, таком как кровотечение. Анализ
крови сможет определить наличие низкого
уровня красных кровяных клеток. Это
поможет врачу также определить наличие
дивертикула, если кровотечение происходит
в кишечнике.
Также стандартная проверка крови устанавливает уровень гематокрита и гемоглобина, которые бы указывали на наличие анемии. Кроме того врач может назначить мазок кала или так называемое гваяковое тестирования кала (тест на скрытую присутствие крови в кале). В этом тесте образец стула будет проанализирован, чтобы выявить содержит ли он следы крови.
Еще одним из популярных методик диагностирования дивертикулита Меккеля является сканирование на основе технеция. Этот тест использует специальную краску (пертехнетат, радиоактивный материал), которую можно просмотреть с помощью специальной камеры. Краситель (технеций) вводится в вену пациента, в дальнейшем собираясь вокруг дивертикулы. Этот тест позволяет определить наличие выпячивания мешочков в кишечнике пациента, тем самым подтверждает наличие дивертикула Меккеля.
Также одной из процедур является ирригоскопия. Ирригоскопия — это рентгенологическое исследование толстой кишки путем введения ректально сульфата бария, который представляет собой жидкость для покрытия внутренней поверхности стенок кишки, которая становится видна при проведении рентгена.
Некоторые пациенты могут иметь активное кровотечение в кишечнике в результате выпячивания дивертикула Меккеля. Это может значительно усложнить процедуру пересмотра дивертикула с помощью техники сканирования. Если это происходит, врач в большинстве случаев назначает ряд дополнительных тестов, чтобы подтвердить диагноз. Такими тестами являются колоноскопия (медицинская процедура для обследования внутренней стенки толстой кишки с помощью специального зонда) или эндоскопия верхних отделов желудочно-кишечного тракта. Эти тесты используют специальную камеру для визуализации выявления этого типа недуга.
Если диагноз не может быть поставлен с помощью выполнения вышеуказанных процедур, врач в большинстве случаев назначает лапароскопию. Во время этой процедуры содержимое брюшной полости может быть рассмотрено через лапароскоп — длинной тонкой трубки с камерой и объективом, который вставляется через крошечный разрез в брюшной стенке. Если дивертикул Меккеля найден, лапароскоп также может быть использован, чтобы удалить его.
Лечение дивертикула Меккеля
 Пациенты,
которые имеют дивертикул Меккеля, но
не имеют никаких симптомов, не требуют
лечения. Но в то время пациентам, которые
испытывают конкретные симптомы, может
понадобиться операция, для того, чтобы
удалить выпячивания.
Пациенты,
которые имеют дивертикул Меккеля, но
не имеют никаких симптомов, не требуют
лечения. Но в то время пациентам, которые
испытывают конкретные симптомы, может
понадобиться операция, для того, чтобы
удалить выпячивания.
Хирургия обычно включает в себя удаление дивертикула и восстановления работоспособности кишечника. Если кишечник был поврежден в результате образования выпячивания, то поврежденная часть кишечника также может быть удалена. Пациентам, которые испытывают потерю крови вследствие выпячивания Меккеля, врач может назначить переливание крови для восстановления нормального объема, который был утрачен во время кровотечения.
Хирургическая операция по коррекции дивертикула Меккеля обычно ассоциируется с низким риском осложнений. Однако некоторые осложнения могут возникнуть после операции. В частности, может образоваться рубцовая ткань, которая может привести к блокированию кишечника, что в свою очередь может быть опасным для жизни и может потребоваться дополнительная операция по удалению закупорки.
Билет 22
Пупочная грыжа у ребенка. Симптомы и лечение
Грыжа — выпячивание внутренних органов из полости, в которой они расположены, через дефекты в стенке этой полости. У младенцев пупочная грыжа появляется из-за внутриутробных пороков развития (незаращение пупочного кольца). Она может быть вызвана также плохо перевязанной пуповиной или скоплением газов. Иногда грыжа появляется при крике ребенка и легко вправляется в состоянии покоя.
Симптомы пупочной грыжи у детей
Пупочная грыжа является одной из самых частых хирургических патологий детского возраста и встречается у каждого пятого ребенка, а среди недоношенных детей - у каждого третьего. При рождении минимальный дефект пупочного кольца определяется практически у каждого новорожденного. При крике, плаче младенца появляется грыжевое выпячивание, что обычно настораживает родителей. Часто родители связывают беспокойство ребенка с наличием пупочной грыжи, однако случаи ущемления пупочной грыжи у младенцев крайне редки.
Пупочная грыжа чаще всего возникает в периоде новорожденности и, как правило, в первый месяц после рождения ребенка. Через некоторое время после отпадения пуповинного остатка может появиться выпячивание в области пупка, которое легко вправляется в брюшную полость. Пупок при этом может торчать на 1-2 см дальше живота. Но торчащий пупок однозначно не говорит о наличии пупочной грыжи, а может быть просто анатомической особенностью.
Пупочная грыжа - это не торчащий пупок, а следствие дефекта передней брюшной стенки, вызванного слабостью пупочного кольца, то есть грыжа прощупывается под пупком. Она может возникнуть в результате сильного кашля, запоров, продолжительного плача. Такие заболевания, как рахит, гипотрофия, снижающие тонус мышц, также создают благоприятные условия для образования пупочной грыжи. Внешне пупочная грыжа проявляется округлым или овальным выпячиванием в области пупочного кольца, которое легко вправляется в брюшную полость. Часто наряду с пупочной грыжей наблюдается расхождение прямых мышц живота из-за слабости мышц передней брюшной стенки.
Величина грыжевого выпячивания зависит от размеров пупочного кольца. Пупочное кольцо — это мышца, окружающая пупок; во время родов акушерка отсекает пуповину, и мышцы, окружающие пупок, сокращаются, поскольку малыш более не нуждается в получении питания через пуповину. При малых его размерах грыжа может лишь иногда появляться во время плача ребенка или при беспокойстве. При прощупывании педиатром области пупка палец "проваливается" в брюшную полость, данный метод дает возможность врачу определить размеры пупочного кольца и четко определить края грыжевых ворот.
Краями грыжевых ворот называют область, окружающую грыжевое выпячивание. При значительных размерах пупочного кольца (и, соответственно, грыжи) постоянно видна припухлость в области пупка, которая увеличивается во время плача и при натуживании. Размеры грыжи могут постепенно увеличиваться в первые месяцы после ее появления.
Грыжа может появиться и после того, как ребенок станет ходить и может быть следствием раннего принятия вертикального положения.
Опыт амбулаторного наблюдения детей с пупочными грыжами, диагностированными в раннем возрасте, позволяет с уверенностью сказать, что к 5-7 летнему возрасту часто наступает самоизлечение. Ликвидации грыжи способствует укрепление брюшной стенки. Это массаж, укладывание детей на животик, гимнастика. Хирургическое лечение начинают не ранее 5 летнего возраста. Правильно и аккуратно проведенная операция, позволяет устранить грыжу с хорошим косметическим эффектом. Как правило, рецидивов не бывает.
Причины появления пупочной грыжи у детей.
На 4-5 сутки после рождения ребенка отпадает пуповина. Пупочное кольцо состоит из двух частей. Нижняя часть, где проходят пупочные артерии и мочевой проток, хорошо сокращаются и образуют плотную рубцовую ткань. В верхней части проходит пупочная вена. Ее стенки тонкие, не имеют мышечной оболочки, плохо сокращаются в дальнейшем. Нередко при слабой брюшинной фасции и незаращенной пупочной вене образуется пупочная грыжа. Кроме этого, важнейшим фактором, способствующим возникновению этой патологии, является частое повышение внутрибрюшного давления. Оно может быть вызвано, например, частым плачем ребенка, газами, запорами. Отверстие в верхней части пупочного кольца может быть широким, и не причинять беспокойство ребенку. Но в случае небольшого дефекта с твердыми краями беспокойство ребенка возможно. Как правило, пупочная грыжа у детей всегда вправимая. Ущемленную пупочную грыжу чаще можно встретить во взрослой практике. Однако, нередко приходится оперировать детей с невправимыми грыжами (когда грыжевое содержимое прикрепляется к внутренней стенки кожи передней брюшной стенки спайками).
Основная причина возникновения пупочных грыж — наследственная предрасположенность слабости мышц передней брюшной стенки. Это значит, что если отец или мать ребенка сами в детстве имели данную патологию, то вероятность того, что их ребенок будет иметь грыжу, составляет приблизительно 70%. Однако бывают случаи, когда родители не имели данной патологии в детстве, а у малыша вдруг появляется пупочная грыжа.
Бытует мнение, что пупочная грыжа может возникнуть из-за того, что акушерка во время родов "неправильно" отрезала пуповину. Это не так: техника наложения пупочной скобки не влияет на возникновение пупочной грыжи у детей. Возникает пупочная грыжа при анатомической слабости мышечной ткани в области пупка.
Содержимым пупочной грыжи обычно являются кишечные петли. Грыжевое выпячивание при легком надавливании свободно убирается вовнутрь. При очень широком пупочном кольце и большой грыже внешне иногда бывает видна перистальтика кишечника, то есть сокращение мышц кишечника и продвижение пищи по нему, что очень пугает многих родителей, однако малышу это не доставляет неудобства.
Диагноз "пупочная грыжа" ставит при осмотре врач-педиатр, наблюдающий ребенка. В дальнейшем доктор может направить малыша на консультацию к хирургу для получения дополнительных рекомендаций по лечению данного состояния.
Как чувствует себя ребенок с пупочной грыжей
Ущемление пупочных грыж, то есть сжатие содержимого выпячивания, практически не наблюдается. Однако многие педиатры замечают, что дети с грыжами бывают более беспокойными по сравнению со сверстниками, а также чувствительными к изменениям погоды. Ребенок не испытывает боли из-за самой грыжи, однако наличие данного состояния у малыша часто сопровождается вздутием живота, что и приводит к беспокойству крохи. Наличие пупочной грыжи у ребенка является в большей степени косметическим дефектом.
При правильном развитии ребенка, нормализации деятельности кишечника, достаточной двигательной активности, может наступить самоизлечение пупочной грыжи. Пупочные грыжи у детей склонны к самоизлечению даже при довольно больших размерах пупочного кольца и грыжевого выпячивания. Тем не менее, чрезвычайно полезно выполнять специальные упражнения, способствующие укреплению мышц передней брюшной стенки, и делать тонизирующий массаж живота.
Чем может помочь ребенку врач
Почти во всех случаях он посоветует подождать. Если пупочная грыжа не закроется сама собой, может понадобиться операция, однако обычно ее проведение откладывается до того времени, когда ребенку исполнится пять-шесть лет. У мальчиков оперативное закрытие пупочного кольца делается лишь в том случае, если грыжа причиняет боль. Девочек в этом возрасте оперируют и при отсутствии недомоганий, поскольку грыжа впоследствии может сказаться на вынашивании беременности.
Лечение пупочной грыжи у детей Что делать, если у ребенка диагностировали грыжу?
Пупочные грыжи у детей склонны к спонтанному закрытию. При этом важен размер дефекта пупочного кольца: при его диаметре менее 1,5 см, как правило, к 3-5 годам жизни отмечается закрытие дефекта. Если пупочная грыжа сохраняется после 5 лет, уточните у хирурга необходимость оперативного лечения.
При наличии дефекта пупочного кольца большого диаметра, самостоятельное закрытие практически невозможно, что также требует проведения операции - возможно, в более раннем возрасте (3-4 года). Таким образом, пупочная грыжа требует наблюдения ребенка у детского хирурга для определения тактики лечения.
К консервативным мероприятиям, направленным на закрытие дефекта пупочного кольца у детей до года, можно отнести общий массаж, массаж передней брюшной стенки, выкладывание на живот, лечебную физкультуру.
Общий массаж и лечебную физкультуру проводят массажисты и врачи ЛФК.
Массаж передней брюшной стенки - поглаживание живота по часовой стрелке - могут делать родители перед каждым кормлением, после чего ребенка рекомендуется выложить на живот на 5- 10 минут. Однако при грыжах большого размера не следует уповать на данные методы.
Рекомендуется выкладывать малыша за 10-15 минут до кормления 2-3 раза в день на ровную твердую поверхность. Это может быть пеленальный столик или стол, накрытый пеленкой. Обязательно находитесь рядом с ребенком, не оставляйте его ни на секунду, даже если ваш малыш еще не умеет переворачиваться.
Во время выкладывания будет полезно провести легкий массаж спинки, ножек и ручек вашего крохи, достаточно просто поглаживания от кончиков пальчиков вверх, от ягодиц к плечикам.
Вторым методом массажа для консервативного лечения пупочной грыжи, а также методом профилактики возникновения данного состояния является массаж живота. Массаж в условиях поликлиники по назначению наблюдающего педиатра, как правило, проводится после достижения ребенком двух месяцев. Однако сами вы можете проводить массаж сразу же после заживления пупочной ранки. Самым маленьким крошкам достаточно провести всего три-четыре легких поглаживающих движения животика по часовой стрелке, начиная с правой подвздошной области к левой, то есть от правой нижней части живота к левой нижней области. Поглаживающий массаж расслабляет мышцы, поэтому движения должны быть очень нежными, комфортными для ребенка. Этот прием проводится ладонной поверхностью кисти.
Массаж детишкам постарше можно проводить по методике "I love U". Данный массаж поможет при метеоризме (вздутии животика), при коликах и при пупочной грыже. Представьте на поверхности животика вашего ребенка перевернутую букву U; так же выглядит и кишечник. Нанесите на свои ладони немного масла для массажа и разминайте животик малыша своими лежащими плашмя пальцами круговыми движениями. Сначала пройдитесь сверху вниз по левой стороне животика ребенка, написав букву "I" (для вас это будет справа). Этим движением вы перемещаете газы вниз, изгоняя их из нисходящей части ободочной кишки. Затем нарисуйте перевернутую букву "L", продвигая перистальтику и газы по поперечному участку ободочной кишки, затем снова вниз по нисходящему участку ободочной кишки (это верхняя часть живота) и далее — снова вниз по левой стороне живота ребенка. Затем изобразите перевернутую букву "U", идя вверх по восходящему участку ободочной кишки, затем по поперечному и далее вниз по нисходящему, то есть справа снизу вверх, затем по верхней части живота и далее — сверху вниз по левой стороне живота малыша.
Особое внимание следует уделить околопупочной области, так как именно из-за слабости прямых мышц живота формируется расширенное пупочное кольцо и, следовательно, пупочная грыжа. Прямые мышцы живота находятся справа и слева от пупка и закрывают почти всю переднюю брюшную стенку. Расположите большой и указательный пальцы справа и слева от пупка ребенка на расстоянии примерно 1-2 см от центра пупка и мелкими точечными движениями сделайте десять нажатий. Такие же нажатия сделайте сверху и снизу от пупка. Движения должны быть нежными и не доставлять дискомфорта малышу. Затем на таком же расстоянии от пупка указательным и средним пальцами проведите десять круговых движений по часовой стрелке. И в завершение вдавите грыжевое выпячивание внутрь животика. Интенсивность данных процедур должна быть комфортной для вашего малыша. В течение дня массаж околопупочной области желательно проводить два-три раза. Длительность процедур составляет не более 5 минут; желательно проводить их до кормления ребенка. Некоторые малыши предпочитают, чтобы им массировали животик до купания, другим больше нравится получение процедур после ванны. Вопрос об этом решается каждый раз индивидуально, в зависимости от состояния ребенка. Как упоминалось выше, детишки с пупочными грыжами чувствительны к перемене погоды, и если малыш капризничает, то проведение массажа лучше отложить до более благоприятного момента.
И еще одним методом консервативного лечения пупочной грыжи является наложение лейкопластырной повязки. Наложение такой повязки как метод лечения пупочной грыжи может быть рекомендовано наблюдающим педиатром или хирургом. Существует несколько способов наложения пластыря. Пластыри для лечения пупочных грыж выпускают различные фирмы (Chicco, Hartmann); такие пластыри продаются в аптеках и детских магазинах. Пластырная повязка накладывается врачом на 10 дней широкой полосой (желательно 4 см), от одной поясничной области до другой, то есть повязка будет наложена вокруг живота. При этом грыжевое выпячивание вправляется пальцем, а прямые мышцы живота соединяются над пупочным кольцом в виде двух продольных складок. При правильном наложении эти складки под пластырем должны остаться (не расправиться). Если после снятия повязки выявляется, что пупочное кольцо не сомкнулось и грыжа осталась, то повязку можно наложить еще на 10 дней. Проведение курса трехкратного наложения повязки (3 раза по 10 дней) бывает достаточно для полного излечения. Данный вариант метода наложения пластыря современные педиатры используют редко, поскольку пластырь может вызвать раздражение нежной кожи ребенка.
Существует также методика наложения пластыря непосредственно на околопупочную область в течение нескольких недель, без формирования складки. Пластырь необходимо менять каждые два-три дня, при этом малыша купают каждый день, не снимая повязки. Этот метод является более щадящим, а родители сами могут поменять пластырь, не прибегая к помощи врача. При применении данного метода рекомендуется использовать гипоаллергенный пластырь, который не нужно снимать во время купания. Если стоит вопрос о применении пластырной повязки в качестве лечения пупочной грыжи, то тактику и метод наложения повязки определяет врач при осмотре ребенка с пупочной грыжей. Детям, которым наложен пластырь, также рекомендуется проводить легкий массаж животика по описанной выше методике, выкладывание на живот. Весь комплекс консервативных мероприятий лечения пупочной грыжи (выкладывание на живот, массаж живота, наложение лейкопластырной повязки) должен проводиться лишь после полного заживления пупочной ранки и при отсутствии изменений кожи, в том числе воспалительных и аллергических реакций в области пупка.
Если весь комплекс проводимых мероприятий консервативного лечения оказался неэффективным и грыжа у ребенка сохраняется после 3 лет, то решается вопрос об оперативном вмешательстве совместно педиатр и хирург.
Методика проведения массажа и лечебной гимнастики при пупочной грыже у детей
 С
первых дней жизни следует выкладывать
ребенка на живот на несколько минут
перед каждым кормлением. В этом положении
он поднимает голову, активно двигает
руками и ногами, напрягает мышцы спины
и живота.
С
первых дней жизни следует выкладывать
ребенка на живот на несколько минут
перед каждым кормлением. В этом положении
он поднимает голову, активно двигает
руками и ногами, напрягает мышцы спины
и живота.
Лечебный массаж можно начинать с 2-3 недель жизни после заживления пупочной ранки. Проводить его следует в сочетании с общим массажем. Все упражнения лечебной гимнастики должны выполняться только после вправления грыжи и закрепления ее повязкой (лейкопластырем). Если вправить грыжу не удается, то во время процедуры одной рукой ее необходимо утопить, прижав пальцами, а другой рукой выполнять массажные движения.
Приемы массажа при пупочной грыже: круговое поглаживание живота по часовой стрелке; встречное поглаживание; поглаживание косых мышц; растирание живота (делается с месячного возраста); пощипывание вокруг пупка. Все приемы массажа, направленные на повышение тонуса мышц брюшной стенки, должны чередоваться с успокаивающим круговым поглаживанием. Для детей в возрасте 4-5 месяцев рекомендуются "парение" на спине; присаживание с поддержкой за выпрямленные и отведенные в стороны руки; присаживание с поддержкой за согнутые руки; самостоятельные повороты со спины на живот. Детям постарше рекомендуются присаживание с поддержкой за кольца, за одну руку, без поддержки; напряженное выгибание позвоночника; поднимание выпрямленных ног; наклоны и выпрямление туловища; упражнение "возьми игрушку со стула".
По рекомендации врача можно проводить точечный массаж: подушечками выпрямленных пальцев быстро и отрывисто надавливать на точки вокруг пупка, что вызывает напряжение мышц и вправление грыжи.
Массаж области пупка - подробная методика выполнения
Три пальца правой руки прикладывают к обла сти пупка так, что средний палец (длинный) идет в область пупочного кольца (в сам пупок), второй и четвертый пальцы — рядом, без промежутков. Движения по кольцевой вправо и влево выполняются с умеренным нажимом по 25 раз в обе стороны. Можно делать массаж косточками пальцев, сжатых в кулачок.
Ребром ладони делают движения по пупочному кольцу по часовой стрелке 25 раз. Продольные движения по пупочному кольцу производятся четырьмя пальцами (2—5): одновременно одна рука идет вверх, другая — вниз и наоборот 25 раз.
Движения пальцами производятся с боковых сторон живота к пупочному кольцу.
Все элементы массажа надо выполнять с умеренным нажимом.
Массаж выполняется 2-3 раза в день перед кормлением ребенка через пеленку или рубашку, чтобы не натереть нежную кожу малыша. Тот, кто выполняет массаж, должен иметь коротко подстриженные ногти. Сами руки, разумеется, должны быть теплыми.
Как видите, методика массажа не так уж сложна. Зато есть возможность, своевременно обнаружив врожденное заболевание, лечить его с момента выявления и обойтись без оперативного лечения.
Примерный комплекс лечебного массажа и гимнастики при пупочной грыже для детей в возрасте до 4 месяцев
Вначале следует произвести рефлекторное удержание тела ребенка (горизонтально) в положении лежа на боку. Выполняться упражнение должно по несколько секунд на правом и левом боку поочередно.
Затем нужно повернуть ребенка из полувертикального положения в горизонтальное. Упражнение следует выполнять на коленях взрослого или на столе, предварительно подготовленном к массажу. При этом отклоняя туловище ребенка назад, нужно следить, чтобы голова малыша не запрокидывалась.
Далее следует выполнить рефлекторное удержание тела ребенка на весу (горизонтально) в положении на спине - "поза пловца". Потом осуществить повороты малыша со спины на живот с помощью взрослого. Далее рефлекторное ползание на животе. В заключение выкладывание на мяч в положении на спине.
Некоторые врачи рекомендуют специальный бандаж или медицинский пояс при грыже, но при ношении бандажа массаж все равно делать нужно обязательно, к тому же если ребенок уже ползает или ходит, бандаж будет постоянно сползать.
Хирургическое лечение пупочной грыжи
Целью операции при пупочной грыже заключается ушивание дефекта пупочного кольца. Разрез небольшого размера производят над пупком в кожной складке, что, наряду с косметическими швами, делает послеоперационный рубец практически незаметным. С возрастом эластичность тканей снижается, и небольшой дефект пупочного кольца, не ликвидированный в детском возрасте, превращается в большую пупочную грыжу у взрослых. Часто пупочная грыжа начинает увеличиваться после родов у женщин. Пупочные грыжи у взрослых склонны к ущемлению и частым рецидивам. Поэтому во всем мире принято лечить грыжи передней брюшной стенки в детском возрасте, лучше до школы.
Хирургическое лечение грыжи необходимо девочкам старше 5 лет, поскольку при беременности и после родов существует опастность увеличения грыжи и защемления. У мальчиков, если грыжа не приченяет беспокойства, это больше косметический дефект и операция показана при опасности ущемления. Операция проходит 15-20 минут под общим наркозом, реабилитация 1-2 недели. После операции физические нагрузки противопоказаны в течение месяца. Если ребенку меньше 3-4 лет, он находится в больнице вместе с матерью.
Можно ли "заговорить" грыжу?
Среди родителей широко распространено мнение о том, что некоторые народные целители могут "заговорить" грыжу - и она исчезнет сама собой. Все объясняется просто. Шаманы и бабушки повитухи знают о возможностях спонтанного закрытия дефекта пупочного кольца у детей до 3-5 лет. Данные научные познания дают им возможность за определенные материальные блага эффективно "лечить" детей. Это беспроигрышный вариант, позволяющий поддерживать миф о необычайных возможностях нетрадиционных методов лечения.
С другой стороны, все заговоры от грыжи обязательным атрибутом имеют покусывание или пощипывание пупка, а это подобие иглорефлексотерапии, которая используется в лечении грыжи у взрослых.
Приклеивание медной монетки врачи советуют при пупочной грыже более 1 см, при меньшем размере грыжи монетка малоэффективна и рекомендуется заклеивание пупка пластырем по специальной технике (пластырь обязательно должен быть гипоаллергенным! Лучший вариант - пупочный пластырь Порофикс).
Народные средства лечения грыжи
Наложить на грыжу ребенка лейкопластырь. Бинтом обматывать нельзя, поскольку у детей дыхание преимущественно животом, а не грудной клеткой. Перед заклеиванием грыжевое выпячивание вправить пальцем. Повторять процедуру 10-15 дней подряд. Лейкопластырь брать гипоаллергенный!
Положить при грыже на пупок старую медную монету («пятачок») и закрепить ее лейкопластырем. Во время купания ребенка монету снимать, пупок обрабатывать слабым раствором йода в воде. Эффективно при больших грыжах (более 1 см). При небольшой грыже нужно брать медный диск поменьше, например монету в 1 цент (США)
Положить на пупок марлю, смоченную соком кислой капусты, а сверху прикрыть ее ломтиком свежего картофеля диаметром примерно 2 см. При регулярном использовании грыжа может пройти через 1 месяц.
Заговор от детской грыжи «Бабушка Соломонидушка у Пресвятой Богородицы грыжу заговаривали медными щеками, железными зубами. Так и я заговариваю у раба Божьего (имя ребенка). Аминь». Заговаривать 3 раза и 3 дня подряд, кроме воскресенья. При заговоре надо слегка прикусывать губами пупок ребенка.
Как видите, народные средства схожи с официальными методами лечения грыжи, механизм их действия описан выше.
Профилактика пупочной грыжи
Профилактикой возникновения пупочной грыжи является, в первую очередь, предупреждение чрезмерного натуживания ребенка и вздутия живота, причиной которого обычно являются повышенное газообразование, запоры.
Для предотвращения чрезмерного вздутия кишечника у ребенка и развития запоров наиболее благоприятным для детей раннего возраста является кормление грудным молоком, однако при этом мама должна соблюдать диету. Мы можем посоветовать мамам временно исключить из своего рациона следующие продукты: цельное молоко, белокочанную капусту, бобовые, орехи, сладости, копчености, колбасы. Предпочтительно употребление кисломолочных продуктов, отрубей, цельнозерновых каш, свежих овощей, фруктов. Во время кормления грудью для профилактики запоров полезны чернослив и курага (не более 3-5 ягод в день).
Если малыш на искусственном вскармливании, чтобы исключить запоры, вздутие живота, колики, аллергическую реакцию, смесь должен подобрать педиатр.
Врач, наблюдающий вашего малыша, может рекомендовать медикаментозные препараты: САБ-СИМПЛЕКС, ЭСПУМИЗАН, ПЛАНТЕКС, БЕБИ-КАЛМ и др.
Для предупреждения запоров, которые могут возникнуть у малыша при неправильно подобранном искусственном питании, из-за погрешностей в диете у кормящей мамы, а также при дисбактериозах и других заболеваниях желудочно-кишечного тракта, при которых происходит чрезмерное натуживание, среди лекарственных препаратов педиатры рекомендуют прием ДЮФАЛАКА, а также введение ГЛИЦЕРИНОВЫХ СВЕЧЕЙ и микроклизм — МИКРОЛАКС. Дозировку и особенности введения этих лекарственных средств вам подскажет педиатр, так как назначение медикаментозной терапии сугубо индивидуально и возможно исключительно со стороны врача, наблюдающего за развитием вашего малыша.
Дети с непереносимостью лактозы (лактазная недостаточность) довольно часто имеют пупочные грыжи. Лактазная недостаточность возникает у детей, которые родились преждевременно или в срок, но функционально остаются незрелыми. При этом состоянии грудное молоко частично или полностью не переваривается, вследствие чего происходит брожение в кишечнике и его вздутие. Кроме того, одной из форм течения лактазной недостаточности может быть склонность к запорам. Наиболее эффективным средством профилактики для таких детей является рациональный подбор вскармливания, при грудном вскармливании часто рекомендуется дополнительное введение фермента лактазы.
В раннем возрасте многие малыши страдают дисбактериозом кишечника, то есть нарушением микрофлоры кишечника, который может возникать на фоне лактазной недостаточности и других состояний. При этом запоры, а также вздутие живота, сопровождающие дисбактериоз, довольно часто провоцируют возникновение пупочной грыжи у малышей. Лечение в данном случае должно быть направлено в первую очередь на устранение симптомов основного заболевания.
2) Сращение почек
главная / медицинский справочник болезней / урологические болезни
|
Сращение почек – врожденная нефропатия, нарушение взаимоотношения выделительных органов, характеризующееся слиянием обеих почек в одну. Сращение почек может сопровождаться болевым синдромом, симптомами сдавления нижней полой вены, вторичными почечными осложнениями (гидронефрозом, хроническим пиелонефритом, нефролитиазом, нефрогенной гипертонией). Диагностика сращения почек основывается на результатах УЗИ, экскреторной урографии, пиелографии, ангиографии, сцинтиграфии, КТ, МРТ. Лечение сращения почек может включать истмотомию (рассечение перешейка), нефрэктомию, устранение сопутствующих осложнений. подробнее |
Сращение почек
Причины сращения почек
Варианты сращения почек
Симптомы сращения почек
Диагностика сращения почек
Лечение сращения почек
Сращение почек - лечение в Москве
С ращение
почек рассматривается в урологии как
аномалия взаимного расположения органов,
при которой обе почки сливаются в одну,
но при этом каждая имеет собственные
сосуды и мочеточники, располагающиеся
на своих обычных местах и открывающиеся
в мочевой пузырь. Сращение почек
составляет около 14 % всех пороков развития
этих органов. Сращение чаще встречается
у лиц мужского пола и в половине случаев
сопровождается дистопией
почек и
другими аномалиями расположения
внутренних органов.
ращение
почек рассматривается в урологии как
аномалия взаимного расположения органов,
при которой обе почки сливаются в одну,
но при этом каждая имеет собственные
сосуды и мочеточники, располагающиеся
на своих обычных местах и открывающиеся
в мочевой пузырь. Сращение почек
составляет около 14 % всех пороков развития
этих органов. Сращение чаще встречается
у лиц мужского пола и в половине случаев
сопровождается дистопией
почек и
другими аномалиями расположения
внутренних органов.
Причины сращения почек
Сращение почек является следствием аномального слияния парных метанефрогенных бластем на ранних этапах эмбриогенеза, приблизительно на 8-10 неделе внутриутробного развития. В результате слияния нарушаются процессы эмбриофетальной миграции почек в область своего анатомического ложа в поясничной области и их ротации. Поэтому сросшиеся почки в той или иной степени всегда являются дистопированными.
При этом врастание метанефральных протоков и дифференциация метанефрогенной ткани в почечную протекает без отклонений, поэтому мочеточники сросшихся почек открываются в мочевой пузырь в типичном месте, а гистологическая структура органов не нарушена.
Причинами, приводящими к сращению почек, как правило, служат неблагоприятные тератогенные влияния (химические, инфекционные, лекарственные, травмы и ушибы плода и пр.).
Варианты сращения почек
Анатомические разновидности сращения почек могут быть весьма разнообразными. Среди вариантов сращения почек выделяют симметричные, при которых каждая почка расположена гомолатерально, и асимметричные – с гетеролатеральным расположением одной из почек.
При симметричном сращении почки могут сливаться своими верхними или нижними полюсами (подковообразная почка) либо срединными поверхностями (галетообразная или комообразная почка).
К вариантам асимметричного сращения относятся слияние противоположных полюсов (верхнего одной почки с нижним другой) в вертикально расположенных почках (S-образная) или горизонтально повернутых почках (L-образная). При совпадении продольных осей сращенных противоположными полюсами почек, говорят об I-образной почке.
I- и S-образную аномалии относят к одностороннему сращению почек, другие виды – к двустороннему слиянию. Наиболее частым вариантом сращения является подковообразная почка, редким – галетообразная почка.
Симптомы сращения почек
Топографические особенности сращения почек обусловливают специфические клинические проявления и сопутствующие осложнения.
Несимметричные виды сращения почек вследствие сдавления соседних органов характеризуются болями в пояснице и подреберьях, гастралгией. На этом фоне развиваются диспептические явления (тошнота, рвота, метеоризм, запоры), неврологическая симптоматика (астенизация, неврастения, истерия).
Как правило, сросшиеся почки пальпируются в виде опухолевого образования по срединной линии или латеральнее позвоночного столба. При сдавливании сосудистых стволов могут отмечаться онемение в нижних конечностях, лимфостаз, венозный застой и отеки нижней половины туловища.
Сращение почек способствует развитию в них различного рода патологических процессов – пиелонефрита, гидронефроза, нефролитиаза (камней почек). На фоне сращения почек нередко возникает нефрогенная артериальная гипертензия, опухоли, в т. ч. рак почки, почечная недостаточность.
Своеобразное расположение и неподвижность сращенных почек представляет потенциальную опасность травмирования аномального органа.
Диагностика сращения почек
Сращение почек может быть распознано в ходе глубокой пальпации живота или бимануального гинекологического исследования у женщин. Для более детального определения типа аномалии используется УЗИ и УЗДГ почек, экскреторная урография, ретроградная пиелография, нефросцинтиграфия, почечная артериография, МРТ или КТ почек.
При почечной эхографии можно непосредственно рассмотреть форму, расположение, размеры почек и их взаимоотношение с другими органами.
Рентгеноконтрастные исследования, кроме варианта сращения почек, позволяют выявить наличие гидронефротической трансформации органа, опухолей, сосудистой патологии, камней в почках. При необходимости оперативного лечения сращения почек исключительно важное значение приобретает исследование васкуляризации аномально расположенных органов с помощью УЗДГ и почечной ангиографии.
Для исключения мочевых инфекций показано исследование мочи – общий анализ, бактериологической посев на флору и чувствительность к антибиотикам.
Лечение сращения почек
Если сращенные почки функционируют нормально, специального лечения порока не требуется. Пациентам с бессимптомным сращением почек показано наблюдение уролога с периодическим прохождением контрольного УЗИ почек и исследования мочи.
При рецидивирующих инфекциях верхних мочевых путей проводятся курсы консервативной терапии пиелонефрита.
Выявление камней в сросшихся почках служит основанием для проведения медикаментозного лечения, а при неэффективности последнего - хирургического удаления камней из почек: дистанционной или перкутанной литотрипсии, пиелолитотомии,нефролитотомии.
В случае сильных абдоминальных болей, вызванных сращением почек, производится хирургическое рассечение аномального образования, разведение почек и их фиксация (нефропексия) в физиологическом положении.
При поражении или утрате функций одной из сросшихся почек показана частичная или тотальная нефрэктомия. Операции на почках при их сращении технически трудоемки, поскольку кровоснабжение аномальных органов отличается сложностью архитектоники сосудов.
Поликистоз почек у взрослых
Определение и частота. Поликистоз почек - наиболее частая причина развития почечной недостаточности и летального исхода у взрослых с кистозными заболеваниями почек. Он встречается примерно у 10% больных, находящихся на длительной диализной терапии. Наследуемый как аутосомно-доминантный признак, поликистоз почек достигает 100% пенетрантности гена к 80-ти летнему возрасту. В большинстве случаев пораженный ген находится в 16-ой хромосоме. Поликистоз взрослых следует отличать от поликистоза почек у детей (аутомсомно-рецессивное наследование), фатального заболевания (больные могут дожить до 30 лет), и от врожденной мультикистозной дисплазии почки. Клиника. Типичные симптомы в виде выбухания в боку или животе и медленно прогрессирующей почечной недостаточности становятся клиническими явлениями к 4-му десятилетию жизни, а почечная заместительная терапия – необходимой в течение 10-ти лет после начальных проявлений. Семейный анамнез отягощен более чем в 75% случаев. сопутствующие клинические признаки могут заключаться в артериальной гипертензии, полиурии и никтурии, эритроцитозе и нефролитиазе. Кисты печени обнаруживаются в 33% случаев, однако печеночная недостаточность в отличие от заболевания у детей развивается редко. Внутричерепные (напоминающие ягоды) аневризмы встречаются у 12% больных. У 6% больных с такими аневризмами имеется поликистоз почек. Диагноз. Поликистоз почек у взрослых необходимо отличать от поликистозных заболеваний другого происхождения, а диагноз легче всего устанавливается на основании специфических признаков при УЗИ. Сопутствующие признаки: гематурия, снижение способности к концентрированию мочи и небольшая протеинурия. Выявление выраженной протеинурия, персистирующей гематурии и пиурии требует специальных исследований, так как они редко наблюдаются при неосложненном поликистозе почек. Лечение. Лечение ограничивается терапией терминального поражения почек по мере его развития. Важное значение имеет генетическая консультация, так как поражается 50% потомства. У женщин с поликистозом почек (взрослая форма) не отмечается повышенного риска гибели плода или артериальной гипертензии во время беременности, а исключением случаев, когда имеется почечная недостаточность.
НЕФРОНОФТИЗ (медуллярная кистозная болезнь)
Определение и частота. Медуллярная кистозная болезнь – наиболее часта я причина развития терминальной почечной патологии у детей и подростков. Патологическая анатомия. При медуллярной кистозной болезни почка малых размеров, что позволяет отличить данное заболевание от поликистоза и мультикистозных заболеваний. Кисты могут быть расположены в кортико-медуллярной области или в мозговой части. Известны акистозные формы. Выражен интерстициальный фиброз, но кальцификации не наблюдается. Клиника. Почти неизбежными ранними признаками заболевания являются, снижение способности к концентрированию мочи и адекватному сохранению натрия. Начальные проявления часто заключаются в полиурии, полидипсии и энурезе, хотя часто наблюдаются симптомы азотемии. Постоянный клинический признак – прогрессирование заболевания с развитием почечной недостаточности. Лечение. Лечение направлено на сохранение натриевого и водного гомеостаза. При заболевании, явно носящем семейные черты, необходимо генетическое консультирование. При подборе донора для пересадки следует учитывать возможность наличия субклинического заболевания у сибсов.
Медуллярная губчатая почка
Определение и частота. Медуллярная губчатая почка является не истинно кистозной патологией, а скорее расширением почечных собирательных трубочек. Эта распространенная патология выявляется в одной из каждых 200 урограмм в больших сериях. Прогноз. Прогноз хороший. У многих больных не определяется ухудшение функции почек. Часто выявляются гиперкальцийурия, а также небольшие изменения концентрационной способности и способности закислять мочу. В 50% случаев обнаруживают нефрокальциноз разной степени выраженности.
Простая киста почки
Определение и частота. Простая киста – наиболее распространенная кистозная патология почек; по меньшей мере у половины всех людей старше 50 лет имеется одна или более микроскопических кист почки. Почечные кисты могут быть солитарными (единичными) или множественными, односторонними или двусторонними. Они обычно располагаются в коре и выбухают через капсулу почки, но могут быть расположены и в мозговой части почки. Большие кисты почки у взрослых встречаются чаще, множественные кисты – реже. Клиника. Простые кисты обычно диагностируют при обследовании больного по поводу других заболеваний. Кровотечение и инфекции вызывают утолщение стенки кисты; в ней часто образуются кальцификаты. Клиническое течение. Простые кисты обычно стабильны, хотя может отмечаться уменьшение киты в период от одного исследования до другого. Солитарные кисты могут подвергаться малигнизации, хотя это наблюдается редко. Неоплазия более вероятна в геморрагических кистах. Множественные простые кисты могут приводить к развитию терминального поражения почек у больных, длительное время (более 7 лет) находившихся на гемодиализе. Диагноз. Диагноз может быть установлен с помощью КТ, МРТ, УЗИ, урографии или ангиографии. При наличии больших кист с аномальным ультразвуковым эхо производят пункцию кисты для аспирации жидкости и проведения цитологического исследования, а также рентгенологическое исследование с контрастированием. Лечение. При отсутствии инфекции или опухоли специфическое лечение при этом доброкачественном заболевании не показано.
3) Кишечная непроходимость Общая характеристика заболевания
Кишечная непроходимость – это состояние, которое характеризуется серьезными нарушениями или полным прекращением процесса продвижения пищи по кишечнику. Чаще всего заболевание встречается у пожилых людей и у тех, кому были проведены хирургические операции на кишечнике или желудке.
Возникновение какого-либо препятствия в кишечной трубке – это основная причина, по которой у человека появляется кишечная непроходимость. Симптомы заболевания очень разнообразны, и все они приводят к тяжелым эндотоксическим поражениям внутренних органов и систем организма. Достаточно сказать о том, что острая кишечная непроходимость является причиной более чем 30% летальных исходов, связанных с заболеваниями брюшной полости. Еще один важный момент – это фактор времени, в течение которого у человека развивается кишечная непроходимость. Лечение болезни необходимо начинать сразу после постановки точного диагноза, иначе она приведет к множеству серьезных проблем.
Острая кишечная непроходимость подразделяется на несколько видов. Наиболее распространенная форма заболевания – это спаечная кишечная непроходимость, но о ней мы расскажем чуть ниже, а пока поговорим о том, как проявляет себя кишечная непроходимость у детей и взрослых.
Симптомы кишечной непроходимости
Заболевание очень коварно. Даже у абсолютно здоровых казалось бы людей может в любой момент проявиться кишечная непроходимость. Симптомы болезни возникают как на фоне неприятных болей в области живота, так и при абсолютно нормальном самочувствии. Сначала неприятные ощущения локализуются в одном месте, но затем боль быстро распространяется по всей области живота. Человек начинает чувствовать бурные сокращения кишечника, у него появляется рвота, повышенное газообразование и задержка стула. В редких случаях у пациента наблюдается понос с кровью. Отметим, что все попытки освободить кишечник заканчиваются неудачей. Именно в этом и заключаетсяглавная проблема, которую несет с собой острая кишечная непроходимость. Лечение болезни осуществляется только в стационаре и чем быстрее пациент попадет в больницу, тем выше его шансы не просто вылечиться, а выжить.
Острая кишечная непроходимость характеризуется взрывным ухудшением состояния человека. И помочь в этом случае может только срочная операция. Если у больного наблюдаются побледнение лица, обильное потоотделение и ассиметричное вздутие живота, то необходимо немедленно вызвать «Скорую помощь», поскольку самолечением в подобных ситуациях заниматься недопустимо.
Спаечная кишечная непроходимость
Одна из самых распространенных форм кишечной непроходимости у взрослых людей. Спайки возникают в кишечнике человека вследствие тяжелых травм живота и кровоизлияний, а также после некоторых болезней, например, перитонитов. Острая кишечная непроходимость данного типа возникает на любом уровне кишечника и в большинстве случаев характеризуется спайкой сальника с послеоперационными рубцами или с органами, которые были травмированы во время хирургического вмешательства. Болезнь протекает очень остро, характеризуется быстрым развитием и появлением гемодинамических расстройств, что в дальнейшем приводит к омертвению тканей кишечника и перитонитам. Все больные с подозрением на спаечную кишечную непроходимость немедленно направляются в стационар, где им делают срочную операцию по удалению спаек.
Острая кишечная непроходимость у детей
Если у взрослых людей наиболее распространенной формой заболевания является спаечная кишечная непроходимость, то у детей чаще отмечаются пилоростеноз и инвагинация. В первом случае возникающие проблемы связаны с сужением привратника, что препятствует прохождению молока в кишечник. В первые две недели жизни ребенка данное состояние не оказывает существенного влияния на организм малыша, но затем мышца, окружающая привратник, утолщается, и большая часть молока возвращается обратно в виде фонтанирующей рвоты, которая может улетать на расстояние более полуметра. Именно обильная рвота является первым признаком пилоростеноза.
Инвагинация – это состояние, при котором тонкая и толстая кишка скручиваются между собой, в результате чего возникает кишечная непроходимость. Симптомы заболевания следующие:
резкие боли в области живота;
частая рвота с зеленоватыми включениями;
общее ухудшение самочувствия;
отсутствие стула в течение длительного промежутка времени;
бледность, обильное потоотделение.
Кишечная непроходимость у детей очень опасна, поэтому при первых же признаках заболевания следует обратиться в больницу, где врачи проведут обследование ребенка и при необходимости назначат ему срочную операцию.
Диагностика и лечение заболевания
Хотя острая кишечная непроходимость имеет ярко выраженные симптомы, всем больным назначается рентгенологическое исследование брюшной полости, что помогает подтвердить поставленный диагноз. Для этой же цели медики нередко используют ультразвуковое исследование области живота.
Если кишечная непроходимость была обнаружена на ранних стадиях, лечение проводится консервативными методами. Пациентам промывают желудок с помощью специального зонда, ставят капельницу, делают клизмы. При отсутствии положительной динамики больному рекомендовано хирургическое вмешательство, которое заключается в удалении части кишки для устранения причины, вызвавшей кишечную непроходимость. Единственное исключение из этого правила – случаи, когда непроходимость пищи по кишечнику связана с ослаблением сокращений кишки. В подобных ситуациях медики используют лекарственные препараты и редко прибегают к хирургическим операциям.
23 билет
Оценка течения острого аппендицита у детей затрудняется более быстрым прогрессированием воспалительных явлений и меньшей выраженностью симптомов. Кроме того, ребенок не умеет о них вовремя сообщить. Отмечена более бурная реакция детей на инфекцию и меньшая резистентность к ней. Положение червеобразного отростка в брюшной полости и по отношению к илеоцекальному отделу кишечника у детей менее типично, чем у взрослых. Чаще у детей червеобразный отросток расположен в правой поясничной области и под печенью, особенно у детей до 3 лет. Положение отростка зависит от вариантов расположения слепой кишки и взаимоотношения с восходящим отделом толстой кишки. Многообразие положения отростка увеличивается вариантами поворота кишечника, опрокидыванием, подворачиванием и поворотом по оси илеоцекального отдела кишок (А. Р. Шуринок). У детей до 5 лет начальная часть аппендикулярного отростка в 80% случаев расположена выше пупочно-остной линии, в то время как у 80% взрослых основание отростка находится ниже этой линии. Таким образом, точки Мак Бурнея и Ланца не имеют большого диагностического значения при остром аппендиците у детей (В. Е. Дейнека). Большой сальник, который своевременно «сигналпзирует» о воспалительном процессе и старается отграничивать его, у новорожденных и маленьких детей слабо развит. К 6 месяцам его нижний край на 3,5 см выше пупка, к 2 годам — на 2 см выше пупка, к 10 годам — на 1 см ниже его. Быстрое развитие сальника наступает в период полового созревания (Ф. И. Валькер, С. Р. Слуцкая). К этому времени слепая кишка опускается значительно ниже в соответствии с ростом восходящей ободочной кишки. Диагностика острого аппендицита представляет особые трудности у детей грудного и раннего детского возраста (А. П. Биезинь, С. Д. Терневский, А. Р. Шуринок, А. Ф. Дронов, Swenson, Grob). Заболевание нередко распознается только после прободения (по Gross, в 77—90% случаев). Следует отметить стертость клинических симптомов, относительную частоту поноса. Тяжелое общее состояние с токсикозом сопровождает прободение с последующим разлитым перитонитом, особенно тяжело протекающим у маленького ребенка. Отграничение воспалительного процесса затруднено вследствие недостаточного развития сальника. При боковом и ретроцекальном расположении отростка острый аппендицит нередко протекает скрыто с мало выраженными симптомами. Боль локализуется сзади и сбоку и выявляется пальпацией поясницы. При воспалительном процессе вблизи подвздошно-поясничной мышцы наступает вынужденное сгибание нижней конечности в правом тазобедренном суставе. Специальным приемом пальпации можно легче выявить инфильтрат вблизи подвздошно-поясничной мышцы. В положении ребенка на здоровом боку при разгибании нижней конечности напрягается подвздошно-поясничная мыпща. С целью выявления напряжения подвздошно-поясничной мышцы применяют пробу Яворского. При расположении воспаленного отростка вмалом тазус самого начала отсутствуют все обычные симптомы: рвота, мышечное защитное напряжение, болезненность. Если прободение не наступает, то заболевание может пройти под видом недомогания, расстройства пищеварения. Развитие воспалительного инфильтрата или абсцесра вокруг отростка в непосредственной близости от прямой кишки проявляется болезненными позывами к акту дефекации (тенезмы), повышается температура, отходит жидкий слизистый стул, т. е. отмечается картина энтероколита. При расположении воспалительного инфильтрата вблизи пузыря появляются боли при мочеиспускании и лейкоциты в моче, т. е. создается картина цистита. Типичные признаки острого аппендицита с рвотой, защитным напряжением мышц, болезненностью возникают с переходом воспаления из полости малого таза в брюшную полость. Нередко местные симптомы появляются слева — так называемый левосторонний аппендицит (Grob), что объясняется анатомическими особенностями органов таза. Ректальное исследование в таких случаях имеет решающее значение. Несмотря на слабое развитие большого сальника, у детей после третьего года жизни нередки случаи прикрытого острого аппендицита. Он может протекать в двух вариантах. При первом варианте — с отростком, прикрытым сальником, вначале отсутствуют симптомы, указывающие на наличие воспалительного процесса в брюшной полости. Они появляются позднее, при прорыве в брюшную полость. При втором варианте отмечается двухфазное течение: после рвоты и болезненности в начале заболевания эти симптомы быстро затихают. Однако вскоре, через несколько дней, они появляются вновь после распространения воспалительного процесса в брюшную полость. Острый аппендицит нередко возникает на фоне некоторых детских инфекционных заболеваний: кори, скарлатины, а также ангины и гриппозных состояний. В этпх случаях рвоту п боли в животе вначале принимают за симптомы первого заболевания. Острый аппендицит распознается уже после перфорации, с развитием перитонита.
Источник: http://meduniver.com/Medical/Xirurgia/1547.html MedUniver
2) Перекрестная дистопия почки
Перекрестная дистопия почки — редкая аномалия. Она характеризуется смещением почки на противоположную сторону, вследствие чего обе почки оказываются расположенными с одной стороны. В большинстве случаев обе почки срастаются, образуя S- или L-образную почку.
Клинические проявления гетеролатеральной дистопии такие же, как и гомолатеральной. Гетеролатерально дистопированная почка находится в таких же неблагоприятных условиях кровоснабжения, венозного и лимфатического оттока. У нее сохраняются условия для нарушения уродинамики. Диагностические ошибки при перекрестной дистопии аналогичны ошибкам при установлении диагноза простой дистопии. Перекрестная дистопия почек значительно чаще сопровождается гидронефрозом одной из почек, нефролитиазом. А. И. Якимиди (1967) описал сочетание перекрестной дистопии почек со сращением и эхинококкозом дистопированной почки.
Мы наблюдали 3 больных с гипернефроидным раком нижней половины (смещенной почки) L- и S-образной почки, 4 — с калькулезным пионефрозом, 1 — с солитарной кистой, 6 — с гидронефрозом, обусловленным врожденной стриктурой (фиброзный парус), высоким отхождением мочеточника, добавочным нижнеполярным сосудом. Во всех случаях верхняя половина почки была в норме. Перекрестная дистопия может быть одно- и двусторонней. В исключительно редких случаях встречается дистопия единственной врожденной почки.
По мнению А. Я. Пытеля, Г. М. Чебанюк (1969), в начальный эмбриональный период обе почки развиты нормально, но затем при восхождении одна из них пересекает срединную линию и располагается на противоположной стороне, при этом часто соединяясь с другой, нормально расположенной почкой. Имеется предположение, что дистопированная почка вследствие раннего смещения ее более правильно развивающейся почкой увлекается последней вверх на противоположную сторону.
Перекрестная дистопия отмечается приблизительно в 1:10 000—12 000 вскрытий. Кровоснабжение перекрестнодистопированной почки очень сложное. Если дистопия возникает поздно, то сосуды, питающие почку, отходят ниже, чем обычно, на той же стороне. Если транспозиция произойдет рано, они отходят на противоположной стороне, то есть с той стороны аорты и ее основных ветвей, куда переместилась почка. Артерии дистопированной почки всегда множественные, часто перекрещиваются с мочеточником.
При перекрестной дистопии нормальная почка, расположенная на нормальном уровне, имеет обычную форму и размеры. Дистопированная почка находится ниже и медиальней основной почки. Она уменьшена в размерах, не полностью ротирована. При перекрестной дистопии почки оба мочеточника открываются в мочевом пузыре, как и при нормальном расположении почек. Мочепузырный треугольник сохранен. Перекрестная дистопия единственной почки описывается как казуистика и в большинстве наблюдений сочетается с аномалией половых органов. Диагноз ставят на основании результатов выделительной урографии, сканирования, сцинтиграфии, почечной аортографии.
Экскреторная урография позволяет определить ход мочеточника дистопированной почки и ее функцию. При почечной ангиографии не только уточняют кровоснабжение дистопированной почки, но и в нефрографическую фазу отмечают отсутствие сращения между дистопированной и нормальной почками. Дифференциальную диагностику при перекрестной дистопии почки проводят с нефроптозом и опухолью брюшной полости. Решающее диагностическое значение имеет почечная ангиография. Снимки производят в положении больного лежа и стоя.
При здоровой дистопированной почке больной в лечении не нуждается. Если появляются симптомы со стороны близлежащих органов в связи со сдавленней их, проводят симптоматическое лечение. При заболеваниях дистопированной почки (нефролитиаз, гидронефроз, опухоли и др.) иногда приходится применять оперативное лечение. Выполнение операций на дистопи-рованных почках затруднено. Трудности возрастают пропорционально степени дистопии почки. Имеют значение своеобразие оперативного доступа, топо-графо-анатомические взаимоотношения с окружающими органами и тканями, особенности кровоснабжения. Нефрэктомия показана в тех случаях, когда функция дистопированной почки резко снижена (если вторая почка может обеспечить гомеостаз). Если тазовая дистопия почки препятствует беременности, нужно индивидуально решать вопрос о показаниях к нефрэктомии. Наибольшее количество операций на дистопированных почках производят по поводу нефролитиаза. Корригирующие операции при гидронефрозе на дистопированных почках затруднены в связи с особенностью анатомического отхождения мочеточника от передней поверхности лоханки, наличием множественных сосудов почки, которые нередко перекрещивают мочеточник. У детей рекомендуется трансперитонеальный доступ к дистопированной почке, особенно при расположении ее в тазу. Этот доступ облегчает манипуляции на лоханочно-уретеральном сегменте и на лоханке, так как эти образования расположены на передней поверхности дистопированной почки, а подвижность почки резко ограничена из-за фиксации ее множественными короткими сосудами.
Удвоение почки характеризуется наличием двух лоханок в одном массиве почечной паренхимы. Это самая частая аномалия почки, встречающаяся у 1 из 150 новорожденных, причем у девочек в 2 раза чаще, чем у мальчиков. Она может быть одно- и двусторонней. Возникновение аномалии связано с расщеплением мочеточникового зачатка в самом начале или на пути перед врастанием его в нефрогенную бластему.
Верхний сегмент почки составляет около 1/3 всей почечной паренхимы, дренируется верхней группой чашечек, впадающих в отдельную лоханку. В лоханку нижнего сегмента впадают средняя и нижняя группы чашечек. Примерно в половине случаев каждый сегмент (пиелон) удвоенной почки имеет изолированное кровообращение из аорты.
Мочеточники, отходящие от лоханок удвоенной почки, проходят рядом, зачастую в одном фасциальном влагалище, и впадают в мочевой пузырь либо раздельно (рис. 192), либо сливаются в один ствол на том или ином уровне. При слиянии мочеточников речь идет о неполном их удвоении (рис. 193). Это состояние чревато возникновением уретеро-уретерального рефлюкса, связанного с несинхронным сокращением и расслаблением ветвей мочеточника. Уретеро-уретеральный рефлюкс является функциональным препятствием, способствующим застою мочи, развитию пиелонефрита. При полном удвоении мочеточника основной ствол, отходящий от нижнего сегмента удвоенной почки, открывается в углу лиетодиева треугольника, а второй — рядом или дистальнее (закон Вейгерта — Мейера). Нередко устье удвоенного мочеточника оказывается суженным, что приводит к образованию кистозной полости, вдающейся в просвет мочевого пузыря (уретероцеле; рис. 194).

Рис. 192. Полное удвоение мочеточников. Экскреторная урограмма.
Яндекс.Директ
|
Рис. 193. Неполное удвоение правого мочеточника. Экскреторная урограмма. Стрелкой указано место слияния мочеточников.
Удвоение мочеточников в ряде случаев является причиной пузырно-мочеточникового рефлюкса ввиду неполноценности замыкательного механизма устьев. Чаще рефлюкс происходит в нижний (основной) сегмент удвоенной почки.
Аномальное строение почки и мочеточников способствует развитию различных приобретенных заболеваний (примерно в 30%), из которых на первом месте стоит пиелонефрит. Последний наиболее часто поражает верхний пиелон, быстро разрушая его и вызывая вторичное сморщивание паренхимы. При этом соответствующий мочеточник оказывается значительно удлиненным, расширенным, извитым (мегауретер).
Человек с удвоенной почкой может прожить долгую жизнь без каких-либо жалоб и клинических проявлений. Аномалия выявляется обычно при обследовании по поводу пиелонефрита.
На экскреторных урограммах верхний пиелон может не выявиться ввиду его функциональной неполноценности. Однако опосредованно можно судить о его существовании на основании смещения нижнего сегмента вниз и латерально и уменьшенного количества чашечек.
При подозрении на удвоение почки необходимо выполнять отсроченные снимки через 1—6 ч.
При цистоскопии устье добавочного мочеточника обнаруживается дистальнее и латеральнее основного. Наличие большого уре-тероцеле затрудняет цистоскопию иногда настолько, что не удается идентифицировать устья мочеточника.
Лечение. Оперативное лечение при удвоении почек и мочеточников показано в следующих случаях:
1) при полной анатомической и функциональной деструкции одного или обоих сегментов почки производят геминефруретерэктомию или нефрэкто-мию;
2) при рефлюксе в один из мочеточников накладывают уре-теро-уретеро- или пиело-пиелоанастомоз; если оба мочеточника рефлюксированы, производят антирефлюксную операцию: поделизистую туннелизацию мочеточников одним блоком;
3) при наличии уретероцеле показано его иссечение с неоимплантацией мочеточников; в случае гибели соответствующего сегмента почки уретероцеле можно не иссекать, а удалить нефункционирующий сегмент почки и мочеточник максимально близко к мочевому пузырю во избежание развития эмпиемы культи.
3) Кишечная непроходимость
Кишечная непроходимость - острое хирургическое заболевание, возникающее в результате прекращения прохождения пищевого комка или каловых масс по кишечнику.
Последствия кишечной непроходимости в организме:
нарушение пищеварения и всасывания питательных веществ в кровь;
самоотравление организма продуктами распада;
нарушение всасывания воды и рвоты приводит к обезвоживанию организма;
развитие смертельно опасных осложнений таких, как перитонит, сепсис.
Клиническая картина
Общими симптомами патологии, независимо от локализации поражения, являются следующие:
боль,
задержка стула,
задержка газов,
рвота.
Острая кишечная непроходимость всегда начинается с сильной, нестерпимой внезапной боли. Особенностью ее является схваткообразный характер, при чем каждая схватка совпадает с волной перистальтики. В период между схватками состояние больного длительное время остается стабильным. Боль вызывает беспокойство, лицо искажает гримаса ужаса. Человек принимает вынужденную позу, которая облегчает боль - коленно-локтевую или на корточках. Боль по интенсивности можно сравнить только с родовыми схватками.
Постепенно состояние больного ухудшается, появляются симптомы шока:
бледность кожных покровов,
учащенный слабый пульс,
холодный пот,
илеусный стон.
Боль стихает или становится постоянной при развитии некроза кишки, снижении ее тонуса и развитии пареза кишечника.
Кишечная непроходимость при отсутствии своевременной медицинской помощи всегда заканчивается развитием перитонита.
Рвота как симптом острой кишечной непроходимости имеет свои отличительные черты. Характер содержимого, интенсивность ее зависят от вида непроходимости и высоты препятствия: чем оно выше, тем сильнее рвота.
Особенностью рвоты при данном заболевании является то, что она не приносит облегчения, и больной долгое время ощущает позывы. За счет частых приступов и обильного содержимого быстро наступает обезвоживание организма, потеря белка и электролитов. Интоксикация нарастает, сгущается кровь, наблюдается значительный лейкоцитоз.
Патогномоничный симптом острой кишечной непроходимости – стойкий запор. При расположении препятствия в толстой кишке стул может отсутствовать много дней, а исследование прямой кишки пальцем указывает на отсутствие кала в ампуле.
При высокой кишечной непроходимости запора может и не быть: нижние отделы кишечника опорожняются самостоятельно или при помощи клизмы.
Обтурационная непроходимость нижних отделов кишечника может поддержать состояние больного стабильным в течение трех дней.
Странгуляционной непроходимости, наличие препятствия в верхних отделах кишечника, а также динамическая непроходимость в результате тромбоза сосудов брыжейки резко ухудшают состояние больного: развивается тахикардия, падает артериальное давление.
Метеоризм является характерным симптомом кишечной непроходимости. Чаще всего вздутие живота ограничено зоной поражения, отчетливо виден контур раздутой кишки через брюшную стенку. На последних стадиях заболевания вздувается и расширяется петля над препятствием. При покачивании двумя руками брюшной стенки над вздутой кишкой слышен «шум плеска» жидкости, который указывает на скопление в атоничной кишке пищеварительного сока.
Виды кишечной непроходимости
Соответственно отделам кишечника, различают верхнюю кишечную непроходимость (в тонком кишечнике) и нижнюю кишечную непроходимость (в толстом кишечнике).
Механизм развития
Механизм пагубного влияния на организм кишечной непроходимости заключается в следующих состояниях:
нарушение поступления питательных веществ за счет прекращения пищеварения.
отравление организма продуктами чрезмерного распада компонентов пищи.
активация флоры кишечника и развитие перитонита, с последующим сепсисом и риском смерти.
нарушение водно-электролитного баланса организма, в результате нарушения всасывающей функции кишечника и рвоты.
В зависимости от вида кишечной непроходимости, различны этапность и выраженность наступления отрицательных эффектов заболевания.
Верхняя кишечная непроходимость
Верхняя кишечная непроходимость чаще всего встречается в более молодом возрасте (до 45 лет). Очень часто она наблюдается у детей ранних лет жизни.
Ее основные причины.
инвагинация кишечника. Это вхождение двух соседних отделов кишечника - один в другой. Чаще всего встречается у детей и связано с нарушением процессов перистальтики (ритмичного, последовательного процесса поперечного сокращения кишечника).
пережатие петель кишечника друг об друга. Также, не редко встречается у детей из-за нарушения перистальтики. Но может быть и в более старшем возрасте. Например, при переедании после продолжительного голода.
сдавление участка кишки из вне. Например, опухоль брюшной полости.
перекрытие просвета кишечника. Опять же, при ее опухоли.
Развитие непроходимости и ее признаки
Верхнекишечная непроходимость имеет тенденции к более раннему появления признаков. Это, в первую очередь связанно с более высокой активностью тонкого кишечника, его меньшим диаметром и близостью желудка. А также высокой активностью пищеварительных ферментов, как кишечника, так и поджелудочной железы.
Признаки
При верхнекиченой непроходимости беспокоят боли в верхней половине живота. Они чаще всего схваткообразные. Относительно быстро наступает тошнота (буквально в течение 1-2 часов) и рвота. Она содержит остатки не переваренной пищи и желчь. Внешне неприятного, желтозеленного цвета.
Нижняя кишечная непроходимость
Она связанна с прекращением прохождения каловых масс (в толстом кишечнике пища уже окончательно переваривается и превращается в кал) по толстому кишечнику.
Причины
Чаще всего, этот вид кишечной непроходимости встречается в пожилом возрасте.
На первом месте, среди причин, стоит перекрытие просвета кишечника опухолью. Реже, наблюдается сдавление из вне. И, совсем редко может наблюдаться перекрут кишки. Обычно, он бывает в так называемом поперечном отделе ободочной кишки.
Признаки
Нижняя кишечная непроходимость развивается медленнее. Чаще всего, ей предшествуют длительные периоды запоров.
Боли беспокоят не так выражено. Они локализованы нижнем отделе живота.
Тошнота наступает спустя несколько часов. Обычно, от 6 до 10. Рвота еще позже. Но она имеет каловых характер - коричневые или серые массы, с неприятным, зловонным запахом.
Диагностика кишечной непроходимости
Объективными диагностическими признаками являются следующие:
Симптом видимой перистальтики. Усиленная перистальтика хорошо заметна у худощавых людей.
Симптом Мондора — наличие ригидности передней брюшной стенки, живот по консистенции напоминает надутый мяч. Появляется на поздних сроках развития патологии.
Симптомы острого живота такие, как напряжение мышц, болезненная пальпация, признаки раздражения брюшины, развиваются в более поздние сроки заболевания и являются проявлениями перитонита.
Пальпаторно: уплотненный участок кишки во время схватки и характерный симптом Валя — растянутая петля кишечника.
Перкуссионно: над растянутой кишкой — тимпанит с металлическим оттенком ( симптом Кивуля ).
Аускультативно: усиление кишечного шума во время схватки, громкое урчание.
Рентгенологическое исследование: наличие чаш Клойбера указывает на кишечную непроходимость. Они формируются в результате скопления жидкости в раздутых петлях кишеника.
Рентгенографическое исследования с барием определит точную локализацию патологии.
Колоноскопия — современный метод диагностики различных заболеваний кишечника, позволяющий определить характер патологии, изменения слизистой кишечника, а при непроходимости даже ввести трубку в суженную часть кишки.
Ректальное исследование у мужчин и влагалищное у женщин некоторых случаях позволяют определить причину сужения или закрытия просвета кишки.
Лечение кишечной непроходимости
Больного с острой кишечной непроходимостью срочно госпитализируют в хирургический стационар. Лечение проводят консервативное, если у больного нетсимптомов перитонита.
Терапия заключается в борьбе с обезвоживанием и направлена на восстановление необходимого количества жидкости и электролитов в организме. Для этого во время транспортировки больного вводят внутривенно физиологический раствор, глюкозу, реополиглюкин.
В стационаре консервативное лечение заключается в отсасывании содержимого желудка и кишечника через зонд, в ослаблении перистальтики спазмолитиками.
При неэффективном лечении проводят операцию, которая состоит из рассечения спаек, раскручивания заворотов, наложения кишечного свища для выведения содержимого при наличии опухоли в толстом кишечнике.
После операции назначают больному введение солевых растворов, заменителей крови, а также противовоспалительную терапию, стимуляцию моторной функции кишечника.
24 билет
Водянка яичка – это заболевание, связанное с накоплением избытка жидкости в пространстве между яичком и оболочкой, его окружающей. В литературе можно встретить так же название гидроцеле.
Причины водянки яичка у новорожденного ребенка
В процессе развития, яички образуются внутри живота (в брюшине). Постепенно яички мигрируют, опускаясь в мошонку. Процесс опущения яичек в мошонку в норме завершается до начала родов, и ребенок рождается с яичками в мошонке. В редких случаях одно или два яичка не успевают опуститься в мошонку до начала родов, и тогда развивается такое состояние, как крипторхизм. Когда яички мигрируют в мошонку, они на своем пути захватывают различные ткани, которые образуют как бы ложе, в котором находится яичко, и формируют его оболочки. В норме, процесс миграции яичек должен завершиться заращением этих оболочек сверху, и, таким образом, создается замкнутое пространство. Если этого не происходит, образуется проток, который сообщается с брюшиной. В брюшной полости образуется серозная жидкость, которая через сообщающийся проток попадает внутрь мошонки. Таким образом, развивается врожденная водянка яичка.
Так же развитию врожденной водянки яичка способствует несовершенство процессов всасывания жидкости оболочками яичка. В норме оболочки яичка продуцируют жидкость, которая увлажняет яички, и снижает трение яичек об оболочки. Эти же оболочки всасывают избыток жидкости обратно. У новорожденных детей процесс всасывания может быть снижен из-за несовершенства лимфатической системы. Получается, что жидкости образуется больше, чем ее всасывается. Избыток жидкости способствует развитию водянки яичка. Водянка яичка – довольно частое заболевание (встречается у 10% новорожденных детей).
Развитию врожденной водянки яичка способствуют: простудные заболевания матери во время беременности, курение матери, наследственность (если у отца в период новорожденности была водянка, то это увеличивает шанс появления ее у его сына).
Причины острой водянки яичка
У более взрослых детей может наблюдаться острая водянка. Она развивается при травмах половых органов (ударах) и при инфекционных заболеваниях. В этих случаях в полости между яичком и его оболочками скапливается кровь либо гной.
Симптомы водянки яичка у детей
Водянка яичка проявляется отечностью и увеличением яичка. Чаще всего водянка развивается только с одной стороны (изолированная водянка яичка). Однако, в редких случаях, может наблюдаться водянка обоих яичек. В этом случае отекает вся мошонка. При водянке яичка на ощупь определяется движение жидкости внутри мошонки. Яичко может не определяться при значительном отеке, если отек минимальный, можно прощупать нижний полюс яичка в мошонке. Если полость вокруг яичка сообщается с брюшной полостью, то в положении лежа и при прощупывании жидкость оттекает в брюшную полость и отек уменьшается.
Беспокойства ребенку водянка яичка не доставляет никакого. Причиной обращения к врачу обычно является обнаружение родителями увеличенного яичка. Так же очень часто водянку яичка впервые обнаруживает врач при плановом осмотре ребенка в поликлинике. В этом случае родители не предъявляют никаких жалоб.
При остро возникшей травматической водянке яичка, чаще всего беспокоит болезненность в паховой области, но она связана только с полученной травмой. При инфекционной водянке яичка может наблюдаться увеличение температуры тела, ощущение болезненности, тяжести в паховой области.
Обследование ребенка с водянкой яичка
Отличать водянку яичка необходимо от паховой грыжи, при которой так же происходит увеличение мошонки. При паховой грыже можно провести вправление грыжи пальцем. Во время вправления слышен характерный «булькающий» звук, и происходит уменьшение объема мошонки. При водянке яичка, когда проток сообщается с брюшной полостью, при пальпации так же происходит уменьшение объема мошонки, однако не наблюдается характерного звука, и уменьшение объема происходит намного медленнее.
Так же в диагностике водянки помогает такой метод исследования как диафаноскопия. Суть этого метода заключается в том, что мошонку просвечивают при помощи фонарика. Так как жидкость хорошо пропускает свет, хорошо различимы все структурные образования в мошонке. Если же в мошонке скапливается гной, кровь или есть опухолевое образование, они не пропускают свет, и мошонка плохо просвечивается. В сложных случаях, когда нельзя исключить опухолевого заболевания, производят ультразвуковое исследование мошонки, в которой, при водянке яичка, определяется свободная жидкость.
Лечение водянки яичка
Врожденная водянка в лечении обычно не нуждается до 2-х летнего возраста, так как в этот период происходит зарастание протока, соединяющего брюшную полость с полостью вокруг яичка. После того, как проток зарастает, жидкость из брюшной полости прекращает поступать в полость вокруг яичка, а избыток жидкости постепенно всасывается оболочками яичка.
Если водянка яичка сохраняется после двухлетнего возраста, производят операцию на мошонке. Во время этой операции под наркозом производят рассечение оболочки, покрывающей яичко. Эту оболочку выворачивают и сшивают позади яичка.
В сложных случаях, когда у ребенка, не достигшего двухлетнего возраста, отек яичка слишком интенсивный, производят пункции пространства вокруг яичка и откачку жидкости. При повторном образовании повышенного объема жидкости, операцию по ее удалению при помощи пункции повторяют еще раз. Такую манипуляцию необходимо повторять по мере необходимости до достижения ребенком двухлетнего возраста, после чего производят оперативное вмешательство. В критических случаях операцию проводят раньше.
При острой водянке яичка необходимо лечение заболевания, вызвавшего появление отека. При интенсивном отеке показана пункция с удалением жидкости. При инфекционном заболевании показана антибактериальная терапия. При травматическом повреждении ребенка наблюдают, оперативное вмешательство показано только при интенсивном отеке.
Осложнения водянки яичка у детей
Отдаленных последствий после перенесенной водянки яичка не наблюдается. Дети совершенно не отличаются в своем развитии от сверстников. При длительной водянке яичка, когда отек достаточно интенсивный, может наблюдаться атрофия яичка. Поэтому очень важно вовремя обратиться к врачу.
2) Пупочная грыжа у ребенка. Симптомы и лечение
Грыжа — выпячивание внутренних органов из полости, в которой они расположены, через дефекты в стенке этой полости. У младенцев пупочная грыжа появляется из-за внутриутробных пороков развития (незаращение пупочного кольца). Она может быть вызвана также плохо перевязанной пуповиной или скоплением газов. Иногда грыжа появляется при крике ребенка и легко вправляется в состоянии покоя.
Симптомы пупочной грыжи у детей
Пупочная грыжа является одной из самых частых хирургических патологий детского возраста и встречается у каждого пятого ребенка, а среди недоношенных детей - у каждого третьего. При рождении минимальный дефект пупочного кольца определяется практически у каждого новорожденного. При крике, плаче младенца появляется грыжевое выпячивание, что обычно настораживает родителей. Часто родители связывают беспокойство ребенка с наличием пупочной грыжи, однако случаи ущемления пупочной грыжи у младенцев крайне редки.
Пупочная грыжа чаще всего возникает в периоде новорожденности и, как правило, в первый месяц после рождения ребенка. Через некоторое время после отпадения пуповинного остатка может появиться выпячивание в области пупка, которое легко вправляется в брюшную полость. Пупок при этом может торчать на 1-2 см дальше живота. Но торчащий пупок однозначно не говорит о наличии пупочной грыжи, а может быть просто анатомической особенностью.
Пупочная грыжа - это не торчащий пупок, а следствие дефекта передней брюшной стенки, вызванного слабостью пупочного кольца, то есть грыжа прощупывается под пупком. Она может возникнуть в результате сильного кашля, запоров, продолжительного плача. Такие заболевания, как рахит, гипотрофия, снижающие тонус мышц, также создают благоприятные условия для образования пупочной грыжи. Внешне пупочная грыжа проявляется округлым или овальным выпячиванием в области пупочного кольца, которое легко вправляется в брюшную полость. Часто наряду с пупочной грыжей наблюдается расхождение прямых мышц живота из-за слабости мышц передней брюшной стенки.
Величина грыжевого выпячивания зависит от размеров пупочного кольца. Пупочное кольцо — это мышца, окружающая пупок; во время родов акушерка отсекает пуповину, и мышцы, окружающие пупок, сокращаются, поскольку малыш более не нуждается в получении питания через пуповину. При малых его размерах грыжа может лишь иногда появляться во время плача ребенка или при беспокойстве. При прощупывании педиатром области пупка палец "проваливается" в брюшную полость, данный метод дает возможность врачу определить размеры пупочного кольца и четко определить края грыжевых ворот.
Краями грыжевых ворот называют область, окружающую грыжевое выпячивание. При значительных размерах пупочного кольца (и, соответственно, грыжи) постоянно видна припухлость в области пупка, которая увеличивается во время плача и при натуживании. Размеры грыжи могут постепенно увеличиваться в первые месяцы после ее появления.
Грыжа может появиться и после того, как ребенок станет ходить и может быть следствием раннего принятия вертикального положения.
Опыт амбулаторного наблюдения детей с пупочными грыжами, диагностированными в раннем возрасте, позволяет с уверенностью сказать, что к 5-7 летнему возрасту часто наступает самоизлечение. Ликвидации грыжи способствует укрепление брюшной стенки. Это массаж, укладывание детей на животик, гимнастика. Хирургическое лечение начинают не ранее 5 летнего возраста. Правильно и аккуратно проведенная операция, позволяет устранить грыжу с хорошим косметическим эффектом. Как правило, рецидивов не бывает.
Причины появления пупочной грыжи у детей.
На 4-5 сутки после рождения ребенка отпадает пуповина. Пупочное кольцо состоит из двух частей. Нижняя часть, где проходят пупочные артерии и мочевой проток, хорошо сокращаются и образуют плотную рубцовую ткань. В верхней части проходит пупочная вена. Ее стенки тонкие, не имеют мышечной оболочки, плохо сокращаются в дальнейшем. Нередко при слабой брюшинной фасции и незаращенной пупочной вене образуется пупочная грыжа. Кроме этого, важнейшим фактором, способствующим возникновению этой патологии, является частое повышение внутрибрюшного давления. Оно может быть вызвано, например, частым плачем ребенка, газами, запорами. Отверстие в верхней части пупочного кольца может быть широким, и не причинять беспокойство ребенку. Но в случае небольшого дефекта с твердыми краями беспокойство ребенка возможно. Как правило, пупочная грыжа у детей всегда вправимая. Ущемленную пупочную грыжу чаще можно встретить во взрослой практике. Однако, нередко приходится оперировать детей с невправимыми грыжами (когда грыжевое содержимое прикрепляется к внутренней стенки кожи передней брюшной стенки спайками).
Основная причина возникновения пупочных грыж — наследственная предрасположенность слабости мышц передней брюшной стенки. Это значит, что если отец или мать ребенка сами в детстве имели данную патологию, то вероятность того, что их ребенок будет иметь грыжу, составляет приблизительно 70%. Однако бывают случаи, когда родители не имели данной патологии в детстве, а у малыша вдруг появляется пупочная грыжа.
Бытует мнение, что пупочная грыжа может возникнуть из-за того, что акушерка во время родов "неправильно" отрезала пуповину. Это не так: техника наложения пупочной скобки не влияет на возникновение пупочной грыжи у детей. Возникает пупочная грыжа при анатомической слабости мышечной ткани в области пупка.
Содержимым пупочной грыжи обычно являются кишечные петли. Грыжевое выпячивание при легком надавливании свободно убирается вовнутрь. При очень широком пупочном кольце и большой грыже внешне иногда бывает видна перистальтика кишечника, то есть сокращение мышц кишечника и продвижение пищи по нему, что очень пугает многих родителей, однако малышу это не доставляет неудобства.
Диагноз "пупочная грыжа" ставит при осмотре врач-педиатр, наблюдающий ребенка. В дальнейшем доктор может направить малыша на консультацию к хирургу для получения дополнительных рекомендаций по лечению данного состояния.
Как чувствует себя ребенок с пупочной грыжей
Ущемление пупочных грыж, то есть сжатие содержимого выпячивания, практически не наблюдается. Однако многие педиатры замечают, что дети с грыжами бывают более беспокойными по сравнению со сверстниками, а также чувствительными к изменениям погоды. Ребенок не испытывает боли из-за самой грыжи, однако наличие данного состояния у малыша часто сопровождается вздутием живота, что и приводит к беспокойству крохи. Наличие пупочной грыжи у ребенка является в большей степени косметическим дефектом.
При правильном развитии ребенка, нормализации деятельности кишечника, достаточной двигательной активности, может наступить самоизлечение пупочной грыжи. Пупочные грыжи у детей склонны к самоизлечению даже при довольно больших размерах пупочного кольца и грыжевого выпячивания. Тем не менее, чрезвычайно полезно выполнять специальные упражнения, способствующие укреплению мышц передней брюшной стенки, и делать тонизирующий массаж живота.
Чем может помочь ребенку врач
Почти во всех случаях он посоветует подождать. Если пупочная грыжа не закроется сама собой, может понадобиться операция, однако обычно ее проведение откладывается до того времени, когда ребенку исполнится пять-шесть лет. У мальчиков оперативное закрытие пупочного кольца делается лишь в том случае, если грыжа причиняет боль. Девочек в этом возрасте оперируют и при отсутствии недомоганий, поскольку грыжа впоследствии может сказаться на вынашивании беременности.
Лечение пупочной грыжи у детей Что делать, если у ребенка диагностировали грыжу?
Пупочные грыжи у детей склонны к спонтанному закрытию. При этом важен размер дефекта пупочного кольца: при его диаметре менее 1,5 см, как правило, к 3-5 годам жизни отмечается закрытие дефекта. Если пупочная грыжа сохраняется после 5 лет, уточните у хирурга необходимость оперативного лечения.
При наличии дефекта пупочного кольца большого диаметра, самостоятельное закрытие практически невозможно, что также требует проведения операции - возможно, в более раннем возрасте (3-4 года). Таким образом, пупочная грыжа требует наблюдения ребенка у детского хирурга для определения тактики лечения.
К консервативным мероприятиям, направленным на закрытие дефекта пупочного кольца у детей до года, можно отнести общий массаж, массаж передней брюшной стенки, выкладывание на живот, лечебную физкультуру.
Общий массаж и лечебную физкультуру проводят массажисты и врачи ЛФК.
Массаж передней брюшной стенки - поглаживание живота по часовой стрелке - могут делать родители перед каждым кормлением, после чего ребенка рекомендуется выложить на живот на 5- 10 минут. Однако при грыжах большого размера не следует уповать на данные методы.
Рекомендуется выкладывать малыша за 10-15 минут до кормления 2-3 раза в день на ровную твердую поверхность. Это может быть пеленальный столик или стол, накрытый пеленкой. Обязательно находитесь рядом с ребенком, не оставляйте его ни на секунду, даже если ваш малыш еще не умеет переворачиваться.
Во время выкладывания будет полезно провести легкий массаж спинки, ножек и ручек вашего крохи, достаточно просто поглаживания от кончиков пальчиков вверх, от ягодиц к плечикам.
Вторым методом массажа для консервативного лечения пупочной грыжи, а также методом профилактики возникновения данного состояния является массаж живота. Массаж в условиях поликлиники по назначению наблюдающего педиатра, как правило, проводится после достижения ребенком двух месяцев. Однако сами вы можете проводить массаж сразу же после заживления пупочной ранки. Самым маленьким крошкам достаточно провести всего три-четыре легких поглаживающих движения животика по часовой стрелке, начиная с правой подвздошной области к левой, то есть от правой нижней части живота к левой нижней области. Поглаживающий массаж расслабляет мышцы, поэтому движения должны быть очень нежными, комфортными для ребенка. Этот прием проводится ладонной поверхностью кисти.
Массаж детишкам постарше можно проводить по методике "I love U". Данный массаж поможет при метеоризме (вздутии животика), при коликах и при пупочной грыже. Представьте на поверхности животика вашего ребенка перевернутую букву U; так же выглядит и кишечник. Нанесите на свои ладони немного масла для массажа и разминайте животик малыша своими лежащими плашмя пальцами круговыми движениями. Сначала пройдитесь сверху вниз по левой стороне животика ребенка, написав букву "I" (для вас это будет справа). Этим движением вы перемещаете газы вниз, изгоняя их из нисходящей части ободочной кишки. Затем нарисуйте перевернутую букву "L", продвигая перистальтику и газы по поперечному участку ободочной кишки, затем снова вниз по нисходящему участку ободочной кишки (это верхняя часть живота) и далее — снова вниз по левой стороне живота ребенка. Затем изобразите перевернутую букву "U", идя вверх по восходящему участку ободочной кишки, затем по поперечному и далее вниз по нисходящему, то есть справа снизу вверх, затем по верхней части живота и далее — сверху вниз по левой стороне живота малыша.
Особое внимание следует уделить околопупочной области, так как именно из-за слабости прямых мышц живота формируется расширенное пупочное кольцо и, следовательно, пупочная грыжа. Прямые мышцы живота находятся справа и слева от пупка и закрывают почти всю переднюю брюшную стенку. Расположите большой и указательный пальцы справа и слева от пупка ребенка на расстоянии примерно 1-2 см от центра пупка и мелкими точечными движениями сделайте десять нажатий. Такие же нажатия сделайте сверху и снизу от пупка. Движения должны быть нежными и не доставлять дискомфорта малышу. Затем на таком же расстоянии от пупка указательным и средним пальцами проведите десять круговых движений по часовой стрелке. И в завершение вдавите грыжевое выпячивание внутрь животика. Интенсивность данных процедур должна быть комфортной для вашего малыша. В течение дня массаж околопупочной области желательно проводить два-три раза. Длительность процедур составляет не более 5 минут; желательно проводить их до кормления ребенка. Некоторые малыши предпочитают, чтобы им массировали животик до купания, другим больше нравится получение процедур после ванны. Вопрос об этом решается каждый раз индивидуально, в зависимости от состояния ребенка. Как упоминалось выше, детишки с пупочными грыжами чувствительны к перемене погоды, и если малыш капризничает, то проведение массажа лучше отложить до более благоприятного момента.
И еще одним методом консервативного лечения пупочной грыжи является наложение лейкопластырной повязки. Наложение такой повязки как метод лечения пупочной грыжи может быть рекомендовано наблюдающим педиатром или хирургом. Существует несколько способов наложения пластыря. Пластыри для лечения пупочных грыж выпускают различные фирмы (Chicco, Hartmann); такие пластыри продаются в аптеках и детских магазинах. Пластырная повязка накладывается врачом на 10 дней широкой полосой (желательно 4 см), от одной поясничной области до другой, то есть повязка будет наложена вокруг живота. При этом грыжевое выпячивание вправляется пальцем, а прямые мышцы живота соединяются над пупочным кольцом в виде двух продольных складок. При правильном наложении эти складки под пластырем должны остаться (не расправиться). Если после снятия повязки выявляется, что пупочное кольцо не сомкнулось и грыжа осталась, то повязку можно наложить еще на 10 дней. Проведение курса трехкратного наложения повязки (3 раза по 10 дней) бывает достаточно для полного излечения. Данный вариант метода наложения пластыря современные педиатры используют редко, поскольку пластырь может вызвать раздражение нежной кожи ребенка.
Существует также методика наложения пластыря непосредственно на околопупочную область в течение нескольких недель, без формирования складки. Пластырь необходимо менять каждые два-три дня, при этом малыша купают каждый день, не снимая повязки. Этот метод является более щадящим, а родители сами могут поменять пластырь, не прибегая к помощи врача. При применении данного метода рекомендуется использовать гипоаллергенный пластырь, который не нужно снимать во время купания. Если стоит вопрос о применении пластырной повязки в качестве лечения пупочной грыжи, то тактику и метод наложения повязки определяет врач при осмотре ребенка с пупочной грыжей. Детям, которым наложен пластырь, также рекомендуется проводить легкий массаж животика по описанной выше методике, выкладывание на живот. Весь комплекс консервативных мероприятий лечения пупочной грыжи (выкладывание на живот, массаж живота, наложение лейкопластырной повязки) должен проводиться лишь после полного заживления пупочной ранки и при отсутствии изменений кожи, в том числе воспалительных и аллергических реакций в области пупка.
Если весь комплекс проводимых мероприятий консервативного лечения оказался неэффективным и грыжа у ребенка сохраняется после 3 лет, то решается вопрос об оперативном вмешательстве совместно педиатр и хирург.
Методика проведения массажа и лечебной гимнастики при пупочной грыже у детей
С первых дней жизни следует выкладывать ребенка на живот на несколько минут перед каждым кормлением. В этом положении он поднимает голову, активно двигает руками и ногами, напрягает мышцы спины и живота.
Лечебный массаж можно начинать с 2-3 недель жизни после заживления пупочной ранки. Проводить его следует в сочетании с общим массажем. Все упражнения лечебной гимнастики должны выполняться только после вправления грыжи и закрепления ее повязкой (лейкопластырем). Если вправить грыжу не удается, то во время процедуры одной рукой ее необходимо утопить, прижав пальцами, а другой рукой выполнять массажные движения.
Приемы массажа при пупочной грыже: круговое поглаживание живота по часовой стрелке; встречное поглаживание; поглаживание косых мышц; растирание живота (делается с месячного возраста); пощипывание вокруг пупка. Все приемы массажа, направленные на повышение тонуса мышц брюшной стенки, должны чередоваться с успокаивающим круговым поглаживанием. Для детей в возрасте 4-5 месяцев рекомендуются "парение" на спине; присаживание с поддержкой за выпрямленные и отведенные в стороны руки; присаживание с поддержкой за согнутые руки; самостоятельные повороты со спины на живот. Детям постарше рекомендуются присаживание с поддержкой за кольца, за одну руку, без поддержки; напряженное выгибание позвоночника; поднимание выпрямленных ног; наклоны и выпрямление туловища; упражнение "возьми игрушку со стула".
По рекомендации врача можно проводить точечный массаж: подушечками выпрямленных пальцев быстро и отрывисто надавливать на точки вокруг пупка, что вызывает напряжение мышц и вправление грыжи.
Массаж области пупка - подробная методика выполнения
Три пальца правой руки прикладывают к обла сти пупка так, что средний палец (длинный) идет в область пупочного кольца (в сам пупок), второй и четвертый пальцы — рядом, без промежутков. Движения по кольцевой вправо и влево выполняются с умеренным нажимом по 25 раз в обе стороны. Можно делать массаж косточками пальцев, сжатых в кулачок.
Ребром ладони делают движения по пупочному кольцу по часовой стрелке 25 раз. Продольные движения по пупочному кольцу производятся четырьмя пальцами (2—5): одновременно одна рука идет вверх, другая — вниз и наоборот 25 раз.
Движения пальцами производятся с боковых сторон живота к пупочному кольцу.
Все элементы массажа надо выполнять с умеренным нажимом.
Массаж выполняется 2-3 раза в день перед кормлением ребенка через пеленку или рубашку, чтобы не натереть нежную кожу малыша. Тот, кто выполняет массаж, должен иметь коротко подстриженные ногти. Сами руки, разумеется, должны быть теплыми.
Как видите, методика массажа не так уж сложна. Зато есть возможность, своевременно обнаружив врожденное заболевание, лечить его с момента выявления и обойтись без оперативного лечения.
Примерный комплекс лечебного массажа и гимнастики при пупочной грыже для детей в возрасте до 4 месяцев
Вначале следует произвести рефлекторное удержание тела ребенка (горизонтально) в положении лежа на боку. Выполняться упражнение должно по несколько секунд на правом и левом боку поочередно.
Затем нужно повернуть ребенка из полувертикального положения в горизонтальное. Упражнение следует выполнять на коленях взрослого или на столе, предварительно подготовленном к массажу. При этом отклоняя туловище ребенка назад, нужно следить, чтобы голова малыша не запрокидывалась.
Далее следует выполнить рефлекторное удержание тела ребенка на весу (горизонтально) в положении на спине - "поза пловца". Потом осуществить повороты малыша со спины на живот с помощью взрослого. Далее рефлекторное ползание на животе. В заключение выкладывание на мяч в положении на спине.
Некоторые врачи рекомендуют специальный бандаж или медицинский пояс при грыже, но при ношении бандажа массаж все равно делать нужно обязательно, к тому же если ребенок уже ползает или ходит, бандаж будет постоянно сползать.
Хирургическое лечение пупочной грыжи
Целью операции при пупочной грыже заключается ушивание дефекта пупочного кольца. Разрез небольшого размера производят над пупком в кожной складке, что, наряду с косметическими швами, делает послеоперационный рубец практически незаметным. С возрастом эластичность тканей снижается, и небольшой дефект пупочного кольца, не ликвидированный в детском возрасте, превращается в большую пупочную грыжу у взрослых. Часто пупочная грыжа начинает увеличиваться после родов у женщин. Пупочные грыжи у взрослых склонны к ущемлению и частым рецидивам. Поэтому во всем мире принято лечить грыжи передней брюшной стенки в детском возрасте, лучше до школы.
Хирургическое лечение грыжи необходимо девочкам старше 5 лет, поскольку при беременности и после родов существует опастность увеличения грыжи и защемления. У мальчиков, если грыжа не приченяет беспокойства, это больше косметический дефект и операция показана при опасности ущемления. Операция проходит 15-20 минут под общим наркозом, реабилитация 1-2 недели. После операции физические нагрузки противопоказаны в течение месяца. Если ребенку меньше 3-4 лет, он находится в больнице вместе с матерью.
Можно ли "заговорить" грыжу?
Среди родителей широко распространено мнение о том, что некоторые народные целители могут "заговорить" грыжу - и она исчезнет сама собой. Все объясняется просто. Шаманы и бабушки повитухи знают о возможностях спонтанного закрытия дефекта пупочного кольца у детей до 3-5 лет. Данные научные познания дают им возможность за определенные материальные блага эффективно "лечить" детей. Это беспроигрышный вариант, позволяющий поддерживать миф о необычайных возможностях нетрадиционных методов лечения.
С другой стороны, все заговоры от грыжи обязательным атрибутом имеют покусывание или пощипывание пупка, а это подобие иглорефлексотерапии, которая используется в лечении грыжи у взрослых.
Приклеивание медной монетки врачи советуют при пупочной грыже более 1 см, при меньшем размере грыжи монетка малоэффективна и рекомендуется заклеивание пупка пластырем по специальной технике (пластырь обязательно должен быть гипоаллергенным! Лучший вариант - пупочный пластырь Порофикс).
Народные средства лечения грыжи
Наложить на грыжу ребенка лейкопластырь. Бинтом обматывать нельзя, поскольку у детей дыхание преимущественно животом, а не грудной клеткой. Перед заклеиванием грыжевое выпячивание вправить пальцем. Повторять процедуру 10-15 дней подряд. Лейкопластырь брать гипоаллергенный!
Положить при грыже на пупок старую медную монету («пятачок») и закрепить ее лейкопластырем. Во время купания ребенка монету снимать, пупок обрабатывать слабым раствором йода в воде. Эффективно при больших грыжах (более 1 см). При небольшой грыже нужно брать медный диск поменьше, например монету в 1 цент (США)
Положить на пупок марлю, смоченную соком кислой капусты, а сверху прикрыть ее ломтиком свежего картофеля диаметром примерно 2 см. При регулярном использовании грыжа может пройти через 1 месяц.
Заговор от детской грыжи «Бабушка Соломонидушка у Пресвятой Богородицы грыжу заговаривали медными щеками, железными зубами. Так и я заговариваю у раба Божьего (имя ребенка). Аминь». Заговаривать 3 раза и 3 дня подряд, кроме воскресенья. При заговоре надо слегка прикусывать губами пупок ребенка.
Как видите, народные средства схожи с официальными методами лечения грыжи, механизм их действия описан выше.
Профилактика пупочной грыжи
Профилактикой возникновения пупочной грыжи является, в первую очередь, предупреждение чрезмерного натуживания ребенка и вздутия живота, причиной которого обычно являются повышенное газообразование, запоры.
Для предотвращения чрезмерного вздутия кишечника у ребенка и развития запоров наиболее благоприятным для детей раннего возраста является кормление грудным молоком, однако при этом мама должна соблюдать диету. Мы можем посоветовать мамам временно исключить из своего рациона следующие продукты: цельное молоко, белокочанную капусту, бобовые, орехи, сладости, копчености, колбасы. Предпочтительно употребление кисломолочных продуктов, отрубей, цельнозерновых каш, свежих овощей, фруктов. Во время кормления грудью для профилактики запоров полезны чернослив и курага (не более 3-5 ягод в день).
Если малыш на искусственном вскармливании, чтобы исключить запоры, вздутие живота, колики, аллергическую реакцию, смесь должен подобрать педиатр.
Врач, наблюдающий вашего малыша, может рекомендовать медикаментозные препараты: САБ-СИМПЛЕКС, ЭСПУМИЗАН, ПЛАНТЕКС, БЕБИ-КАЛМ и др.
Для предупреждения запоров, которые могут возникнуть у малыша при неправильно подобранном искусственном питании, из-за погрешностей в диете у кормящей мамы, а также при дисбактериозах и других заболеваниях желудочно-кишечного тракта, при которых происходит чрезмерное натуживание, среди лекарственных препаратов педиатры рекомендуют прием ДЮФАЛАКА, а также введение ГЛИЦЕРИНОВЫХ СВЕЧЕЙ и микроклизм — МИКРОЛАКС. Дозировку и особенности введения этих лекарственных средств вам подскажет педиатр, так как назначение медикаментозной терапии сугубо индивидуально и возможно исключительно со стороны врача, наблюдающего за развитием вашего малыша.
Дети с непереносимостью лактозы (лактазная недостаточность) довольно часто имеют пупочные грыжи. Лактазная недостаточность возникает у детей, которые родились преждевременно или в срок, но функционально остаются незрелыми. При этом состоянии грудное молоко частично или полностью не переваривается, вследствие чего происходит брожение в кишечнике и его вздутие. Кроме того, одной из форм течения лактазной недостаточности может быть склонность к запорам. Наиболее эффективным средством профилактики для таких детей является рациональный подбор вскармливания, при грудном вскармливании часто рекомендуется дополнительное введение фермента лактазы.
В раннем возрасте многие малыши страдают дисбактериозом кишечника, то есть нарушением микрофлоры кишечника, который может возникать на фоне лактазной недостаточности и других состояний. При этом запоры, а также вздутие живота, сопровождающие дисбактериоз, довольно часто провоцируют возникновение пупочной грыжи у малышей. Лечение в данном случае должно быть направлено в первую очередь на устранение симптомов основного заболевания.
3) Врожденный вывих бедра - это крайне запущенная степень дисплазии тазобедренного сустава и представляет собой недоразвитие тазобедренного сустава. Отсутствует правильное сочленение костей тазобедренного сустава. Головка бедренной кости выходит за пределы вертлужной впадины, в результате образуется вывих. Либо имеется предрасположенность к вывиху, что в некоторых случаях тоже рассматривают как собственно вывих сустава.
Врожденный вывих бедра у детей встречается в 5-7 случаях из 1000 новорожденных. Девочки в 3-6 раз болеют чаще мальчиков. Левый сустав поражается чаще, иногда заболевание может быть двустороннее.
Симптомы врожденного вывиха бедра
Выявить врожденный вывих бедра у детей можно только после рождения по следующим симптомам.
Ограничение отведения бедра. Ребенок лежит на спине, ножки ребенка сгибаются под углом 90 градусов в коленных и тазобедренных суставах. После чего разводятся до упора по сторонам до упора. При врожденном вывихе угол разведения ног уменьшается в сравнении с нормальным 160-180 градусов.
Симптом Маркса-Ортолани (симптом «щелчка»). Ребенок лежит на спине, ножки сгибаются в коленных и тазобедренных суставах под прямым углом. Они сводятся вместе, а затем постепенно раздвигаются по сторонам. Со стороны вывиха отчетливо слышен щелчок.
Укорочение длинны ножки ребенка со стороны вывиха. Для выявления этого симптома нужно согнуть ножки вашего ребенка в коленях и постараться прижать их к животу.
Несимметричные кожные складки на ногах. На выпрямленных ногах ребенка и спереди и сзади кожные складки должны быть относительно симметричны.
При обнаружении одного из этих четырех симптомов следует немедленно обратиться к лечащему врачу для более тщательного осмотра. Для уточнения диагноза применяют рентген и ультразвук.
Лечение врожденного вывиха бедра
Последствия врожденного вывиха бедра при отсутствии лечения могут быть довольно серьезными. Невылеченный в детстве вывих может привести к диспластическому коксартрозу во взрослом возрасте.
Чем раньше вы начнете лечение данного заболевания, тем более эффективным оно будет. Чаще всего используют традиционное лечение. Мать уже в роддоме обучают ЛФК и правильному пеленанию (ножки должны лежать свободно и максимально отводиться в стороны). Суть консервативного лечения в том, чтобы относительно зафиксировать кости тазобедренного сустава в таком положении, при котором головка бедренной кости будет находиться в центре вертлужной впадины. В таком положении головка сустава постоянно раздражает и стимулирует к отстройке недоразвитую крышку суставной впадины.
Для фиксирования ножек младенца в постоянно отведенном состоянии используют специальные ортопедические приспособления (стремена Павлика, подушка Фрейка, шина Виленского и шина Волкова). Чаще всего при лечении врожденного вывиха бедра применяют именно Стремена Павлика (изобретение чешского ортопеда Арнольда Павлика). Шина позволяет фиксировать ноги ребенка в положении разведения, при этом сохраняя подвижность ног в определенных пределах. Длительность лечения контролируется рентгеном. Длится до тех пор, пока не сформируется крышка вертлужной впадины сустава.
При лечении детей старше года используют постепенное липкопластырное вытяжение Соммервила, усовершенствованное Мау. Суть метода примерно та же – инициируется отстройка крышки вертлужной впадины.
Если консервативное лечение не дало результатов, или в случаях, когда заболевание было обнаружено поздно, применяют хирургическое вмешательство. На сегодняшний день существует большое множество различных видов операций, направленных на лечение врожденного вывиха бедра. Чаще используют внесуставные операции. При таких операциях сохраняются выработанные адаптационные механизмы и создаются благоприятные условия для дальнейшего функционирования сустава. Для лечения врожденного вывиха бедра у детей и подростков чаще используют операцию Солтера. Для лечения взрослых – надацетабулярную остеотомию таза по Хиари и прочие артропластические операции профессора А.М. Соколовского.
Правильное и своевременно начатое лечение является залогом быстрого выздоровления при врожденном вывихе бедра.
БИЛЕТ №25
Врожденные свищи пупка: неполные свищи пупка (аномалия развития желточного и мочевого протока) дифференциально-диагностические критерии. Сроки и показания к оперативному лечению.
Мочевой проток (урахус) — трубчатое образование, исходящее изверхушки мочевого пузыря и идущее к пупку между брюшиной и поперечнойфасцией живота. У эмбриона он служит для отведения первичной
мочи в околоплодные воды.На IV—V месяце внутриутробного развития мочевой проток обли-
терируется, превращаясь в срединную пупочную связку. Однако в рядеслучаев, особенно у недоношенных детей, он может остаться открытымк моменту рождения, и его облитерация происходит на первомгоду жизни. При задержке облитерации мочевой проток может остатьсяоткрытым на всём протяжении (пузырно-пупочный свищ) илиотдельных участках.
Желточный проток входит в состав пупочного канатика и служитв первые недели внутриутробного развития для питания эмбриона,соединяя кишечник с желточным мешком. На 3—5-м месяце внутриутробнойжизни происходит обратное развитие протока.Возможны различные нарушения облитерации желточного протока.
В зависимости от того, в какой степени и на каком уровне сохранилсяэмбриональный ductusomphalo-entericus, различают:
• свищи пупка (полные и неполные);
• дивертикул подвздошной кишки;
• энтерокистому.
Неполный свищ пупка образуется при нарушении облитерациидистального отдела желточного протока и возникает значительночаще полного.
Клиническая картина
Характерны скудные выделения из пупочной ямки, вследствиечего детей длительно лечат по поводу ≪мокнущего пупка≫. При присоединенииинфекции отделяемое становится гнойным. Осмотр пупочной
ямки позволяет обнаружить среди необильных грануляцийточечное свищевое отверстие со скудным отделяемым.
Диагностика
Диагноз подтверждают зондированием свищевого хода; в этомслучае пуговчатый зонд удаётся провести на глубину 1—2 см. Дифференциальныйдиагноз необходимо проводить с фунгусом пупка, для которого характерно разрастание грануляционной ткани на дне пупочнойямки из-за инфицирования и задержки эпителизации.
Лечение
Лечение неполного свища пупка всегда начинают с консервативныхмероприятий. Назначают ежедневные ванны со слабым растворомперманганата калия, обработку свищевого хода раствором
перекиси водорода и 3% спиртовым раствором йода, повязки с антисептиками(1% раствор хлорофиллипта). В случае неэффективногоконсервативного лечения показана операция.
Гидронефроз. Эмбриогенез, классификация, клиника, методы исследования. Дифференциально-диагностические критерии. Сроки и показания к оперативному лечению.
Эмбриогенез:
У эмбриона и плода последовательно формируются три почки: пронефрос, мезонефрос и метанефрос. Первая из них рудиментарна и не функционирует, вторая действует на ранних стадиях развития
плода, метанефрос формирует постоянную почку. Пронефрос. В конце 3-й или начале 4-й недели развития в шейной области формируются сегментированные клеточные скопления, имеющие форму стебелька с внутренней полостью, — нефротомы, растущие в латеральном направлении. Нефротомы дают начало нефрическим канальцам, медиальные концы которых открываются в полость тела, а латеральные растут в каудальном направлении. Нефрические канальцы соседних сегментов объединяются и образуют парные продольные протоки, растущие по направлению к клоаке(первичный почечный проток). От дорсальной аорты отделяются небольшие ветви, одна из которых внедряется в стенку нефрического канальца, а другая — в стенку целомической полости, формируя соответственно внутренний и наружный клубочки.
Мезонефрос появляется на 3-й неделе эмбриогенеза, ещё до того времени, как редуцируется пронефрос. Он располагается каудальнеепронефроса и состоит из сегментарных канальцев, соединяющихся
тем же экскреторным каналом — вольфовым протоком. Кроме вольфова (мезонефрического) развивается второй парный проток — мюллеров (парамезонефрический). В дальнейшем у мужских особей мюллеровы ходы редуцируются, а у женских из них образуются матка, маточные трубы и влагалище. Вольфовы протоки редуцируются у женских особей, а у мужских дают начало выводным протокам яичек.Метанефрос развивается из метанефрогенной бластемы (источника канальцев нефрона) и метанефрического дивертикула (источника собирательных трубочек и более крупных мочевыводящих путей). Метанефрос появляется в течение 5-й недели развития. Производное метанефрического
дивертикула — собирательная трубочка, на дистальном конце покрытая ≪шапочкой≫метанефрогенной бластемы. Под индуктивным влиянием трубочек из этой ткани формируются небольшие почечные пузырьки, дающие начало канальцам. Канальцы, объединяясь с капиллярным клубочком, формируют нефроны. Проксимальный конец нефрона образует капсулу, в которую глубоко внедряется клубочек. Дистальный конец соединяется с одной из собирательных трубочек. Далее каналец удлиняется, в результате чего образуются проксимальный извитой каналец, петля Хенле и дистальный
извитой каналец. Сначала почка располагается в области таза. В дальнейшем (7-8-я неделя развития) она перемещается краниальнее, как бы поднимается из таза кверху (рис. 6—20). Подъём почки связан с уменьшением кривизны тела при развитии плода и его ростом в поясничной и крестцовой областях.
У новорождённого почка имеет выраженный дольчатый вид. Дольчатость в дальнейшем исчезает в результате роста, но не формирования denovoнефронов (нефроногенез завершается к 36-й неделе развития; к этому сроку в каждой почке существует около 1 млн нефронов).
Гидронефроз — прогрессирующее расширение лоханки и чашечек, возникающее вследствие нарушения оттока мочи в области лоханочно-мочеточникового сегмента. Причины, вызывающие гидронефроз, могут быть анатомическими (рис. 6-39) и функциональными, обусловленными дисплазией
мышц и нервных элементов стенки сегмента и нарушением проходимости в нём перистальтической волны. Наиболее частая причина гидронефроза в детском возрасте — стеноз лоханочно-мочеточникового сегмента. Следствием антенатального воспаления бывают эмбриональные тяжи и спайки, сдавливающие его извне или вызывающие фиксированный перегиб. У части больных затруднение опорожнения лоханки связано с наличием добавочных (аберрантных) нижнеполюсных сосудов. Высокое отхождение мочеточника— следствие врождённой аномалии, приводящее к преимущественному расширению нижней части лоханки. Ещё одной из причин гидронефроза могут быть клапаны мочеточника, локализующиеся в области лоханочно-мочеточникового сегмента и либо представляющие собой складку слизистой оболочки (ложные клапаны), либо в их состав входят все слои мочеточника (истинные клапаны).
Рис. 6-39. Причины врождённого гидронефроза (схема). / — стеноз лоха-
ночно-мочеточникового сегмента; 2 — добавочный сосуд; 3 — фиксированный
перегиб мочеточника; 4 — высокое отхождение мочеточника; 5 — эмбриональные
спайки; 6 — клапан мочеточника.

Независимо от причин, вызывающих развитие гидронефроза, его патогенез сходен во всех случаях. Задержка мочи в лоханке вследствие затруднённого оттока вызывает ишемию и постепенную атрофию почечной паренхимы. Скорость развития этого процесса связана со степенью обструкции и типом лоханки. При внутрипочечнойлоханкеэтот процесс развивается быстрее. При наличии препятствия оттоку лоханка некоторое время справляется с функцией выведения мочи за счёт рабочей мышечной гипертрофии, затем наступает её атония, лоханка значительно растягивается, чашечки увеличиваются и приобретают монетообразную форму. Интересен факт, что даже при выраженном блоке почка длительное время остаётся работоспособной. Спасают почку пиелореналь-
ные рефлюксы. Повышение давления в лоханке приводит к поступлению мочи из лоханки в канальцы (тубулярный рефлюкс). При выраженной обструкции мочеточника возможен разрыв форникальных зон, при этом моча проникает в интерстициальное пространство, откуда оттекает по венозным и лимфатическим сосудам (пиеловенозный и пиелолимфатический рефлюксы). Но вместе с тем пиелоренальные рефлюксы вызывают воспаление паренхимы и приводят к замещению её рубцовой тканью. Стаз мочи и ишемия органа способствуют присоединению такого грозного осложнения гидронефроза, как обструктивный пиелонефрит, встречающийся у 87% больных.
Клиническая картина
Основные клинические проявления гидронефроза — болевой синдром, изменения в анализах мочи и синдром пальпируемой опухоли в брюшной полости. Болевой синдром возникает у 80% больных. Боли носят разнообразный характер — от ноющих тупых до приступов почечной колики.Частота и интенсивность болей связаны с присоединением пиелонефрита и/или растяжением почечной капсулы на фоне резкого нарушения оттока мочи. Боль обычно локализуется в области пупка, лишь дети старшего возраста жалуются на боль в поясничной области. Изменения в анализах мочи характеризуются лейкоцитурией и бактериурией (при присоединении пиелонефрита) либо гематурией (за счёт пиелоренального рефлюкса и форникального кровотечения).
Синдром пальпируемой опухоли — нередкое клиническое проявление гидронефроза, особенно у маленьких детей со слабо развитой передней брюшной стенкой. Образование врач обычно выявляет случайно при пальпации брюшной стенки. Иногда его находят и сами родители, что становится причиной обращения к врачу. Опухолевидное образование обычно имеет чёткие контуры, эластическую консистенцию, при пальпации смещается.
Диагностика
Основные методы диагностики гидронефроза у детей — УЗИ, экскреторная урография, радионуклидное исследование и почечная ангиография. При УЗИ выявляют увеличение размеров почки за счёт расширения её коллекторной системы, истончение и уплотнение паренхимы. Мочеточник не визуализируется. Следующий этап исследования — выполнение экскреторной уро-
графии. Характерная рентгенологическая картина гидронефроза — расширение и монетообразная деформация чашечек, их шеек, расширение лоханки, более выраженное при её внепочечном расположении. Следует отметить, что при выполнении экскреторной урографии больным с подозрением на гидронефроз обязательным является выполнение отсроченных (через 1—6 ч) рентгеновских снимков для получения чёткой картины на фоне снижения функций почек и
большого объёма коллекторной системы. Мочеточник при гидронефрозе визуализируется редко, обычно на отсроченных снимках; он узкий, контрастируется по цистоидному типу, ход его обычный.Выполнение радионуклидного исследования позволяет количественно оценить степень сохранности почечных функций и определить тактику лечения. Если при УЗИ заподозрен гидронефроз, а при экскреторной урографии даже на отсроченных снимках изображения коллекторной системы почки нет, можно думать о значительном снижении её функций. В этих случаях уточнить диагноз помогает ангиографическое исследование. Оно даёт представление об ангиоархитектонике почки, а иногда позволяет установить и такую причину гидронефроза, как аберрантный сосуд. Нередко трудности возникают при дифференциальной диагностике гидронефроза и гидрокаликоза, характеризующегося стойким расширением чашечек при нормальных размерах лоханки и хорошей проходимости лоханочно-мочеточникового сегмента . Заболевание— результат медуллярной дисплазии, сопровождается недоразвитием и истончением мозгового вещества почки. Диагностике помогают экскреторная урография с выполнением отсроченных снимков и ангиографическое исследование. При гидрокаликозе почечные артерии сохраняют сегментарное строение, диаметр основных стволов обычный, отмечают обеднение и истончение сосудистого рисунка в участках расположения чашечек.
Лечение
Лечение гидронефроза только оперативное. Объём оперативного вмешательства зависит от степени сохранности почечных функций. Если функции почки снижены умеренно, выполняют реконструк-тивно-пластическую операцию — резекцию изменённого лоханочно-мочеточникового сегмента с последующей пиелоуретеростомией (операция Андерсена—Кучеры). В случае значительного снижения функций почек можно прибегнуть к предварительной деривации мочи с помощью нефростомии. При последующем улучшении почечных функций, выявляемом с помощью радионуклидного исследования, возможно выполнение реконструктивной операции. Если изменения функций почки необратимы, встаёт вопрос о нефрэктомии.
Методы санации брюшной полости при перитоните, особенности у детей.
Одним из первых и распространенных до настоящего времени методов санации остается дренирование брюшной полости. В 1881 году J. Mikulicz разработал метод тампонады при кровотечениях и гнойных процессах. В настоящее время доказано, что применение тампонов при перитоните не только не эффективно, но и опасно из-за развития таких осложнений, как формирование внутрибрюшных абсцессов, кровотечения, прогрессирование перитонита, образование свищей.
Введенный тампон в течение первых 2-3 часов пропитывается экссудатом и превращается в «пробку», закупоривающую «отверстие» в брюшной стенке. Оправданием использования тампонов может служить только остановка кровотечения, в случае неэффективности или отсутствия других гемостатических приемов. Применение его также возможно с целью отграничения неудалимого источника перитонита от свободной брюшной полости.
С целью повышения эффективности дренирования с того момента, предложено множество различных дренажных устройств. В настоящее время широкое применение нашли силиконовые дренажи, так как они обладают гибкостью, прочностью и при длительном пребывании в брюшной полости не вызывают пролежни стенки кишечника. В функциональном отношении, действие дренажей ограниченно временным интервалом, так как они не обладают биологической инертностью и быстро обособляются от брюшной полости в результате процессов спайкообразования и наложений фибрина . Экспериментальные исследования показывают, что дренирование брюшной полости независимо от количества дренажных трубок и активной аспирации далеко не всегда способствует адекватной санации. В условиях распространенного перитонита почти в 80 % наблюдений в течение 12-24 ч после лапаротомии дренажные трубки теряют проходимость .
Из двух основных методов - активное и пассивное дренирование, большинство хирургов предпочитает последний. Считается, что отрицательное давление в дренажной системе при активном дренировании способствует обтурации отверстий дренажа прилежащими тканями и органами.
До сих пор продолжаются дискуссии о методах дренирования, материале и форме дренажа, способе его проведения, частоте использования и показаниях. Не существует также единого мнения и в вопросе о необходимости дренирования брюшной полости при перитоните. Применение различных дренажных устройств не всегда может адекватно эвакуировать токсический экссудат из брюшной полости и предотвратить дальнейшую интоксикацию организма и развитие ранних послеоперационных осложнений. Распространенным способом санации брюшной полости до настоящего времени является промывание ее растворами антисептиков (1-1,5 % перекись водорода, раствор фурациллина в разведении 1:5000, 0,5 % раствор диоксидина, гипохлорит натрия, озонированные растворы и др.). Как правило, для промывания брюшной полости используют от 4 до 6 литров раствора. Некоторые авторы считают, что необходимо до 10 литров. Вопрос о количестве используемых растворов остается дискутабельным.
Обязательным требованием к санации является удаление налетов фибрина, так как под ними сохраняется патогенная микрофлора. Обычное промывание брюшной полости не всегда удовлетворяет в полном объеме данное требование.
Более 100 лет назад H.Nolan и J. Price предложили промывание брюшной полости в послеоперационном периоде - «перитонеальныйлаваж». Были предложены два метода: проточный (непрерывный) и фракционный (прерывистый). Показанием для перитонеального диализа служили наличие фибринозного или гнойного перитонита, при котором после интраоперационной санации брюшной полости оставалось большое количество наложений фибрина, удалить которые одномоментно не представлялось возможным. Авторы данной методики считали, что в процессе промывания брюшной полости происходит механическая ее очистка, используемый раствор препятствует спаечному процессу, образованию внутрибрюшных абсцессов.
Изменяя состав раствора, можно воздействовать на водно-солевой обмен, создать высокую концентрацию антибиотиков в брюшной полости. Для достижения перечисленных эффектов в состав раствора добавляли гепарин, стрептокиназу, ферменты и другие вещества. В процессе применения данной методики были выявлены и отрицательные воздействия на организм пациента, что послужило в последующем причиной отказа от перитонеального диализа. К ним относятся распространение инфекции по брюшной полости, неконтролируемая потеря белков с диализатом, развитие гиперволемии, дыхательная и сердечная недостаточность в результате напряженного гидроперитонеума, токсическое действие антибиотиков, почечная недостаточность, нарушение естественных условий в брюшной полости, способствующих отграничению воспаления, образование внутрибрюшных абсцессов.
В 1928 году Жан Луи Фор усовершенствовал и применил предложенный J. Mikulicz метод лапаростомии, ранее известной как «открытый живот, фенестрация брюшной полости, закрытаяэвисцерация, открытый способ лечения перитонита, открытое ведение брюшной полости». Различают два вида лапаростомии - закрытая эвисцерация, лапаротомная рана не ушивается, а внутренние органы отграничиваются салфетками или пленкой. При втором виде брюшная полость остается открытой, а в края раны вшиваются различные каркасные устройства (молнии-застежки, вентрофилы, аппарат для сближения краев раны и др.).
Широкое распространение лапаростомии пришлось на 50-е годы прошлого столетия, из-за возможности динамической ревизии и санации брюшной полости. Показаниями к лапаростомии были терминальная стадия распространенного перитонита в фазе полиорганной недостаточности, послеоперационный перитонит, эвентерация в гнойную рану, перитонит с флегмоной всех слоев передней брюшной стенки, анаэробный перитонит.
Наряду с достоинствами данного метода, существуют и недостатки, ограничивающие сферу применения лапаростомии. Открытая брюшная полость приводит к большим потерям жидкости, нарушениям всех видов обмена веществ, образованию кишечных свищей, формированию массивного спаечного процесса брюшной полости, образованию обширных дефектов передней брюшной стенки, требующих повторного оперативного вмешательства, присоединению суперинфекции .
В 1987 М.И. Кузин предложил метод программнойрелапаротомии. Суть его заключается в том, что после завершения операции ушивается только кожа. Показаниями к программным релапаротомиям служат формирующиеся абсцессы брюшной полости, массивные наложения фибрина и девитализированных тканей, которые невозможно удалить одномоментно, послеоперационный перитонит, неуверенность в жизнеспособности органов, перитонит с распространением воспалительного процесса на забрюшинную клетчатку, синдром интраабдоминальной гипертензии. К недостаткам метода относятся операционная травма в результате повторного вмешательства, гнойные осложнения брюшной полости и передней брюшной стенки, образование свищей, высокий риск внутрибрюшного кровотечения.
Наименьшей травматичностью обладает минирелапаротомия, когда с краев раны снимают 1-2 шва и исследуют брюшную полость методом «щарящего катетера».
В последние десятилетия с развитием миниинвазивной хирургии широкое применение в диагностике и лечении распространенного перитонита нашли лапароскопические технологии, которые позволяют:
Санировать брюшную полость, корригировать расположение дренажей, контролировать состояние кишечных швов и анастомозов, возможность наложения швов в случае обнаружения дефекта полого органа.
Произвести пункцию и дренирование внутрибрюшных абсцессов.
Остановка кровотечения с использованием гемостатических полимерных материалов, осуществить клипирование, коагуляцию, прошивание сосудов.
Рассечь сформированные и формирующиеся спайки между органами брюшной полости.
Обработать брюшину и органы брюшной полости ультразвуком в растворе антисептика или лазерное облучение брюшной полости.
Различают преимущественно два вида лапароскопической санации: механическое воздействие промываемым раствором (гидропрессивная санация, БРЮСАН Малкова) и физические факторы (обработка ультразвуком, облучение лазером).
Показания к программированным санациям: давность заболевания свыше 24 часов, в случае, если источник перитонита - патология ободочной кишки, выраженные воспалительные изменения париетальной и висцеральной брюшины, сопровождающиеся массивными, плотными наложениями фибрина, экссудат с наличием каловых масс, ретенция жидкости после перитонеальноголаважа, желчеистечение, а также все случаи, требующие визуального динамического контроля.
Недостатками лапароскопической санации являются - невозможность адекватной санации брюшной полости при массивной бактериальной контаминации, при массивных фибринозных наложениях, плохой обзор при наличии паралитической кишечной непроходимости, отсутствие возможности произвести назоинтестинальную интубацию.
БИЛЕТ №26
1.Аномалия развития опускания яичка - крипторхизм. Сроки и показания к оперативному лечению.
Крипторхизм относят к аномалиям положения яичка, возникновение которых связывают с нарушением процесса их опускания. Крипторхизм наблюдают у недоношенных в 30% случаев, у доношенных новорождённых — в 3—4%, у юношей — в 0,7% случаев; двусторонний крипторхизм встречают в 5 раз реже одностороннего. У плода яички располагаются забрюшинно на задней стенке живота. С 6-го месяца внутриутробного развития яички вслед за гунтеровым тяжом начинают опускаться. Пройдя паховый канал, они опускаются на дно мошонки и фиксируются там к моменту рождения ребёнка. Однако вследствие разных причин (недоразвития пахового канала, препятствия
в виде соединительнотканной перегородки у выхода из пахового канала или у входа в мошонку и пр.) процесс опускания прекращается или извращается. Существуют сведения, что в основе развития крипторхизма лежит задержка дифференцировки мезенхимальной ткани. Генетические аспекты: в части случаев найдена мутация гена G T D (306190, Хр21). При наличии препятствий по ходу пахового канала яичко задерживается у входа в него или в его просвете. В этих случаях речь идёт
об истинном крипторхизме. Другими словами, крипторхизм — задержка (ретенция) яичка на пути его следования в мошонку. Если яичко расположено в брюшной полости, до входа в паховый канал, такую ретенцию называют абдоминальной. Задержку яичка в паховом канале называют ингвинальной. Если в процессе опускания яичка у входа в мошонку встречаетсяпрепятствие в виде соединительнотканной перепонки, проводник яичка (гунтеров, или проводящий, тяж) прокладывает путь в подкожной клетчатке на лобок, в паховую область, на бедро или промежность. Расположение яичка в этих областях называют эктопией (дистопией) яичка. Другими словами, эктопия — отклонение яичка от пути следования в мошонку. Формы эктопии определяются областью расположения яичка (лонная, паховая, бедренная, промежностная. Крайне редко встречают перекрёстную форму эктопии, обусловленную попаданием яичка в противоположную половину мошонки. Аномальное расположение яичка — фактор, предрасполагающий к развитию осложнений: нарушения сперматогенной функции, некроза яичка в результате перекрута, травматического орхита, малигнизации. Нарушение сперматогенной функции связано с повышенной температурой
окружающих тканей (на 1,5—2 °С выше, чем в мошонке). Нарушение температурного режима приводит к задержке дифферен-циации герминативного эпителия и склеротическим изменениям
паренхимы яичка. Эти изменения у детей старше 10—11 лет необратимы. Перекруту чаще подвергается яичко, расположенное в паховом канале. Запоздалое оперативное вмешательство в этих случаях может закончиться удалением некротизированного яичка.
Клиническая картина и диагностика
Выявление крипторхизма и эктопии яичка основано на данных осмотра и пальпации. При эктопии яичко в виде эластического малоболезненного образования пальпируется в подкожной клетчатке.
Подвижность его ограничена. Соответствующая половина мошонки уплощена и недоразвита. При перекрёстной дистопии в одной половине мошонки выявляют два яичка, расположенных одно над другим. При крипторхизме яичко либо не удаётся пропальпировать (при абдоминальной ретенции), либо его обнаруживают в паховом канале. Исследование проводят в горизонтальном положении ребёнка. Врач одной рукой снизу захватывает мошонку, а ладонью второй руки проводит, слегка нажимая, вдоль пахового канала и от корня мошонки вниз. При паховой ретенции яичко подвижно, но низвести его в мошонку не удаётся. Если пальпаторно яичко не определяется (выраженная
жировая клетчатка, гипоплазия яичка), выполняют УЗИ паховой области. Отсутствие яичка при УЗИ — показание к проведению диагностической лапароскопии с целью выявления абдоминальной формы крипторхизма или подтверждения диагноза монорхизма. Истинный паховый крипторхизм следует отличать от ложного,обусловленного повышенным кремастерным рефлексом, при котором
яичко выявляют у наружного отверстия пахового канала, а во время пальпации его можно опустить в мошонку. При двустороннем истинном крипторхизме нередко отмечают признаки полового инфантилизма и гормональной дисфункции. В связи с тем, что вагинальный отросток брюшины при крипторхизме почти всегда остаётся необлитерированным, у четверти больных выявляют паховую грыжу.
Лечение
Неопущенное яичко низводят в мошонку. Операцию выполняют рано ввиду опасности различных осложнений, обусловленных аномальным расположением яичка, — в возрасте 1—2 лет. В случае выраженных эндокринных нарушений проводят гормональное лечение, которое в части случаев приводит к опущению яичка без операции. При эктопии яичко выделяют из окружающих тканей и опускают в мошонку, фиксируя за оболочки к tunicadartos (операция Шюллера). При крипторхизме низведение и фиксацию яичка (орхипексию) осуществляют разными способами в зависимости от возможности мобилизации сосудов яичка. Иногда при первой операции яичко удаётся фиксировать лишь в наружном паховом кольце или у входа в мошоночно-скротальную область. А второй этап, во время которого яичко и семенной канатик выделяют из окружающих тканей для низведения в мошонку, весьма травматичен и чреват опасностью повреждения сосудов семенного канатика. Особенно часто такая ситуация возникает при абдоминальной ретенции яичка. Чтобы избежать указанных осложнений, разработана методика двухэтапного низведения яичка с помощью лапароскопической техники.
2.Нейромышечная дисплазия мочеточников. Эмбриогенез, классификация, клиника. Методы исследования, дифф.-диагностические критерии. Сроки и показания к оперативному лечению.
Один из наиболее частых пороков развития верхних мочевых путей. Единого мнения об этиологии и патогенезе этого заболевания до настоящего времени нет. Одни исследователи связывают развитие мегауретера с функциональным или врожденными препятствиями в юкставезикальном или интрамуральном отделе мочеточника, другие рассматривают его как комбинацию врожденного сужения устья мочеточника и его интрамурального отдела с нейромышечной дисплазией нижнего цистоида. В патогенезе заболевания ведущую роль играет постепенное развитие нарушения тонуса верхних отделов мочевых путей в виде их расширения и удлинения. Расширение нижнегоцистоида называют ахалазией. В этом случае уродинамикаверхнихцистоидов сохранена. Вовлечение в процесс двух верхних цистоидов с увеличением длины мочеточника носит название мегауретера. В этом случае мочеточник выглядит резко расширенным и удлиненным, сократительные движения его существенно замедлены или отсутствуют, динамика опорожнения мочеточника резко нарушена. Нейромышечная дисплазия мочеточника — одно- или двусторонняя аномалия.
В ее течении выделяют следующие стадии:
I — скрытая или компенсированная (ахалазия мочеточников);
II — возникновение мегауретера по мере прогрессирования процесса;
III — развитие уретерогидронефроза, что обусловлено распространенностью по окружности интрамурального отдела мочеточника, и потеря функции гладкомышечных клеток стенки. Наиболее часто это заболевание выявляется у детей в возрасте от 1 года до 15 лет, у взрослых — в поздних стадиях развития. Преобладает двусторонний процесс. Характерной клинической картины дисплазии мочеточника нет; выявляется это заболевание в большинстве случаев при присоединении пиелонефрита или почечной недостаточности. Длительное отсутствие клинических симптомов заболевания является одной из причин поздней диагностики нейромышечной дисплазии у детей.
В I стадии симптомы болезни обычно не наблюдаются. Во II стадии появляются первые клинические симптомы: общая слабость, быстрая утомляемость, головная боль, тупые боли в животе, стойкая пиурия. При ультразвуковом исследовании выявляют расширение мочеточника и чашечно-лоханочного аппарата. При хромоцистоскопии отмечается нарушение выделения индигокармина из устья аномального мочеточника, на экскреторных урограммах — расширение мочеточника на всем протяжении, на урокинематограммах удается увидеть резкие и вялые сокращения мочеточника.
В III стадии клиническая картина выражена более четко. Содержание мочевины в сыворотке крови достигает 17—25 ммоль/л. У большинства больных отмечаются значительные анатомо-функциональные изменения в верхних отделах мочевых путей; мочеточники резко расширены, достигают диаметра 3—4 см, и удлинены — возникает гидронефротическая трансформация.
Нейромышечная дисплазия мочеточника у детей нередко сочетается с другими пороками развития (поликистозная дисплазия почки, рудиментарная нефункционирующая почка, пузырно-мочеточниковый рефлюкс и т.д.), иногда в сочетании с двусторонним крипторхизмом или аплазией мышц живота (синдром «сливового живота»). Урокинематография показывает, что при ахалазии мочеточника волна сокращений достигает нижнего цистоида и не распространяется дальше, при мегауретере- и гидроуретеронефрозе сократительные волны очень редкие или отсутствуют. Гидроуретеронефротическая трансформация неизбежно приводит к развитию хронической почечной недостаточности. Это требует проведения своевременных комплексных лечебных мероприятий, среди которых основное место занимают различные оперативные методы лечения. Цель их — сохранить функцию почки и содействовать восстановлению или хотя бы улучшению динамики опорожнения мочевых путей. Важное значение в детской урологии придается фармакоурографии. Если при стимуляции мочегонными средствами (лазикс и др.) регистрируется снижение тонуса чашечно-лоханочной системы и нарушение кинетической ее деятельности, отсутствует усиление ее сократительной способности, то рассчитывать на положительный результат оперативного лечения трудно. В этих условиях в качестве подготовительного этапа к выполнению органосохраняющей операции прибегают к чрескожной пункционной нефростомии.
При проведении дифференциальной диагностики необходимо учитывая возможность возникновения двустороннего мегауретера вследствие так называемой пузырно-зависимой формы, т.е. при нейрогенной дисфункции мочевого пузыря. Основными видами оперативного лечения являются создание дубликатуры из расширенного мочеточника, антирефлюксныйуретероцистоанастомоз или замещение мочеточника сегментом тонкой кишки.
У детей моделирование тазового отдела мочеточника до нормального диаметра (после резекции его стенозированного участка) достигается продольным иссечением расширенного отдела на длину 3—3,5 см и наложением узловых швов или прошиванием П-образными швами этого участка с фиксацией его на противоположной стороне мочеточника. После моделирования выполняется антирефлюксная операция. В последние годы по показаниям (в основном при ахалазии мочеточника с сохранной функцией почки) применяются эндоскопические виды вмешательства: бужированиестенозированного отдела мочеточника или его рассечение с установкой на 3-4 недели внутреннего стента.
3.Особенности переломов костей у детей. Классификации, клиника, диагностика.
Переломы костей у детей встречаются реже, чем у взрослых. Это связано с большей эластичностью и гибкостью детских костей, большим количеством в ней эластических и коллагеновых волокон, меньшей минерализацией и наличием толстой, хорошо кровоснабжаемой надкостницы, образующей вокруг кости гибкий амортизирующий футляр. Этими факторами объясняется преобладание у детей переломов костей в виде «надломов» или переломов по типу «зеленой ветки», а также поднадкостничных переломов с сохранением целости надкостницы. Амортизирующий эффект оказывает и богатство эпифизов трубчатых костей хрящевой тканью, содержание которой тем больше, чем меньше возраст ребенка. С другой стороны, у детей встречаются переломы по линии
росткового эпифизарного хряща — эпифизеолизы, часто с отрывом костного фрагмента — остеоэпифизеолизы. В области суставов, где суставная капсула прикрепляется к кости кнаружи от эпифизарногохряща, переломы у детей часто бывают внутрисуставными. По линии
росткового хряща могут отрываться апофизы детских костей — это так называемые апофизеолизы.
Вывихи у детей встречаются тоже намного реже, чем у взрослых. Большая эластичность и прочность капсульно-связочного аппарата детских суставов объясняет большую частоту так называемых «под-
вывихов», самым типичным из них является характерный для 2–4-летнего возраста подвывих головки лучевой кости.
Диагностика переломов у детей труднее, чем у взрослых, и чем меньше возраст, тем больше трудностей. Часто переломы в области метаэпифизов можно диагностировать лишь при сравнении рентгенограмм симметричных конечностей, а для распознания поднадкостничныхпе-
реломов рентгенограммы иногда следует рассматривать под увеличением (с лупой).
В лечении детских переломов костей предпочтение отдается консервативным методам. Большая их часть излечивается одномоментнойрепозицией с последующей иммобилизацией сегмента конечности. Репозицию переломов желательно проводить под общим обезболиванием.
Скелетное и лейкопластырное вытяжение применяется при лечении переломов голени и бедра со смещением. Переломы бедра у грудных детей лечатся лейкопластырнымвытя-
жением по Шеде. Сроки иммобилизации у детей меньше, чем у взрослых, и чем меньше
возраст ребенка, там они короче. Переломы трубчатых костей у детей имеют свойство к самокоррекциисмещений отломков по ширине (чем меньше возраст, тем выраженнее эти
способности). Плохо подвергаются самокоррекции угловые смещения, они должны полностью устраняться. Идеального сопоставления отломков, в том числе с применением оперативного вмешательства, требуют внутрисуставные переломы, так как неполное устранение смещения ведет к нарушению функций суставов, причем с возрастом эти нарушения не только не уменьшаются,
но даже прогрессируют. Это особенно касается переломов в области локтевого сустава. Трудно диагностируются родовые переломы костей. Чаще всего в родах происходит перелом ключицы, плеча и бедра. Переломы ключицы и плеча требуют иммобилизации верхней конечности в повязке Дезо, переломы бедра лечатся вытяжением поШеде. Срок иммобилизации — двенедели. Переломы у новорожденных обычно сопровождаются образованием гипертрофированной костной мозоли, которую нередко принимают за костную опухоль. Во всех случаях она рассасывается, и переломы не оставляют следа.
БИЛЕТ №27
Острые заболевания яичка. Клиника. Методы диагностики и лечения.
Синдром острой мошонки объединяет ряд заболеваний: заворот, травма и ущемление яичка, заворот гидатид яичка и придатка, орхит и эпидидимит. Острые заболевания яичек относятся к числу распространенных и встречаются у детей разных возрастных групп. Их возникновение может быть обусловлено различными причинами – воспалительными заболеваниями, травмой, инструментальными вмешательствами на мочевыводящих путях, инфекционными заболеваниями и т. д.
Существует два пика роста частоты острых заболеваний яичек – до 1 года жизни и пре- и пубертатный периоды (10–16 лет), совпадающие с фазами интенсивности развития семенной железы. Так, первый год жизни мальчика характеризуется выраженным ростом яичек. За это время их размеры увеличиваются в 1,5–2, а масса — в 3 раза. В дальнейшем развитие семенных желез происходит медленно, и лишь в конце препубертатного периода их рост вновь активизируется, особенно интенсивно протекая в пубертатном возрасте. Придаток яичка проходит те же периоды усиленного и замедленного роста.
К моменту рождения ребенка яичко относительно незрелое, а созревание структурных элементов происходит неравномерно. Учет этого фактора имеет значение для понимания развития некоторых заболеваний органов мошонки у новорожденных и грудных детей. Кожа мошонки тонкая, легко ранимая, полость ее широкая. Оболочки яичка четко выражены и разделены щелевидными пространствами. Мышца, поднимающая яичко, хорошо развита. Гипертонус m. cremaster в этот период обусловливает значительную подвижность яичка. К моменту рождения влагалищный отросток брюшины у 10–30% новорожденных облитерирован, а у 70–90% имеет место полное или частичное незаращение.
У детей раннего возраста гидатиды яичка расположены в щелевидном пространстве под головкой придатка. Подвижность их значительно ограничивается верхним полюсом яичка и головкой придатка, что обусловливает редкость перекрутагидатид в этом возрасте. Кровоснабжение, лимфоциркуляция и иннервация детского яичка отличаются от таковых у старших детей и взрослых. В целом же морфологические структуры органов мошонки у новорожденных и грудных детей являются относительно незрелыми.
Эти данные позволяют объяснить быстроту развития необратимых изменений в яичках у детей младшей возрастной группы при остром нарушении кровообращения (перекрут, ущемление, разрыв), что обусловлено недостаточностью кровотока и слабой устойчивостью половых клеток к гипоксии. Знание эволюции органов мошонки в онтогенезе имеет клиническое значение и необходимо для правильного понимания этиологии и патогенеза острых заболеваний органов мошонки у новорожденных и грудных детей.
Ни одно заболевание, сопровождающееся болью и отеком мошонки, не имеет патогномоничных признаков, однако тщательный сбор анамнеза и обследование ребенка при подозрении на острое заболевание яичек значительно сужают круг вероятных болезней, а в ряде случаев позволяют поставить точный диагноз.
Анамнез. Для диагностики острых заболеваний яичек важен учет возраста ребенка. Заворот яичка наиболее часто отмечается у новорожденных, грудных детей и в пубертатном возрасте, хотя может встречаться у детей разных возрастных групп. Типичным является заворот гидатид яичка при болезни Schonlein—Henoch у мальчиков в пубертатном возрасте, тогда как эпидидимит чаще развивается в постпубертатном периоде.
Следует оценить начало и длительность болевого синдрома. Заворот яичка обычно начинается остро и неожиданно. Боль носит выраженный характер. Умеренная боль, развивающаяся постепенно в течение нескольких дней, более характерна для эпидидимита или заворота гидатид. Ребенок чувствует себя вполне комфортно, за исключением периода исследования. Необходимо быть уверенным, что источником боли является мошонка, а не нижние отделы живота или паховая область. Травма в анамнезе не исключает диагноз заворота яичка. Следует выяснить наличие болей в предшествовавший заболеванию период. В некоторых случаях при наличии заворота яичка имеют место эпизоды боли сходного характера, которая длится короткое время и спонтанно прекращается. Острое начало боли и самостоятельное ее прекращение свидетельствует об интермиттирующем завороте и спонтанной деторзии яичка.
Клиническое исследование. Необходимо ориентироваться на поведение ребенка и желание его вступать в контакт. Исследование живота производится с акцентом на болезненность фланков и надлобковой области. Далее производится осмотр паховых областей, оценивается наличие припухлости и гиперемии. При эпидидимите и завороте яичка семенной канатик обычно болезненный в паховой области.
Исследование половых органов начинается с осмотра мошонки. Сравниваются размеры обеих ее половин, уточняется наличие отека, гиперемии, расположение яичек. Одностороннее увеличение объема мошонки без изменений кожи предполагает наличие грыжи или водянки яичка. Необходимо выяснить длительность симптомов заболевания. Высокое и поперечное расположение яичка предполагает заворот яичка, однако этот диагноз маловероятен, если болевой синдром наблюдается более 12 ч, а мошонка имеет нормальный вид. Как при эпидидимите, так и при завороте яичка заинтересованная половина мошонки обычно выглядит гиперемированной и отечной через 24 ч.
Всегда должен быть оценен кремастерный рефлекс. Рефлекс выявляется при поколачивании или нежном щипке кожи верхневнутреннего отдела бедра. Нормальная реакция – сокращение m. cremaster с поднятием яичка на данной стороне. Исследованиями установлено, что кремастерный рефлекс наблюдается у 100% мальчиков в возрасте от 30 мес до 12 лет, однако может отсутствовать у новорожденных и подростков. Кремастерный рефлекс редко вызывается у детей с заворотом яичка и обычно сохранен при завороте гидатид яичка.
Полноценное исследование яичек требует знания их топографии. Яичко лучше пальпировать, охватив его между большим и двумя последующими пальцами кисти. Придаток может быть определен в заднелатеральном отделе яичка как мягкое образование с гладкими краями. Оба яичка в норме имеют одинаковый размер. В начальном периоде заворота яичко отечно, болезненно и больше, чем интактная семенная железа. Наличие болезненности, ограниченной верхним полюсом яичка, предполагает заворот гидатиды, особенно при наличии плотного, болезненного узелка, пальпируемого в этой области. Здесь же в начальном периоде заболевания через кожу может просвечиваться небольшое образование синего цвета. Этот признак при наличии локальной болезненности патогномоничен завороту гидатиды яичка. В ранней стадии развития эпидидимита придаток болезненный и уплотненный, при этом яичко безболезненное. Невозможность пальпации придатка может указывать на его заворот, если от начала заболевания прошло всего несколько часов. При завороте придатка и гидатид яичка нарушение его топографии наблюдается позже, чем в случае заворота.
Помощь в диагностике заворота яичка может оказать выявление симптома Пренна, для чего необходимо приподнять яичко (мошонку). Сохранение или усиление боли характерно для заворота яичка. Уменьшение боли свидетельствует в пользу фуникулита, который наблюдается при эпидидимите. Обязательным является проведение общего хирургического и урологического исследования. Неврологические заболевания, врожденные аномалии мочеполовой сферы и инструментальные уретральные исследования могут способствовать развитию инфекции мочеполового тракта и эпидидимита.
Специальные методы исследования. При синдроме острой мошонки обязательно выполнение анализа мочи для выявления инфекции мочевого тракта. Пиурия с наличием (или без) бактерий предполагает инфекцию и может быть обусловлена эпидидимитом. Лейкоцитарная формула белой крови обычно не дает полезной информации, однако общий анализ крови необходим. До недавнего времени отсутствовали высокоинформативные инструментальные методы, которые помогали бы в дифференциальной диагностике при синдроме острой мошонки. Обычно при подозрении на заворот яичка выполнялось экстренное оперативное вмешательство. Однако исследования последних лет показали, что только 16–42% мальчиков с синдромом острой мошонки имеют заворот яичка.
Для улучшения качества диагностики острых заболеваний органов мошонки и сведения к минимуму числа напрасных хирургических вмешательств предприняты попытки использования УЗИ и МРТ, которые, однако, не получили широкого распространения. Диагностика данной патологии улучшилась при применении методов, основанных на определении тестикулярного кровотока. В последние годы все чаще используют цветную допплеровскую сонографию. Данное исследование становится методом выбора в диагностике острых заболеваний органов мошонки и позволяет характеризовать кровоток, что помогает выявить особенности кровообращения в яичке и окружающих тканях. Кроме того, имеется возможность обнаружить ряд иных патологических состояний органов мошонки.
При выполнении допплеровской сонографии следует иметь в виду, что неправильное ее осуществление приводит к получению как ложноотрицательных, так и ложноположительных результатов. Прежде всего необходима калибровка прибора для установления нормального кровотока в интактном яичке контралатеральной стороны. Затем производится исследование кровотока пораженного яичка. При выявлении нормального либо повышенного кровотока заворот яичка исключается.
Клинические проявления и лечение острых заболеваний органов мошонки. Ранний детский возраст является периодом жизни, характерным для заворота яичка. Одна из причин, способствующих завороту яичка, — нарушение аппарата, фиксирующего яичко. При этом отсутствует нормальное прикрепление семенной железы к влагалищной оболочке, вследствие чего яичко свободно свисает. При резком сокращении m. cremaster, волокна которой имеют спиралевидный ход, возможен заворот яичка.
Вращению яичка и семенного канатика способствуют гипертонус мышцы, поддерживающей яичко, рыхлость сращения оболочек между собой и особенности строения пахового канала у детей раннего возраста. Семенной канатик у детей старшего возраста имеет косое направление и две точки опоры – у глубокого и поверхностного паховых колец, что обеспечивает относительную стабильность канатика. У детей раннего возраста паховый канал короткий, широкий, имеет почти прямое направление, вследствие чего стабильность канатика снижена. У новорожденных и грудных детей заворот яичка происходит, как правило, вместе с его оболочками (экстравагинальная форма), в то время как у детей старше 3 лет вращение половой железы происходит внутри серозной полости яичка (интравагинальная форма).
При торсии яичка заворот сосудистой ножки приводит к развитию острого нарушения крово-, лимфообращения и, как следствие, тотального геморрагического инфаркта яичка. Если в ближайшее время кровообращение не восстанавливается, в яичке развиваются необратимые патологические изменения, которые через 6–12 ч могут обусловить некроз семенной железы.
При завороте яичка у новорожденных и грудных детей в раннем периоде (1 сут) заболевания наблюдается выраженное нарушение состояния, отмечаются беспокойство, рвота. Местные изменения характеризуются отеком и умеренной гиперемией кожи мошонки на стороне поражения. Яичко плотное, резко болезненное, увеличенное в объеме. Семенной канатик утолщен. При экстравагинальной форме подтянутость яичка к поверхностному паховому кольцу менее выражена, чем при интравагинальной форме. Ни одно заболевание органов мошонки не требует столь срочной постановки диагноза, как заворот яичка. Однако в течение первых суток сделать это очень трудно, что объясняется отсутствием настороженности в отношении данной патологии.
В позднем периоде заболевания (после 1 сут) клинические проявления связаны с некрозом яичка. На первый план выступают местные изменения – симптомы воспаления мошонки на стороне поражения. Отек мошонки увеличивается, в ряде случаев она представляется в виде стекловидного шара вследствие распространения отека и гиперемии на обе ее половины, что затрудняет выявление топографии патологического процесса. Яичко и придаток увеличены в объеме и менее болезненны, чем в начале заболевания, семенной канатик утолщен. Дифференцировать придаток затруднительно. Если локальные воспалительные изменения мало выражены, то яичко «просвечивает» через мошонку как темное образование с четкими контурами. Клиническая картина обычно трактуется педиатрами как орхоэпидидимит.
При наличии соответствующего анамнеза и клинических данных, свидетельствующих о завороте яичка, и длительности болевого синдрома менее 12 ч показано экстренное оперативное вмешательство. В данном случае не требуется специального исследования, которое может способствовать задержке адекватного лечения и подвергнуть яичко опасности некроза. При наличии болевого синдрома более 12 ч или сомнении в диагнозе целесообразно выполнение цветной допплерографии.
Оперативное лечение рекомендуется при наличии сниженного кровотока или его отсутствии, а при невозможности выполнения допплеровского исследования – при наличии соответствующих клинических признаков. Необходимо отметить затруднения при получении допплеровского сигнала у новорожденных вследствие малого размера яичек. Наряду с заворотом яичка снижение кровотока (хотя и в меньшей степени) характерно для заворота гидатид семенной железы. Данный метод исследования, помимо заворота яичка, помогает диагностировать ущемленную грыжу, варикоцеле, гематомы и разрыв яичка. Цель операции — ликвидация заворота яичка и фиксация противоположного яичка (орхидопексия) для предотвращения торсии.. Хирургическое вмешательство может быть выполнено через небольшой доступ по средней линии мошонки (raphe). Заведомо некротизированное яичко удаляется. Жизнеспособное яичко фиксируется неабсорбирующимся шовным материалом.
Возможен внутриутробный перекрут яичка. В этом случае непосредственно после рождения в одной из половин мошонки определяется плотное безболезненное образование. Мошонка умеренно отечна и гиперемирована. Так как внутриутробный заворот яичка происходит рано, в результате воспалительного процесса некротически измененное яичко спаивается с тканями мошонки. В ряде случаев необходимость дифференциальной диагностики между заворотом яичка и ущемленной грыжей может потребовать экстренной операции. При этом если обнаруживается перекрут яичка, оно, как правило, бывает нежизнеспособным. В таких случаях необходима фиксация контралатерального яичка для предотвращения возможного заворота в последующем. Следует отметить, что перекрут яичка у новорожденных может быть причиной синдрома «исчезающего яичка», который проявляется как крипторхизм у детей в старшем возрасте.
Заворот гидатид яичка и придатка (эпидидимиса). Гидатиды яичка являются остатками мюллерова протока, локализуются в верхнем полюсе яичка и могут подвергаться завороту. Придаток эпидидимиса локализуется в области его головки, является остатком вольфова протока и также может подвергаться завороту. При завороте придатков наблюдается болевой синдром, однако менее выраженный и развивающийся более медленно, чем при завороте яичка. Отек и гиперемия мошонки мало выражены. Пропальпироватьгидатиду и определить симптом «синего пятна» обычно не удается.
Заворот гидатид яичка может быть ложно интерпретирован как эпидидимит. Однако при завороте анализы мочи нормальные, тогда как при эпидидимите, как правило, с изменениями. При постановке диагноза заворота гидатиды целесообразно ее оперативное удаление ввиду возможного развития атрофии яичка. Заворот яичка у детей грудного возраста возможен при крипторхизме. При этом развивается острое нарушение кровообращения в семенном канатике и яичке. Перекрут сосудистой ножки приводит к отеку и гиперемии мошонки. Степень патологических изменений в яичке зависит от времени ущемления и возраста ребенка. У новорожденных и грудных детей по указанным ранее причинам деструкция половых клеток наступает быстрее. Однако необходимо иметь в виду, что при повреждении органов мошонки изменения сводятся не только к нарушению крово- и лимфообращения. Возможно нарушение гематотестикулярного барьера и развитие аутоиммунной агрессии.
В начальном периоде ишемии яичка ребенок беспокоен, возможна рвота. В паховой области появляются припухлость, болезненность. Ущемленное яичко определяется в виде плотного болезненного опухолевидного образования с четким контуром. При этом мошонка не изменена, яичко в ней отсутствует. Отек мягких тканей и гиперемия в паховой области появляются к концу первых суток после ущемления.
В позднем периоде, когда наступает некроз яичка, общие симптомы заболевания обычно мало выражены. Более значимы местные воспалительные изменения в паховой области на стороне поражения. Младенцы, как правило, госпитализируются в стационар с диагнозом «ущемленная грыжа». В таких случаях необходимо проводить дифференциальную диагностику также с паховым лимфаденитом и аденофлегмоной.
Ущемление и ишемия яичка могут возникнуть как осложнение ущемленной паховой грыжи. Заболевание развивается внезапно и проявляется в виде беспокойства ребенка. Возможны гипертермия, рвота. В паховой или пахово-мошоночной области определяются опухолевидное образование, отек, гиперемия мошонки и болезненное, увеличенное яичко.
Травматические повреждения органов мошонки наблюдаются преимущественно в возрасте 12–15 лет. У новорожденных в родах возможно закрытое повреждение органов мошонки при тазовомпредлежании. Тяжесть повреждений может быть различной. При этом обильное кровоснабжение, рыхлость подкожной клетчатки способствуют быстрому появлению отека и гематомы, которые могут распространяться по мясистой оболочке или между ней и влагалищной оболочкой, а также переходить на области, смежные с мошонкой. При травме мошонки возможно образование внутрияичковой гематомы, гематоцеле или разрыв белочной оболочки яичка. Для диагностики методом выбора является цветная допплеровская сонография.
Травматический эпидидимит характеризуется неспецифическим воспалительным процессом, который развивается в течение нескольких дней после травмы яичка. При травматическом повреждении мошонки (внутрияичковая гематома, гематоцеле, разрыв яичка) необходима оперативная ревизия яичка для решения вопроса о выборе тактики. При постановке диагноза травматического орхита, эпидидимита проводится лечение, как и при нетравматическом эпидидимите.
В некоторых случаях имеет место так называемый идиопатический инфаркт яичка, когда причина заболевания остается невыясненной. Чаще идиопатический инфаркт яичка наблюдается у новорожденных. «Скрытыми» причинами инфаркта являются родовая травма, врожденные аномалии сосудов гонады, не диагностированная ранее ущемленная паховая грыжа, перекрут семенной железы со спонтанной деторсией яичка. Основные клинические симптомы заболевания: беспокойство младенца, отказ от еды. Определяются отек и гиперемия мошонки, увеличенное, болезненное яичко, иногда утолщенный болезненный семенной канатик. К исходу первых суток состояние ребенка ухудшается, повышается температура тела. Диагноз обычно устанавливается интраоперационно. Сохранить яичко, как правило, не удается.
Диагноз орхита и эпидидимита у младенца (как и у детей старшего возраста) может быть поставлен только после исключения заболеваний, требующих оперативного лечения (заворот яичка, гидатид и др). Обязательно лабораторное исследование мочи. При наличии любого эпизода инфекции мочевых путей необходимо УЗИ мочевыводящей системы и выполнение экскреторной цистоуретерограммы для выявления аномалий мочевого тракта. Лечение заключается в проведении эмпирической антибиотикотерапии до получения чувствительности культуры выделенных из мочи микроорганизмов. Если посев отрицательный, клиническая картина, наиболее вероятно, обусловлена пузырно-мочеточниковым рефлюксом. Для облегчения состояния могут быть использованы неспецифические противовоспалительные препараты и анальгетики. Показан щадящий режим и суспензорий. Болевой синдром и отечность мошонки обычно проходят в течение недели. Для ликвидации инфильтрации придатка необходимо несколько недель.
Острый идиопатический отек мошонки — другая возможная причина синдрома острой мошонки. При этом наблюдается быстрое развитие выраженного отека мошонки без болевого синдрома. Может быть гиперемия. Повышение температуры тела обычно отсутствует, и все диагностические исследования не дают результата. Этиология данного состояния остается неясной. Лечение заключается в применении суспензория. Аллергический отек мошонки требует проведения дифференциальной диагностики с заворотом яичка. Диагноз правомочен, когда у ребенка в анамнезе имеются сведения об аллергическом заболевании или предрасположенности к нему (экссудативный диатез, пищевая идиосинкразия и др.). В ряде случаев у детей раннего возраста отек мошонки может быть первым проявлением повышенной чувствительности в ответ на синтетическую одежду, средства обработки кожи промежности и др. В таких случаях большое значение имеет сбор анамнеза. Яички при этом интактны.
Диагностика гнойно-воспалительных заболеваний мошонки – абсцесса, флегмоны, рожистого воспаления обычно не вызывает трудностей. Увеличение половины мошонки возможно вследствие водянки, обусловленной незаращением вагинального отростка. В ряде случаев водянка яичка имеет персистирующее течение. На первом году жизни водянка может ликвидироваться спонтанно. Вследствие этого у новорожденных и грудных детей при отсутствии грыжи возможна выжидательная тактика до 1–2 лет.
2.Аномалии почек: удвоение почек и мочеточников. Диагностика, рентгенодиагностика. Критерии дифференциальной диагностики. Показания к оперативному лечению.
Различают аномалии количества, положения, взаимоотношения,величины и структуры почек.
• Аномалии количества включают агенезию почек и различные варианты
удвоения почек и мочеточников.
• Аномалии положения представлены различными видами дистопии
почек.
• Аномалии взаимоотношения представляют собой сращение почек.
Различают симметричные и асимметричные формы сращения.
К первым относят подково- и галетообразную, ко вторым — S-,
L- и I-образную почки.
• Аномалии величины и структуры включают аплазию, гипоплазию,
удвоение почки и кистозные аномалии.
Агенезия почки
Отсутствие закладки почки встречают с частотой 1 на 1000 новорождённых.Двусторонняя почечная агенезия возникает в 4 раза режеодносторонней и преимущественно у мальчиков (в соотношении 3:1).Дети с агенезией обеих почек (аренией) нежизнеспособны и обычно рождаются мёртвыми. Однако описаны казуистические наблюдения довольно длительного выживания. Это можно объяснить замечательнойособенностью детского организма, когда другие органы выполняют
функцию поражённого или полностью вышедшего из строяоргана. При этом функцию выделения осуществляют печень, кишечник,кожа и лёгкие.
Агенезия почки обычно сочетается с отсутствием мочевого пузыря дисплазией половых органов, нередко — с лёгочной гипоплазией, менингоцеле и другими врождёнными пороками.
Клиническая картина и диагностика
Односторонняя агенезия почки связана с отсутствием образованиянефробластемы с одной стороны. При этом, как правило, отсутствуетсоответствующий мочеточник, отмечают недоразвитие половины мочевогопузыря и нередко полового аппарата. Единственная почкаобычно гипертрофирована и полностью обеспечивает выделительнуюфункцию. В таких случаях аномалия протекает бессимптомно.При экскреторной урографии на стороне агенезии контраст не появляется.Цистоскопия выявляет отсутствие соответствующего устья мочеточника и гемиатрофиюмочепузырного треугольника. Ангиографияуказывает на отсутствие почечной артерии.
Удвоение — самая частая аномалия почки, встречающаяся у 1 и3150 новорождённых, причём у девочек в 2 раза чаще, чем у мальчиков.Она может быть одно- и двусторонней. Возникновение аномалии связано с расщеплением мочеточникового зачатка в самом начале или на пути перед врастанием его в нефрогенную бластему.Верхний сегмент почки составляет около трети всей почечнойпаренхимы, дренируется верхней группой чашечек, впадающих вотдельную лоханку. В лоханку нижнего сегмента впадают средняяи нижняя группы чашечек. Примерно в половине случаев каждыйсегмент удвоенной почки имеет изолированное кровоснабжение
из аорты.Мочеточники, отходящие от лоханок удвоенной почки, проходятрядом, зачастую в одном фасциальном влагалище, и впадают в мочевойпузырь либо раздельно, либо сливаясь в один ствол на
том или ином уровне. При слиянии мочеточников речь идёт о неполномудвоении коллекторных систем почки и мочеточников.Это состояние чревато возникновением уретеро-уретерального рефлюкса, связанного с несинхронным сокращением и расслаблениемветвей мочеточника. Уретеро-уретеральный рефлюкс — функциональноепрепятствие, способствующее застою мочи и развитию пиелонефрита.При полном удвоении коллекторной системы почки имочеточников каждый из мочеточников открывается в мочевой пузырьотдельным устьем. При этом мочеточник, дренирующий нижнийсегмент, открывается в мочевой пузырь проксимальнееобычного
места впадения (угла мочепузырного треугольника), а мочеточник,дренирующий верхний сегмент, — дистальнее (закон Вейгерта—Мейера). При этом у девочек он может оказаться эктопиро-
ванным в производные урогенитального синуса (шейку мочевогопузыря, уретру, преддверие влагалища) и мюллеровых протоков (влагалище,матку), а у мальчиков — в производные воль-
фовых протоков (заднюю уретру, семенные пузырьки, семявыносящие протоки, придаток яичка).
По статистическим данным, эктопия устья при удвоении мочеточникабывает в 10% случаев, причём у девочек в 4 раза чаще, чем у мальчиков.
Клиника
Эта форма заболевания у детей чаще всего проявляется инфекциеймочевых путей, что служит показанием к комплексному исследованию,хотя человек с удвоенной почкой может прожить долгую
жизнь без каких-либо жалоб и клинических проявлений, и лишь прислучайном УЗИ выявляют аномалию. Удвоение мочеточников в частислучаев становится причиной пузырно-мочеточникового рефлюксаввиду неполноценности замыкательного механизма устьев. Чаще рефлюкспроисходит в нижний сегмент удвоенной почки. Устье мочеточникаверхнего сегмента иногда оказывается суженным, что приводит к образованию кистозной полости, вдающейся в просветкочевого пузыря (уретероцеле), и расширению мочеточника (мегауретер.Диагноз ставят на основании результатов УЗИ и экскреторнойУРографии.На экскреторных урограммах, если функция обоих сегментов
почки сохранена, коллекторные системы чётко дифференцируются. При поражении паренхимы одного из сегментов (чаще верхнего) удвоенной почки он может быть не виден. Однако опосредованноможно судить о существовании поражённого сегмента на основании
смещения функционирующего сегмента и уменьшения количествачашечек.Цистоскопия позволяет отдифференцировать полное и неполноеудвоение мочеточников, оценить состояние их устьев. Наличие большогоуретероцеле нередко затрудняет цистоскопию и не позволяетидентифицировать устья мочеточников.При шеечной и уретральной эктопиях мочеточника основная жалоба
— постоянное недержание мочи наряду с сохранёнными позывами к мочеиспусканию и нормальными микциями.Диагностике помогают данные экскреторной урографии с отсроченными
снимками (удвоение лоханки), цистоуретрографии (возможенрефлюкс в эктопированный мочеточник), цистоуретроскопии.Некоторую помощь может оказать проба с введением в мочевой пузырьпо катетеру с баллоном метилтиониния хлорида. Подтеканиенеокрашенной мочи мимо катетера свидетельствует о наличии уретральнойэктопии мочеточника.
Лечение
Оперативное лечение при удвоении почек и мочеточников показанов следующих случаях:
• полное отсутствие функций одного или обоих сегментов почки
— проводят геминефруретерэктомию или нефрэктомию;
• рефлюкс в один или оба мочеточника — выполняют антиреф-
люксную операцию;
• уретероцеле — показано его иссечение с неоимплантацией мочеточников
в мочевой пузырь;
• внесфинктерная эктопия мочеточника — последнийанастомо-
зируют с мочеточником, впадающим в мочевой пузырь, и ребёнок
избавляется от недержания мочи.
3.Дивертикул пищевода.Удвоение пищевода. Врожденный короткий пищевод. Клиника. Современные принципы диагностики и лечения.
Врожденные дивертикулы пищевода располагаются при переходе глотки в пищевод, в грудной части (в местах сужений пищевода), отходят от пищевода в виде выпячиваний или мешков с отверстием разной ширины. Эта редкая аномалия устанавливается при операции или на секции, в отдельных случаях в результате рентгенологического исследования (Nelson). Приобретенные дивертикулы — истинные и ложные, пульсионные и тракционные — у детей встречаются редко. При крупных дивертикулах временами наступают затруднения проглатывания, иногда с отрыжкой и регургитацией задержавшейся пищи. У детей практически не бывает отмечаемого у взрослых выпячивания на шее слева при высоко расположенном («ценкеровском») дивертикуле. Диагноз дивертикула уточняется рентгенологическим исследованием. Приходится дифференцировать с врожденным и приобретенным сужением пищевода, с воспалительными процессами вблизи пищевода. Врожденное расширение пищевода (megaoesophagus), или ахалазия пищевода, встречается редко. Возникает в результате недоразвития ганглиозных клеток в дистальной части стенки пищевода. Симптомы в противоположность врожденному сужению пищевода появляются относительно поздно, поскольку жидкая и полужидкая пища при кормлении грудного ребенка хорошо проходит в желудок. При переходе на более густую и плотную пищу появляются нарушения проглатывания, срыгивание пищи вместе со слюной и слизью, без кислоты. Дети жалуются на давление под ложечкой, наблюдается частая отрыжка. При рентгенологическом исследовании со взвесью бария видны характерное веретенообразное расширение пищевода в средней части с постепенным воронкообразным сужением книзу и суженная сократившаяся дистальная (нижняя) часть пищевода.
При эзофагоскопии обнаруживается расширенный мешок в средней части пищевода с остатками пищи. Желудочный зонд проходит без труда в желудок, что важно при дифференцировании от сужения. Врожденное расширение пищевода некоторые авторы считают идентичным с ахалазией пищевода. Ахалазия пищевода — состояние близкое, может быть, даже аналогичное предыдущему. Термин «ахалазия пищевода» у детей предложил Hurst (1915) для обозначения состояния кардиоспазма, описанного еще Mikuli (1882). Отсутствие расслабления мышц пищевода также объясняют недостатком или отсутствием ганглиозных клеток ауэрбахова сплетения в стенке нижней (дистальной) части пищевода. Симптомы ахалазии пищевода проявляются в нарушении проглатывания пищи (дисфагии). Отмечается регургитация (срыгивание) и рвота, обычно без тошноты. Рвотные массы содержат остатки предыдущего кормления, не кислые. Во время частой рвоты может наступить аспирация пищи в дыхательные пути с развитием аспирационной пневмонии. Рентгенологически отмечается картина, весьма близкая к изменениям, характерным для врожденного расширения пищевода. У кардии, на месте, перехода пищевода в желудок, выявляются задержка прохождения пищи, а выше — расширение пищевода, обычно значительное. Несмотря на выраженную дисфагию и на задержку проходимости пищи через кардию, резиновый зонд свободно проходит в желудок. Халазией пищевода называют изредка встречающееся у новорожденных расслабление (релаксацию) кардии. В результате пища из желудка легко поступает обратно в пищевод (рефлюкс), особенно при вдохе, если ребенок находится в положении лежа. С первых дней после рождения у ребенка отмечается рвота, как только его укладывают в горизонтальное положение после кормления. В результате ребенок остается голодным и поэтому охотно сосет вновь. Диагноз уточняют с помощью рентгенологического контрастного исследования. На рентгенограмме видно ослабление перистальтики пищевода. Он умеренно расширен, его стенки тонкие и вялые. Контрастное вещество (взвесь бария) при дыхании перемещается вверх и вниз в зависимости от вдоха и выдоха, как в сторону рта, так и в сторону желудка. Отмечаются свободный рефлюкс (обратный отток) и регургитация (срыгивание) из желудка в пищевод, которые прекращаются в вертикальном положении ребенка (Ravitch). Дифференцировать халазию пищевода приходится с грыжей пищеводного отверстия.
Билет №28
Паховые грыжи: дифференциально-диагностические критерии. Сроки и показания к оперативному лечению.
Паховая грыжа представляет собой опухолевидное образование в паховой области. При наличии образования в паховой области и мошонке грыжа называется пахово-мошоночной. При этом, содержимым образования - грыжевого мешка - является прядь сальника, петля кишки, яичник и др. При надавливании на это опухолевидное образование оно «урчит» и исчезает - грыжа «вправляется».
У детей в большинстве случаев встречаются косые паховые грыжи. Они имеют общую природу с сообщающейся водянкой яичка и кистой семенного канатика. Грыжевым мешком является незаращенный, широкий вагинальный отросток брюшины, который соединяет мошонку с брюшной полостью и по которому происходит выхождения содержимого брюшной полости в паховый канал.
Обычно паховые грыжи выявляются у детей первых 2-х лет жизни, нередко при плаче, натуживании, беспокойстве ребенка. Редко в детском возрасте встречается прямая паховая грыжа, аналогичная паховым грыжам у взрослых.
Наиболее грозным осложнением паховой грыжи является ее ущемление. При этом образование в брюшную полость не вправляется, ребенок становится беспокойным, может появляться покраснение кожи над образованием, повышение температуры тела. Во время ущемления в паховом канале происходит сдавление содержимого грыжевого мешка, что может приводить к воспалению и омертвению (некрозу) тканей, а также развитию перитонита (воспаления в брюшной полости).
У девочек грыжевым содержимым при ущемлении часто оказывается яичник с маточной трубой, что может вести к омертвению части или всего яичника или некрозу маточной трубы.
При невозможности вправления паховой грыжи необходимо экстренная операция. Ребенка необходимо срочно доставить в больницу. При затягивании такой операции возможно прогрессирующее ухудшение состояния ребенка и развитие перитонита.
ЛЕЧЕНИЕ
Ребенку с паховой грыже показана операция в плановом порядке. Применяют операцию - грыжесечение, которая заключается в том, что разрезом в паховой области (разрез длиной 1-2 см внизу живота) выделяют и иссекают грыжевой мешок, вправляют содержимое в брюшную полость. Накладывается внутрикожный косметический шов. Во время выполнения вмешательства необходимо аккуратное и деликатное выделение и сохранение сосудов семенного канатика и семявыносящего протока. При неправильно проведенной операции сохраняется грыжевой мешок, что может вести к сохранению патологии, кроме того возможно высокая фиксация яичка (выше дна мошонки).
Операция выполняется под общим обезболиванием - наркозом. Продолжительность операции 20-30 минут.
Как правило, операция грыжесечение выполняется в день поступления ребенка в стационар. После операции ребенок быстро адаптируется. Просыпается после наркоза через 30 минут и в этот же день настолько хорошо себя чувствует, что уезжает домой. Контрольный осмотр ребенка после операции происходит через 7 дней и 3 месяца.
2.Мочекаменная болезнь. Дифференциально-диагностические критерии мочекаменной болезни: камни почек, мочеточников, уретры. Показания к оперативному и консервативному лечению.
Мочекаменную болезнь у детей встречают реже, чем у взрослых;мальчики страдают ею чаще, чем девочки.
Этиология и патогенез
К основным причинам заболевания относят разнообразные врождённыеи приобретённые энзимопатии (тубулопатии), инфекциимочевых путей, обструктивныеуропатии, нарушения кровоснабженияпочек (при шоке, травме).В детском возрасте наиболее часто выявляют фосфатные, оксалатные, карбонатные и цистиновые камни. Обычное место образованиякамней — верхние отделы мочевых путей. Размеры и формаконкрементов могут быть самыми разнообразными: от несколькихмиллиметров в диаметре до крупных, заполняющих всю коллекторнуюсистему почки коралловидных камней.
Клиническая картина и диагностика
Клиническая картина и диагностика зависят от локализации камня,возраста ребёнка и выраженности мочевой инфекции. К общимсимптомам относят изменения мочи в виде гематурии и лейкоцитурии
и отхождение мелких конкрементов.Наиболее характерный симптом — боль. Она может быть постояннойили интермиттирующей, тупой или острой. Локализация и иррадиацияболи зависят от местонахождения камня. Большие и коралловидныекамни почки малоподвижны и вызывают тупую боль впоясничной области. Боль по типу колики свойственна мелким конкрементамлоханки и мочеточника, склонным к миграции. Возникновениеболей связано с обтурацией камнем мочевыводящих путей иповышением вследствие этого внутрилоханочного давления, что вызывает
раздражение рецепторов чувствительных нервов ворот и фибрознойкапсулы почки. Продвигаясь по мочеточнику, камень последовательноменяет иррадиацию боли — в паховую область, бедро и
половые органы.Помимо локальной симптоматики почечная колика проявляетсяобщими признаками: повышением температуры тела, рвотой, метеоризмом,запором, интоксикацией, лейкоцитозом и увеличением СОЭ.У детей раннего возраста почечная колика проявляется двигательнымбеспокойством, диспепсией, рвотой, что создаёт картину острого
хирургического заболевания брюшной полости. Сложность дифференциальной
диагностики в этой группе больных часто приводитк неоправданным лапаротомиям (при правосторонней колике — аппендэктомии по поводу «катарального аппендицита»).Для больных с камнями нижних мочевых путей характерныдизурические явления. Камни мочевого пузыря травмируют слизистуюоболочку, вызывая её воспаление. Это проявляется частым болезненным
мочеиспусканием, иррадиацией боли в головку полового члена.Почечная колика, вызванная мелким камнем, обычно заканчиваетсясамопроизвольным его отхождением и купированием болевого приступа.Один из самых частых признаков уролитиаза — гематурия. Она может быть различной интенсивности — от эритроцитурии до выраженноймакрогематурии, обычно появляющейся после физическойнагрузки. Появление терминальной гематурии (в конце акта мочеиспускания)
свойственно больным с камнем мочевого пузыря и вторичнымциститом.Лейкоцитурия (пиурия) — симптом вторичного пиелонефрита илицистита, осложняющего течение мочекаменной болезни.
Отхождение мелких конкрементов служит достоверным признакомуролитиаза, однако не свидетельствует о наличии оставшихсякамней.При диагностике мочекаменной болезни следует учитывать семейныйанамнез, выявление в моче эритроцитов и кристаллов, результаты
бактериологического исследования мочи, её рН, концентрациюгидрокарбоната в сыворотке с целью исключения почечного канальцевого ацидоза, концентрации в крови кальция, фосфора, щелочнойфосфатазы и мочевой кислоты, результаты пробы с нитропруссидомна цистин, содержание кальция и щавелевой кислоты в суточноймоче.Ведущими в диагностике уролитиаза служат рентгенологическиеметоды исследования. Рентгеноконтрастный камень обнаруживают
на обзорном снимке органов мочевой системы. Экскреторная урографиявыявляет локализацию камня, наличие и степень вторичныхизменений в органах мочевой системы. В случае неконтрастного камняна урограммах определяют дефект наполнения. Рентгенонегативные камни почек можно выявить путём ретрограднойпневмоуретеропиелографии (введение воздуха в мочеточник).
Лечение
Выбор метода лечения больных нефролитиазом зависит от величиныи локализации камня, его клинических проявлений и состава,возраста и состояния ребёнка, анатомо-функционального состоянияпочек и мочевых путей. Методы лечения могут быть консервативнымии оперативными. Как правило, больные подлежат комплексномулечению.Консервативное лечение показано в тех случаях, когда конкрементне вызывает нарушения оттока мочи. Применяют средства, способствующиерастворению камней или спонтанному их отхождению.Показано потребление в течение суток большого количества жидкостидля уменьшения концентрации мочи. Особое место в лечениинефролитиаза занимают мероприятия по купированию почечной колики,которые следует начинать с тепловых процедур в сочетании санальгетиками и спазмолитиками. Делают новокаиновую блокадусеменного канатика по Лорину—Эпштейну. При отсутствии эффекта
катетеризируют мочеточник, проводя катетер выше камня, для снятиявнутрилоханочной гипертензии. При инфекции мочевых путейследует применять соответствующие антибактериальные препараты.Показания к оперативному лечению — прогрессирование пиелонефрита,нарастание гидронефротической трансформации, ухудшениефункций почек, постоянный и выраженный болевой синдром.При хирургическом лечении проводят пиелолитотомию (удалениекамня через разрез лоханки), каликотомию (через разрез чашки), нефролитотомию (через разрез паренхимы), уретеролитотомию (черезразрез мочеточника). При полном отсутствии функций почки выполняют
нефрэктомию.Кроме указанных, существуют также методы ударной ультразвуковойлитотрипсии, находящей всё большее применение в детскойурологической практике, трансуретрального эндоскопического разрушениякамней мочевого пузыря, удаление небольших камней из
мочеточников с помощью экстракторов (петли Дормиа и Цейсса).
3.Врожденный вывих бедра. Клиника и диагностика у детей до 1 года жизни.
Врожденный вывих бедра — одна из наиболее часто встречающихся врожденных деформаций опорно-двигательного аппарата. Этот порок развития характеризуется недоразвитием всех элементов тазобедренного сустава и нарушением соотношений головки бедренной кости и вертлужной впадины. Он проявляется в трех формах, переходящих одна в другую: неустойчивое бедро, врожденный подвывих и, наконец, врожденный вывих бедра.
Этиология. Причиной заболевания могут быть порок первичной закладки опорно-двигательного аппарата, задержка внутриутробного развития плода в связи с изменениями витаминного баланса, особенно витамина В2, гормональными нарушениями, токсикозы и нефропатии беременных, сопровождающиеся нарушением водно-солевого и белкового обмена, а также наследственная дисплазия тазобедренных суставов и т. д.
Патогенез врожденного вывиха связан с предшествующим подвывихом, неустойчивостью бедра (или дисплазией). Последняя характеризуется гипоплазией вертлужной впадины плода, ее уплощением, развитие головки бедренной кости замедляется, верхний конец бедренной кости поворачивается кпереди (антеторсия), одновременно замедляется развитие нервно-мышечного и сумочно-связочного аппарата. Если после рождения у ребенка определяется дисплазия бедренной кости или ее подвывих, то с ростом ребенка и при отсутствии раннего неоперативного лечения к времени начала ходьбы развивается врожденный вывих бедра. Поэтому для предупреждения изменений тазобедренного сустава необходим осмотр новорожденного в родильном доме микропедиатром или ортопедом.
Основным, ранним клиническим симптомом неустойчивого бедра у новорожденных и грудных детей является ограничение пассивного разведения согнутых под прямым углом в тазобедренных и коленных суставах ног у новорожденного, лежащего на столе для пеленания. Надо иметь в виду, что у новорожденных повышен тонус мышц конечностей, поэтому полное разведение бедер невозможно, однако разница в углах отведения говорит о децентрации головки бедра в вертлужной впадине, что косвенно указывает на недоразвитие сустава.
Другими признаками являются асимметрия складок кожи на бедре, асимметрия ягодичных складок.
Относительное укорочение и ротация конечности кнаружи также являются симптомом вывиха в тазобедренном суставе. Укорочение нижней конечности можно выявить при осмотре ребенка, лежащего на спине, при сгибании ножек в тазобедренных и коленных суставах (рис. 279, б).
При врожденном вывихе бедра ранее описанные симптомы более выражены. Появление поздних симптомов связано с началом ходьбы: значительное ограничение отведения бедра, напряжение приводящих мышц, большой вертел выше линии Розера — Нелатона. При отведении бедра в положении сгибания в тазобедренном суставе увеличивается глубина бедренного треугольника, в котором отсутствует головка бедра. При одностороннем вывихе бедра выявляются значительное укорочение и ротация конечности наружу (симптом Тренделен-бурга — при стоянии на вывихнутой ноге снижается уровень ягодичной складки с этой стороны, возникает перекос таза).
При вывихе нарушается походка. При одностороннем выявляются прихрамывание с отклонением туловища в сторону вывиха, наклон таза в больную сторону и функциональный сколиоз. При двустороннем вывихе бедер походка утиная, таз наклоняется вперед с образованием лордоза.
Рентгенограмму обоих тазобедренных суставов производят в положении больного лежа на спине с вытянутыми и приведенными ногами, расположенными симметрично, а также с небольшой ротацией конечностей внутрь. При оценке рентгенограммы надо иметь в виду, что вертлужная впадина содержит хрящевую ткань и контрастная тень отсутствует, головки бедренных костей — также хрящевые, до 4 мес ядра окостенения отсутствуют, поэтому условно высота головки бедренной кости равна ширине шейки.
К рентгенологическим признакам неустойчивого бедра относятся скошенность крыши впадины тазобедренного сустава и позднее появление ядер окостенения головок бедренных костей.
При вывихе бедра на рентгенограмме головка на стороне вывиха меньших размеров, уплощена и располагается вне впадины. Крыша вертлужной впадины скошена. Нарушение состояния бедренного и тазового компонентов сустава увеличивается по мере роста ребенка.
Ранние рентгенологические признаки врожденного вывиха бедра были описаны в виде триады: 1) повышенная скошенность крыши вертлужной впадины; 2) смещение проксимального конца бедренной кости кнаружи и кверху; 3) позднее появление и гипоплазия ядра окостенения. Была предложена схема, на которой одна линия соединяет верхние части метафизовобоих бедренных костей и две линии проведены перпендикулярно через середины суставных впадин. Смещение проксимального конца бедренной кости кверху и кнаружи от линии пересечения перпендикуляров говорит о поражении сустава. В норме ядро окостенения головки бедренной кости на рентгенограмме появляется на 4—6-м месяце жизни, а при неустойчивом бедре, подвывихе или вывихе окостенение задерживается до 9—10 мес. Если у ребенка имеются лишь первые две формы поражения бедра, желательно использовать схему Хильгенрайнера для оценки рентгенограммы. При этом проводят горизонтальную линию через оба V-образных хряща и от верхней точки диафиза к этой линии восстанавливают перпендикуляр. В норме высота h должна равняться 1—1,5 см, расстояние от дна вертлужной впадины до перпендикуляра d = 1...1,5 см. Угол наклона вертлужной впадины у новорожденного равен 27—30°, а к 2-летнему возрасту — 20°. Но при диагностике неустойчивого бедра важны не сами углы наклона, а разница в углах с обеих сторон. При подвывихе и вывихе расстояние d больше, чем на противоположной стороне.
Описанная клинико-рентгенологическая картина позволяет выявить ранние патологические изменения тазобедренного сустава.
29
1. Атрезия ануса и прямой кишки: клиника, диагностика, лечение
1. Атрезия заднего прохода и прямой кишки — отсутствие естественного канала прямой кишки и/или заднепроходного отверстия; аномалия развития.
Частота. 1:500–1:5000 живорождённых. Преобладающий пол — мужской (2:1).
Генетические аспекты. Существуют наследственные формы атрезий • Синдромы VATER и VACTERL (192350): атрезия заднего прохода, пищевода, двенадцатиперстной и прямой кишок, трахеопищеводный свищ, гипоплазия лёгких, дисплазия лучевой кости, шестипалость, гипоплазия бедренной кости, аномальное расположение большого пальца кисти, ДМЖП, агенезия почек, атрезия мочеиспускательного канала и гидронефроз, дефекты позвонков (полупозвонки) • Синдром VACTERL и гидроцефалия (314390, A или r). Сочетание синдрома VAСTERL и гидроцефалии • Дизостозпозвонково-рёберный с атрезией заднего прохода и урогенитальными аномалиями (271520, r): атрезия заднего прохода, мочеполовые аномалии, единственная пупочная артерия, выраженная дисплазия рёбер и позвонков, необычная форма грудной клетки.
КЛАССИФИКАЦИЯ. • Атрезии •• Клоакальная форма (у девочек)* ••• пузырная ••• вагинальная •• Со свищами ••• в мочевую систему у мальчиков (в мочевой пузырь и мочеиспускательный канал)* ••• в половую систему у девочек (матку*, влагалище*, преддверие влагалища) ••• на промежность у мальчиков и девочек (у мальчиков также на мошонку и половой член) •• Без свищей ••• атрезия заднего прохода и прямой кишки* ••• атрезия заднепроходного канала ••• прикрытое заднепроходное отверстие ••• атрезия прямой кишки при нормально развитом заднем проходе • Примечание. Звёздочкой (*) отмечены высокие формы атрезии (надлеваторные, слепой мешок прямой кишки расположен выше 2–2,5 см от кожи). Все остальные относят к низким (подлеваторные).
КЛИНИКА.
• Обычно выявляют при первичном осмотре новорождённого в родильном доме.
• Если осмотр ребёнка после рождения по каким-либо причинам не был произведён, то к концу суток новорождённый начинает беспокоиться, появляются обильное срыгивание, рвота содержимым желудка, затем — жёлчью, а в поздние сроки — меконием, постепенное вздутие живота. Меконий и газы не отходят. Развивается картина низкой кишечной непроходимости.
• Физикальное исследование в первые часы после рождения устанавливает вид атрезии и её высоту •• Прикрытое анальное отверстие — наиболее лёгкая форма низкой атрезии. На месте заднепроходного отверстия выявляют полупрозрачную мембрану, через которую просвечивает заполненная меконием прямая кишка •• Атрезия анального канала: также относят к разряду низких. На месте заднепроходного отверстия обнаруживают незначительное вдавление пигментированного участка кожи. При надавливании на него ощущают баллотирование (низкое расположение прямой кишки) •• Атрезия анального канала и прямой кишки: относят к высоким формам атрезий. Промежность обычно уменьшена в размерах, недоразвита. Нередко недоразвит или отсутствует копчик, иногда — крестец. На месте заднепроходного отверстия кожа чаще всего гладкая •• Атрезия прямой кишки (изолированная) может быть высокой и низкой. Заднепроходное отверстие с хорошо сформированным наружным сфинктером расположено на обычном месте. Для установления диагноза достаточно ввести катетер через заднепроходное отверстие или провести пальцевое исследование •• Свищ в половую систему бывает исключительно у девочек. Основной признак — выделение мекония, а затем кала и газов через половую щель •• Свищ в мочевую систему (мочевой пузырь, мочеиспускательный канал) возникает почти исключительно у мальчиков. Основной признак — отхождение мекония и газов через наружное отверстие мочеиспускательного канала. При расположении свища выше сфинктера мочевого пузыря меконий отходит только во время мочеиспускания (моча, окрашенная меконием) •• Клоакальная форма атрезии — наиболее сложный аноректальный порок развития. Во время осмотра обнаруживают отсутствие заднепроходного отверстия. На месте, где должны быть наружные отверстия мочеиспускательного канала или влагалища, находится одно отверстие — выход клоаки, в которую открываются мочеиспускательный канал, влагалище и прямая кишка. Анатомические формы клоаки многообразны, поэтому необходимо детальное обследование •• Свищ на промежность возникает у мальчиков и девочек. Диагностика основана на наружном осмотре — отхождение мекония и газов из «нетипичного места» •• Сочетанные пороки развития в разнообразных комбинациях (аплазия почки, мегауретер, гипоспадия, удвоение почки и мочеточника и др.) часто возникают при атрезиях заднего прохода и прямой кишки.
ДИАГНОСТИКА. • Тщательный осмотр промежности • Зондирование прямой кишки • УЗИ • Рентгенография по Вангенстину проводят через 12–18 часов (после заполнения прямой кишки воздухом). Место естественного расположения заднепроходного отверстия маркируют рентгеноконтрастным предметом (дробинка, небольшое количество сульфата бария и т.п.). Ребёнка заворачивают в пелёнки, оставляя ноги открытыми, помещают под рентгеновский экран и опускают вниз головой. По расстоянию между слепым концом кишки (газовый пузырь) и меткой судят о высоте атрезии • Катетеризация мочеиспускательного канала — диагностика свища в его мембранозной части • Уретроцистографияоблегчает диагностику свища в мочевую систему • Лапароскопия показана для уточнения состояния внутренних половых органов.
ЛЕЧЕНИЕ
Методы хирургических вмешательств • Одномоментная радикальная операция по методике Пена • При противопоказаниях к одномоментной радикальной операции или при невозможности её выполнения накладывают колостому.
Противопоказания к одномоментной радикальной операции • Тяжёлые сочетанные пороки развития • Сопутствующие заболевания • Высокая атрезия прямой кишки у ребёнка с недоношенностью II–IV степени.
2. Пороки развития легких у детей
Этиол: Бактериальная инфекция(а также как всегда: среда, радиация, палигон и т.д)
Клиническая картина
Гипоплазии долей легких являются наиболее частой формой из всех пороков развития легких, встречающихся у детей. В зависимости от формы гипоплазии (простая, кистозная) значительно различаются их клинические проявления и рентгено-бронхологическая картина, а в связи с этим тактика лечения (консервативное или хирургическое). Консервативная терапия как при отсутствии показаний к хирургическому лечению, так и в до- и послеоперационном периодах должна включать в себя в качестве важнейшего компонентаантибиотикотерапию.
Эмфизема часто захватывает долю легкого (лобарная). В основе заболевания лежит дефект развития хрящевых колец долевого или сегментарного бронха, в результате этого развивается вентильный механизм, способствующий резкому вздутию паренхимы легких, которая определяет клинико-рентгенологическую картину порока. Наслоение инфекционного воспалительного процесса (пневмония) вызывает резкое утяжеление заболевания.
Кисты легкого могут быть одиночными и множественными. Неосложненные кисты могут протекать бессимптомно. Инфицированные, дренирующиеся через бронхи кисты характеризуются частыми обострениями, протекающими нередко по типу пневмонической вспышки, по клиническому течению близки к бронхоэктазам.
Секвестрация - порок легкого, связанный с аномальным кровоснабжением. Рудиментарный зачаток легкого, не имеющий сообщения с бронхами, кровоснабжается осуществляется аномальной артерией, отходящей непосредственно от аорты. Клиническое течение зависит от инфицирования.
Распространенные пороки развития бронхов
Основной формой из группы распространенных пороков развития стенки бронхов является синдром Вильямса - Кемпбелла. В его основе лежит отсутствие хряща в бронхах с 3-4-го до 6-8-го порядков. В результате слабость бронхиальной стенки приводит к выраженной дискинезии бронхов, нарушению вентиляции легких, застою бронхиального секрета и его инфицированию. При этом развивается тяжелый хронический бронхит и характерные (баллонные) бронхоэктазы. Заболевание характеризуется тяжелым течением. У больных развивается деформация грудной клетки и концевых фаланг пальцев по типу (барабанных палочек). Отмечается постоянный влажный кашель с мокротой, хроническая интоксикация, нарушение вентиляции комбинированного типа. Бронхоскопически определяется катарально-гнойный или гнойный эндобронхит. Характерна хроническая гипоксемия и формирование легочного сердца у части больных. Процесс обычно двусторонний, хотя в отдельных случаях он бывает односторонним. В таких случаях заболевание протекает легче.
Синдром Картагенера представляет собой комбинированный (системный), наследственно-обусловленный порок развития с триадой симптомов: обратное расположение сердца (декстракардия) и других внутренних органов, хронический бронхолегочный процесс и синусоринопатия. В основе легочного компонента порока лежит анатомическая и функциональная патология ресничек мерцательного эпителия слизистой оболочки бронхов, что приводит к нарушению мукоцилиарного клиренса, являющегося основным механизмом их самоочищения. В результате у больных развивается тяжелый бронхолегочный процесс, в основе которого лежит распространенный хронический бронхит. Наряду с этим у больных синдромом Картагенера могут обнаруживаться участки пневмосклероза с деформацией бронхов и бронхоэктазами. Типичным является упорное, трудно поддающееся лечению поражение носоглотки (рецидивирующий синусит, ринит). Нарушение вентиляции легких и бронхоскопические изменения близки к обнаруживаемым у детей с синдромом Вильямса - Кемпбелла. Показания к оперативному лечению крайне ограничены в связи с распространенностью основного дефекта.
К описанному пороку примыкает синдром неподвижности (или дисфункции) ресничек. Как и при синдроме Картагенера, у больных имеется врожденный дефект ресничек мерцательного эпителия бронхов в виде их неподвижности или асинхронного биения, нарушающий нормальную работу эскалатора. Бронхолегочные изменения при этом аналогичны обнаруживаемым у детей с синдромом Картагенера. Если диагноз последнего не вызывает трудностей, то для подтверждения описываемого синдрома требуется электронно-микроскопическое исследование ресничек.
Лечение Консервативная терапия, как упоминалось, занимает существенное место в лечении пороков развития легких как подлежащих, так и не подлежащих хирургическому лечению. В случаях, при которых показано хирургическое лечение, консервативная терапия должна проводиться в дооперационном периоде для снятия обострения и снижения активности воспалительного процесса. В послеоперационном периоде она показана для профилактики осложнений и более быстрой реабилитации больного.
Хирургическое лечение
Хирургическому лечению подлежат дети преимущественно с ограниченными пороками развития легких, кистозными и бронхоэктатическими формами гипоплазии долей легких, кистами легких, легочной секвестрацией, врожденной долевой эмфиземой.
Оперативные вмешательства должны проводиться после тщательного обследования больных, с учетом выраженности морфологических и функциональных изменений, объема поражения, эффективности консервативной терапии. Решение о целесообразности хирургического лечения и сроков его проведения должно приниматься совместно хирургом и педиатром-пульмонологом. Распространенные пороки развития легких, синдром Зиверта-Картагенера, синдром Вильямса-Кемпбелла оперативному лечению не подлежат в связи с распространенностью врожденных дефектов бронхов и легких.
Ввиду того, что субстратом хронического воспаления при аномалиях развития бронхов и легких являются стойкие необратимые морфологические изменения, заболевание не может в принципе быть излечено консервативными методами, итем не менее, проведение целенаправленного лечения и реабилитации позволяет улучшить прогноз этих тяжелых инвалидизирующих заболеваний, способствовует уменьшению частоты обострении и улучшению качества жизни ребенка
3. Врожд вывих бедра- это порок развития тканей тазобедсуст, при котором может наблюд выхождение головки бедрен кости из вертлуж впадины. Частота- дисплазия у 16 из 1000 новорожд, тяжелый вывих бедра- у 5-7 на 1000. Односторонний вывих преобладает над двусторонним. Левосторонний вывих встреч в 2 раза чаще чем правосторон. Женский пол пораж в 2 раза чащемужского. КлассификацияВыделяют три степени дисплазии:
Врожденный вывих бедра. Суставная впадина, головка и шейка бедра изменены. Суставные поверхности разобщены. Головка бедра находится выше суставной впадины и в стороне от нее.Клиника- 1. симптом щелчка 2. огранич отведения бедер 3. ассиметрия кожных складок или неравномер их количество на бедрах 4. укорочение конечности 5. наружная ротация отмечается на больной стороне
ЛЕЧЕНИЕ до 1 года консервативное (посм в книге)
30
1.Внутрибрюшная грыжа – это выпадение внутренних органов в карманы брюшины (оболочки, выстилающей брюшную полость): сальниковую сумку, карманы около сигмовидной или слепой кишки и т.д.
Предрасполагающие факторы. К ним относят особенности конституции человека, сложившиеся на основе наследственных или приобретенных свойств. Это, прежде всего, наследственная предрасположенность к образованию грыж, а также типовые, половые и возрастные различия в строении тела. Например, изменения в брюшной стенке, связанные с беременностью, тяжелым физическим трудом, при нарушении питания (ожирение или истощение).
Производящие факторы, способствующие повышению внутрибрюшного давления или его резким колебаниям. Например, поднятие груза, частый плач и крик в младенческом возрасте, кашель при хронических заболеваниях лёгких, продолжительные запоры, затруднение мочеиспускания при аденоме предстательной железы.
Симптомы
Поскольку чаще при внутрибрюшных грыжах ущемляется тонкий или толстый кишечник, появляются признаки кишечной непроходимости.
Как правило, сначала возникает сильная острая боль в животе, затем появляется рвота, задержка стула и отхождения газов. Боль обычно схваткообразная, совпадающая с кишечными волнами перистальтики. Если боли ослабевают, это может указывать на некроз кишечной стенки.
При непроходимости в верхних отделах тонкого кишечника наблюдается обильная и частая рвота (вначале с примесью желчи, затем калоподобная), если же ущемляются нижние отделы или толстый кишечник, рвоты может не быть вовсе.
Важно как можно раньше заподозрить ущемление грыжи, осложненное непроходимостью кишечника, однако в первые часы обычно не бывает характерных симптомов острого живота, в том числе напряжения брюшной стенки. Если же промедлить с операцией, развивается некроз кишечника, что может привести к прободению кишки и перитониту (гнойному воспалению брюшной стенки) с неблагоприятным для жизни прогнозом.
Лечение
Ущемленные грыжи требуют скорейшего оперативного вмешательства. Во время операции вскрывается грыжевой мешок и удаляется гнойное содержимое. Также оценивается, развился ли некроз кишки. Если это произошло, проводится удаление части кишечника.
2. Острый паранефрит (от греч.раrа - возле, мимо, вне и nephritis, от nephrоs - почка) - острое гнойное воспаление околопочечной жировой клетчатки. Его вызывают те же микроорганизмы, что и абсцесс почки, но чаще всего обнаруживают Escherichiacoli, распространяющиеся восходящим путём, реже - Staphylococcusspp., распространяющиеся гематогенно.
Симптомы острого паранефрита
Симптомы острого паранефрита в начальной стадии заболевания не имеет характерных симптомов и начинается как любой острый воспалительный процесс с повышения температуры тела до 39-40°С, озноба, недомогания.
Местные симптомы острого паранефрита вначале отсутствуют. В этом периоде острый паранефрит нередко принимают за инфекционное заболевание. Спустя 3-4 дня, а иногда и позже возникают локальные признаки в виде болей в поясничной области различной интенсивности, болезненности при пальпации в косто-вертебральном углу с соответствующей стороны, защитного сокращения поясничных мышц, болезненности при поколачивании в этой области.
Иногда в поясничной области на стороне поражения присутствуют гиперемия и отёчность кожи. Несколько позже обнаруживают искривление позвоночника в больную сторону за счёт защитного сокращения поясничных мышц, характерное положение больного в постели с приведённой ногой к животу и резкую болезненность при её разгибании (так называемый псоас-симптом, или симптом «прилипшей пятки»). Распознать острый паранефрит в начале заболевания бывает нелегко, так как местные явления выражены слабо или клиническая картина маскируется проявлением того заболевания, осложнением которого служит паранефрит. Нередко течение болезни напоминает инфекционное или гнойное заболевание с неясной локализацией очага. И не случайно таких больных довольно часто госпитализируют в инфекционные и терапевтические отделения, гораздо реже - в хирургические и урологические.
Симптомы острого паранефрита во многом зависят от локализации гнойного процесса. При переднем паранефрите во время пальпации живота в области соответствующего подреберья нередко возникает болезненность в отдельных наблюдениях присутствует напряжение мышц брюшной стенки. Иногда в области подреберья или несколько ниже удаётся прощупать плотный, болезненный, неподвижный опухолевидный воспалительный инфильтрат.
При верхнем остром паранефрите нередко отмечают симптомы со стороны плевры и боли в плече на стороне поражения, ограничение подвижности купола диафрагмы. При этом возможно смещение почки книзу, поэтому она становится доступной при пальпации.
Для нижнего остром паранефрита характерно низкое расположение воспалительного инфильтрата, пальпируемого через брюшную стенку, а также выраженный псоас-симптом.
Формы
По механизму возникновения различают первичный и вторичный паранефрит. При первичном паранефрите заболевание самой почки отсутствует. Микроорганизмы попадают в околопочечную клетчатку гематогенно из других очагов воспаления (фурункул, остеомиелит, фолликулярная ангина). Чаще это случается вследствие иммунодефицита, переохлаждении или перегревания организма. Паранефрит также может возникнуть после травмы поясничной области или вследствие оперативного вмешательства на почке. В некоторых наблюдениях к паранефриту приводят воспалительные процессы соседних органов - матки, яичников, прямой кишки, аппендикса.
Вторичный паранефрит обычно бывает осложнением гнойно-воспалительного процесса в самой почке (абсцесс, карбункул почки, пионефроз). При этом воспалительный процесс почечной паренхимы распространяется на околопочечную жировую клетчатку.
В зависимости от локализации гнойно-воспалительного процесса в паранефральной клетчатке различают верхний, нижний, передний, задний и тотальный паранефрит. При верхнем паранефрите гнойный процесс находится в области верхнего сегмента почки, при нижнем - в области нижнего сегмента, при переднем - по передней поверхности почки, при заднем - по её задней поверхности, при тотальном паранефрите в воспалительный процесс вовлечены все отделы паранефральной клетчатки. Хотя и крайне редко, но существуют случаи двустороннего паранефрита. По клиническому течению паранефрит может быть острым и хроническим.
Острый паранефрит вначале проходит стадию экссудативного воспаления, которое может подвергнуться обратному развитию или перейти в гнойную стадию. Если гнойный процесс в околопочечной клетчатке имеет тенденцию к распространению, то обычно расплавляются межфасциальные перегородки, и, достигнув больших размеров, гной может распространиться за пределы клетчатки, образуя обширные гнойные затёки (может спуститься вниз по ходу мочеточника, по подвздошной мышце в малый таз). Возможно образование флегмоны забрюшинного пространства. Флегмона может прорваться в кишку, брюшную или плевральную полости, в мочевой пузырь или под кожу паховой области, через запирательное отверстие распространиться на внутреннюю поверхность бедра. Верхний острый паранефрит осложняется поддиафрагмальным абсцессом с прорывом гноя в плевру.а иногда и в лёгкое. В исключительных случаях гнойник прорывается наружу в область поясницы. Дифференциальную диагностику следует проводить с острым аппендицитом, абсцессом поддиафрагмального пространства, пневмонией.
Диагностика острого паранефрита
![]()
Убедительное подтверждение гнойного острого паранефрита получение гноя при пункции околопочечной клетчатки. Однако отрицательный результат исследования не исключает гнойного воспаления.
На обзорной рентгенограмме поясничной области нередко обнаруживают искривление в поясничном отделе позвоночника в сторону поражения, отчётливое сглаживание или отсутствие края контура поясничной мышцы с этой стороны. Контуры почки, в зависимости от размеров и распространения инфильтрата, в одних случаях нормальные, в других - сглажены и даже отсутствуют. Возможно также высокое стояние и неподвижность диафрагмы, выпот в плевральном синусе с больной стороны.
На экскреторных урограммах можно выявить деформацию лоханки и чашечек вследствие сдавления последних воспалительным инфильтратом. Верхний отдел мочеточника нередко смещён в здоровую сторону. На снимках, выполненных на вдохе и выдохе, картина контуров лоханки и чашечек одинаковая на больной стороне и смазанная или удвоенная на здоровой. Это свидетельствует о неподвижности или резком ограничении подвижности поражённой почки. Ценную информацию при гнойном остром паранефрите могут дать КТ, УЗИ и радиоизотопные методы исследования. У некоторых больных прибегают к диагностической пункции околопочечного инфильтрата.
При тяжёлом септическом состоянии больного возможна истинная альбуминурия, а также наличие в моче цилиндров (как результат токсического нефрита).
Лечение острого паранефрита
Лечение острого паранефрита заключается в назначении антибиотиков широкого спектра действия, сочетания их с сульфаниламидными препаратами и уроантисептиками. Обязательны дезинтоксикационное и общеукрепляющее лечение - инфузии глюкозы, солевых и коллоидных растворов, назначают витамины, сердечные средства, по показаниям проводят переливание крови. Применение антибактериальной терапии и активных лечебных мероприятий в ранней стадии острого паранефрита у ряда больных позволяет добиться обратного развития воспалительного процесса, что приводит к выздоровлению.
При сформировавшемся абсцессе или при безуспешности консервативного лечения в течение 4-5 дней, когда клиническая симптоматика нарастает, показано оперативное лечение - ревизия забрюшинного пространства, вскрытие абсцесса и дренирование околопочечного пространства. Косым поясничным разрезом обнажают забрюшинное пространство и вскрывают гнойный очаг. При расположении последнего у верхнего сегмента или по передней поверхности почки найти его бывает не всегда просто. После вскрытия основного гнойного очага тупо разрушают фасциальные перемычки, среди которых могут располагаться мелкие гнойники. После вскрытия гнойного очага его необходимо хорошо дренировать. Задний угол раны следует оставить незашитым.
При остром паранефрите почечного происхождения (пионефроз, апостематозный небрит, карбункул почки), если возникает показание к нефрэктомии, а состояние больных тяжёлое, операцию целесообразно провести в два этапа: первый - вскрытие гнойника и дренирование забрюшинного пространства, второй - нефрэктомии через 2-3 нед с учётом состояния больного. Лечение острого паранефрита антибиотиками, а также общеукрепляющую терапию необходимо продолжать длительное время до стабилизации состояния больного.
3. Врожд вывих бедра- это порок развития тканей тазобедсуст, при котором может наблюд выхождение головки бедрен кости из вертлуж впадины. Частота- дисплазия у 16 из 1000 новорожд, тяжелый вывих бедра- у 5-7 на 1000. Односторонний вывих преобладает над двусторонним. Левосторонний вывих встреч в 2 раза чаще чем правосторон. Женский пол пораж в 2 раза чащемужского. КлассификацияВыделяют три степени дисплазии:
Врожденный вывих бедра. Суставная впадина, головка и шейка бедра изменены. Суставные поверхности разобщены. Головка бедра находится выше суставной впадины и в стороне от нее.Клиника- 1. симптом щелчка 2. огранич отведения бедер 3. ассиметрия кожных складок или неравномер их количество на бедрах 4. укорочение конечности 5. наружная ротация отмечается на больной стороне
ЛЕЧЕНИЕ после 1 года оперативное (посм в книге)
31 билет
Эхинококкоз легких представляет собой кистозную стадию развития ленточного глиста (Echinococcus granulosus). Эхинококкоз легкого встречается в виде гидатидной (однокамерной) формы. Поражения легких по частоте занимают второе место (15-20 %) после поражения печени (80 %). Эхинококкоз имеет широкое распространение во всем мире. По статистике наиболее интенсивно поражено население и животные южных стран: страны Южной Америки (Уругвай, Парагвай, Аргентина, Чили, Бразилия), Австралия и Новая Зеландия, Северная Африка (Тунис, Алжир, Марокко, АРЕ), Южная Европа (Италия, Греция, Кипр, Турция, Испания, Югославия. Болгария, Франция), далее - южная часть США, Япония, Индия, бывший СССР. По мере продвижения с юга на север пораженность снижается. На территории бывшего Союза эхинококкоз распространен в тех республиках и областях, где развито животноводство, главным образом овцеводство - Северном Кавказе, Закавказье, Казахстане, Киргизстане, Узбекистане, Молдове (заболеваемость населения составляет 1,37 - 3,85 на 100 000), в России - Башкортостане, Татарстане, Ставропольском, Краснодарском, Алтайском, Красноярском, Хабаровском краях, Волгоградской, Самарской, Ростовской, Оренбургской, Челябинской, Томской, Омской, Камчатской, Магаданской, Амурской областях и Чукотском автономном округе. В Украине эхинококкоз чаще регистрируется в южных областях - Одесской, Крымской, Херсонской, Николаевской, Донецкой, Запорожской, в остальных - спорадические случаи. На территории Украины регистрируется 2 типа очагов: в степной южной зоне циркулирует «овечий» штамм, в полесской и лесостепной - преимущественно «свиной». Пораженность овец в Одесской области составила 32%, крупного рогатого скота - 20%, свиней - 9%.
Что провоцирует / Причины Эхинококкоза легких:
Возбудителем эхинококкоза человека является личиночная стадия цепня эхинококка - Echinococcus granulosus. Половозрелая форма эхинококка - мелкая цестода длиной 2,5 - 5,4 мм, шириной 0,25 - 0,8 мм. Она состоит из грушевидного сколекса, шейки и 3 - 4 члеников. Сколекс снабжен четырьмя присосками и короной из двух рядов крючьев (28 - 50). За сколексом идет короткая шейка и членики, первые два - незрелые, третий гермафродитный и четвертый - зрелый. Зрелый членик (длина 1,27 - 3,17 мм) заполнен растянутой маткой, представляющей собой широкий продольный ствол с боковыми выпячиваниями. Матка набита яйцами (400 - 600 штук), не отличающимися по своему строению от яиц бычьего и свиного цепней (тениид), содержащих внутри шестикрючную онкосферу. Половозрелая форма - цепень эхинококка - паразитирует только у животных: собак, волков, шакалов, лисиц, которые являются окончательными хозяевами. Личиночная стадия - эхинококковая киста - паразитирует у промежуточных хозяев - различных травоядных и всеядных копытных животных (овцы, козы, крупный рогатый скот, свиньи, лошади и др.) и человека. Эхинококковая киста представляет собой пузырь весьма сложной структуры. Снаружи он окружен слоистой оболочкой (кутикулой), толщина которой иногда достигает 5 мм. Под многослойной кутикулярной оболочкой лежит тонкая внутренняя зародышевая (герминативная) оболочка, которая продуцирует выводковые капсулы со сколексами, дочерние пузыри, а также дает рост слоистой оболочке. Выводковые капсулы представляют собой небольшие пузырьковидные образования, рассеянные на зародышевой оболочке и соединенные с ней тоненькой ножкой. Они имеют то же строение, что и основной пузырь, но с обратным расположением оболочек (снаружи герминативная, внутри - слоистая). Каждая выводковая капсула содержит прикрепленные к ее стенке сколексы, ввернутые внутрь и имеющие типично для цепней строение. Пузырь заполнен жидкостью, играющей роль защитной питательной среды для выводковых капсул и сколексов. В жидкости могут находиться свободно взвешенные, оторвавшиеся сколексы и выводковые капсулы, так называемый гидатидозный песок. Пузырь постепенно покрывается соединительнотканной оболочкой. Нередко в такой материнской кисте, помимо выше перечисленных элементов, содержатся еще так называемые дочерние пузыри, имеющие такое же строение, а внутри них - внучатые пузыри. Такие кисты наблюдаются у человека. Иногда дочерние пузыри образуются не внутри материнской кисты, а снаружи. Такие пузыри называют экзогенными. Эхинококковые кисты, образующиеся у животных, как правило, не содержат выводковых капсул и сколексов, их называют ацефалоцистами. У человека эта форма не встречается. В овцеводческих районах южной зоны кругооборот эхинококка идет по схеме: овца —› сторожевые собаки, сопровождающие отару —› овцы. В западных районах интенсивного свиноводства кругооборот эхинококка идет по схеме: свиньи —› собаки —› свиньи. Отсутствие активной двигательной функции у члеников «свиного» штамма уменьшает загрязнение шерсти собак, почвы, тем самым ограничивает условия заражения людей и животных. Интенсивность передачи инвазии определяется, прежде всего, численностью источников инвазии окончательных хозяев и количеством выделяемого ими инвазионного материала - онкосфер и члеников. Онкосферы переносят температуру от -30°С до +38°С, на поверхности почвы в тени при температуре 10 - 26°С сохраняют жизнеспособность в течение месяца, но на солнце при температуре 18 - 50°С погибают через 1-5 суток. В траве при температуре 14 - 28°С они погибают не ранее, чем через 1,5 месяца. Онкосферы хорошо переносят низкую температуру, при которой могут сохраняться ряд лет, но весьма неустойчивы к высыханию. Циркуляция инвазии при эхинококкозах осуществляется по известной схеме: источник инвазии (окончательные хозяева - плотоядные животные) —› внешняя среда, загрязненная онкосферами и члениками паразита, —› промежуточный хозяин (травоядные, всеядные животные, зараженные личинками) —› незараженный окончательный хозяин. Человек - промежуточный хозяин - является биологическим тупиком. При эхинококкозе человека в качестве окончательного хозяина основное положение занимает собака. Собаки заражаются при поедании мясных отбросов боен, убойных площадок, кухонь, при скармливании им конфискатов с боен или пораженных ларвоцистами органов забитых на дому животных. Возможно заражение собак также при скармливании им продуктов охоты - пораженных органов или трупов диких травоядных животных. Пути заражения промежуточных хозяев также различны, травоядные сельскохозяйственные животные заражаются при проглатывании яиц, члеников гельминта с травой, сеном, водой, загрязненных фекалиями инвазированных собак. Свиньи, будучи копрофагами, заражаются, поедая фекалии собак. Основную роль в заражении человека через грязные руки играет общение с инвазированными собаками, на шерсти и языке которых могут находиться яйца и членики цепней эхинококка. Здоровые животные также могут передавать инвазию человеку в качестве механических переносчиков яиц, которыми загрязняется их шерсть, язык при облизывании зараженной собаки. Не исключается заражение человека при употреблении пищу немытых овощей, ягод, фруктов, загрязненных фекалиями собак, содержащих онкосферы. Человек может заражаться также от диких плотоядных во время охоты при разделке шкур, изготовлении меховой одежды, а также при употреблении в пищу немытых дикорастущих ягод, питье воды из природных водоемов. В овцеводческих районах, где циркуляция возбудителя происходит в основном между собаками и овцами, к группам риска относятся пастухи, чабаны, сопровождающие отары, а также стригали шерсти овец и члены из семей.
Патогенез (что происходит?) во время Эхинококкоза легких:
Эхинококкоз развивается в связи с внедрением и ростом в различных органах личинки ленточного глиста - эхинококка. Человек заражается эхинококкозом преимущественно перорально, и в связи с гематогенным путем распространения онкосферы могут поражать любой орган, любую ткань, но чаще всего печень (44 - 85%), затем легкие (15 - 20%) в более редких случаях по большому кругу кровообращения - почки, кости, головной и спинной мозг и другие органы. В пораженных органах может развиться одна киста или сколько - множественный эхинококкоз в зависимости от занесенных онкосфер. Патологическое влияние эхинококка обусловлено механическим и сенсибилизирующим влиянием растущей личинки. Размеры кист от 1 - 5 см в диаметре до гигантских кист, содержащих несколько литров жидкости. Механическое воздействие такой кисты приводит к нарушению функции пораженного органа. Локализация и размеры определяют основную симптоматологию и тяжесть заболевания. Сенсибилизация организма продуктами обмена паразита ведет к развитию гиперчувствительности немедленного и замедленного типа. Ярким проявлением аллергической реакции немедленного типа являются эозинофилия и крапивница в результате просачивания эхинококковой жидкости, а в более тяжелых случаях (при вскрытии пузыря) анафилактический шок. В поздних стадиях болезни особенно при множественном эхинококкозе важную роль играют иммунопатологические реакции. Первичным хозяином эхинококкоза являются собаки, волки, шакалы, лисы и др. Паразит, который живет у них в тонкой кишке, состоит из головки, шейки и члеников - самый задний и крупный, четвертый, является зрелым. Такой зрелый членик, отделившись от червя, выбрасывает яйца, которые с фекалиями выделяются наружу. Чаще собака, являясь носителем гельминта (глист), служит источником загрязнения яйцами эхинококка пастбищ, водоемов, помещений для животных и жилищ человека. С момента проглатывания членика или его яиц (т.н. онкосферы) начинается период развития личинки паразита. Пищеварительные соки помогают зародышу освободиться от оболочек и с помощью своих крючьев проникает в слизистую оболочку желудочно-кишечного тракта. Далее, с током крови или лимфы, разносится по органам (печень, легкие, почки, мышцы) и, уже осев в их тканях, превращается в личинку. К концу 2 недели она принимает пузырчатую структуру. Через 5 мес. образовавшийся пузырек имеет в диаметре 5 мм. В дальнейшем пузырек растет медленно, годами, и постепенно, спустя 20-25 лет, достигает больших размеров, емкостью 10 л и более: соединительнотканная капсула со стенками из хитина. Полость этой кисты наполнена слегка желтоватой жидкостью нейтральной реакции, содержащей хлорид натрия, виноградный сахар, тирозин, янтарную кислоту, альбумин и др. Хитиновая оболочка состоит их двух слоев: наружного плотного (кутикулярного) толщиной до 0,5 см и внутреннего (герминативного) зародышевого, из которого образуются в большом количестве, иногда до 1000, дочерние пузыри. Патологоанатомические изменения в организме человека связаны с механическим давлением на органы растущей кисты. Продукты жизнедеятельности паразита раздражают окружающие ткани, вызывая их хроническое воспаление.
Симптомы Эхинококкоза легких:
Эхинококкоз легких - второе по частоте проявление инвазии, может симулировать любое заболевание легких другой этиологии. Обычно различают три стадии развития заболевания. • Стадия I - бессимптомная - может тянуться многие годы с момента заражения. Эхинококковая киста растет медленно, не причиняя расстройств. Заболевание обнаруживают случайно при рентгенологическом исследовании. • Стадия II - стадия клинических проявлений. В этом периоде болезни больных беспокоят тупые боли в груди, иногда одышка, кашель. Симптомы болезни развиваются при значительных размерах кисты. • Стадия III - стадия развития осложнений. У больных отмечается инфицирование и нагноение кисты, прорыв ее в бронх (около 90 %), плевру, брюшную полость, желчные пути, полость перикарда. При прорыве нагноившейся кисты в бронхи откашливаются гнойное содержимое, обрывки оболочек кисты, сколексы (мелкие дочерние пузыри). Попадание в бронхи эхинококковой жидкости, оболочек пузырей и мелких дочерних кист может вызвать асфиксию. Прорыв кисты в бронхи сопровождается тяжелым анафилактическим шоком вследствие всасывания токсичной эхинококковой жидкости и воздействия ее на рецепторный аппарат. Нередко появляются уртикарные высыпания на коже. Излившаяся из полости кисты жидкость содержит сколексы, которые при попадании в плевральную полость могут вызвать обсеменение плевры и появление новых пузырей. При эхинококкозе легких нередко отмечается повышение температуры тела, обусловленное перифокальным воспалением. При нагноении кисты температура тела повышается до 38-39 °С и держится долго. При осмотре грудной клетки при больших кистах иногда определяют ее выбухание на стороне поражения, расширение межреберных промежутков. В области прилежания эхинококкового пузыря выявляют притупление перкуторного звука. Аускультативные данные весьма разнообразны: при перифокальном воспалении выслушиваются хрипы; при наличии опорожнившейся полости и заполнении ее воздухом - бронхиальное, иногда амфорическое дыхание. Кисты, расположенные у корня легкого, а также кисты небольших размеров не сопровождаются указанными симптомами.
Диагностика Эхинококкоза легких:
Основным методом диагностики эхинококкоза легких являются: рентгенологические, ультразвуковые исследования, томография, сканирование, лапароскопия, серологические методы. В выявлении эхинококкоза легких очень большую роль играет массовое флюорографическое обследование населения. Именно профилактическое обследование позволяет в настоящее время распознать заболевание до появления каких-либо клинических симптомов. При рентгенологическом исследовании в легком обнаруживают одну или несколько гомогенных теней округлой или овальной формы с ровными четкими контурами . Иногда определяют обызвествление фиброзной капсулы. Вследствие перифокального воспаления контуры тени кисты становятся менее четкими. Сдавление прилежащих бронхов большой кистой может вызвать ателектаз легочной ткани. При гибели паразита и частичном всасывании жидкости между хитиновой оболочкой и фиброзной капсулой образуется свободное пространство, которое при рентгенографии выявляется в виде серпа воздуха (симптом отслоения). При бронхографии это пространство заполняется контрастным веществом (феномен субкапсулярного контрастирования). При прорыве нагноившегося эхинококка в бронх рентгенологическая картина аналогична картине, наблюдаемой при абсцессе легкого, т. е. выявляется полость с ровными внутренними стенками и уровнем жидкости. В клиническом анализе крови определяют эозинофилию, увеличение СОЭ, лейкоцитоз со сдвигом лейкоцитарной формулы влево. Постановке диагноза помогают: • реакция непрямой гемагглютинации (РНГА) - достоверный диагностический титр 1:200-250 и выше; • иммуноферментный анализ (ИФА) - реакция считается положительной при оценке в 2-3 плюса. Выявление округлой тени с ровными контурами на рентгенограмме легкого, КТ или МРТ, сочетающееся с положительными серологическими реакциями (РНГА, ИФА), дает возможность точно диагностировать заболевание. Эхинококковую кисту следует дифференцировать от туберкулемы, периферической карциномы и других заболеваний, при которых выявляются шаровидные тени в легких. При подозрении на эхинококкоз округлую шаровидную тень в легком пунктировать не следует из-за возможности разрыва кисты, опасности попадания эхинококковой жидкости в плевру с развитием тяжелой анафилактоидной реакции и обсеменением плевральной полости зародышевыми элементами эхинококка. Диференциальный диагноз проводят между эхинококком, туберкулемой, периферической карциномой, т. е. между заболеваниями, дающими шаровидные образования в легких. Используют весь комплекс специальных методов исследования за исключением пункции. Последняя при подозрении на эхинококк недопустима из-за возможности разрыва кисты, опасности попадания эхинококковой жидкости в плевру с развитием тяжелой анафилактоидной реакции и обсеменения паразитом.
Лечение Эхинококкоза легких:
Лечение эхинококкоза легких только хирургическое. Оптимальной операцией, к выполнению которой следует стремиться во всех случаях, является “идеальная эхинококкэктомия” - это удаление, вылущивание из фиброзной капсулы паразита в хитиновой оболочке, не нарушая ее целостности (без вскрытия пузыря). Традиционно применяют комбинированное лечение, которое включает операцию с проведением повторных курсов лечения гермицидами. При диссеминированных поражениях одного или нескольких органов и размерах кист до 3 см. получены обнадеживающие результаты при проведении химиотерапии без операции. Наибольшее применение получили препараты карбоматимидазола (альбендазол, эсказол, зентель). Препараты назначают в дозах 10-50 мг. на 1 кг. массы тела в сутки. Курс лечения длительностью 3 нед с повторением через 4 нед необходимо начинать в ранние сроки после операции. При проведении химиотерапии необходим контроль функций печени, красного и белого кровяных ростков. Для оперативного удаления эхинококковых кист применяют различные методики. • Эхинококкэктомия. После торакотомии кисту пунктируют толстой иглой, отсасывают содержимое. При отсутствии бронхиальных свищей в полость кисты водят такой же объем 80 % водного раствора глицерина с экспозицией 5 мин. В некоторых клиниках вместо глицерина вводят 20-30 % раствор натрия хлорида с экспозицией 25-30 мин. При наличии бронхиального свища обработку кисты производят после ее вскрытия тампонами, обильно смоченными раствором глицерина. После вскрытия кисты удаляют хитиновую оболочку. Полость обрабатывают 76 % спиртом или раствором глицерина, тщательно осматривают изнутри. При обнаружении открывающихся в нее бронхиальных свищей их отверстия ушивают. Затем иссекают избыток фиброзной капсулы и ушивают образовавшуюся полость, вворачивая края оставшейся оболочки в полость кисты (капитонаж). При глубоких полостях, когда ушивание трудно выполнимо и резко деформирует легкое, целесообразнее максимально иссечь фиброзную капсулу и обшить ее края отдельными гемостатическими швами. После этого, повышая давление в системе наркозного аппарата, легкое раздувают до тех пор, пока оно не приходит в соприкосновение с париетальной плеврой. • Идеальная эхинококкэктомия (энуклеация кисты) . При этом способе эхинококковую кисту удаляют без нарушения целости хитиновой оболочки. После отгораживания кисты, расположенной в периферических отделах легкого, влажными марлевыми салфетками, смоченными 80 % раствором глицерина или 20-30 % раствором натрия хлорида, достаточно широко рассекают фиброзную оболочку (при необходимости и ткань легкого над ней). Легкое раздувают через интубационную трубку. При этом эхинококковая киста выдавливается неповрежденной через разрез в фиброзной капсуле. Затем бронхиальные свищи и образовавшуюся полость в легком тщательно ушивают. Идеальная эхинококкэктомия выполнима при небольших эхинококковых кистах и отсутствии перифокального воспаления. • Перицистэктомия (радикальная эхинококкэктомия) - удаление паразита вместе с фиброзной капсулой. При этом максимально щадят легочную ткань, чтобы не повредить рядом расположенные крупные сосуды. • Резекция легкого. Производят операцию по строго ограниченным показаниям, главным образом при обширных вторичных воспалительных процессах или сочетании эхинококкоза с другими заболеваниями, требующими резекции легкого. При двусторонних поражениях операцию на втором легком выполняют через 2-3 мес после первой. Летальность после операций составляет 0,5-1 %, рецидивы наблюдаются примерно у 1 % оперированных.
Профилактика Эхинококкоза легких:
Комплекс ветеринарно-медицинских мероприятий при эхинококкозе направлен прежде всего на выявление и искоренение источника инвазии. В соответствии с официальными рекомендациями речь идет о сокращении количества сторожевых служебных собак, их учете, регистрации и уничтожении бродячих животных. Ветеринарные специалисты хозяйств проводят профилактическую дегельминтизацию служебных собак с декабря по апрель каждые 45 дней, с мая по ноябрь - каждые 30 дней, остальных - один раз в квартал. Эти меры нужно проводить и в отношении личных собак. Дегельминтизацию проводят на специальных площадках, где выделенные фекалии собирают в металлическую емкость и обезвреживают: (кипятить 10 - 15 мин., заливать на 3 ч 10%-ным раствором хлорной извести, почву обрабатывают 3%-ным раствором карбатиона (4 л на 1 м2). Для предупреждения заражения собак необходимо соблюдать правила убоя сельскохозяйственных животных и обеспечивать уничтожение пораженных органов, а также преградить собакам доступ на территорию мясокомбинатов, боен, скотомогильников. Мероприятия по предупреждению заражения собак включают также такие обязательные рекомендации, как: повышение ветеринарно-санитарного уровня ферм; строительство утилизационных ям, скотомогильников; выполнение правил хранения и транспортировки трупов животных; убой животных только в соответствующих для этого местах и др. Медицинские мероприятия предусматривают выявление инвазированных путем обследования декретированных групп (охотников, лиц, имеющих контакт с собаками, занимающихся обработкой пушнины, изготовлением меховых изделий, пастухов) и обследование по клиническим показаниям; дегельминтизацию и диспансерное наблюдение. Важное значение имеет санитарно-просветительская работа. Личная профилактика эхинококкоза состоит в том, чтобы ограничить контакт с собаками, игры с ними детей, тщательно мыть руки после контакта с животными, перед едой после работы на огороде, игр во дворе, в саду, сбора грибов, не употреблять в пищу немытые дикорастущие ягоды, не пить некипяченую воду из природных водоемов.
2) Инвагинация кишечника - смешанная форма механической кишечной непроходимости, возникающей при телескопическом внедрении проксимальной части кишки в просвет дистальной части кишечника.
Этиология инвагинаций кишечника
В большинстве случаев неизвестна. К факторам, способствующим возникновению инвагинаций, относят: нарушение режима питания, кишечные заболевания, лимфаденопатии в результате поражения аденовирусной инфекцией, травмы живота, полипы или опухоли кишечника, дивертикул Меккеля. Из анатомических причин развития инвагинаций можно выделить: патологическую подвижность слепой и подвздошной кишок, пороки развития илеоцекального клапана.
Патогенез инвагинаций кишечника
Инвагинация возникает при внезапной дискоординации кишечной перистальтики. Изначально при ущемлении рябь внедренной кишки, возникает странгуляционная кишечная непроходимость. Ущемление рябь приводит к обструкции лимфатического и венозного дренажа, отека внедренного кишечника и выхода эритроцитов из кровеносного русла путем диапедеза. Смешиваясь со слизью, усиленно продуцируется, кровянистый транссудат формирует стул в виде "малинового (смородинового) желе". Усиление отека кишки приводит к нарушению артериального кровоснабжение и возникновения гангрены кишечника. Гангрена начинается на головке инвагината и распространяется назад. В дальнейшем к странгуляционной присоединяется и обтурационная непроходимость кишечника при закрытии просвета кишечной трубки инвагината. У ребенка за счет рвоты развивается дегидратация. Ишемия и некроз кишки приводят к перфорации кишки и развития сепсиса. Некроз значительной длины кишки может привести к развитию синдрома "короткой кишки". В инвагината различают 3 цилиндра (внешний, средний, внутренний) и головку инвагината.
Классификация инвагинаций кишечника
По клиническому течению различают: 1. Острые инвагинации (98,8%). 2. Хронические инвагинации - возникновение спайкового процесса в инвагината (в результате развития воспаления) при отсутствии полного перекрытия просвета кишечника (0,7%). 3. Рецидивирующие инвагинации (0,5%). По локализации (по В. П. Портным): I. инвагинации в области илеоцекального угла-91, 3%): a) слипоободова форма - внедрение стенки слепой кишки в восходящую, подвздошная кишка пассивно втягивается, не проходя через илеоцекальный клапан; b) кпубово-подвздошно-ободочная форма - внедрение подвздошной кишки в подвздошную, затем через илеоцекальный клапан в толстую кишку: • простая форма - слепая кишка не углубляется в инвагинат; • сложная форма - слепая кишка и другие отделы толстой кишки углубляются в инвагинат с образованием части среднего цилиндра. с) подвздошно-клапанно-ободочная форма - часть подвздошной кишки у илеоцекального клапана углубляется в толстый кишечник с вовлечением толстой кишки. II. Тонко-тонкокишечная форма - 6,5%. III. Толсто-толстокишечного форма - 2,25%.
Клиника инвагинаций кишечника
Вид ребенка, больного инвагинацию, достаточно обманчив. Обычно это ребенок хорошо откормленное и не выдается больным. Напротив, у детей худых или с плохим питанием инвагинация встречается реже. Клинические проявления инвагинации, как правило, следующие: 1. Внезапное возникновение интенсивных (вплоть до болевого шока) приступообразный болей в животе, носящие периодический (периодичность в 5-30 минут) характер. Во время приступа боли ребенок бледнеет, кричит и подтягивает ноги к животу. Эти эпизоды боли продолжаются несколько секунд, в промежутках ребенок кажется спокойной или даже сонной. 2. Рвота, сначала остатками пищи. 3. Кровь в стуле или слизь, пропитанный кровью ("малиновое" или "смородиновое желе"), без примесей кала через 4-6 часов от начала заболевания. 4. Мягкоэластической умеренно подвижная опухоль - инвагинат, что прощупывается при пальпации живота. 5. Отсутствие слепой кишки в правой подвздошной области - симптом удовлетворено 6. Задержка газов и стула. 7. При ректальном исследовании иногда можно заметить или прощупать головку инвагината и выявить кровь в стуле.
Диагностика инвагинаций кишечника
1. Общий и биохимический анализы крови - не имеют определенных признаков при инвагинации, но в зависимости от длительности заболевания и связанной с ним рвоты и кровопотери могут отражать дегидратацию, анемию и / или лейкоцитоз. 2. Обзорная рентгенография - невсегда дает данные для диагноза, однако достаточно часто на рентгенограмме различаются расширенные петли тонкого кишечника, тень инвагината на фоне кишки, чаши Клойбера как признак непроходимости кишечника). 3. УЗИ - при двумерной эхографии - ехонегативни и ехопозитивни участки изображения, которые чередуются в виде концентрических колец при поперечном УЗИ), или симптом "псевдониркы" при продольном УЗИ). УЗИ лучше используется как диагностический инструмент для исключения диагноза инвагинации. 4. Компьютерная томография - часто используется для дифференциальной диагностики заболеваний, сопровождающихся болями в животе. Хотя этот метод и не применяется для диагностики инвагинации, но она может быть обнаружена случайно, при анализе данных компьютерной томографии). 5. Ирригография с воздухом как основной метод диагностики (симптомы "клешни рака", "кокарды"). Давление воздуха не должно превышать 50-60 мм рт. ст. Воздух вводится с помощью аппарата Ричардсона. При отсутствии признаков перфорации или перитонита, возможно проведение контрастной иригорафии с водорастворимыми контрастом (урографин, верографинн, Триомбраст)). 6. Колоноскопия выявляет состояние головки инвагината - возможен некроз головки. Дифференциальная диагностикапроводится с острой дизентерией, токсическим диспепсией, острым аппендицитом, пептической язвой меккелев дивертикула, острыми холециститом и панкреатитом, полипами желудочно-кишечного тракта, выпадением слизистой прямой кишки.
Лечение инвагинаций кишечника Консервативное
Применяется методика сквозного продувания под наркозом с помощью аппарата Ричардсона. Давление воздуха в прямой кишке не должен превышать 120 мм рт.вот. Контроль расправления инвагината - пальпаторно и с помощью назогастрального зонда, через который выходит воздух в стакан с жидкостью.Рецидивы инвагинации после консервативного лечения составляют около 5%. Противопоказания к консервативному лечению: 1. Подвздошно-подвздошно-ободочная форма инвагинации. 2. Кровотечение из прямой кишки. 3. Обструкция тонкой кишки на рентгенограмме. 4. Срок более 18 часов от начала заболевания. 5. У детей старше 1 года или моложе С месяцев. 6. Дегидратация более чем на 5%. 7. Рецидивирующие инвагинации. 9. Некроз головки инвагината, обнаруженный при колоноскопии.
Оперативное
Обязательна предоперационная подготовка в течение 2-3 часов. Методы хирургического лечения - лапароскопическим и путем лапаротомии. При лапаротомии, в зависимости от состояния инвагината, выполняют: 1. Дезинвагинацию с "видоювання" инвагината. 2. Дезинвагинацию с последующей резекцией кишечника и наложением анастомоза. 3. Одномоментную резекцию инвагината без его расправления. 4. Резекцию инвагината через кишку. Рецидивы инвагинации после оперативного лечения составляют около 1-4%. Летальность менее 1%.
3) Гнойная хирургическая инфекция
Существует два вида гнойных инфекций по своим проявлениям: местные и общие.
Местные проявления гнойной инфекции по своей симптоматике зависят от места расположения воспалительного очага. Очевидно, что симптоматика будет различной при гнойной инфекции в брюшной полости и флегмоне мягких тканей. Клиника - различной при поверхностной и глубоко расположенной гнойной инфекции.
Общими симптомами местного гнойного воспаления являются повышение температуры, отечность ткани или плотное образование в ней, болевой синдром и нарушение функции органа или ткани.
Гнойный процесс может носить ограниченный характер (например, панариций) и разлитой (к примеру, флегмона).
Для гнойных инфекций этого вида характерна также в той или иной степени интоксикация организма, приводящая зачастую к развитию анемии. Лабораторные исследования: лейкоцитоз, увеличенная СОЭ, в тяжелых случаях- анемический синдром (с падением числа эритроцитов в единице объема и снижением уровня гемоглобина).
Общая гнойная инфекция - это сепсис. По своему течению сепсис чрезвычайно тяжелое заболевание, при котором (даже при активном лечении) нередки летальные исходы.
Сепсис бывает первичным и вторичным (скажем, на фоне фурункула).
Сепсис классифицируют:
по виду возбудителя (стафилококковый, стрептококковый, колибациллярный, неклостридиальный, клостридиальный и смешанный),
по расположению сходных ворот инфекции (урологический, гинекологический, хирургический и т. п.),
по наличию или отсутствию видимого очага инфекции, т. е. первичный или вторичный,
по наличию или отсутствию гнойных метастазов (септицемия и септикопиемия) и
по клинической картине (острый, подострый, хронический и молниеносный).
Основными клиническими проявлениями сепсиса являются высокая температура (до 40-4 ГС), тяжелое общее состояние, выраженнейший озноб, тахикардия, падение АД, затемнение сознания, которое нередко сменяется возбуждением с последующим торможением. Нередки галлюцинации. Объективно у больных отмечается желтушность кожных покровов, в ряде случаев на коже имеются те или иные высыпания, часто увеличивается селезенка (ее пальпация болезненна).
В тяжелых случаях сепсис может осложняться развитием шока (септический шок). Указанные симптомы становятся еще более выраженными. Значительно нарушаются функции печени.
Лечение проводится в стационаре и включает в себя широкий комплекс разнообразных терапевтических мероприятий. Хирургическое же лечение включает полноценную санкцию всех гнойно-некротических очагов с широким вскрытием, удалением некротизированных тканей и активным дренированием ран.
32 билет
Что такое Эхинококкоз печени -
Эхинококкоз печени (echinococcosis hepatis) - гельминтоз человека, вызываемый внедрением и развитием в печени личинок ленточных червей Echinococcus granulosus и E. (Alveococcus) multilocularis. Эхинококкоз печени встречается в двух разновидностях - пузырный и альвеолярный (многокамерный). В России и странах ближнего зарубежья эхинококкоз распространен главным образом в Средней Азии, Казахстане, Грузии, Крыму, Сибири (Новосибирская, Омская, Томская области), Якутии. Пузырный (однокамерный, кистевидный, гидатидозный) эхинококкоз примерно в половине случаев протекает с поражением печени, причем киста чаще локализуется в правой доле, изредка наблюдается несколько кист. Болезнетворное влияние эхинококка на организм определяется механическим давлением эхинококковой кисты па печень и соседние органы, а также токсическим и сенсибилизирующим воздействием паразита.
Что провоцирует / Причины Эхинококкоза печени:
Возбудителем эхинококкоза человека является личиночная стадия цепня эхинококка - Echinococcus granulosus. Половозрелая форма эхинококка - мелкая цестода длиной 2,5 - 5,4 мм, шириной 0,25 - 0,8 мм. Она состоит из грушевидного сколекса, шейки и 3 - 4 члеников. Сколекс снабжен четырьмя присосками и короной из двух рядов крючьев (28 - 50). За сколексом идет короткая шейка и членики, первые два - незрелые, третий гермафродитный и четвертый - зрелый. Зрелый членик (длина 1,27 - 3,17 мм) заполнен растянутой маткой, представляющей собой широкий продольный ствол с боковыми выпячиваниями. Матка набита яйцами (400 - 600 штук), не отличающимися по своему строению от яиц бычьего и свиного цепней (тениид), содержащих внутри шестикрючную онкосферу. Половозрелая форма - цепень эхинококка - паразитирует только у животных: собак, волков, шакалов, лисиц, которые являются окончательными хозяевами. Личиночная стадия - эхинококковая киста - паразитирует у промежуточных хозяев - различных травоядных и всеядных копытных животных (овцы, козы, крупный рогатый скот, свиньи, лошади и др.) и человека. Эхинококковая киста представляет собой пузырь весьма сложной структуры. Снаружи он окружен слоистой оболочкой (кутикулой), толщина которой иногда достигает 5 мм. Под многослойной кутикулярной оболочкой лежит тонкая внутренняя зародышевая (герминативная) оболочка, которая продуцирует выводковые капсулы со сколексами, дочерние пузыри, а также дает рост слоистой оболочке. Выводковые капсулы представляют собой небольшие пузырьковидные образования, рассеянные на зародышевой оболочке и соединенные с ней тоненькой ножкой. Они имеют то же строение, что и основной пузырь, но с обратным расположением оболочек (снаружи герминативная, внутри - слоистая). Каждая выводковая капсула содержит прикрепленные к ее стенке сколексы, ввернутые внутрь и имеющие типично для цепней строение. Пузырь заполнен жидкостью, играющей роль защитной питательной среды для выводковых капсул и сколексов. В жидкости могут находиться свободно взвешенные, оторвавшиеся сколексы и выводковые капсулы, так называемый гидатидозный песок. Пузырь постепенно покрывается соединительнотканной оболочкой. Нередко в такой материнской кисте, помимо выше перечисленных элементов, содержатся еще так называемые дочерние пузыри, имеющие такое же строение, а внутри них - внучатые пузыри. Такие кисты наблюдаются у человека. Иногда дочерние пузыри образуются не внутри материнской кисты, а снаружи. Такие пузыри называют экзогенными. Эхинококковые кисты, образующиеся у животных, как правило, не содержат выводковых капсул и сколексов, их называют ацефалоцистами. У человека эта форма не встречается. В овцеводческих районах южной зоны кругооборот эхинококка идет по схеме: овца -› сторожевые собаки, сопровождающие отару -› овцы. В западных районах интенсивного свиноводства кругооборот эхинококка идет по схеме: свиньи -› собаки -› свиньи. Отсутствие активной двигательной функции у члеников «свиного» штамма уменьшает загрязнение шерсти собак, почвы, тем самым ограничивает условия заражения людей и животных. Интенсивность передачи инвазии определяется, прежде всего, численностью источников инвазии окончательных хозяев и количеством выделяемого ими инвазионного материала - онкосфер и члеников. Онкосферы переносят температуру от -30°С до +38°С, на поверхности почвы в тени при температуре 10 - 26°С сохраняют жизнеспособность в течение месяца, но на солнце при температуре 18 - 50°С погибают через 1-5 суток. В траве при температуре 14 - 28°С они погибают не ранее, чем через 1,5 месяца. Онкосферы хорошо переносят низкую температуру, при которой могут сохраняться ряд лет, но весьма неустойчивы к высыханию. Циркуляция инвазии при эхинококкозах осуществляется по известной схеме: источник инвазии (окончательные хозяева - плотоядные животные) -› внешняя среда, загрязненная онкосферами и члениками паразита, -› промежуточный хозяин (травоядные, всеядные животные, зараженные личинками) -› незараженный окончательный хозяин. Человек - промежуточный хозяин - является биологическим тупиком. При эхинококкозе человека в качестве окончательного хозяина основное положение занимает собака. Собаки заражаются при поедании мясных отбросов боен, убойных площадок, кухонь, при скармливании им конфискатов с боен или пораженных ларвоцистами органов забитых на дому животных. Возможно заражение собак также при скармливании им продуктов охоты - пораженных органов или трупов диких травоядных животных. Пути заражения промежуточных хозяев также различны, травоядные сельскохозяйственные животные заражаются при проглатывании яиц, члеников гельминта с травой, сеном, водой, загрязненных фекалиями инвазированных собак. Свиньи, будучи копрофагами, заражаются, поедая фекалии собак. Основную роль в заражении человека через грязные руки играет общение с инвазированными собаками, на шерсти и языке которых могут находиться яйца и членики цепней эхинококка. Здоровые животные также могут передавать инвазию человеку в качестве механических переносчиков яиц, которыми загрязняется их шерсть, язык при облизывании зараженной собаки. Не исключается заражение человека при употреблении пищу немытых овощей, ягод, фруктов, загрязненных фекалиями собак, содержащих онкосферы. Человек может заражаться также от диких плотоядных во время охоты при разделке шкур, изготовлении меховой одежды, а также при употреблении в пищу немытых дикорастущих ягод, питье воды из природных водоемов. В овцеводческих районах, где циркуляция возбудителя происходит в основном между собаками и овцами, к группам риска относятся пастухи, чабаны, сопровождающие отары, а также стригали шерсти овец и члены из семей.
Патогенез (что происходит?) во время Эхинококкоза печени:
Эхинококкоз развивается в связи с внедрением и ростом в различных органах личинки ленточного глиста - эхинококка. Человек заражается эхинококкозом преимущественно перорально, и в связи с гематогенным путем распространения онкосферы могут поражать любой орган, любую ткань, но чаще всего печень (44 - 85%), затем легкие (15 - 20%) в более редких случаях по большому кругу кровообращения - почки, кости, головной и спинной мозг и другие органы. Патологическое влияние эхинококка обусловлено механическим и сенсибилизирующим влиянием растущей личинки. Размеры кист от 1 - 5 см в диаметре до гигантских кист, содержащих несколько литров жидкости. Механическое воздействие такой кисты приводит к нарушению функции пораженного органа. Локализация и размеры определяют основную симптоматологию и тяжесть заболевания. Сенсибилизация организма продуктами обмена паразита ведет к развитию гиперчувствительности немедленного и замедленного типа. Ярким проявлением аллергической реакции немедленного типа являются эозинофилия и крапивница в результате просачивания эхинококковой жидкости, а в более тяжелых случаях (при вскрытии пузыря) анафилактический шок. В поздних стадиях болезни особенно при множественном эхинококкозе важную роль играют иммунопатологические реакции. В начале развития паразита в организме человека он представляет собой заполненный бесцветной жидкостью пузырек диаметром около 1 мм, который со временем увеличивается в размерах. Стенка гидатиды состоит из внутренней (герминативной) и наружно (хитиновой или кутикулярной) оболочек. Снаружи к такой эхинококковой кисте предлежит плотная фиброзная оболочка, состоящая из соединительной ткани и являющаяся результатом реакции ткани печени в ответ на присутствие паразита. Эта оболочка очень плотная и практически неотделима от здоровой паренхимы печени, но может быть отделена от хитиновой оболочки. Единственно функционально активной является вяутренняя герминативная оболочка гидатиды, которая постоянно образует новые зародышевые сколексы. По мере их созревания в жидкости эхинококковой кисты образуются так называемые дочерние (а позже внутри них и внучатые) пузыри. Кроме того, герминативная оболочка в просвет кисты секретирует гидатидозную жидкость и участвует в образовании наружной хитиновой оболочки паразита. Более чем у 80% больных поражена правая доля печени, у 1/2 больных выявляют множественные кисты.
Симптомы Эхинококкоза печени:
Выделяют две формы эхинококкоза: кистозную (гидатидозную) и альвеолярную. Гидатидозная форма эхинококкоза определяет собой заболевание, обусловленное кистозной или личиночной стадией развития эхинококкозного ленточного глиста Echinococcus granulosus. Длительное время (иногда в течение многих лет), начиная с момента заражения, нет никаких клинических признаков заболевания, и человек чувствует себя практически здоровым. Клиническая манифестация болезни начинается лишь при достижении гидатиды довольно больших размеров. Возникают тупые, ноющие, постоянные боли в правом подреберье и эпигастральной области, нижних отделах правой половины грудной клетки. При осмотре в случае больших размеров кисты можно обнаружить выбухание передней брюшной стенки в области правого подреберья. Перкуторно отмечается расширение границ печени вверх. При пальпации печени можно определить округлое, эластической консистенции опухолевидное образование (при локализации больших эхинококковых кист в передненижних отделах печени). При локализации кист глубоко в паренхиме печени наблюдается гепатомегалия. По локализации различают три типа эхинококка печени: передний, нисходящий (абдоминальный) и восходящий (грудной). При большом объеме передних кист область печени сильно расширяется. Верхние кисты, симулирующие выпотной плеврит, определяются рентгеноскопически по высокому стоянию диафрагмы справа с куполообразным выпячиванием местоположения кисты. При нижних кистах опухоль может прощупываться в брюшной полости, она движется при дыхании с печенью, имеет эластичную консистенцию. Кисты, локализующиеся в левой доле печени, становятся доступными пальпации в более поздние периоды болезни. Ухудшение состояния связано с аллергической реакцией организма на присутствие живого паразита, что проявляется в виде крапивницы, диареи и др. Симптоматика заболевания изменяется при сдавлении крупными кистами соседних органов. Наиболее частые осложнения гидатидозной формы эхинококкоза: желтуха, разрыв гидатидозной кисты, нагноение гидатидозной кисты. Желтуха (механическая) связана или со сдавлением кистой магистральных желчных путей, прорывом кисты в желчные пути (у 5–10% больных). Асцит возникает редко (5-7%) при сдавлении воротной вены. Разрыв гидатидозной кисты может происходить с излиянием содержимого в своеобразную брюшную полость, в просвет желудочно-кишечного тракта, в желчные протоки, в плевральную полость или в бронх. Наиболее серьезное осложнение – перфорация кисты в свободную брюшную полость. Возникают симптомы анафилактического шока и распространенного перитонита. Перфорация кисты в свободную брюшную полость существенно ухудшает прогноз заболевания в связи с диссеминацией процесса. Нагноение эхинококковой кисты связано с образованием трещины в капсуле гидатиды, особенно при наличии сообщения с желчными путями. Находящиеся в желчи бактерии служат источником инфицирования. При нагноении эхинококковой кисты возникают сильные боли в области печени, гепатомегалия, гипертермия и другие симптомы тяжелой гнойной интоксикации. Альвеолярный эхинококкоз во всех случаях сопровождается поражением печени. Длительное время инвазия протекает бессимптомно. Ведущий симптом - гепатомегалия за счет развития опухолеподобного узла исключительной, "деревянной", плотности. Подвижность печени ограничена вследствие развития перигепатита. Селезенка увеличена в у трети или половины больных. Частый и стойкий симптом - желтуха. При далеко зашедшем процессе резко нарушаются функциональные пробы печени.
Диагностика Эхинококкоза печени:
В диагностике гидатидозной формы эхинококкоза помогает анамнез больного (проживание в местности, являющейся эндемичной по данному заболеванию). Решающую роль отводят дополнительным способам исследования. В общем анализе крови часто обнаруживают эозинофилию (до 20% и выше). Применяют внутрикожную реакцию Кацони со стерильной жидкостью эхинококкового пузыря. Механизм этой пробы аналогичен реакции на туберкулин при туберкулезе. Проба Кацони положительная у 75 85% больных. Приблизительно через 1 год после гибели паразита реакция становится отрицательной. Более точна и информативна реакция агглютинации с латексом (синтетическая полистирольная смола) и реакция непрямой гемагглютинации. При обзорной рентгенографии можно отметить высокое стояние купола диафрагмы или его выпячивание, кальцинаты в проекции эхинококковой кисты. Более подробную информацию можно получить при рентгенографии в условиях пневмоперитонеума. О локализации и размерах эхинококковой кисты можно судить по данным радиоизотопного гепатосканирования (в месте проекции кисты будет виден дефект накопления изотопа). Наиболее достоверна и проста ультразвуковая эхолокация и компьютерная томография. Среди инвазивных способов исследования широкое распространение получили лапароскопия и ангиография. При целиакографии обнаруживают дугообразное оттеснение сосудов печени, характерное для объемного образования. Для диагностики альвеолярного эхинококкоза имеет значение длительно существующая "опухоль" печени чрезвычайной плотности, гиперэозинофилия, сканирование печени и положительные результаты аллергических проб. Наибольшую диагностическую ценность имеет реакция Кацони с альвеолярным антигеном.
Лечение Эхинококкоза печени:
Самоизлечение от гидатидозной формы эхинококка происходит очень редко, что связанно с гибелью паразита и последующим обызвествлением его стенок. Однако при наличии большой полости реальна угроза нагноения или разрыва кисты. Нет ни одного лекарственного препарата, оказывающего терапевтическое воздействие на кистозную форму эхинококкоза. Высокая частота развития серьезных осложнений гидатидозной формы эхинококкоза диктует необходимость хирургического лечения независимо от размеров кисты. Оптимальный способ лечения эхинококкэктомия. Идеальную эхинококкэктомию, при которой удаляют всю кисту с ее хитиновой и фиброзной оболочками без вскрытия просвета, применяют редко при небольших размерах кисты, ее краевом расположении. При крупных кистах, расположенных в толще ткани печени, такой способ чреват повреждением крупных сосудов и желчных протоков. Чаще применяют удаление кисты с ее герминативной и хитиновой оболочками после предварительной пункции полости кисты, с отсасыванием ее содержимого. Этот прием позволяет избежать при выделении кисты ее разрыва и диссеминации паразита. После удаления кисты фиброзную оболочку изнутри обрабатывают 2% раствором формалина и ушивают отдельными швами изнутри (капитонаж). При невозможности ушить полость прибегают к тампонаде ее сальником. При нагноении содержимого кисты после завершения основного этапа операции оставшуюся полость дренируют. При больших размерах кисты, а также в случае обызвествления ее стенок в качестве вынужденной меры прибегают к марсупиализации (вшиванию стенок кисты в переднюю брюшную стенку). Цель операции - радикальное удаление кисты вместе с оболочками и их содержимым не оставляя в печени, брюшной или грудной полости сколексов и пузырей. Фиброзная капсула в большинстве случаев не удаляется. Объемы оперативных вмешательств зависят от локализации, размеров, количества и осложнений кист. При краевой локализации кисты с обызвествлением выполняется идеальная эхинококкэктомия вместе с фиброзной капсулой по А.В.Мельникову, возможно с применением С02-лазера. При множественном эхинококкозе и при краевом расположении кист, а также гигантских кистах, занимающих всю долю выполняется атипичная или анатомическая резекция печени. При одиночных кистах, даже при гигантских, при кистах обеих половин печени и при нагноившейся кисте операцией выбора является одномоментная закрытая эхинококкэктомия по А. А. Боброву и С. И. Спасокукоцкому. Для профилактики обсеменения сколексами после пункции содержимое кисты удаляют эхинококкотомами, фиброзную капсулу не удаляют, полость обрабатывают различными антипаразитарными средствами (2-5% раствор формалина, 5% раствор йода, 96% спирт и др.), а также криовоздействием и расфокусированным лучом С02-лазера. При поддиафрагмальной локализации кисты (7-8-й сегменты) и большой остаточной полости выполняют капитонаж по Дельбе или закрытие полости по А.Т.Пулатову в сочетании с оментопластикой или пластикой лоскутом диафрагмы. При прорыве кисты в желчные пути выполняют срочное оперативное вмешательство - холедохотомию с наружным дренированием или закрытую эхинококкэктомию, холедохотомию с удалением оболочек и кист из желчных путей. Операцию заканчивают наружным дренированием общего желчного протока, или наложением холедоходуоденостомии, или эндоскопической папиллосфинктеротомией, чреспеченочной гепатохолангиостомией в связи с механической желтухой. Срочное оперативное вмешательство выполняется также при прорыве кисты в брюшную полость, бронх или в плевральную полость. Выполняется закрытая или полузакрытая и исключительно в сложных случаях открытая (марсупилизация) эхинококкэктомия. При желчно-бронхиальном свище - разобщают свищ, ушивают отверстие в бронхе. При множественном эхинококкозе печени операцию выполняют до развития осложнений, вначале удаляют осложненные кисты или гигантские, иногда оперируют в 2-3 приема через 2 недели - 3 месяца. Летальность - 1-5%, отдаленные результаты хорошие, рецидивы - 2-25% и возникают из-за неполного удаления дочерних пузырей, оставления незамеченных кист, обсеменения раны брюшной и грудной полости содержимым кисты, повторных инвазий, технических погрешностей.
Профилактика Эхинококкоза печени:
Комплекс ветеринарно-медицинских мероприятий при эхинококкозе направлен прежде всего на выявление и искоренение источника инвазии. В соответствии с официальными рекомендациями речь идет о сокращении количества сторожевых служебных собак, их учете, регистрации и уничтожении бродячих животных. Ветеринарные специалисты хозяйств проводят профилактическую дегельминтизацию служебных собак с декабря по апрель каждые 45 дней, с мая по ноябрь - каждые 30 дней, остальных - один раз в квартал. Эти меры нужно проводить и в отношении личных собак. Дегельминтизацию проводят на специальных площадках, где выделенные фекалии собирают в металлическую емкость и обезвреживают: (кипятить 10 - 15 мин., заливать на 3 ч 10%-ным раствором хлорной извести, почву обрабатывают 3%-ным раствором карбатиона (4 л на 1 м2). Для предупреждения заражения собак необходимо соблюдать правила убоя сельскохозяйственных животных и обеспечивать уничтожение пораженных органов, а также преградить собакам доступ на территорию мясокомбинатов, боен, скотомогильников. Мероприятия по предупреждению заражения собак включают также такие обязательные рекомендации, как: повышение ветеринарно-санитарного уровня ферм; строительство утилизационных ям, скотомогильников; выполнение правил хранения и транспортировки трупов животных; убой животных только в соответствующих для этого местах и др. Медицинские мероприятия предусматривают выявление инвазированных путем обследования декретированных групп (охотников, лиц, имеющих контакт с собаками, занимающихся обработкой пушнины, изготовлением меховых изделий, пастухов) и обследование по клиническим показаниям; дегельминтизацию и диспансерное наблюдение. Важное значение имеет санитарно-просветительская работа. Личная профилактика эхинококкоза состоит в том, чтобы ограничить контакт с собаками, игры с ними детей, тщательно мыть руки после контакта с животными, перед едой после работы на огороде, игр во дворе, в саду, сбора грибов, не употреблять в пищу немытые дикорастущие ягоды, не пить некипяченую воду из природных водоемов.
2) Гнойная хирургическая инфекция
Существует два вида гнойных инфекций по своим проявлениям: местные и общие.
Местные проявления гнойной инфекции по своей симптоматике зависят от места расположения воспалительного очага. Очевидно, что симптоматика будет различной при гнойной инфекции в брюшной полости и флегмоне мягких тканей. Клиника - различной при поверхностной и глубоко расположенной гнойной инфекции.
Общими симптомами местного гнойного воспаления являются повышение температуры, отечность ткани или плотное образование в ней, болевой синдром и нарушение функции органа или ткани.
Гнойный процесс может носить ограниченный характер (например, панариций) и разлитой (к примеру, флегмона).
Для гнойных инфекций этого вида характерна также в той или иной степени интоксикация организма, приводящая зачастую к развитию анемии. Лабораторные исследования: лейкоцитоз, увеличенная СОЭ, в тяжелых случаях- анемический синдром (с падением числа эритроцитов в единице объема и снижением уровня гемоглобина).
Общая гнойная инфекция - это сепсис. По своему течению сепсис чрезвычайно тяжелое заболевание, при котором (даже при активном лечении) нередки летальные исходы.
Сепсис бывает первичным и вторичным (скажем, на фоне фурункула).
Сепсис классифицируют:
по виду возбудителя (стафилококковый, стрептококковый, колибациллярный, неклостридиальный, клостридиальный и смешанный),
по расположению сходных ворот инфекции (урологический, гинекологический, хирургический и т. п.),
по наличию или отсутствию видимого очага инфекции, т. е. первичный или вторичный,
по наличию или отсутствию гнойных метастазов (септицемия и септикопиемия) и
по клинической картине (острый, подострый, хронический и молниеносный).
Основными клиническими проявлениями сепсиса являются высокая температура (до 40-4 ГС), тяжелое общее состояние, выраженнейший озноб, тахикардия, падение АД, затемнение сознания, которое нередко сменяется возбуждением с последующим торможением. Нередки галлюцинации. Объективно у больных отмечается желтушность кожных покровов, в ряде случаев на коже имеются те или иные высыпания, часто увеличивается селезенка (ее пальпация болезненна).
В тяжелых случаях сепсис может осложняться развитием шока (септический шок). Указанные симптомы становятся еще более выраженными. Значительно нарушаются функции печени.
Лечение проводится в стационаре и включает в себя широкий комплекс разнообразных терапевтических мероприятий. Хирургическое же лечение включает полноценную санкцию всех гнойно-некротических очагов с широким вскрытием, удалением некротизированных тканей и активным дренированием ран.
3) равма опорно-двигательного аппарата у детей занимает значительное место в практической работе амбулаторного хирурга. При лечении переломов некоторые хирурги недостаточно учитывают особенности растущего организма, а это, в свою очередь, приводит к ошибкам и осложнениям, которые подчас вызывают стойкие деформации, требующие вмешательства ортопеда. Во избежание диагностических ошибок для своевременного и рационального лечения, а также для выбора необходимых сроков иммобилизации и правильного ведения восстановительного периода необходимо знание анатомических и физиологических особенностей детского организма, которые обусловливают возникновение особых форм переломов, специфику их течения.
Анатомо-физиологические особенности детской кости состоят в том, что толстая и прочная надкостница с богато развитой сетью, а также хрящевая ткань в области метафизов придают кости эластичность и гибкость. Это обстоятельство способствует тому, что переломы у детей наблюдаются относительно реже, хотя дети падают чаще, чем взрослые. Сохранению целостности кости способствуют также меньшая масса тела ребенка и наличие на концах трубчатых костей эпифизов, соединенных с метафизами эластичным ростковым хрящом, ослабляющим силу удара. Эти анатомические особенности, с одной стороны, препятствуют возникновению перелома, с другой — обусловливают эпифизеолизы и остеоэпифизеолизы (рис. 15).
Яндекс.Директ
|
Костно-мозговой канал у детей, особенно до 2-летнего возраста, заполнен красным костным мозгом, жировой ткани мало. Этим объясняется наличие гематом на месте повреждения при диафизарных переломах длинных трубчатых костей конечностей у детей, а также большая редкость жировых эмболии.
Преобладание минеральных элементов (оссеина) в диафизах трубчатых костей, наличие толстой и прочной надкостницы и росткового эпифизарного хряща способствуют тому, что в детском возрасте встречаются такие повреждения, которые характерны только для растущего организма: надломы по типу «зеленый ветки», поднадкостничные переломы, апофизеолизы и др.

Рис. 15. Примерные сроки выявления ядер окостенения у детей при рентгенологическом обследовании
Надломы и переломы по типу «зеленой ветки» или «ивового прута» являются типичными повреждениями в детском возрасте (рис. 16). При этом виде перелома, наблюдаемом особенно часто при повреждении диафизарной части костей предплечья, кость слегка согнута, по выпуклой стороне наружные слои подвергаются перелому, обычно щелевидному; по вогнутой — сохраняют свою нормальную структуру. Кость удерживается неповрежденной частью, прежде всего надкостницей.

Рис. 16. Перелом по типу «зеленой ветки» обеих костей предплечья с угловым смешением отломков. Рентгенограмма.
Рис. 17. Типичные для детского возраста переломы: а — поднадкостничный перелом лучевой кости в нижней трети без смещения отломков; б — эпифизеолиз дистального конца большеберцовой кости и перелом малоберцовой в нижней трети со смещением отломков.
Следующей характерной формой в детском возрасте являются поднадкостничные переломы, возникающие при действии силы вдоль продольной оси кости. Эти переломы являются полными, проходят в виде сквозной, поперечной или извилистой трещины через всю толщу костей. Надкостница остается неповрежденной, смещение по оси отсутствует или весьма незначительное. Сопутствующая гематома при этих переломах небольшая. Наблюдаются эти переломы чаще всего на костях предплечья и голени (рис. 17, а)
Эпифизеолизы и остеоэпифизеолизы — травматический отрыв и смещение эпифиза от метафиза или с частью метафиза по линии росткового эпифизарного хряща — встречаются только у детей и подростков до окончания процесса окостенения (рис. 17,6).
В утробной жизни диафизы оссифицируют энхондрально и перихондрально. Эпифизы (за исключением дистального эпифиза бедренной кости, имеющего ядро окостенения) окостеневают в различные для развития костей сроки после родов. На месте соединения окостеневшего диафиза с эпифизом длительное время остается хрящевая ткань, которая оссифицируется лишь после завершения роста в длину; Эта рыхлая хрящевая зона на границе эпифиза и метафиза является местом слабого сопротивления, где и происходит отрыв эпифиза. Эпифизеолиз или остеоэпифизеолиз возникает чаще всего в результате прямого действия силы на эпифиз.
Внесуставное расположение эпифизарного хряща, когда суставная сумка и связки прикрепляются ниже эпифизарной линии, способствует отрыву эпифиза. При этом, как правило, от метафиза отрывается небольшой костный фрагмент треугольной формы, состоящий в связи с эпифизом (остеоэпифизеолиз). Эта костная пластинка находится на противоположной стороне травмирующей силы и играет особую роль для рентгенологического диагноза эпифизеолиза в тех случаях, когда эпифиз имеет еще полностью хрящевую структуру и на рентгеновском снимке не виден. Разрыв целостности костной ткани при эпифизеолизах происходит в рыхлой среде молодого костного мозга и поэтому эпифизарный хрящ сохраняет связь с эпифизом.
В тех случаях, когда эпифизеолизы и остеоэпифизеолизы не сопровождаются заметным смещением эпифиза» локальные изменения незначительны и характеризуются умеренной болезненностью и припухлостью места перелома. Однако у детей при травме чаще наступает смещение эпифиза, который требует самой тщательной репозиции.
Апофизы в отличие от эпифизов располагаются вне суставов, имеют шероховатую поверхность и служат для прикрепления мышц и связок. Отрыв апофиза по линии росткового хряща называется апофизеолизом. Примером этого вида повреждения может служить смещение внутреннего или наружного надмыщелков плечевой кости.
Распознавание переломов костей у детей иногда представляет значительные трудности в связи с упомянутыми выше анатомо-физиологическими особенностями. При переломах без смещения или с незначительным смещением локальные изменения не выражены, т. е. отсутствует ряд кардинальных симптомов: деформация, патологическая подвижность, крепитация. Без рентгенологического исследования возможны диагностические ошибки.
При переломах по типу «зеленой ветки», поднадкостничных переломах и эпифизеолизах без смещения только рентгенологическое исследование помогает правильно установить диагноз. Однако следует заметить, что при эпифизеолизах с небольшим смещением у маленьких детей даже рентгенография не всегда вносит ясность из-за отсутствия ядер окостенения в эпифизе. В таких случаях приходится прибегать к дополнительному рентгенологическому исследованию соответствующего сегмента здоровой конечности для сопоставления его с предполагаемым местом повреждения.
Переломы костей у грудных детей нередко не диагностируют ввиду хорошо выраженной подкожной жировой клетчатки, которая затрудняет пальпацию. Припухлость и болезненность в области конечности, сопровождающиеся повышением температуры тела (всасывание гематомы), наводят врача на мысль о воспалительном процессе, в частности об остеомиелите. Поэтому тактически необходимо во всех случаях при местной припухлости и болезненности в области костей и суставов, сопровождающихся щажением конечности, делать рентгеновский снимок.
Во время осмотра больного после травмы особое внимание должно быть обращено на состояние мягких тканей в области повреждения, кожную чувствительность и двигательную функцию конечности, периферический пульс.
Кроме переломов, возникающих у здоровых детей после травмы, следует помнить и о переломах, которые наблюдаются при патологической хрупкости и заболеваниях костей (несовершенное костеобразование, костные опухоли и кисты и др.).
В процессе диагностики и лечения переломов костей конечностей у детей иногда необходимо более детальное обследование с измерением абсолютной и относительной длины конечностей, определением объема движения в суставах.
Консолидация переломов у детей наступает значительно быстрее, чем у взрослых. Чем младше ребенок, тем более благоприятны условия для сращения переломов. У новорожденных и грудных детей даже переломы бедренной кости консолидируются через 14 дней. Сроки сращения переломов зависят от формы переломав Чем больше площадь соприкосновения костных отломков, тем быстрее заживление перелома, поэтому консолидация косых и винтообразных переломов наступает быстрее, чем поперечных. Чем меньше возраст ребенка, тем интенсивнее образование костной мозоли. Даже при значительном смещении костных фрагментов костная мозоль у маленьких детей образуется в короткие сроки. Ложные суставы при правильном лечении обычно не встречаются.
Поскольку костная система ребенка находится в процессе интенсивного роста и перестройки, то неправильное положение фрагментов может со временем выровняться. Степень коррекции поврежденного сегмента конечности зависит как от возраста ребенка, так и от локализации перелома, степени и вида смещения отломков. В то же время при повреждении ростковой зоны (при эпифизеолизах) с ростом может выявиться деформация, которой не было в период лечения, о чем всегда надо помнить, оценивая прогноз на будущее.
Спонтанная коррекция оставшейся деформации происходит тем лучше, чем меньше возраст больного. Особенно, хорошо выражено нивелирование смещенных костных фрагментов у новорожденных. У детей в возрасте младше 7 лет допустимы смещения при диафизарных переломах по длине в пределах 1 — 2 см, по ширине — почти на поперечник кости и под углом не более 10°. В то же время ротационные смещения в процессе роста не корригируются и их следует устранять. У детей старшей возрастной группы необходима более точная адаптация костных отломков и обязательно устранение прогибов и ротационных смещений.
При внутри- и околосуставных переломах костей конечностей у детей необходима точная репозиция с устранением всех видов смещений, так как неустраненное смещение даже небольшого костного отломка при внутрисуставном переломе может привести к блокаде сустава или вызвать варусное или вальгусное отклонение оси конечности.
При хорошем анатомическом сопоставлении костных отломков, которое достигается правильным лечением, функция поврежденной конечности восстанавливается быстрее и лучше.
33 Билет
1) Атрезия кишечника (стеноз) представляет собой сужение или отсутствие просвета кишечника (кишечной трубки) на определенном участке. Продукты питания блокируются на этом участке и не могут пройти через кишечник, что препятствует нормальному функционированию кишечника.
Атрезия тонкой кишки предполагает обструкцию средней области тонкой кишки или нижней области повздовшной (тонкой) кишки. При этом часть кишки, которая блокируется, расширяется и уменьшает способность кишечника поглощать питательные вещества, а также создает давление, выталкивая его содержимое через пищеварительный тракт. Существует четыре типа атрезии тонкой кишки:
Тип 1. Мембранные блоки расположены в тонкой кишке, но непрерывность кишечника не нарушена. Кишечник имеет нормальную длину.
Тип 2. Перерастянутый проксимальный конец тонкой кишки образует слепой конец – это связано с уменьшением сегмента кишечника из-за рубцовой ткани. Кишечник имеет нормальную длину.
Тип 3. Два слепых конца кишки полностью разделены изъяном в кишечном кровоснабжении. Это значительно сокращает длину кишечника и приводит к синдрому короткой кишки и дефициту питательных веществ.
Тип 4. Множественная атрезия, при которой блокируются несколько разделов кишечника, может привести к укорачиванию общей длины тонкого кишечника.
У младенцев с любым из четырех типов атрезии тонкой кишки в течение дня после рождения начинается рвота зеленой желчью. В некоторых случаях рвота может начаться на два-три дня позже. У ребенка может раздуться живот, а испражнения в первый день жизни, как это обычно происходит, отсутствуют.
Дифференциальную диагностику следует проводить со следующими заболеваниями: заворот средней кишки, стеноз кишечника, мекониевыйилеус, кистозное удвоение, внутренняя грыжа, ущемленная паховая грыжа,болезньГиршпрунга, функциональная кишечная непроходимость при сепсисе или родовой травме, а также в результате приема матерью различных медикаментозных препаратов, кроме того, при недоношенности или гипотиреоидизме.
Лечение атрезии тонкой кишки
Больным с диагнозом атрезия тонкой кишки показано проведение операции. Перед операцией необходимо провести специальную подготовку пациента, длительность которой может зависеть от степени дегидратации. Сама операция по удалению атрезии представляет собой верхнюю поперечную лапаротомию, которая позволяет обнаружить пораженные заболеванием участки кишки по всей длине кишечника. Во время операции проводится резекция участков кишки, где обнаруживается атрезия, и соединение участков кишечника при помощи однорядных П-образных швов атравматическими хирургическими иглами.
2) Причина дефицита общего неспецифического иммунитета новорожденных — сниженное содержание комплемента в сыворотке крови. Это способствует генерализации местного инфекционного процесса в хирургический сепсис.
Этому же способствует и дефицит общего специфического иммунитета, состоящий в сниженной способности иммунной системы новорожденного ребенка к выработке антител — иммуноглобулинов, особенно Ig G. В норме организм новорожденного получает достаточное их количество от матери. Но расход их в этом возрасте высокий, а выработка собственных Ig G в достаточной степени устанавливается лишь к третьему месяцу жизни. Поэтому со второй недели и до конца второго месяца жизни содержание этих иммуноглобулинов у ребенка снижено.
Гнойные процессы наиболее часто вызываются стафилококками, стрептококками, диплококками, кишечной палочкой, протейной флорой, синегнойной палочкой, бактероидами. По данным большинства исследователей основным возбудителем гнойно-воспалительных заболеваний в настоящее время является стафилококк.
Стафилококк обладает выраженным свойством приспосабливаться к воздействиям экзо - и эндогенных факторов. Этому способствуют особенности его обмена. Наиболее важными из них являются:
1. Выработка «ферментов защиты» (продуцирует пенициллиназу, которая инактивирует пенициллин, В-лактомазная активность и др.).
2. Перестройка жизнедеятельности микроорганизма по пути исключения из обмена фермента, на который воздействует антибиотик.
3. Избирательное изменение проницаемости клеточной мембраны стафилококка к антибиотику.
Выделяемые стафилококком токсины могут вызывать фазовые состояния в центральной нервной системе вплоть до запредельного торможения бульбарных центров, а местно — вызывают быстрое наступление некроза в очаге инфекции (некротоксин). Стафилотоксинспособен также разрушать лейкоциты и эритроциты и воздействовать на ретикуло-эндотелиальную систему. Результатом этих влияний являются угнетение клеточного и гуморального иммунитета вплоть до «иммунологического паралича».
С помощью ряда ферментов, продуцируемых стафилококком, образуется выраженная зона демаркации (отграничения) вокруг очага инфекции, вследствие чего воздействие макроорганизма на этот очаг затрудняется. К таким ферментам относится, например, коагулаза, которая способствует образованию фибрина в очаге инфекции и перифокально и приводит к закупорке сосудов. Изоляция местного процесса усугубляется сосудистым спазмом под действие стафилотоксина (местные аксон-рефлексы и через надпочечники).
Чрезвычайно важным свойством стафилококковой инфекции является склонность к генерализации процесса, особенно в связи с ослаблением иммунобиологических сил макроорганизма.
Патогенез острой гнойной хирургической инфекции. Характер гнойного воспалительного процесса зависит от вирулентности и патогенности возбудителя, а также от реактивности организма ребенка. Входными воротами инфекции может быть пупочная рана, кожа, слизистые оболочки. Имеется два пути возникновения и развития воспалительного процесса: эндогенный (заболевание является результатом аутоинфекции сенсибилизированного организма) и экзогенный (возбудитель проникает в организм извне). Возникновение гнойно-воспалительного заболевания у новорожденных относится к экзогенному, хотя качественно отличается от него, т. к. организм новорожденного еще не имел опыта взаимодействия с микроорганизмами.
Начальным звеном этого процесса является контаминация (обсеменение) организма ребенка микробной флорой, которая иногда происходит еще антенатально, но значительно чаще интра- и постнатально. Антенатально ребенок заражается от больной гнойными заболеваниями матери, интранатально — при прохождении инфицированных родовых путей при вульвовагинитах матери. Большую же часть микроорганизмов ребенок получает постнатально — из окружающей его госпитальной среды: воздуха, воды, пищи, белья, сосок и т. д.
Вслед за контаминацией начинается процесс колонизации (приживления и заселения) в организме ребенка микробной флоры. Результаты колонизации определяются взаимодействием трех факторов: реактивности организма новорожденного, агрессивности обсеменяющей его микробной флоры и микробного антагонизма. Колонизация заканчивается к седьмому дню жизни. При оптимальном взаимоотношении перечисленных факторов результатом колонизации является установление симбионтных (оптимальных) отношений макроорганизма и населяющей его микробной флоры. При высокой агрессивности госпитальной инфекции и сниженной сопротивляемости к ней организма новорожденного может установиться ненормальная картина его микробного пейзажа — дисбактериоз.
Нейро-гуморальные реакции при гнойной инфекции. Воздействие стафилококкового токсина на центральную нервную систему вызывает возбуждение, быстро переходящие в торможение, а также развитие процессов иррадиации. Это обусловливает при острой стафилококковой инфекции быстрое развитие нейротоксикоза, сопровождающегося в тяжелых случаях остановками дыхания, сердечной деятельности и др. Раздражение центральной и вегетативной нервной систем реализуется в виде гиперергических реакций. Нарушение функций центра терморегуляции у детей раннего возраста сопровождается развитием гипертермии, т. к. нарушаются процессы теплоотдачи и кумулирования тепловой энергии.
В условиях гнойной инфекции ярко проявляются гемодинамические сдвиги, обусловленные влиянием микробного экзо - и эндотоксина, гистамина и гистаминоподобных веществ, медиаторов воспаления (брадикининов, простогландинов), продуктов распадающихся тканей. Результатом этих влияний является нарушение микроциркуляции в тканях. Компенсаторно за счет выброса катехоламинов в организме происходит «централизация» кровоснабжения. В тяжелых случаях вследствие спазма прекапиллярных сфинктеров происходит «шунтирование» крови. Тем самым поддерживается объем циркулирующей крови, необходимый для поддержания жизнедеятельности центральных органов, хотя тканевой обмен на периферии нарушается. В результате «централизации» кровообращения ухудшается кровоток в почках, уменьшается фильтрация и ограничивается выведение шлаков ими.
Увеличение катехоламинов и глюкокортикойдов в крови усугубляет катаболизм и «голодание» клетки, ведет к распаду эндогенного белка и жира с образование большого числа недоокисленных продуктов (усугубление ацидоза).
Течение местного процесса при гнойной инфекции у детей характеризуются быстрым наступлением отека и некроза, угнетением местной фагоцитарной реакции. Отек особенно значительно выражен у детей раннего возраста. В патогенезе отека большую роль играет деструкция стромы с накоплением в ней воды; этот фактор приобретает большое значение в раннем возрасте, когда гидрофильность тканей в норме повышена. На этот процесс влияет повышенная проницаемость сосудов под воздействием гипоксии, гистамина и гиотаминоподобных веществ, а также эндотоксинов, в большом количестве выделяющихся при распаде микробов. Обширному отеку способствует, кроме того, паретическое расширение сосудов вследствие склонности к иррадиации раздражения (недифференцированность нервной системы). Накопление жидкости в зоне воспаления усугубляется резким местным ацидозом и повышением осмотического давления (распад белков, углеводов, освобождение кислых продуктов и солей), а также выделяемым стафилококками фактором проницаемости.
При блокировании очага значительно снижаются местные барьерные функции (особенно у детей раннего возраста). Все перечисленные факторы, ведущие к избыточному отеку, способствуют резкому нарушению сосудистой трофики (ишемии), что обусловливает преобладание некротических процессов.
3) Анатомические особенности строения костной системы детей и ее физиологические свойства обусловливают возникновение некоторых видов переломов, характерных только для этого возраста. Известно, что дети младшего возраста часто падают во время подвижных игр, но при этом у них редко бывают переломы костей. Это объясняется меньшей массой тела и хорошо развитым покровом мягких тканей ребенка, а следовательно, ослаблением силы удара при падении. Детские кости тоньше и менее прочные, но они эластичнее, чем кости взрослого. Эластичность и гибкость зависят от меньшего количества минеральных солей в костях ребенка, а также от строения надкостницы, которая у детей отличается большей толщиной и обильно снабжена кровью. Надкостница образует как бы футляр вокруг кости, который придает ей большую гибкость и защищает при травме. Сохранению целости кости способствует наличие на концах трубчатых костей эпифизов, соединенных с метафизами широким эластичным ростковым хрящом, ослабляющим силу удара. Эти анатомические особенности, с одной стороны, препятствуют возникновению перелома кости, с другой, — кроме обычных переломов, наблюдающихся у взрослых, обусловливают следующие типичные для детского возраста повреждения скелета: надломы, поднадкостничные переломы, эпифизеолизы, остеоэпифизеолизы и апофизеолизы. Надломы и переломы по типу зеленой ветви или ивового прута объясняются гибкостью костей у детей. Этот вид перелома наблюдается особенно часто при повреждении диафизов предплечья. При этом кость слегка согнута, по выпуклой стороне наружные слои подвергаются перелому, а по вогнутой сохраняют нормальную структуру. Поднадкостничные переломы характеризуются тем, что сломанная кость остается покрытой надкостницей, целость которой сохраняется. Возникают эти повреждения при действии силы вдоль продольной оси кости. Чаще всего поднадкостничные переломы наблюдаются на предплечье и голени; смещение кости в таких случаях отсутствует или бывает весьма незначительным. Эпифизеолизы и остеоэпифизеолизы — травматический отрыв и смещение эпифиза от метафиза или с частью метафиза по линии росткового эпифизарного хряща. Они встречаются только у детей и подростков до окончания процесса окостенения.
Эпифизеолиз возникает чаще в результате прямого действия силы на эпифиз и по механизму травмы подобен вывихам у взрослых, в детском возрасте наблюдающимся редко. Это объясняется анатомическими особенностями костей и связочного аппарата суставов, причем имеет существенное значение место прикрепления суставной капсулы к суставным концам кости. Эпифизеолизы и остеоэпифизеолизы наблюдаются там, где суставная сумка прикрепляется к эпифизарному хрящу кости: например, лучезапястный и голеностопный суставы, дистальный эпифиз бедренной кости. В местах, где сумка прикрепляется к метафизу так, что ростковый хрящ покрыт ею и не служит местом ее прикрепления (например, тазобедренный сустав), эпифизеолиза не бывает. Это положение подтверждается на примере коленного сустава. Здесь при травме возникает эпифизеолиз бедренной кости, но не бывает смещения проксимального эпифиза болыпеберцовой кости по эпифизарному хрящу. Апофизеолиз — отрыв апофиза по линии росткового хряща.
34 Билет
1) В зависимости от состояния костной ткани различают переломы травматические и патологические. Травматические переломы возникают от воздействия на неизменённую кость кратковременной, значительной величины механической силы. Патологические переломы возникают в результате тех или иных болезненных процессов в кости, нарушающих её структуру, прочность, целостность и непрерывность. Для возникновения патологических переломов достаточно незначительного механического воздействия. Нередко патологические переломы называют спонтанными.
В зависимости от состояния кожных покровов переломы разделяют на закрытые и открытые. При закрытых переломах целостность кожных покровов не нарушена, костные отломки и вся область перелома остаётся изолированной от внешней среды. Все закрытые переломы принято считать асептическими, неинфицированными (незаражёнными). При открытых переломах имеет место нарушение целостности кожных покровов. Размеры и характер повреждения кожных покровов различаются от точечной ранки до огромного дефекта мягких тканей с их разрушением, размозжением и загрязнением. Особым видом открытых переломов являются огнестрельные переломы. Все открытые переломы являются первично инфицированными, т. е. имеющими микробное загрязнение!
В зависимости от степени разобщения костных отломков различают переломы без смещения и со смещением. Переломы со смещением могут быть полными, когда связь между костными отломками нарушена и имеется их полное разобщение. Неполные переломы, когда связь между отломками нарушена не на всём протяжении, целостность кости в большей степени сохранена или костные отломки удерживаются надкостницей.
В зависимости от направления линии перелома различают продольные, поперечные, косые, винтообразные, звёздчатые, T-образные, V-образные переломы с растрескиванием кости.
В зависимости от вида костей различают переломы плоских, губчатых и трубчатых костей. К плоским костям относятся кости черепа, лопатка, подвздошные кости (образуют таз). Чаще всего при переломах плоских костей значительного смещения костных фрагментов не возникает. К губчатым костям относятся позвонки, пяточная, таранная и другие кости. Переломы губчатых костей характеризуются компрессией (сжатием) костной ткани и приводят к сдавлению кости (уменьшению её высоты). К трубчатым относятся кости, образующие основу конечностей. Переломы трубчатых костей характеризуются выраженным смещением. В зависимости от местоположения переломы трубчатых костей бывают диафизарными (перелом средней части кости — диафиза), эпифизарными (перелом одного из концов кости — эпифиза, как правило, покрытого суставным хрящом), метафизарными (перелом части кости — метафиза, расположенной между диафизом и эпифизом).
В зависимости от количества повреждённых участков (сегментов) конечностей или других систем организма различают изолированные (переломы костей одного сегмента), множественные (переломы костей двух и более сегментов), сочетанные (переломы костей в сочетании с черепно-мозговой травмой, травмой органов брюшной полости или грудной клетки).
Лечение
В связи с достаточно быстрым сращением костей у детей, особенно в возрасте до 7 лет, ведущим методом лечения переломов является консервативный. Переломы без смещения костных отломков лечат путём наложения гипсовой лонгеты. Критерием правильно наложенной гипсовой повязки является стихание болей, отсутствие нарушения чувствительности и движений в пальцах кисти или стопы. «Тревожными» симптомами того, что повязка сдавливает конечность, являются боль, выраженный отёк, нарушение чувствительности и движений в пальцах кисти или стопы. При появлении этих симптомов необходимо срочно обратиться к травматологу. Лечение переломов путём наложения гипсовой повязки является простым, безопасным и эффективным методом.
При переломах со смещением, при тяжёлых оскольчатых, внутрисуставных переломах проводится операция под общим наркозом — закрытая репозиция костных отломков с последующим наложением гипсовой повязки. Длительность хирургической манипуляции — несколько минут. Однако, проведение наркоза не позволяет сразу отпустить ребёнка домой. Пострадавший должен быть оставлен в стационаре на несколько дней под наблюдением врача.При нестабильных переломах для профилактики вторичного смещения костных отломков нередко применяют чрескостную фиксацию металлическими спицами, т. е. отломки костей фиксируют спицами и дополнительно гипсовой повязкой. Как правило, методику репозиции и фиксации врач определяет до проведения манипуляции. При фиксации области перелома спицами в последующем необходим уход и перевязка мест выхода спиц из конечности, Такой способ обеспечивает надёжную фиксацию перелома и через 3-5 дней ребёнок может быть выписан на амбулаторное лечение.В детской травматологии широко применяется метод постоянного скелетного вытяжения, который чаще всего используется при переломах нижних конечностей и заключается в проведении спицы через пяточную кость или бугристость большеберцовой кости (кость голени) и вытяжение конечности грузом на срок сращения перелома. Этот метод является простым и эффективным, но требует стационарного лечения и постоянного наблюдения врачом до полного сращения перелома.
Восстановительный период
В среднем, переломы верхней конечности срастаются в сроки от 1 до 1,5 месяцев, переломы костей нижней конечности — от 1,5 до 2,5 месяцев с момента травмы, переломы костей таза — от 2 до 3 месяцев. Лечение и реабилитация компрессионных переломов позвоночника зависят от возраста ребёнка и могут продлится до 1 года.
Активный восстановительный период начинается после снятия гипсовой иммобилизации или других видов фиксации. Его целью является разработка движений в смежных суставах, укрепление мышц, восстановление опорной способности травмированной конечности и прочее. К средствам восстановительного лечения относятся лечебная физкультура (ЛФК), массаж, физиотерапия, бассейн. Физиотерапия и массаж проводятся курсами по 10-12 сеансов и способствуют улучшению микроциркуляции крови и лимфы в повреждённом участке, восстановлению функции мышц и движений в суставах.
2) Читать 2 вопрос с 33 билета)
Воздействие на макроорганизм. Одной из главных задач при лечении гнойного инфекционного процесса являются поддержание и стимуляция иммунобиологических свойств организма. С этой целью применяют средства, улучшающие антителообразование и клеточный иммунитет. К ним прежде всего относится пассивная и активная иммунизация. Пассивную иммунизацию осуществляют введением специфического гипериммунного гамма-глобулина по 3 мл 2—3 раза с интервалом в 1—2 дня. Для активной иммунизации применяют анатоксины и аутовакцины. В последние годы при гнойных заболеваниях все шире используют стафилококковый анатоксин. Обычно назначают 10 инъекций препарата с промежутками в 2 — 3 дня в возрастающих дозах: 0,05; 0,07; 0,1; 0,3; 0,5; 0,7; 1,0; 1,5; 1,7; 2 мл. Если отмечается реакция на введение анатоксина, дозу не увеличивают. К активной иммунизации прибегают лишь у детей старше 6 мес.
Для стимуляции ретикулоэндотелиальной системы и улучшения фагоцитарных реакций целесообразно использовать пентоксил в дозе от 8 до 15 мг на 1 год жизни ребенка. Этот препарат назначают повторно, не реже 1 раза в 5 —7 дней в течение 25 — 30 дней.
У больных с гнойной инфекцией ввиду значительного напряжения обмена организму требуется повышенное количество витаминов, особенно группы В (В1 — до 30 мг, В2 — до 5 мг, Вб — до 8 мг) и С — до 300 мг в сутки.
Важной задачей воздействия на макроорганизм является его десенсибилизация, что достигается назначением антигистаминных препаратов в возрастных дозировках.
Воздействие на микроорганизм (антибактериальная терапия) заключается в использовании антибиотиков и сульфаниламидных препаратов. Стратегия и тактика антибиотикотерапии в последнее время подвергается существенному пересмотру. Тем не менее существует ряд принципов, которых следует придерживаться неукоснительно:
1. Шаблонное, «профилактическое» назначение антибиотиков не должно иметь места.
2. Необходим постоянный контроль за антибиотикограммой, не реже 1 раза в 5 —7 дней. До получения антибиотикограммы применяют препараты, действующие как на грамположительную, так и на грамотрицательную флору.
3. Антибиотики применяют в рациональном сочетании, и к назначаемым препаратам флора не должна быть резистентной. При использовании бактериостатического антибиотика обязательно назначают еще один — бактериолитический. Наиболее рациональны сочетания: гентамицин с цепорином или карбенициллином; оксациллин с ампициллином; пенициллин с гентамицином и оксациллином. При затянувшихся процессах параллельно применяют сульфаниламиды в возрастных дозах. Весьма эффективны сочетания антибиотиков с диоксидином.
4. Во время лечения постоянно поддерживают оптимальную концентрацию антибиотиков в крови и местном очаге, в связи с чем интервалы между введениями антибиотиков не должны быть слишком большими (не более 4 —6 ч).
5. Антибиотикотерапию проводят не менее 5 — 7 дней в полной возрастной дозировке.
Воздействие на местный процесс преследует две главные цели:
а) санацию гнойного очага и создание оттока гноя; б) отграничение воспалительного процесса и зоны некроза.
3) Травма почки у детей
В структуре всей закрытой травмы живота у детей повреждения почек составляют 10%. В 75 % случаев травма почки у детей сочетается с повреждением других органов. Анатомо-физиологические особенности.
Значительно более выраженное отношение между размерами почек и брюшной полостью у детей, чем у взрослых.
Слабо развитые мускулатура передней брюшной стенки и паранефральная жировая клетчатка.
Высокая эластичность и податливость окружающего реберного каркаса.
Эмбриональный тип строения почек у детей, связанный сеедольчатостью.
Капсула почки и фасция Герота слабо развиты, создавая условия более частого повреждения почки у детей, кровотечения и экстравазации мочи.
Высокая частота врожденных аномалий развития почек у детей.
Механизм травмы почек у детей вызван травмой ускорения-торможения при падении с высоты или автомобильных происшествиях. В связи с тем, что почки относительно фиксированы сосудистой ножкой, эффект ускорения-торможения может вызвать нарушение артериального кровотока и различную степень разрыва паренхимы органа. При прямом ударе почка повреждается вследствие механического воздействия на нее нижних ребер с одной стороны и позвоночника — с другой.
Классификация травм почки у детей
Тип 1 — ушиб почки. Кровоизлияния в паренхиму.
Тип 2 — разрыв фиброзной капсулы и неглубокие надрывы коры почки. Гематома в паранефральной клетчатке.
Тип 3 — подкапсульный разрыв паренхимы, не проникающий в лоханку или чашечки.
Тип 4 — разрыв фиброзной капсулы и паренхимы с распространением на лоханку или чашечки. Урогематома в паранефральной клетчатке.
Тип 5 — размозжение органа.
Тип 6 — отрыв почки от сосудистой ножки
Симптомы травмы почки у детей
Основными клиническими симптомами травмы почек являются: боль в животе или поясничной области, припухлость в поясничной области, гематурия.
Легкие повреждения почек проявляются умеренной болью в поясничной области и микрогематурией.
Субкапсулярные разрывы почек сопровождаются постоянными или приступообразными болями, массивной гематурией, нарушением центральной гемодинамики, симптомами раздражения брюшины
Разрывы паренхимы почек с вовлечением чашечек и лоханки характеризуются тяжелым состоянием, выраженными болями в животе и поясничной области, нарушением центральной гемодинамики, значительной припухлостью в поясничной области, симптомами раздражения брюшины, массивной гематурией.
Отрыв почки сопровождается клинической картиной шока.
Диагностика травмы почки у детей
Рентгенологическое исследование (обзорная рентгенография) позволяет диагностировать переломы ребер, позвонков, наличие забрюшинной гематомы по отсутствию тени края поясничной мышцы.
Экскреторная урография показывает сторону повреждения почки, ее анатомо-функциональное состояние.
УЗИ облегчает диагностику травмы почки по наличию очаговых изменений в ней и жидкостного образования в забрюшинной клетчатке.
Компьютерная томография обладает высокой чувствительностью и специфичностью и позволяет оценить следующее наличие внутрипочечной гематомы и ее размеры, характер и глубину разрывов паренхимы почки, степень забрюшинной гематомы.
Лечение травмы почки у детей
Консервативное лечение показано при удовлетворительном состоянии, отсутствии профузной гематурии, симптомов внутреннего кровотечения, стабильной гемодинамике.
Хирургическое лечение показано при сочетанном повреждении почек и других органов брюшной полости, сопровождающихся массивным кровотечением.
35 Билет
1) Вывихи. При несчастном случае может разорваться суставная сумка, и тогда одна из костей выскальзывает из полости сустава. Суставные сумки и связки у детей очень эластичны, а потому вывихи в раннем возрасте бывают довольно редко. Распознать вывих вы можете по таким признакам: нарушаются обычные контуры сустава, движения в нем становятся резко ограниченными, нарастает боль в суставе, конечность укорачивается или удлиняется. При вывихе или подозрении на него нужно создать для травмированной руки или ноги максимальный покой, наложить шину или фиксирующую повязку и как можно быстрее доставить ребенка к хирургу. При промедлении из-за быстро нарастающего отека будет трудно вправить кость в сустав. Кроме того, между костями может ущемиться нерв или сосуд, и это приведет к тяжелым последствиям (параличу или омертвению конечности). Непрофессионал не должен вправлять вывих, так как в ряде случаев бывает трудно отличить вывих от перелома кости и при оказании первой помощи можно скорее навредить, чем помочь ребенку. Подвывих лучевой кости в локтевом суставе. Эта травма встречается только в возрасте 2-3 лет и называется также «вывихом от вытягивания». К травме обычно приводит движение, при котором рука ребенка, находящаяся в вытянутом положении, подвер-гается резкому растяжению по продольной оси руки чаще вверх, иногда вперед. Ребенок может оступиться или поскользнуться, а взрослый, который ведет его, держа за руку, тянет за нее, чтобы удержать малыша от падения. Иногда у маленького ребенка такое растяжение происходит во время игры (взрослые, взяв его за руки, крутят вокруг себя) или надевания узкого рукава. В некоторых случаях взрослый может услышать, что рука хрустнула. Какова бы ни была причина, вызвавшая повреждение, ребенок вскрикивает от боли, после чего сразу перестает двигать рукой, держит ее в вынужденном положении, вытянув вдоль туловища и слегка согнув в локте. Особенно болезненны вращательные движения предплечья в локтевом суставе. Это повреждение связано с тем, что у таких маленьких детей связка, удерживающая лучевую кость, еще слаба. К 4-5 годам она крепнет, и подобные осложнения более не встречаются. Вправление подвывиха в большинстве случаев производится легко. Предплечье осторожно переводят в положение сгибания под прямым углом в локтевом суставе, захватывают кисть больного одноименной рукой и делают вращательные движения предплечья. При этом ребенок испытывает некоторою боль, а вправляющий ощущает щелканье или легкий хруст. Происходит вправление. Ребенок сразу успокаивается и буквально через 1-2 минуты свободно двигает рукой и начинает пользоваться ею как здоровой. Накладывать фиксирующую повязку нет необходимости. Но нужно соблюдать осторожность и не водить ребенка за больную руку. Во время прогулок с детьми ясельного возраста лучше пользоваться «вожжами».
2)Симптомы фурункулеза у детей
При фурункулезе на разных участках кожи ребенка появляются гнойники. В своем развитии фурункул проходит определенный цикл.
Сначала появляется пустула (небольшой болезненный фурункул), после наступает стадия инфильтрации, во время которой пустула и окружающая ее ткань уплотняются.
Волосяная луковица подвергается гнойно-некротическому расплавлению. В его центре находится плотный стержень. Позже некротические ткани отторгаются, ранка очищается, и фурункул зарубцовывается. Небольшие фурункулы пропадают бесследно, а на месте глубокого поражения тканей кожи нередко остаются рубцы.
Даже один фурункул способен доставить дискомфорт, а если гнойников много, страдает общее состояние здоровья ребенка. Фурункулы достаточно болезненны, и в зависимости от места своего расположения часто мешают выполнять привычные бытовые действия. Гнойник на попе мешает сидеть, на голове - поворачивать голову, на лице - доставляет болезненные ощущения при прикосновении к глазу или носу, в подмышечных впадинах мешает делать движение руками. Очень болючим бывает чирей в ухе. При фурункулезе у ребенка иногда появляются признаки интоксикации. У него повышается температуры тела до субфебрильных цифр, ухудшается самочувствие, мучает головная боль, снижается аппетит. Однако фурункулез у детей, если его правильно лечить, проходит быстрее, чем у взрослых.
Диагностика фурункулеза
Ввиду того, что очаги воспаления имеют поверхностное расположение (кроме гнойников в ухе), диагностировать фурункулез несложно. Однако при длительном, не поддающемся лечению фурункулезе может возникнуть необходимость в развернутой диагностике для установления точных причин болезни. В таком случае проводится иммунодиагностика, развернутый анализ крови, а фурункул исследуется на бактериальный посев гнойного содержимого. Если исследование не дало результатов, необходимо делать полное обследование организма, т. к. фурункулез может оказаться следствием какого-либо общего заболевания (болезни крови, диабета и др.).
Осложнения фурункулеза
При длительном течении заболевания могут появиться осложнения:
хронический фурункулез - воспалительный процесс, склонный к рецидивам, лечить который непросто;
тромбофлебит – закупорка тромбом просвета венозного отверстия, сопровождаемая воспалением стенок кровеносного сосуда;
лимфаденит, лимфангит (воспаления лимфоузлов);
флегмона – воспаление жировой ткани;
абсцесс – воспаление прилегающих к гнойнику тканей, вызывающее их расплавление, отчего образовывается наполненная гноем полость. Лечение абсцесса возможно лишь в условиях стационара, антибиотики здесь жизненно необходимы.
Гистопатология. Гнойное воспаление захватывает весь волосяной фолликул, потовую железу и окружающую соединительную ткань (глубокий фолликулит с перифолликулярным инфильтратом). Вначале гисто-патологическая картина аналогична картине при остиофолдикулите, затем отмечается некроз всего сально-волосяного аппарата и близлежащих тканей с обильным лейкоцитарным инфильтратом по периферии. В окружающей соединительной ткани множество расширенных кровеносных сосудов, значительный отек коллагена. В очаге поражения эластические и коллагеновые волокна полностью разрушены. Коллагенизированные пучки волокон толстым кольцом окружают очаг поражения, затрудняя проникновение инфекции из очага поражения в организм (выдавливание фурункула может привести к прорыву инфекции через защитное «кольцо»).
Лечение фурункула зависит от стадии процесса. В периоде инфильтрации применяют ультрафиолетовое облучение в эритемных дозах. В стадии созревания производят обкалывание в окружности инфильтрата растворами антибиотиков и новокаина (в условиях хирургических отделений). Создают покой для поражённой части тела, на конечности накладывают съёмные гипсовые лонгеты. Если воспалительный процесс не купируется, блокады повторяют ежедневно или через день до отхождения некротического стержня. Накладывают повязки с 1% раствором азотнокислого серебра, которые ежедневно меняют. Обычно одноразовое обкалывание на ранних стадиях фурункулёза приводит к быстрому выздоровлению. Редко приходится делать двукратную блокаду. Для других стадий характерны активизация, отграничение воспалительного процесса, после чего быстро наступает излечение. Полости вскрывшихся фурункулов промывают 3% раствором перекиси водорода и ежедневно делают перевязки с гипертоническим раствором хлорида натрия до очищения полости от некротических масс. Затем через каждые 2-3 дня накладывают повязки с мазью Вишневского, а при наличии грануляций – индифферентные жировые повязки (со стерильным вазелиновым маслом, рыбьим жиром, синтомициновой эмульсией и пр.). К хирургическому лечению прибегают при абсцедирующих фурункулах, флегмонах, запущенных карбункулах и других тяжёлых осложнениях. Операция заключается в проведении разреза под местной анестезией. Послеоперационный период ничем не отличается от местного лечения вскрывшихся фурункулов. Применяют и полное иссечение фурункула с наложением первичных швов. 3) Первично-хронический остеомиелит
Клиника первично-хронического остеомиелита
В отличие от вторично-хронического процесса, которому предшествует манифестовани острый хронический остеомиелит, при первично-хроническом течении заболевания острой фазы нет, болезнь изначально характеризуется "холодным" течением и "смазанностью" клинических проявлений. Дискомфорт, незначительные боли в течение длительного времени остаются нелокализированными, преобладает симптом длительного "щажение" пораженной конечности, может быть повышение температуры тела до субфебрильных цифр. Больные обращаются в стационар в связи с устойчивым болевым синдромом или же при появлении четкой локальной симптоматики: инфильтрация параосальных тканей, повышение местной температуры, боль при пальпации кости, ее утолщение, редко может наблюдаться флегмона мягких тканей и даже может открыться свищ. Лабораторные тесты малоинформативные (могут быть умеренно повышенными лейкоцитоз, лимфоцитоз, ускорение СОЭ). Среди первично-хронического гематогенного остеомиелита выделяют: • Абсцесс Brodie • Остеомиелит Garre • Апьбуминозний остеомиелит Oilier • антибиотическое остеомиелит Попкирова • опухолевидное остеомиелит Абсцесс Brodie чаще встречается у мальчиков и локализуется преимущественно в метафизе длинных трубчатых костей. Типичным и любимым местом гнойника являются кости, образующих коленный сустав, большеберцовая кость поражается в 80% случаев; в близлежащем суставе может возникать "дружественных" синовит. При рентгенологическом исследовании у метафиза длинной трубчатой кости определяется круглая или овоидные полость с четкими склерозированные пределами, очень редко в полости абсцесса может находиться маленький секвестр. Остеомиелит Garre еще иначе называется склерозирующим и чаще поражает диафиз и метадиафиз бедренной и большеберцовой костей. При этой патологии отмечается утолщение кости, уплотнение параосальных мягких тканей, мышц, но кожа, как правило, не меняется. Рентгенологически отмечается воронкообразное (иногда полуворонкообразное) утолщение кости на принципе плотной гомогенного склероза, костно-мозговой канал резко сужен. Очень редко на фоне склероза могут находиться ячейки деструкции и маленькие секвестры. Альбуминозний остеомиелит Oilier также зачастую поражает бедренную и большеберцовой кости. Рентгенологическая картина заболевания тождественна типичном хроническом ГО, но клинически типового навоза не бывает - вместо него образуется белковый экссудат, напоминающий синовиальную жидкость. Антибиотический остеомиелит (впервые было описано С. Попкировим) разворачивается как следствие вялого течения патологического процесса на фоне массивной пролонгированной общей антибиотикотерапии. Болезнь характеризуется несоответствием клинической и рентгенологической картин: при почти бессимптомном локальном клиническом течении рентгенологически определяются манифестовани деструктивно-пролиферативные тотальные или субтотальные изменения пораженной кости, вплоть до образования крупных секвестров. Опухолевидное ход первично-хронического ХО сопровождается несоответствием клинической и рентгенологической картин (скудность первой при выразительности второй). Рентгенологические проявления опухолевидного остеомиелита в основном отмечаются в двух вариантах: • с преобладанием метафизарных деструкции и кистоподибнимы изменениями; • диафизарные деструкция с "лукообразными" реакциями надкостницы. Решающее значение в постановке диагноза в подобных ситуациях имеет цитологическое исследование пунктата из очага поражения, которое помогает отклонить диагноз бластоматозного процесса.
Лечение хронического остеомиелита
При хроническом остеомиелите, как и при остром, проводится комплексное лечение, объем которого зависит от фазы заболевания, распространенности процесса, наличия осложнений и сопутствующих изменений со стороны паренхиматозных органов. В фазу обострения влияние на микро- и макроорганизм мало чем отличается от характера терапии острой стадии. Влияние на очаг воспаления в фазу обострения предусматривает декомпрессию внутрикостного гнойника с помощью постоянных игл Апексюка или катетеров, локальную антибиотикотерапию, дренирование пидокисных и межмышечной флегмон, санацию свищей. К хирургическому вмешательству прибегают после стихания воспалительных явлений. Хирургическому лечению подлежат все виды хронического остеомиелита - как первично-, так и вторично-хронические варианты течения. Хирургическое вмешательство предусматривает: 1. Радикальнуюнекрэктомию (удаление всех нежизнеспособных тканей: секвойи встретил, патологических грануляций, избыточного склероза, свищей). 2. Интраоперационную санацию пораженного сегмента (промывание антисептиками, обработка С02-лазер). 3. Множественные перфорации остаточных костных стенок в случае их выразительного склероза и пластика остаточных костных полостей аутоспонгиозою.
36 Билет
1) КОПРОСТАЗ - вариант обтурационной непроходимости толстой кишки. Причины копростаза у детей разнообразны: пороки развития толстой кишки, неправильный режим питания, вялая перистальтика на почве миелодисплазии и др. В анамнезе почти всегда отмечают задержку стула.
Клинические проявления. Явления кишечной непроходимости нарастают медленно, в виде частичного илеуса. Полная непроходимость возникает, когда образуется каловый камень больших размеров. Нарастают явления интоксикации, возникает рвота. Стул отсутствует, газы отходят в незначительном количестве. Увеличивается вздутие живота, появляются тянущие боли, переходящие в схваткаобразные.
Рентгенологическое исследование - при ирригография на снимке наблюдается обтекания калового камня контрастным веществом.
Неотложные мероприятия. Лечение преимущественно консервативное. Применяют теплые, высокие очистительные сифонные клизмы с 1% раствором натрия хлорида. Назначают слабительное (вазелиновое, касторовое масло). Одновременно для предотвращения каловой интоксикации проводят дезинтоксикационнуюинфузионную терапию.
2) Классификация переломовывиха костей предплечья
Выделяют две разновидности переломовывихов костей предплечья: Монтеджа и Галеацци. В первом случае происходит перелом локтевой кости в верхней трети с вывихом головки лучевой кости. Во втором - перелом лучевой кости в нижней трети с вывихом головки локтевой кости.
ПереломовывихМонтеджа
Причины
Разгибательный тип возникает при падении и ударе верхней третью предплечья о твёрдый предмет или же при ударе по этой области. Происходит перелом локтевой кости, а продолжение насилия ведёт к разрыву кольцевидной связки и вывиху головки лучевой кости.
Сгибательный тип повреждения возникает при нагрузке, приложенной преимущественно к дистальному отделу предплечья и направленной с тыльной в ладонную сторону и по продольной оси предплечья.Происходят перелом локтевой кости в средней трети со смещением отломков под углом, открытым в ладонную сторону, и вывих головки лучевой кости в тыльную сторону.
Симптомы и диагностика
Разгибательный тип. Боль в месте перелома и резкое нарушение функций локтевого сустава. Предплечье несколько укорочено, отёчно в верхней трети и в области локтевого сустава. Движения в локтевом суставе резко ограниченные, при попытке движений - боль и ощущение препятствия по передненаружной поверхности сустава. Пальпаторно в этой зоне выявляют выпячивание. При ощупывании гребня локтевой кости в месте травмыопределяют болезненность, деформацию, возможны патологическая подвижность и крепитация. На рентгенограмме выявляют вывих головки лучевой кости кпереди, перелом локтевой кости на границе верхней и средней третей с углообразным смещением. Угол открыт в тыльную сторону.
Сгибательный тип. Нарушение взаимоотношений костей и определяет клиническую картину повреждения: боль в области перелома и локтевого сустава, который деформируется за счёт отёка и выстоящей кзади головки лучевой кости, умеренное ограничение функций из-за боли, укорочение предплечья. Рентгенологическая картина подтверждает диагноз.
Лечение
Консервативное лечение
Консервативное лечение состоит из репозиции отломков и устранения вывиха. Манипуляцию выполняют под местной анестезией или общим обезболиванием вручную или же с помощью аппаратов для репозиции костей предплечья.
При разгибательном типе производят тракцию за кисть согнутого под прямым углом и супинированного предплечья и сопоставляют отломки локтевой кости. Если репозиция удалась, то лучевая кость во многих случаях вправляется самостоятельно. Если этого не случилось, вывих устраняют путём давления на головку лучевой кости и смещения её кзади.
При сгибательном типе также производят тракцию за кисть супинированного, но разогнутого предплечья. Надавливая пальцами с тыльной на ладонную поверхность предплечья, хирург сопоставляет отломки. Дальнейшие манипуляции такие же, как и при разгибательном типе повреждения.
По завершении пособия накладывают циркулярную гипсовую повязку от верхней трети плеча до головок пястных костей при сгибании в локтевом суставе под углом в 90°, супинации предплечья и функционально выгодном положении кисти на 6-8 нед. Затем приступают к восстановительному лечению, сохраняя съёмную лонгету ещё в течение 4-6 нед.
Хирургическое лечение
Операция заключается в устранении интерпоната, вправлении головки лучевой кости и внутрикостном металлоостеосинтезе ретроградным способом локтевой кости. Для профилактики повторных вывихов сшивают или выполняют пластику полоской аутофасции кольцевидной связки. Иногда, чтобы предупредить релюксацию, проводят через плечелучевой сустав спицу Киршнера, извлекают её через 2-3 нед. Другой способ удержания головки - пришпилить её короткой спицей к венечному отростку.После операции конечность фиксируют гипсовой повязкой от верхней трети плеча до пястно-фаланговых сочленений на 6 нед, затем превращают её в съёмную и сохраняют ещё в течение 4-6 нед.
ПереломовывихГалеацци
При разгибательном типе отломки лучевой кости смещены п о д углом, открытым в тыльную сторону, а вывих головки локтевой кости происходит в ладонную сторону.
Для сгибательного типа повреждения характерно смещение отломков лучевой кости под углом, открытым в ладонную сторону, а головка локтевой кости смещается в тыльную сторону.
Симптомы и диагностика
Диагноз ставят на основании механизма травмы, боли и нарушения функций лучезапястного сустава, углообразной деформации лучевой кости, болезненности при пальпации. Головка локтевой кости выстоит кнаружи и в тыльную или ладонную сторону, подвижна. Перемещения её болезненны. Рентгенограмма подтверждает диагноз и способствует определению типа повреждения.
Лечение
Консервативное лечение
Консервативное лечение начинают с достаточного обезболивания одним из способов. Затем производят ручную или аппаратную репозицию перелома лучевой кости путём тракции за кисть в среднем между супинацией и пронацией положении предплечья. Смещения по ширине и под углом хирург устраняет руками. Вправить головку локтевой кости также не представляет никакого труда. Сложность заключается в том, что не всегда возможно удержать локтевую кость во вправленном положении. Если все же это удаётся, то в область головки локтевой кости кладут пелот, а конечность фиксируют гипсовой повязкой от верхней трети плеча до основания пальцев на 6-8 нед, а затем для активного физиотерапевтического лечения иммобилизацию превращают в съёмную и сохраняют ещё на 4-6 нед.
Хирургическое лечение
Если консервативные мероприятия не дают успеха, переходят к хирургическому лечению. Начинают с устойчивого остеосинтеза лучевой кости интрамедуллярным штифтом или пластинкой. Чтобы удержать головку локтевой кости, применяют различные способы: пластику радиоульнарной связки, фиксацию её спицей Киршнера, фиксацию лучевой и одновременно локтевой костей с их сближением в аппарате Илизарова. Некоторые авторы в трудных случаях советуют резецировать головку.
3) Карбункул представляет собой разлитое гнойно-некротическое воспаление глубоких слоев дермы и гиподермы с вовлечением в процесс нескольких соседних волосяных фолликулов. При карбункуле гнойно-некротический инфильтрат занимает большую площадь и распространяется в более глубоких слоях дермы и гиподермы, чем при фурункуле.
В начале развития карбункула в коже обнаруживается несколько отдельных плотных узелков, которые сливаются в один инфильтрат. Поверхность его приобретает полушаровидную форму, кожа становится напряженной, в центре инфильтрата окрашена в синюшный цвет: выражена местная болезненность. Это первая стадия развития инфильтрата, которая длится 8-12 дней. Затем в области инфильтрата формируется несколько пустул, покрышки которых вскрываются, и образуется несколько отверстий, придающих карбункулу вид, напоминающий решето. Через эти отверстия выделяются гной и некротические массы зеленого цвета с примесью крови. Постепенно все большие участки центра карбункула подвергаются некрозу. Отторгшиеся массы образуют обширный дефект ткани - формируется глубокая язва, иногда доходящая до мышц. Вторая стадия - стадия нагноения и некроза - длится от 14 до 20 дней. Далее язва заполняется грануляционной тканью и образуется, как правило, грубый глубокий рубец, спаянный с подлежащими тканями. Крупные рубцы остаются и после оперативного вмешательства, если его проводят по поводу карбункула. Обычно бывают одиночные карбункулы. Их развитие сопровождается высокой температурой, мучительными болями рвущего, дергающего характера, ознобом, недомоганием. Злокачественное течение карбункула может наблюдаться в старческом возрасте, у истощенных больных, страдающих выраженным диабетом, при нервно-психических переутомлениях. В этих случаях появляются невралгические боли, бред или же глубокая прострация, лихорадка септического характера. Смерть может наступить от профузного кровотечения из крупного сосуда и от сепсиса. При локализации в области носа, верхней губы возможны тяжелые менингеальные осложнения.
Диагностика Карбункула:
Диагноз не представляет затруднений. Следует помнить о сибиреязвенном карбункуле, при котором более резко выражен отек тканей; в области пустулы наблюдается образование черного струпа, напоминающего уголь (anthrax), и обнаруживается специфический возбудитель - аэробная грамположительная сибиреязвенная палочка. От фурункула карбункул легко отличить на основании описанной выше клинической картины.
Осложнения. При таком течении заболевания отмечаются следующие возможные осложнения: - лимфаденит – гнойные воспаления в области лимфатических узлов; - лимфангит – воспаление лимфатических сосудов, к которому приводит распространение инфекции с током лимфы в направлении лимфатических узлов; - тромбофлебит – образование тромба при воспалении стенки вены; - сепсис – попадание в кровь, ткани гноеродных микроорганизмов, их токсинов; - гнойный менингит – гнойное воспаление оболочек мозга.
Лечение Карбункула:
В амбулаторных условиях допустимо лечение карбункулов небольших размеров, локализующихся на туловище и конечностях, при отсутствии выраженной интоксикации. В начале заболевания, при наличии только воспалительного инфильтрата, до формирования гнойно-некротического очага, показана антибактериальная терапия. Назначают антибиотики, как правило, широкого спектра действия - ампициллин, ампиокс и др., синтетические антибактериальные препараты широкого спектра действия - бисептол, фурагин. Показаны аналгезирующие и сердечные средства, молочно-растительная диета. Поверхность инфильтрата обрабатывают 70% этиловым спиртом и накладывают асептическую повязку. Применяют ультрафиолетовое облучение, УВЧ-терапию. При благоприятном эффекте консервативной терапии обратное развитие инфильтрата происходит через 2 - 3 дня и сопровождается уменьшением болей, снижением температуры тела, нормализацией картины крови. Показанием к операции карбункула является формирование очага некроза. Операцию по поводу небольшого карбункула проводят под местной анестезией 0,5 - 0,25% раствором новокаина. Карбункул крестообразно рассекают через всю толщу некроза до жизнеспособных тканей с последующейнекрэктомией. Операцию заканчивают введением в рану тампонов с гипертоническим раствором хлорида натрия или протеолитическими ферментами. До окончательного отторжения гнойно-некротических масс ежедневно сменяют повязки с протеолитическими ферментами, гипертоническим раствором хлорида натрия, по показаниям выполняют этапные некрэктомии, затем применяют препараты на мазевой основе (10% метилурациловая мазь, винилин и др.). После операции продолжают антибактериальную терапию, физиотерапию.
Билет №37
Врожденные пороки развития пищевода. Этиология. Патогенез. Методы диагностики.
1111Пороки развития пищевода. Причины. Симптомы. Диагностика.
К порокам развития пищевода относятся его дисгенезии, касающиеся его формы, размеров и топографического отношения к окружающим тканям. Частота этих пороков составляет в среднем 1:10 000, соотношение полов - 1:1. Аномалии пищевода могут касаться только одного пищевода, но могут также сочетаться с аномалиями развития трахеи - факт объяснимый, если принимать во внимание, что и пищевод, и трахея развиваются из одних и тех же эмбриональных зачатков. Одни аномалии пищевода бывают несовместимы с жизнью (смерть новорожденного наступает через несколько дней после рождения), другие - совместимы, но требуют определенных вмешательств.
К врожденным порокам развития пищевода относятся сужения, полная непроходимость, агенезия (отсутствие пищевода), гипогенезия, касающаяся различных частей пищевода, пищеводно-трахеальный свищ. По мнению известного исследователя пороков развития П.Я.Коссовского, и английских авторов во главе с известным эзофагологомР.Шимке, чаще всего встречаются комбинации полной непроходимости пищевода с пищеводно-трахеальным свищом. Реже наблюдают комбинацию сужения пищевода с пищеводно-трахеальный свищом или ту же комбинацию, но без сужения пищевода.
Помимо пороков развития самого пищевода, обрекающих новорожденных либо на быструю голодную смерть, либо на травматичные оперативные вмешательства, врожденная дисфагия может быть обусловлена пороками развития сопредельных с нормальным пищеводом органов (аномальное отхождение правой сонной и подключичной артерий от дуги аорты и от ее нисхоящей части слева, что предопределяет давление этих аномально расположенных крупных сосудов на пищевод в месте перекреста - dysphagialussoria). И.С.Козлова и соавт. (1987) выделяют следующие виды атрезий пищевода:
атрезии без пищеводно-трахеального свища, при которых проксимальный и дистальный концы заканчиваются слепо или весь пищевод замещен фиброзным тяжем; эта форма составляет 7,7-9,3% от числа всех аномалий пищевода;
атрезии с пищеводно-трахеальным свищом между проксимальным отрезком пищевода и трахеей, составляющие 0,5%;
атрезии с пищеводно-трахеальным свищом между дистальный сегментом пищевода и трахеей (85-95%);
атрезия пищевода с пищеводно-трахеальный свищом между обоими концами пищевода и трахеей (1%).
Часто атрезии пищевода сочетаются с другими пороками развития, в частности с врожденными пороками сердца, ЖКТ, мочеполовой системы, скелета, ЦНС, с расщелинами лица. В 5% случаев аномалии пищевода встречаются при хромосомных болезнях, например при синдромах Эдвардса (характеризуется врожденными аномалиями у детей, проявляющимися парезами и параличами в различных периферических нервов, глухотой, множественными дисгенезиями внутренних органов, в том числе органов груди) и Дауна (характеризуется врожденным слабоумием и характерными признаками физических уродств - низкий рост, эпикант, маленький короткий нос, увеличенный складчатый язык, лицо «клоуна» и мн. др.; 1 случай на 600-900 новорожденных), в 7% наблюдений является компонентом нехромосомной этиологии.
Атрезия пищевода. При врожденной непроходимости пищевода верхний (глоточный) конец его заканчивается слепо примерно на уровне вырезки грудины или несколько ниже; продолжением его является мышечно-фиброзный тяж большей или меньшей длины, переходящий в слепой конец нижнего (кардиального) отрезка пищевода. Сообщение с трахеей (пищеводно-трахеальный свищ) чаще располагается на 1-2 см выше ее бифуркации. Свищевые отверстия открываются либо в глоточный, либо в кардиальный слепой отрезок пищевода, а иногда и в тот, и в другой. Врожденная непроходимость пищевода обнаруживается с первого кормления новорожденного и особенно ярко, если она сочетается с пищеводно-трахеальным свищом. В этом случае данный порок развития проявляется не только непроходимостью пищевода, для которой характерны постоянное слюнотечение, срыгивание всей проглоченной пищи и слюны, но и тяжелые расстройства, вызванные попаданием жидкости в трахею и бронхи. Эти расстройства синхронизируются с каждым глотком и проявляются с первых минут жизни ребенка кашлем, захлебыванием, цианозом; они возникают при свище в проксимальном отделе пищевода, когда жидкость из слепого конца попадает в трахею. Однако и при пищеводно-трахеальном свище в области кардиального отрезка пищевода вскоре развиваются дыхательные расстройства ввиду того, что в дыхательные пути попадает желудочный сок. В этом случае возникает стойкий цианоз, а в мокроте обнаруживается свободная хлористоводородная кислота. При наличии указанных аномалий и без экстренного хирургического вмешательства дети погибают рано либо от пневмонии, либо от истощения. Спасти ребенка можно только путем пластической операции, в качестве временной меры может быть применена гастростомия.
Диагноз атрезии пищевода устанавливают на основании указанных выше признаков афагии, при помощи зондирования и рентгенографии пищевода с контрастированием йодлиполом.
Стеноз пищевода с частичной его проходимостью в большинстве своем относится к стенозам, совместимым с жизнью. Чаще всего сужение локализуется в нижней трети пищевода и, вероятно, обусловлено нарушением его эмбрионального развития. Клинически стеноз пищевода характеризуется нарушением глотания, которое проявляется сразу же при питании полужидкой и особенно плотной пищей. При рентгенологическом обследовании визуализируется плавно сужающаяся тень контрастирующего вещества с веретенообразным ее расширением над стенозом. При фиброгастроскопии определяется стеноз пищевода с ампуловидным расширением над ним. Слизистая оболочка пищевода воспалена, в области стеноза она гладкая, без рубцовых изменений. Стеноз пищевода вызывают пищевые завалы плотными продуктами питания.
Врожденные нарушения размера и положения пищевода. К этим нарушениям относятся врожденные укорочения и расширения пищевода, его латеральные смещения, а также вторичные диафрагмальные грыжи, обусловленные расхождением волокон диафрагмы в кардиальном ее отделе с втяжением в грудную полость кардиальной части желудка.
Врожденное укорочение пищевода характеризуется недоразвитостью его в длину, в результате чего прилегающая часть желудка выходит через пищеводное отверстие диафрагмы в грудную полость. Симптомы этой аномалии состоят в периодически возникающих тошноте, рвоте, срыгивании пищей с примесью крови, появлении крови в кале. Эти явления быстро приводят новорожденного к потере массы и обезвоживанию.
Диагноз устанавливают при помощи фиброэзофагоскопии и рентгенографии. Дифференцировать эту аномалию следует от язвы пищевода, особенно у грудных детей.
Врожденные расширения пищевода - аномалия, возникающая чрезвычайно редко. Клинически она проявляется застойными явлениями и медленным прохождением пищи по пищеводу.
Переломы в области локтевого сустава. Классификация. Клиника, диагностика.
Внутрисуставные переломы локтевого сустава занимают первое место среди всех внутрисуставных переломов исоставляют18,8%.Перелом локтевого сустава может иметь самые сложные последствия. Это связано с тем6 что движения в суставе происходят в двух плоскостях, но при этом сам сустав имеет сложное строение и состоит из плечевой кости, локтевой и лучевой, а еще из трех малых костей (плечелучевая, плечелоктевая, верхняя лучелоктевая). Рядом с суставом близко проходят нервы и сосуды.
Классификация
1. Околосуставные переломы:
перелом бугристости;
простой перелом метафиза;
оскольчатый перелом метафиза.
2. Внутрисуставные переломы:
перелом локтевого отростка изолированный;
перелом локтевого и венечного отростков;
оскольчатыйэпиметафизарный перелом.
3. Классификация переломов проксимального конца лучевой кости:
трещины и надломы;
краевые переломы головки( без смещения; со смещением);
оскольчатые переломы;
переломы шейки лучевой кости;
эпифизиолиз.
4. По характеру:
открытые (серьезные смещения костных отломков возникают при открытых переломах локтевого сустава и сопровождаются повреждением мягких тканей и целостности кожи. Часто именно открытые переломы осложняются несращением костных элементов);
закрытые;
раздробленные;
краевые со смещением.
Механизмтравмы Перелом локтевого сустава появляется как в результате падения, так и после прямого сильного удара, полученного, например, в результате дорожной аварии. Повреждение возникает внутри самого сустава локтевого отростка. Чаще всего это происходит все-таки по причине механического повреждения, но роль и предрасполагающих факторов никто не исключал. Так, перелом руки в локтевом суставе чаще может происходить у женщин, страдающих хронической резорбцией костной ткани (остеопороз), при слабости связочного аппарата сустава, аномалиях строения суставных поверхностей, множественных дисплазиях и т.д. Перелом локтевого сустава часто может сочетаться с его вывихом, другими повреждениями в нижних и верхних конечностях. Данный механизм травмы особенно актуален при ДТП. Симптомы При переломе локтевого сустава возникает боль, движения сильно ограничены, возможно визуально видны будут деформации. Проще составить следующую схему, наиболее точно отражающее симптоматику:
деформация и отечность локтевого сустава;
повреждение околосуставных тканей, развитие отека;
чувство онемения конечности, покалывания или жжения, распространяющееся вплоть до фаланг пальцев (в случае повреждения нерва);
ограничение в разгибании и сгибании сустава (вопль до полного обездвижевания);
гемартроз (кровоизлияние в сустав);
резкая болезненность при пальпации отростка;
западение кожи вместо привычного костного возвышения.
Диагностика
рентгенография локтевого сустава в двух проекциях;
компьютерная томография (КТ).
Флегмона новорожденных. Клиника и патоморфологические изменение. Диагностика. Возможные осложнения. Общее и местное лечение.
Флегмона новорожденных (некротическая флегмона новорожденных) — своеобразное воспаление подкожной клетчатки, наблюдаемое в первый месяц жизни. Возбудителем может быть любой гноеродный микроб, но чаще стафилококк. Входные ворота — незначительные повреждения кожи, гнойнички. Морфологически отмечается преобладание некротических изменений над воспалительными благодаря особенностям кровоснабжения и возрастной реактивности. Кожа поражается вторично.
Симптоматология и клиника флегмоны новорожденных. Заболевание начинается остро. Ребенок беспокоен, теряет аппетит. Температура тела 38—39°. На колее появляется ограниченный участок покраснения и уплотнения, болезненный при ощупывании. Локализация поражения может быть разной, но чаще в крестцово-копчиковой области, на груди и шее. Воспалительный очаг быстро увеличивается, «расплывается, как масляное пятно». Кожа приобретает багровый, затем цианотичный оттенок. На 2—3-й сутки в центре поражения возникает участок размягчения. Далее в этом месте кожа расплавляется и образуется свищ, через который отторгается некротизированная клетчатка тусклого цвета. По краям происходит отслойка кожи, которая подвергается расплавлению, в результате чего образуется обширная рана с подрытыми краями. При благоприятном течении процесса по отторжении некротических тканей рана постепенно заживает. Но в большинстве случаев, если не оказана своевременная помощь, некроз распространяется вширь и вглубь, обнажаются кости. У ребенка развивается сепсис. Наступает смерть.
Диагностика флегмоны новорожденных. Флегмону новорожденных смешивают с остеомиелитом, рожистым воспалением, часто трактуют как обыкновенный абсцесс. Ошибка в диагнозе скорее является результатом недостаточного знакомства врачей с данной нозологической единицей.
Лечение. При флегмоне новорожденных требуется экстренная помощь. Процесс развивается молниеносно, что резко ухудшает прогноз. По установлении диагноза, не дожидаясь появления флюктуации, пораженную зону обкалывают раствором антибиотиков в 0,25% растворе новокаина (суточная доза) и производят множественные мелкие насечки, проникающие в подкожный слой. Такие насечки лучше делать в шахматном порядке и захватывать ими границу здоровой и пораженной кожи, что ограничивает распространение процесса. Накладывают повязки с 10% раствором поваренной соли или 25% раствором сернокислой магнезии. В первые 2—3 дня повязки меняют 3—4 раза за сутки. Ранки не тампонируют, ибо тампонада способствует отслойке кожи и ее гнойному расплавлению. После прекращения отторжения некротических масс применяют марганцовые ванны и физиотерапевтические процедуры (ультрафиолетовое облучение). Накладывают мазевые повязки. Одновременно до полного выздоровления проводят общее лечение (антибиотики внутримышечно, внутривенные переливания крови, плазмы, глюкозы, витаминотерапия).
Исход и осложнения
При своевременном и правильном лечении исход благоприятен.[3] Флегмона опасна развитием сепсиса — распространённого инфекционного процесса, часто заканчивающегося неблагоприятно.[1]
От распространения местного воспаления возможны такие осложнения, как плеврит, перитонит, остеомиелит ребер и т.д. При развитии септического состояния возможны осложнения, не связанные пространственно с местным процессом (пневмония, отит, парентеральная диспепсия, склерема).[2]
В качестве длительных последствий следует упомянуть возможное образование деформирующих рубцов, которые, в частности, могут служить причиной нарушения функции внешнего дыхания при локализации на грудной клетке.
Билет №38
Врожденная кишечная непроходимость. Этиология, классификация .
Врожденная кишечная непроходимость возникает вследствие аномалий развития кишечника или других органов.
Причины врожденной кишечной непроходимости
Атрезия — наиболее частая причина кишечной непроходимости и составляет одну треть от всех пороков развития кишечника.
Стенозы кишечника составляют до 20 % всех видов кишечной непроходимости.
Мальротация кишечника — нарушение процесса вращения и фиксации кишечника, которые разделяются на отсутствие ротации кишечника, неполную ротация кишечника, неполную фиксацию кишечника.
Сдавление кишки эмбриональными спайками, аномально расположенными сосудами брыжейки, опухолями и кистами, неполным обратным развитием желточного протока.
Клинико-анатомические варианты врожденной кишечной непроходимости
Высокая кишечная непроходимость — непроходимость на уровне двенадцатиперстной кишки и начального отдела тощей кишки.
Низкая непроходимость кишечника — непроходимость кишечника на уровне от начальных отделов тощей кишки до прямой кишки.
Симптомы врожденной кишечной непроходимости
Острая форма клинически проявляется с первых дней жизни ребенка.
Хроническая форма наблюдает« я при частичной непроходимости кишечника, когда периоды усиления кинических проявлений чередуются с периодами благополучия, которые длятся до нескольких месяцев.
Рецидивирующая форма характеризуется непостоянством клинических проявлений, однако общим является перемежающийся характер кишечной непроходимости.
Особенности клинических проявлений.
Острая высокая врожденная кишечная непроходимость:
— основным симптомом служит рвота с примесью желчи, которая появляется в течение первых суток после рождения;
— обмечается отхождение мекония;
— потеря массы тела;
— вздутие живота в эпигастральной области и его западение в нижних отделах.
Острая низкая врожденная кишечная непроходимость:
— отсутствие мекония или его небольшое количество;— рвота появляется с 2-3 сут;— стремительное ухудшение состояния ребенка;— живот увеличен в размерах, особенно в нижних отделах.
Хроническая высокая врожденная кишечная непроходимость:
— срыгивание и рвота через несколько месяцев после рождения (в зависимости от степени сужения просвета кишки);— отставание в физическом развитии.
Рецидивирующая врожденная кишечная непроходимость:
— периодические приступы беспокойства, сопровождающиеся вздутием живота и рвотой у детей грудного возраста;— спонтанное исчезновение приступов беспокойства или улучшение после очистительной клизмы;
— период благополучия, который может длиться от дней до месяцев, после вновь развивается рецидив кишечной непроходимости.
Лимфадениты у детей. Этиология. Классификация. Клинические проявления. Диагностика. Консервативное и оперативное лечение. Возможные осложнения.
Лимфаденит у детей – воспалительная реакция лимфатических узлов в ответ на локальные или общие патологические процессы в организме. Серозный лимфаденит у детей протекает с увеличением, уплотнением, болезненностью лимфоузлов; гнойный лимфаденит сопровождается местными (гиперемией, отеком) и общими симптомами (резким ухудшением самочувствия, лихорадкой). Диагноз лимфаденита у детей устанавливается на основании клинического осмотра, общего анализа крови, УЗИ и пункции лимфоузлов. В лечении лимфаденита у детей применяется консервативная тактика (антибактериальная, десенсибилизирующая, дезинтоксикационная терапия, местные аппликации, УВЧ) или хирургическое вскрытие и дренирование гнойного очага с обязательной ликвидацией первичного источника инфекции. подробнее |
Лимфаденит у детей
Лимфаденит у детей – инфекционный или неинфекционный воспалительный процесс в периферических органах лимфатической системы – лимфоузлах. Лимфадениту принадлежит одно из ведущих мест по частоте встречаемости в педиатрии, что обусловлено морфофункциональной незрелостью лимфатической системы ребенка. Чаще всего лимфаденит наблюдается у детей в возрасте от 1 до 6 лет и имеет более бурное течение, чем у взрослых. Лимфаденит у детей развивается вторично, осложняя течение основных инфекционно-воспалительных заболеваний, поэтому увеличение лимфатических узлов у ребенка может обнаруживаться различными детскими специалистами: педиатром, детским отоларингологом, детским стоматологом, детским хирургом,детским иммунологом, детским ревматологом и др.
Классификация лимфаденита у детей
В зависимости от типа возбудителя выделяют неспецифический и специфический лимфаденит у детей, который может иметь острое (до 2-х недель), подострое (от 2-х до 4-х недель) или хроническое (более месяца) течение.
По характеру воспалительных изменений лимфатических желез у детей различают серозные (инфильтрационные), гнойные, некротические (с расплавлением узлов) лимфадениты и аденофлегмоны.
По очагу поражения лимфадениты у детей разделяют на регионарные (шейные, подчелюстные, подмышечные, паховые и т. д.) и генерализованные; по этиологическому фактору - одонтогенные (связанные с патологией зубо-челюстной системы) и неодонтогенные.
Причины лимфаденита у детей
Рост и развитие лимфоидных образований у детей продолжается до 6-10 лет; этот период связан с повышенной восприимчивостью к различным инфекционным агентам и недостаточной барьерно-фильтрационной функцией. Лимфоузлы, как элементы иммунной защиты, вовлекаются во все патологические процессы, протекающие в организме: распознавая и захватывая чужеродные частицы (бактерии, токсины, продукты распада тканей), они препятствуют их распространению из местного очага и попаданию в кровь.
Лимфаденит у детей чаще всего имеет неспецифический генез, его основными возбудителями являются гноеродные микроорганизмы, в первую очередь, стафилококки и стрептококки. При лимфадените у детей обычно имеется первичный очаг острого или хронического гнойного воспаления, из которого инфекция попадает в лимфоузлы с током лимфы, крови или контактным путем.
Более 70% случаев лимфаденита у детей связано с воспалительными процессами ЛОР-органов - тонзиллитом, ангиной, синуситом,отитом. Лимфаденит у детей часто сопутствует инфекциям кожи и слизистых оболочек: фурункулам, пиодермии, гнойным ранам, экземе,стоматиту. Лимфаденит может осложнять течение различных бактериальных и вирусных инфекций у детей - скарлатины, дифтерии,ОРВИ, гриппа, паротита, ветряной оспы, кори. Наибольшее количество лимфаденитов у детей отмечается в осенне-зимний период вследствие увеличения числа инфекционных и обострения хронических заболеваний.
Лимфаденит у детей старше 6-7 лет может быть связан с воспалительными заболеваниями зубо-челюстной системы (кариесом,пульпитом, периодонтитом, остеомиелитом). При этом нарастание симптомов лимфаденита у детей может происходить после затухания патологического процесса в первичном очаге.
Причиной специфического лимфаденита у детей являются инфекционные заболевания с типичным для них поражением лимфатических узлов - туберкулез, инфекционный мононуклеоз, бруцеллез, актиномикоз, сифилис и др.
В некоторых случаях лимфаденит у детей может быть связан с заболеваниями крови (острыми и хроническими лейкозами), опухолями лимфоидной ткани (лимфосаркомой, лимфогрануломатозом), а также травматическим повреждением самих лимфоузлов.
Лимфаденит обычно наблюдается у детей с лимфатико-гипопластическим диатезом, часто болеющих ОРВИ, имеющих в анамнезе сопутствующие герпесвирусные инфекции (ЦМВ, вирус Эпштейна-Барра) и хронические заболевания ЖКТ.
Симптомы лимфаденита у детей
Как правило, при лимфадените у детей поражаются лимфоузлы в области лица и шеи (наиболее часто - подчелюстные и шейные с одной или обеих сторон, реже - околоушные, щечные, затылочные, заушные), в отдельных случаях – подмышечные, паховые.
Серозная стадия острого неспецифического лимфаденита у детей (1-3 сутки заболевания) проявляется болезненными, заметно увеличенными в размерах и плотно-эластичными на ощупь регионарными лимфоузлами, без потери их подвижности и развития местной кожной реакции. Общее состояние ребенка не нарушено, температура колеблется от нормальных до субфебрильных значений.
Переход острого лимфаденита в гнойную стадию (3-6 сутки заболевания) протекает с ярко выраженными местными признаками и резким ухудшением самочувствия детей. Наблюдаются признаки интоксикации: озноб, высокая температура (до 40ºС), головная боль, сильная слабость, отсутствие аппетита и нарушение сна. В области пораженных лимфоузлов возникают интенсивные тянущие или стреляющие боли, явления периаденита, местная гиперемия и отек кожи. Возможно развитие аденофлегмоны с появлением очагов флюктуации и выходом гнойного воспаления за пределы лимфоузла. Аденофлегмоны челюстно-лицевой области могут осложниться тромбозом кавернозного синуса, медиастинитом, сепсисом.
Хроническая форма лимфаденита у детей может развиться первично, если возбудителями являются слабовирулентные микроорганизмы, или стать продолжением острой формы заболевания. При хроническом течении вне обострения лимфоузлы увеличены, ограничены в подвижности, достаточно плотные, но безболезненные; самочувствие ребенка не нарушено; нагноение развивается редко. При наличии у ребенка очага хронической инфекции, длительно поддерживающего вялотекущий лимфаденит, лимфоузлы постепенно разрушаются и замещаются грануляционной тканью.
Туберкулезный лимфаденит у детей имеет продолжительное течение, ограничивается обычно шейной группой лимфоузлов, собранных в плотный, безболезненный, значительный пакет, похожий на ошейник. Туберкулезный лимфаденит у детей может осложняться казеозным распадом, образованием свищевых ходов, рубцовыми изменениями кожи.
Специфический лимфаденит, связанный с вакцинацией против туберкулеза («бецежеит»), может развиться у детей с низкой и измененной общей реактивностью, проявляясь хроническим кальцинирующим казеозным поражением подмышечных лимфоузлов. Генерализованный лимфаденит у детей отмечается при диссеминированном туберкулезе и хронической туберкулезной интоксикации; сопровождается характерным фиброзированием узлов («железы-камушки»).
Диагностика лимфаденита у детей
Диагностика лимфаденита у детей включает тщательный физикальный осмотр, оценку клинической картины и анамнеза заболевания, исследование клинического анализа крови, УЗИ лимфатических узлов и ряд дополнительных дифференциально-диагностических исследований. Выявление лимфаденита у детей может потребовать обследования у врачей различных специальностей: педиатра, инфекциониста, детского отоларинголога, гематолога, хирурга, фтизиатра.
В ходе диагностики необходимо установить этиологию лимфаденита у детей, выявить первичный очаг гнойного воспаления. Вспомогательными методами выявления туберкулезного лимфаденита у детей служат туберкулиновые пробы, рентгенография грудной клетки, диагностическая пункция и бактериологический посев материала. При подозрении на онкологический процесс выполняетсябиопсия лимфатических узлов с цитологическим и гистологическим исследованием ткани.
Дифференциальная диагностика лимфаденитов различной локализации у детей проводится с опухолями слюнных желез, метастазами злокачественных новообразований, флегмоной, ущемленной паховой грыжей, остеомиелитом, системными заболеваниями (саркоидоз, лейкоз), диффузными заболеваниями соединительной ткани (ювенильный ревматоидный артрит, системная красная волчанка,дерматомиозит).
Лечение лимфаденита у детей
Лечение лимфаденита у детей определяется стадией, типом заболевания, степенью интоксикации и направлено на купирование инфекционно-воспалительных процессов в лимфоузлах и устранение первичного очага инфекции.
При остром серозном и хроническом неспецифическом лимфадените у детей применяют консервативную терапию, включающую антибиотики (цефалоспорины, полусинтетические пенициллины, макролиды), десенсибилизирующие средства, местное лечение (сухое тепло, компрессы с мазью Вишневского, УВЧ). Показаны общеукрепляющие препараты – кальция глюконат, аскорутин, витамины, иммуностимуляторы.
При отсутствии эффекта терапии или переходе лимфаденита в гнойную стадию, ребенка госпитализируют и проводят экстренное вскрытие, дренирование и санацию гнойного очага. В случае некротического лимфаденита у детей выполняют тщательный кюретаж полости, при необходимости производят удаление лимфоузла. В послеоперационном периоде показана комплексная противовоспалительная и дезинтоксикационная терапия. Лечение специфического туберкулезного лимфаденита у детей проводят в специализированных лечебных учреждениях.
Прогноз и профилактика лимфаденита у детей
Прогноз лимфаденита у детей при своевременном адекватном лечении – благоприятный, при длительном хроническом течении возможно замещение лимфоидной ткани на соединительную; иногда в области пораженных лимфоузлов развивается нарушение лимфооттока (лимфостаз).
Предупреждение лимфаденита у детей заключается в устранении источников хронической инфекции, своевременном лечении зубов, травматических и гнойных поражений кожи и слизистых оболочек, повышении общей и местной сопротивляемости организма.
3 Переломы в области локтевого сустава. Методы консервативного и оперативного лечения.
Перелом локтевого сустава – патологическое состояние, вызванное переломом одной из кости, участвующей в образовании сустава. Ввиду особенностей анатомического строения, переломы локтевого сустава также классифицируются. Различают следующие виды:
1) Перелом локтевого отростка
2) Перелом надмыщелков плеча
3) Внутрисуставной перелом одной из костей
Несмотря на анатомическую разобщенность указанных образований, все они входят в собирательное понятие перелома локтевого сустава. Следует сказать, что перелом локтя бывает открытым и закрытым. Последний в 90% случаев протекает намного благоприятнее.
Причины
Перелом локтевого сустава сопровождается применением сильного механического воздействия, приводящего к разрушению костной ткани. Однако, если у пациента имеется остеопороз (размягчение) локтевого сустава, интенсивность той самой силой требуется уже не столь сильной. Это означает, что перелом может случиться не только от падения с большой высоты, дорожно-транспортного происшествия и много другого, но и при банальном легком бытовом ударе, например, об угол стола. Перелом локтя описан и спонтанный, когда тяжелая степень остеопороза привела практически к полной резорбции костной ткани. В настоящее время проблемы остеопороза в свете открытия новых замещающих фармакологических препаратов обсуждаются в научных кругах, и, очевидно, если человечество и не удастся в обозримом будущем избавить от этого недуга, его последствия будут контролироваться врачами. Следует сказать, что лечение перелома локтя, вызванного остеопорозом, или осложняющимся им проводить крайне затруднительно, и если хирургическая операция не потребуется, медикаментозная нагрузка будет сильнее выражена, чего стоит ожидать пациенту.
Симптомы
Симптомы перелома локтевого сустава просты, визуально видны, но требуют дифференциального подхода в ряде случаев. Боль – частый спутник всех патологических состояний в травматологии, не исключением будет и при переломе локтя. Отечность тканей наступает также в ближайшие минуты с момента травмы. Принципиальное значение имеет кровоснабжение в месте, ниже участка перелома кости. Анатомическая близость кости и сосудисто-нервного пучка с одной стороны служит защитным фактором, с другой при переломе последнего дополнительно травмирует и его. Важно нащупать пульс, что укажет на некоторое сохранение кровотока, и как следствие, отсутствие к срочной операции. Лечение перелома локтевого сустава при травмировании сосудов или нервов проводится только оперативным путем по жизненным показаниям, об этом необходимо помнить. Диагноз подтверждается рентгенологически, после чего приступают к комплексу лечебных мероприятий.
Основными принципами лечения переломов локтевого сустава являются:
точная репозиция отломков;
прочная Фиксация;
ранняя функция.
За последние годы при лечении переломов костей локтевого сустава в нашей стране, да и за рубежом, широко применяется метод чрескостного остеосинтеза аппаратами внешней фиксации, который позволяет успешно репонировать отломки костей, прочно их фиксировать и начать раннюю лечебную гимнастику. В настоящее время признается приоритет оперативных методов лечения переломов костей локтевого сустава над консервативными. В случае обширных повреждений костные отломки фиксируют с помощью спиц аппарата Илизарова или стержневого аппарата. Это делают для того, чтобы мягкие ткани заживали перед окончательной оперативной фиксацией перелома. В таком случае риск инфекционных осложнений и ампутаций конечности меньше.
Консервативная терапия Перелом локтевого отростка без смещения обычно требует консервативного лечения. Первые 6 дней после травмы отек может нарастать и сохраняться, поэтому накладывается задняя гипсовая лонгетная повязка в положении сгибания предплечья в локтевом суставе под углом 80-90 градусов (см. рисунок ниже). Повязка должна быть от верхней трети плечевой кости, до лучезапястного сустава, при этом предплечье должно быть в положении супинации (ладонью вверх). Иммобилизация руки в косыночной повязке продолжается 3 недели с момента травмы. Иммобилизацию можно продолжить в лонгете, периодически снимая её для разработки локтевого сустава. Либо заменить гипс на ортез жесткой фиксации с регулировкой амплитуды движений. Может возникнуть перелом головки и шейки лучевой кости. Такие переломы руки в локтевом суставе возможны как со смещением, так и без смещения. Следует сказать, что возможные смещения костных отломков создают препятствие для врачей, и лечение перелома локтевого сустава затягивается, т.е. приходится госпитализировать таких пациентов в стационар на неделю как минимум. Оперативная терапия Перелом локтевого отростка, имеющий выраженное смещение осколков, требует обязательного оперативного вмешательства хирурга-травматолога. Иначе предплечье не будет полностью разгибаться, это серьезное нарушение функции верхней конечности. Успех операции зависит от точного сопоставления костных отломков и их фиксации в правильном анатомическом положении. А в дальнейшем успех зависит от правильной разработки локтевого сустава. Но чаще операция необходима.Лечение перелома локтевого сустава проводится различными хирургическими доступами, в зависимости от локализации перелома. Пациенту при этом дается общий наркоз.
При простом переломе проксимального конца локтевой кости лечение перелома локтя сводится к стягиванию кости при помощи проволочной петли, сделав перед этим репозицию кости спицами Киршнера или без них.
Если произошел внутрисуставной перелом локтевого сустава и образовались осколки, то репозицию локтевой кости произвести наиболее трудно. В таком случае прибегают к костной пластике. При оскольчатых переломах нельзя произвести стягивание проволочной петлей, иначе укоротятся суставные поверхности, тогда используют специальные динамические компрессирующие пластины.
Клиновидный перелом локтевого сустава со смещением головки лучевой кости анатомически сопоставляют, особенно при смещении суставной поверхности «ступенькой», больше 2 мм. А так же бывают смещения части суставной поверхности более чем на треть сечения головки в поперечнике. Если капсула перелома не повреждена, ее вторичное растяжение в результате гематомы вызывает очень сильную боль. Значит экссудат из сустава нужно срочно эвакуировать. Для остеосинтеза применяют набор винтов малых размеров, а при латеральном доступе по Koher обеспечивают адекватное обнажение зоны перелома.
Если переломы суставной части плечевой кости имеют характер раздробления, то хирург может произвести замещение локтевого сустава протезом. Такой перелом локтевого сустава с раздроблением чаще встречается у пожилых пациентов. Имплантанты делают из металла и пластика и крепятся специальным костным цементом. Перелом локтевого сустава после оперативного лечения может осложниться повреждением локтевого нерва. Происходит это сравнительно редко и функция нервов чаще восстанавливается почти полностью. Наилучшим методом лечения внутрисуставного перелома локтевого отростка, позволяющим сохранить движения в суставе – это остеосинтез (устранение смещения и фиксация отломков металлоконструкцией). В случае оскольчатого перелома со смещением и отрыве верхушки отростка локтевой кости, выполняют фиксацию осколков специальной титановой конструкцией, восстанавливая целость локтевого отростка и суставной поверхности локтевой кости. Итак, лечение перелома локтевого отростка, с учетом характера повреждения, заключается в следующем:
восстановление разрушенного участка локтевого сустава;
фиксация положения травмированного участка, пока не произойдет сращение.
Для фиксации травмированной кости используют следующие методы:
ортез или гипсовая повязка (лонгет);
титановая пластина с винтами для фиксации (операция);
винты без дополнительного удерживающего элемента (операция);
фиксация спицами и стягивающей петлей (остеосинтез по Веберу).
Билет №39
Динамическая кишечная непроходимость. Клиника, диагностика, лечение. Дифференциальная диагностика.
Динамическая кишечная непроходимость
Динамическая кишечная непроходимость встречается у 4—10% больных острой кишечной непроходимостью. Различают спастическую и паралитическую ее формы.
Классификация
По морфофункциональным признакам:
Динамическая (функциональная) кишечная непроходимость — нарушена двигательная функция кишечной стенки без механического препятствия для продвижения кишечного содержимого:
Паралитическая кишечная непроходимость (в результате снижения тонуса миоцитов кишок);
Спастическая кишечная непроходимость (в результате повышения тонуса); Клиническая картина Спастическая форма динамической кишечной непроходимости встречается значительно реже паралитической. Спазмы кишечника могут продолжаться от нескольких часов до нескольких дней. Больные жалуются на сильные схваткообразные боли в брюшной полости, иногда отмечаются повторные рвоты желудочным содержимым. Состояние больных остается удовлетворительным, без нарушений сердечно-сосудистой деятельности и дыхания. Язык влажный, живот обычной конфигурации, мягкий, безболезненный, симптом Щетки-на—Блюмберга отрицательный. При пальпации иногда удается прощупать спазмированный участок кишечника, При аускультации выслушиваются обычные кишечные шумы. Стул может быть задержан, газы отходят свободно. Мочеиспускание не нарушено. Анализы крови и мочи нормальные. При обзорном рентгенологическом исследовании брюшной полости изменений не отмечается. Спастическая кишечная непроходимость может возникать на почве травм брюшной полости, заболеваний нервной системы, гиповитаминоза, глистной инвазии, она может быть алиментарного происхождения (переедание, прием грубой пищи и др.). Для спастической кишечной непроходимости, в отличие от механической, не характерны тяжелые нарушения общего состояния, сердечно-сосудистой деятельности, отсутствуют вздутие живота, усиленная перистальтика, симптомы раздражения брюшины. Большое значение имеет рентгенологическое исследование. При спастической кишечной непроходимости отсутствуют чаши Клойбера, характерные для механических ее форм. Паралитическая кишечная непроходимость характеризуется равномерным вздутием брюшной полости, сопровождающимся периодическими рвотами желудочным, а затем кишечным содержимым, задержкой стула и газов. Больные жалуются на разлитые боли и вздутие живота, задержку стула и газов. Состояние больных ухудшается постепенно ввиду пареза кишечника. Отмечаются повторные рвоты вначале принятой пищей, затем — содержимым тонкого кишечника. Дыхание грудного типа, учащенное, отмечается умеренная тахикардия. При нарастании симптомов непроходимости отмечаются резкая тахикардия до 130—140 ударов в минуту, гипотония. Живот вздут, при аускультации перистальтика вялая или полностью отсутствует. При пальпации в начальных стадиях живот мягкий, безболезненный. При прогрессировании заболевания и развитии перитонита отмечаются напряжение мышц, положительный симптом Щеткина—Блюмберга и нарастание симптомов паралитической кишечной непроходимости. Паралитическая кишечная непроходимость развивается после переедания и приема неудобоваримой пищи, при повреждениях органов брюшной полости и забрюшинного пространства, при нарушении кровоснабжения кишечника и особенно часто — после операций на органах брюшной полости и при перитонитах. Лечение динамической кишечной непроходимости Лечение спастической формы динамической кишечной непроходимости консервативное. Больным назначают двустороннюю поясничную блокаду 0,25%-ным раствором новокаина по Вишневскому, введение 1 мл 0,1%-ного раствора атропина, тепло на живот и теплые ванны. Лечение паралитической формы динамической кишечной непроходимости должно быть направлено на ликвидацию основного заболевания. Необходимо, прежде всего, исключить острые хирургические заболевания и повреждения органов брюшной полости (острый аппендицит, внутренние ущемления, перфорации гастродуоде-нальных язв, острый панкреатит, тромбоз брыжеечных сосудов и др.), требующие срочного хирургического вмешательства. Паралитическая кишечная непроходимость подлежит консервативному лечению с применением двусторонних поясничных блокад по Вишневскому, постоянного отсасывания содержимого желудка и повторных сифонных клизм. Положительный эффект у ряда больных отмечается после внутривенных введений 5—10%-ного раствора хлористого натрия в количестве 50—100 мл, при сохранении перистальтики назначают 1 мл 0,05%-ный раствор прозерина или питуитрина. При наличии симптомов перитонита показано срочное хирургическое вмешательство. При наличии гангрены кишки производят резекцию в пределах здоровых тканей, у очень тяжелых больных может быть применена резекция омертвевшей кишечной петли с наложением калового свища.
Дифференциальная диагностика
Перфорация полого органаОстрый аппендицитОстрый панкреатитПеритонитОстрый синдром приводящей петли (с резекцией желудка по Бильрот-2 в анамнезе) Почечная коликаПневмония (нижнедолевая) Плеврит
Ишемическая болезнь сердца (острый инфаркт миокарда, стенокардия)
2 Омфалиты у детей. Этиология. Классификация. Клинические проявления. Диагностика. Консервативное и оперативное лечение. Возможные осложнения.
Омфалит — это воспаление кожи и подкожной клетчатки в области пупочной ранки у новорожденного. Возникает на 2-3 недели жизни младенца. Возбудителями заболевания чаще всего являются стафилококки, стрептококки, кишечная палочка.ти
Симптомы омфалита
Общие симптомы омфалита:повышение температуры тела;плаксивость;ребенок ведет себя беспокойно, а в тяжелых случаях, наоборот, отличается вялостью;плохойаппетит;уменьшение прибавки веса.
Местные проявления:
отделяемое из ранки различного цвета (от светлого до темно-желтого, иногда с примесью крови);
покраснение (гиперемия) пупочного кольца;
местное повышение температуры кожи вокруг пупка (кожа горячая на ощупь);
отечность кожи вокруг пупка;
красные полосы (при присоединении воспаления лимфатических сосудов).
Формы
Простая (катаральная) форма или мокнущий пупок:
самый частый вариант омфалита;
характеризуется наличием светлого (катарального) отделяемого, редко с примесью крови и легким покраснением кожи пупка;
протекает без осложнений;
быстрые сроки выздоровления;
лечение ограничивается местными мероприятиями.
Гнойная форма:
цвет мокнущей поверхности более темный (от светло-желтого до коричневого), имеет неприятный запах,вязкуюконсистенцию;покраснение кожи в области пупка более выражено;появляется субфебрильная температура тела (до 38° С);ребенок становится плаксив, у него пропадает аппетит;кроме местного лечения применяются антибактериальные препараты системного действия;
более длительные сроки выздоровления.
Флегмонозная форма:общее состояние ребенка – тяжелое;температура тела до 39° С и выше;ребенок отказывается от груди;пупочная ранка представляет собой язву, прикрытую кожной складкой, подкоторой скапливается гной;возможно развитие осложнений в виде распространения инфекции на окружающиеткани;комбинированное лечение с применением местных и системных средств.
Некротическая форма:
характеризуется омертвлением (некрозом) инфицированных тканей;возникает при позднем обращении за медицинской помощью;часто осложняется воспалением околопупочных сосудов;большая распространенность процесса определяет тяжелое общее самочувствие ребенка.
Причины
Омфалит возникает вследствие попадания инфекции в еще не затянувшуюся пупочную ранку.
Возникновению омфалита способствуют:нарушения гигиенических требований по уходу за пупочной ранкой (не ежедневная обработка ранки, ее загрязнение растворами с антисептиком);преждевременные роды матери, ослабленный организм ребенка;наличие внутриутробной инфекции;наличие других инфекционных заболеваний у новорожденного (например, пиодермия – гнойничковое заболевание кожи,фолликулит – инфекционное воспаление волосяного фолликула (корня волоса)).
Диагностика
Диагностика заболевания не представляет трудностей и основывается на характерных местных признаках заболевания (наличие отделяемого из пупочной ранки, покраснение кожи вокруг нее).
При развитии гнойной, флегмонозной или некротической форм возможны воспалительные изменения в общем анализе крови (повышение уровня лейкоцитов и СОЭ).
При неэффективности назначенного лечения проводится исследование – посев отделяемого из пупка с определением чувствительности микроорганизмов к антибиотикам (в зависимости от его результатов подбирается другой антибиотик).
Дополнительные исследования проводятся при возникновении осложнений:
УЗИ брюшной полости (при подозрении на перитонит (воспаление брюшной полости));
УЗИ мягких тканей (при подозрении на флегмону брюшной стенки – гнойное воспаление подкожной клетчатки).
Лечение омфалита
Объем лечебных мероприятий напрямую зависит от формы омфалита. Больные дети с флегмонозной и некротической формами должны лечиться в условиях стационара. Местное лечение:
заключается в удалении отделяемого и обработки пупочной ранки антисептическими растворами (спиртовым раствором, бриллиантовым зеленым (зеленка) или раствором йода);
в случае гнойной формы местно назначаются антибактериальные мази, а также применяется дренирование раны (установка в рану специальной трубки для оттока гноя наружу с ее помощью);
иссечение (удаление хирургическим путем) « мертвых» (некротизированных) тканей;
применяется также физиолечение (УФО – ультрафиолетовое облучение, УВЧ – ультравысокочастоная терапия).
Системное лечение:
антибиотики (преимущественно с широким спектром активности, в тяжелых случаях возможно назначение нескольких препаратов);витаминотерапия (витамин А, витамин С, витамины группы В);
в тяжелых случаях – внутривенное введение растворов глюкозы в целях снижения интоксикации (токсического влияния на организм инфекции);средства, повышающие иммунитет.
Осложнения и последствия
Прогноз заболевания при своевременном обращении за медицинской помощью благоприятный (выздоровление). Длительность заболевания и возможные осложнения напрямую зависят от формы омфалита:
простая форма омфалита – легко поддается лечению, протекает без осложнений;
при лечении гнойного омфалита осложнений не возникает, несколько увеличивается длительность заболевания;
флегмонозная и некротическая формы часто протекают с осложнениями.
Если лечение любой (в том числе простой) формы омфалита проводится без контроля врача, вероятность развития осложнений резко повышается. Могут возникнуть следующие осложнения.
Воспаление околопупочных лимфатических сосудов (лимфангит).Воспаление артерий и вен (артериит, флебит).Воспаление костей (остеомиелит).Воспаление кишечника (энтероколит).Флегмонозная и некротическая формы могут давать следующие осложнения:
скопление гноя (флегмона) в брюшной стенке;воспаление брюшной полости (перитонит);попадание микроорганизмов в кровь в большом количестве (сепсис);гнойные очаги (абсцессы) внутренних органов;
при затянувшемся заживлении пупочной ранки разрастание грануляционной (соединительной) ткани образует небольшую опухоль – гриб пупка (fungusumbilici).
Профилактика омфалита
После рождения ребенка пупочную ранку необходимо:ежедневно обрабатывать до полного ее заживления;сначала ранка обрабатывается 3% раствором перекиси водорода, затем сухую ранкуобрабатывают 2% раствором бриллиантовой зелени (зеленкой) или спиртом;частота обработки — 3-4 раза в сутки;если из ранки появляется гнойное (отличается желтым цветом, зловонным запахом и вязкой консистенцией) или с примесью крови отделяемое, необходимо сразу обратиться к врачу.
Переломы костей таза у детей. Классификация. Клиника. Диагностика. Лечение.
Классификация переломов костей таза
Переломы костей таза составляют 4-7% всех переломов костей и относятся к тяжелым травмам костного аппарата. Наиболее уязвимым местом является передний отдел тазового кольца. Задние отделы тазового кольца, благодаря хорошо развитому связочному аппарату и выраженным костным массивам, более устойчивы к повреждениям. Сравнительно редко переломы возникают вследствие прямой травмы или падения. Чаще -это следствие сдавлении тазового кольца в переднезаднем или поперечном направлении. На сегоднешний день существует следующая классификация переломов костей таза:
В зависимости от локализации и степени повреждения тазового кольца различают:
1. Краевые переломы костей таза.
Перелом крыла подвздошной кости
Переломы верхней передней и нижней передней ости
Перелом седалищного бугра
Перелом крестца
Перелом копчик
2. Переломы костей таза без нарушения непрерывности тазового кольца.
Перелом лобковой кости
Перелом седалищной кости
3. Переломы костей таза с нарушением непрерывности тазового кольца (в переднем отделе, заднем отделе, в переднем и заднем отделах).
Односторонние переломы
Двусторонние переломы
Разрывы лобкового симфиза
Вертикальные переломы крестца и подвздошной кости (задний отдел)
Перелом Мальгеня
Перелом Воллюмье
4. Переломы вертлужной впадины.
Переломы подвздошной кости, проникающие в вертлужную впадину;
Переломы подвздошной кости на уровне вертлужной впадины с внедрением головки бедренной кости между фрагментами;
Переломы ямки вертлужной впадины (У-образного хряща у детей) без смещения бедра и со смещением бедра в полость сустава(центральный вывих бедра);
Перелом верхнезаднего края вертлужной впадины без вывиха и с вывихом бедра
5. Переломы костей таза с повреждением тазовых органов.
Внебрюшинные разрывы мочевого пузыря
Внутрибрюшинные разрывы мочевого пузыря
Повреждения уретры
Диагностика
Установление точного диагноза возможно благодаря проведению рентгенологического исследования. В случае получения серьезной травмы, ни в коем случае не должна быть выжидательная тактика. Есть необходимость в проведении лапароцентеза, а также лапароскопии, диагностическая лапаротомия (это исследование проводится крайне редко).
Если же у специалиста возникают сомнения относительно правильности поставленного диагноза и при наличии подозрений повреждения внутренних органов, есть необходимость в проведении МРТ, компьютерной томографии, микционной цистографии.
Профилактика
В основе профилактики образования перелома костей таза, лежит избежание получения различных видов травм, которые способны привести к его появлению.
Лечение
В том случае, если была получена довольно тяжелая травма, в обязательном порядке, на месте будут проводиться все необходимые противошоковые мероприятия – это и применение обезболивания, а также возмещение кровопотери (путем вливания внутривенно растворов), и конечно, иммобилизация самого перелома.
Больного укладывают с разведенными ногами, при этом под колени помещается валик, который может быть сделан из любых подручных материалов. Применяются обезболивающие препараты. В очень тяжелых травмах делается специальный лечебный наркоз.
На сегодняшний день наиболее эффективным методом лечение непосредственно самого перелома костей таза является иммобилизация. В зависимости от степени и обширности повреждения, а также от целостности тазового кольца и будет определяться вид и продолжительность иммобилизации.
Если диагностирован перелом первой группы фиксация будет проводиться на щите либо в гамаке, значительно реже применяются специализированные шины Белера либо валики подколенной и коленной области. Есть необходимость в наложении скелетного вытяжения в том случае, если произошло нарушение целостности самого тазового кольца.
В том случае, если при переломе костей таза происходит и повреждение внутритазовых органов, образовалось расхождение лонных костей либо не дает эффективности проводимое консервативное положение обломков, при условии их смещения, тогда есть необходимость в незамедлительном хирургическом вмешательстве, так как появляется серьезный риск для жизни больного.
БИЛЕТ №40
Классификация низкой кишечной непроходимости. Клиника, диагностика.
Низкая кишечная непроходимость проявляется позднее и протекает вначале менее бурно. При врожденной непроходимости рвота появляется не сразу после рождения, а через 2—3 суток, при приобретенной — тоже через определенное время (через несколько часов или суток в зависимости от характера причины нарушения пассажа). У новорожденных рвота не связана с кормлением. Рвотные массы содержат примесь желчи, но со временем они принимают каловый характер; меконий, кал и газы не отходят. Беспокойство ребенка быстро нарастает, общее состояние стремительно ухудшается. Живот вздут равномерно как в верхней, так и в нижней части. После обильной рвоты его размеры несколько уменьшаются (в эпигастральной области). Через растянутую брюшную стенку видны очертания вздутых петель кишечника, вначале с усиленными волнами перистальтики, затихающими по мере нарастания пареза кишечника. Перкуторно выявляется тимпанит, при аускультации — вначале усиленные шумы перистальтики («с перелишанием»), ослабляющиеся и затухающие по мере нарастания пареза кишечника. Пальпация живота болезненна, ребенок на нее реагирует беспокойством, плачем, отталкиванием руки врача, болевой реакцией. Ценные указания может дать ректальное бимануальное исследование. Выявляется колбасовидная подвижная переполненная и растянутая подвздошная плп толстая кишка, иногда сдавливающее новообразование. Конечный отдел кишечника п ампула прямой кишки пустые, за пальцем отходит лишь слизь в небольшом количестве. Уточнить диагноз помогают данные рентгенологического обследования. Рентгенодиагностика острой кишечной непроходимости обычно осуществляется с помощью обзорного исследования, без введения контрастного вещества. При непроходимости кишечника в петлях кишечника над. местом непроходимости скапливаются газы и жидкость. Если ширина уровня жидкости больше высоты газового пузыря в петле раздутой кишки, то это так называемый спмптом, или чаша, Клойбера. Когда петля тонкой кишки содержит больше газа, чем жидкости, то виден симптом арки. Они появляются через 2—4 часа после начала непроходимости. Следствием непроходимости тонкого кишечника является полное отсутствие или незначительное количество газа в толстой кишке. При высокой непроходимости в желудке и в двенадцатиперстной кишке видны два газовых пузыря с горизонтальными уровнями жидкости, выше и больше слева — в желудке, ниже и в середине — в растянутой двенадцатиперстной кишке. Разница расположения уровней как в передне-задней, так и в боковой проекции. В дистальных отделах кпшечника при полной врожденной непроходимости газа не бывает, при частичной — видны небольшие и немногочисленные пузыри газа. При низкой кишечной непроходимости рентгенологически выявляются раздутые петлпкпшечника с газовыми пузырями разного размера и количества и с уровнями в них. При непроходимости подвздошной кишки пузыри широкие, располагаются поперечно, а при локализации препятствия в толстой кишке пузыри множественные, неравномерные, с горизонтальными уровнями. При ущемлении или завороте тонкого кишечника заполненные жидкостью петли кишки дают опухолевидную тень с полициклическим контуром. Рентгенологически можно выявить смещение желудка, толстой кишки, мочевого пузыря и мочеточников, наступившее в результате давления переполненных петель кишечника. Исследование лапароскопией позволяет определить место фиксации кишечных петель при перегибах, ущемлении, завороте, узлообразовании (Н. К. Симагина).
2 Противошоковые мероприятия при осложненных переломах костей таза.
Лечениепереломовтаза
Posted on 08.07.2013 by medcm
Шок и кровопотеря при переломах таза. Раздражение нервных сплетений, узлов и нервных окончаний столь богатой этими образованиями области таза и боль при этом являются основными факторами патогенеза при переломах таза. Как уже было указано, при переломах таза, особенно множественных, в забрюшинное пространство истекает большое количество, 1-2 л и более, крови (В. Ф. Пожариский, 1972, и др.). В связи с этим шок при сложных переломах таза протекает на фоне кровопотери, в результате чего развивается анемия, еще больше снижается артериальное давление и учащается пульс.
В комплексном лечении шока при переломах таза в связи с большой кровопотерей ведущая роль принадлежит гемотрансфузионной терапии. При переломах костей таза, сопровождающихся медленным и продолжительным кровотечением, редко развивается шок III-IV степени, и в комплексе лечения достаточно струйно-капельного переливания 1500-2000 мл крови. При шоке III-IV степени в ряде случаев даже быстрое (в течение 10-20 мин) переливание 2000-3000 мл крови может оказаться безрезультатным, очевидно, в связи с профузным кровотечением в забрюшинное пространство. Борьба с шоком должна начаться как можно раньше и проводиться комплексно.
Помимо обычных мероприятий, в борьбе с шоком приобретают особое значение внутритазовая анестезия, предложенная Л. Г. Школьниковым, В. П. Селивановым, В. М. Цодыксом (1966), и переливание крови для возмещения столь большой потери, которая наблюдается при множественных переломах таза. В основу внутритазовой анестезии при переломах таза положены теоретические обоснования новокаиновой блокады по А. В. Вишневскому. При внутритазовой анестезии раствор новокаина вводится в ложе подвздошной мышцы и распространяется по фасциальным пространствам таза и по каналу пояснично-подвздошной мышцы. Таким образом блокируются внутритазовые нервные сплетения, узлы, нервные окончания.
Внутритазовая анестезия при переломах костей таза по Школьникову — Селиванову — Цодыксу. Авторы разработали следующие показания и технику анестезии. Внутритазовая анестезия показана при переломах костей таза, особенно множественных и переломах заднего полукольца. При переломах копчика обезболивающий эффект менее выражен. Повреждение тазовых органов не является противопоказанием к анестезии. При открытых переломах и переломах с повреждением тазовых органов к вводимому раствору новокаина рекомендуется добавлять антибиотики.
Положение больного на спине. Волосы на лобке сбривают. Кожу в области передневерхней ости подвздошной кости широко смазывают спиртовым раствором йода. В кожу брюшной стенки на 1 см кнутри от передневерхней ости подвздошной кости вводят 1-2 мл 0,25% раствора новокаина. Иглу длиной 14-15 см, насаженную на шприц с новокаином, вкалывают через анестезированный участок кожи под ость спереди назад срезом к внутренней поверхности подвздошной кости. Вводя раствор новокаина, врач продвигает иглу кзади на глубину 12-14 см. При продвижении иглы все время должна ощущаться близость подвздошной кости. При выполнении указанной методики конец иглы оказывается во внутренней подвздошной ямке, куда вводят 300-600 мл 0,25% раствора новокаина.
При одностороннем переломе раствор новокаина вводится на стороне перелома в количестве 400-500 мл. При двустороннем переломе новокаин следует вводить по 250-300 мл с каждой стороны. При нагнетании раствора в полость таза вытекающий из павильона иглы раствор (при снятии шприца) может приобретать розовую окраску от примеси крови из гематомы или разорванных мелких кровеносных сосудов.
Однократного введения раствора новокаина по предлагаемой методике обычно достаточно для получения обезболивающего эффекта на весь период лечения. В редких случаях спустя несколько дней после анестезии могут возобновляться боли в местах перелома, менее интенсивные, чем вначале. В этих случаях анестезию рекомендуется повторить. При проведении анестезии по указанной методике может встретиться осложнение, связанное с непереносимостью новокаина, интоксикацией (побледнение, учащение пульса, головокружение). В этих случаях анестезию следует прекратить и ввести 1-2 мл 10% раствора кофеина. Для профилактики подобного осложнения к раствору новокаина следует добавлять 1 мл 1 % раствора эфедрина.
Внутрикостная анестезия таза. И. Г. Герцен и М. А. Тамаркин (1969) пользуются этим методом при лечении переломов таза. В гребень подвздошной кости на стороне повреждения медленно вводят 50-80 мл 0,5% раствора новокаина. При двусторонних и вертикальных переломах таза анестезию производят с обеих сторон. Игла, введенная в гребень подвздошной кости, используется при необходимости для повторных вливаний новокаина в целях получения стойкого противошокового эффекта, а также для вливания различных лекарственных веществ, противошоковых жидкостей и переливания крови.
В. А. Поляков и Б. В. Сахаров (1968) при переломах таза для борьбы с болью и тем самым с шоком применяют пролонгированную тазовую внутрикостную блокаду, используя 10 мл 5% раствора новокаина, тщательного перемешанного с 90 мл желатиноля. В обе подвздошные кости вводят по 50 мл раствора, который оказывает также гемостатическое действие. После внутритазовой анестезии, если нет противопоказаний (например, повреждение мочевого пузыря, мочеиспускательного канала, внутренних органов и т. п.), следует наложить скелетное вытяжение. Вытяжение как иммобилизующий фактор на этом этапе также служит важным противошоковым мероприятием. Чрезвычайно важно одновременно производить переливание крови в целях борьбы с шоком и восполнения потерянной крови.
Мастит и мастопатия новорожденных. Клиника. Диагностика. Лечение.
Гнойный мастит новорожденных
...или:Воспаление грудных желез новорожденного
Гнойный мастит новорожденных — это воспаление грудных желез у новорожденного, которое протекает с их увеличением, покраснением, резкой болезненностью, ухудшением самочувствия ребенка. Причиной является плохой уход за новорожденным, попадание грязи в грудную железу, а также попытки лечения симптомов полового криза (растирание грудных желез, различные компрессы, “ выдавливание” жидкости из желез). Половой криз — физиологическое состояние новорожденного, связанное с выбросом большого количества половых гормонов в результате адаптации ребенка к условиям внеутробной жизни, одним из симптомов является увеличение грудных желез и выделение из них белесоватой жидкости. При мастите чаще всего поражается только одна железа (левая или правая). Встречается у девочек и мальчиков.
ДетиСимптомы гнойного мастита новорожденных
Увеличение в размере грудных желез.Покраснение грудных желез.Грудные железы горячие на ощупь.При прикосновении к грудным железам ребенок резко становится беспокойным, начинает плакать(из-за резкой болезненности).Возможно выделение гноя из грудных желез при надавливании на них или самопроизвольно.Общее состояние ребенка ухудшается — ребенок беспокойный, плаксивый.
Возможно повышение температуры тела (от 37,5° С до 40° С).Снижение аппетита.На фоне повышения температуры (выше 39° С) возможны судороги и рвота.При надавливании на грудную железу может ощущаться движение жидкости под кожей (гной).
Причины
Причиной возникновения мастита новорожденных является попадание в грудную (молочную) железу инфекции (стафилококков, стрептококков и др. бактерий). Происходит это в большинстве случаев в первый месяц жизни ребенка, на фоне симптомов полового криза новорожденного (физиологическое состояние новорожденного, связанное с выбросом большого количества половых гормонов в результате адаптации ребенка к условиям внеутробной жизни, одним из симптомов является увеличение грудных желез и выделение из них белесоватой жидкости). Родители пытаются самостоятельно “ лечить” симптомы полового криза, выдавливать жидкость из желез, делать различные растирания, компрессы. Нежная кожа малыша травмируется, и в железы попадает инфекция.
Также заражение может происходить при ненадлежащем уходе за новорожденным (ребенка не купают, используют грязные пеленки, распашонки и т.п.).
Наиболее подвержены заболеванию новорожденные со сниженным иммунитетом — недоношенные, ослабленные (какими-либо другими фоновыми заболеваниями, например, с врожденным пороком сердца, малой массой тела (менее 2500 граммов)).
Диагностика
Диагностика основана на появлении вышеописанных симптомов (воспаление грудных желез, ухудшение самочувствия, повышение температуры тела) у детей первых трех месяцев жизни.
Для определения возбудителя инфекции и подбора рациональной антибиотикотерапии прибегают к посеву отделяемого из желез (гноя) с определением чувствительности к антибиотикам.
Возможна также консультация детского хирурга.
Лечение гнойного мастита новорожденных
При появлении симптомов мастита (увеличение, покраснение грудной (молочной) железы, повышение температуры тела, беспокойство ребенка) необходимо срочно обратиться к детскому хирургу. Лечение проводят в условиях стационара. Применяют:антибактериальнуютерапию;противовоспалительнуютерапию;местно — компрессы на пораженную железу;при отсутствии эффекта или запущенном мастите (своевременно ребенку не былаоказана помощь) прибегают к хирургическому лечению: воспаленную железу вскрывают и удаляютгной (дренируют);после операции используют рассасывающие мази и компрессы, физиолечение.
Осложнения и последствия
При отсутствии своевременного лечения возможно распространение инфекции на грудную клетку с образованием флегмоны (обширного гнойного воспаления кожи и подкожной жировой клетчатки), а в крайних случаях — сепсиса (“ заражение крови” — распространение инфекции через инфицированную кровь ко всем органам организма с формированием из воспаления пневмонии (воспаление легких), менингита (воспаление оболочек головного мозга) и пр.). Данные заболевания могут угрожать жизни ребенка.
У девочек при гнойном мастите могут закупориваться протоки молочной железы и/или отмирать ткань самой железы, что в будущем может негативно сказаться на выработке молока при кормлении ребенка (лактация).
Профилактика гнойного мастита новорожденных
Основной профилактикой развития гнойного мастита новорожденного является тщательный уход за ребенком с соблюдением правил гигиены:
ежедневно купать ребенка, менять пеленки, распашонки; использовать только чистое белье;
обязательно мыть руки перед тем, как прикоснуться к ребенку;
избегать контакта ребенка с людьми с простудными заболеваниями, ангинами и т.п., а также с гнойными ранами на теле.
При появлении у ребенка симптомов полового криза (физиологическое состояние новорожденного, связанное с выбросом большого количества половых гормонов в результате адаптации ребенка к условиям внеутробной жизни, одним из симптомов является увеличение грудных желез и выделение из них белесоватой жидкости) не пытаться самостоятельно лечить заболевание, а обратиться к педиатру.
Всячески избегать любого травмирования кожи и грудных желез малыша, а также попадания на них грязи.
41 билет
1. Варикоцеле — это варикозное расширение вен, образующих так называемое гроздевидное (лозовидное) сплетение яичка. Слово «варикоцеле» произошло от латинского «varix»-венозный узел и греческого «kele»-опухоль, что вместе можно трактовать как «опухоль» из венозных узлов. Варикоцеле возникает из-за увеличения давления в венах, образующих т.н. лозовидное сплетение яичка, что обычно связано с особенностями анатомического расположения этих вен. Чаще варикоцеле возникает слева из-за особенностей хода левой яичковой вены.
Среди факторов, способствующих развитию заболевания, следует упомянуть длительные интенсивные физические нагрузки, заболевания, при которых повышается внутрибрюшное давление, и тромбоз или сдавление почечных вен. Например, внезапное появление варикоцеле в пожилом возрасте встречается при раке почки.
Клиника. Очень редко выявляется у детей младшего возраста (2-5л)
3 степени
1. -расширение вен над яичком опред-ся пальпаторно только в вертик. положении при напряжении мышц
2- расшир и извитые вены четко видны через кожу мошонки (" с-м дождеых червей в мешке"), в гориз положении вены спадаются
3- на фоне визульно определяемого расширения вен на ощупь определяется тестоватость и уменьшение яичка
Часто жалоб нет. только в подростковом возрасте могут жаловаться на боль и тяжесть, чувство дискомфорта в левой половинке мошонки.
Лечение. Оперативное лечение. Перевязка яичковой вены в забрюшинным пространстве лапароскопической техникой и Эндоваскулярная склеротерапия яичковой вены после ее флебографии.
2. Рожистое воспаление. Рожа- острый серозно-воспалительный процесс кожи или слизистых оболочек. Возбудитель- В гемолит стрептококк. Вход ворота- поврежденные кожные покровы.
Появление на коже,чаще нижних конечностей,области лица медно-красной гиперемии с четкими границами фестончатой формы. Гиперемия имеет склонность к распространению. В области гиперемий чувство жжения, отечность и повышение температуры. Общее состояние нарушается, слабость, недомогание, повышение темп до 38-40С, редко- тошнота, рвота.
При рожистом воспалении на лице существует опасность распространения на глазницу и в полость черепа, что может вызвать атрофию зрительного нерва, менингит и тромбоз кавернозного синуса.
Лечение заключается в назначении АБ( бензилпенициллины,амоксициллин,макролиды, цефалоспорины 2 поколения) и местной физиотерапии ( УВЧ, УФО).
3.
42 Билет
1..Паховая грыжа представляет собой патологическое образование, возникающее при выходе какого-либо расположенного в области брюшины органа (большой сальник, кишечник, яичники) за пределы брюшной стенки через паховый канал. Паховая грыжа, симптомы которой проявляются в частности в форме опухолевидного выпячивания, локализованного в паховой области, а также в болевых ощущениях различной степени интенсивности, является самым распространенным вариантом образования грыж.
Паховая грыжа в пять раз чаще появляется у мужчин, чем, соответственно, у женщин. Помимо этого, такая грыжа – достаточно распространенная патология, отмечаемая в детском возрасте. В качестве слабого места, в котором происходит образование грыжи, выступает внутреннее паховое кольцо, представляющее собой заднюю стенку в паховом канале. Семенной канатик проходит у мужчин именно через нее, у женщин же здесь находится круглая маточная связка.
Положение и величина грыжевого мешка:
паховая грыжа, мешок которой расположен непосредственно в области пахового канала;
грыжа канатиковая пахово-мошоночная, опускающаяся в мошонку и не достигающая яичка;
грыжа яичковая пахово-мошоночная, опускающаяся в мошонку, достигая яичка, ее расположение может быть сосредоточено в его окружении.
Характер и место образования грыжи:
паховая грыжа прямая, проходящая через брюшную стенку, не затрагивающая паховый канал (возникает на фоне воздействия значительных физических нагрузок, также связана и со свойственной связочному аппарату слабостью);
паховая грыжа косая, проходящая сквозь паховый канал, который представляет собой естественное отверстие в организме, в норме заполненное сосудами яичек и семенным канатиком.
Причины возникновения: 1. паховая грыжа врожденная, возникающая по причине врожденного порока в развитии;
2. паховая грыжа приобретенная, которая преимущественно становится результатом комбинации таких факторов, как врожденная слабость, свойственная связочному аппарату, и чрезмерные физические нагрузки.
Относительно симптоматики, помимо характерного выпячивания, можно отметить и свойственную ему болезненность. В случае с паховой грыжей у мальчиков отмечается округлость ее формы, в то время как пахово-мошоночная грыжа имеет форму овальную. Если речь идет о последнем варианте развития грыжи, то здесь происходит опущение выпячивания к мошонке, что вызывает соответствующего вида растяжение, сосредоточенное в области одной стороны и приводящее к асимметрии. В основном отмечается постепенное нарастание характерных признаков ущемления. Паховая грыжа у ребенка, симптомы которой, помимо болезненности, также проявляются в беспокойстве и постоянном плаче, достаточно сильно выпячивается и приобретает твердость. В лежачем положении грыжевое выпячивание может значительно уменьшиться в собственных размерах, в некоторых случаях оно полностью исчезает. В вертикальном же положении, наоборот, грыжа появляется, увеличиваясь в размерах. В случае нажима на выпячивание нередко возможно его вправление, что сопровождается характерным урчанием. При кашле, попытках натужиться или при чихании отмечается, опять же, увеличение грыжи в размерах, также наблюдается усиление в ее напряжении – ощутить его можно при прикладывании к грыже руки. При опущении грыжи в мошонку отмечается увеличение размеров соответствующей этому опущению половины. Как правило, паховые грыжи дополнительной симптоматикой не сопровождаются. В некоторых случаях беспокоит вздутие живота и нарушение пищеварения.
2.Острый гематогенный остеомиелит. В зависимости от тяжести заболевания, скорости развития патологического процесса, распространенности его и других клинических факторов различают три формы острого гематогенного остеомиелита: токсическую, септикопиемическую и местную.
Токсическая форма, которая нередко обозначается как молниеносная, характеризуется преобладанием резко выраженной септической интоксикации, которая возникает с первых же часов от начала заболевания, очень быстро прогрессирует и приводит к летальным исходам в первые несколько суток. При этом локальные патологические изменения в костях и окружающих мягких тканях не успевают еще развиться.
Септикопиемическая форма, которая обозначается как тяжелая, характеризуется появлением очень быстро от начала заболевания нескольких гнойно-деструктивных очагов одновременно в нескольких костях. Нередко почти одновременно обнаруживаются абсцессы и в таких паренхиматозных органах, как легкие, печень, почки. Все это обусловливает очень тяжелое течение заболевания, которое нередко приводит к летальным исходам. Очень часто определяемая при этом бактериемия обусловливает появление новых остеомиелитических очагов.
Местная форма острого гематогенного остеомиелита по сравнению с двумя предыдущими формами протекает клинически легче: явления гнойной интоксикации выражены слабее, обычно выявляется один гнойно-деструктивный очаг в кости. Местные воспалительные изменения преобладают над общими проявлениями инфекционного заболевания и интоксикации. Эта форма остеомиелита часто переходит в хроническую стадию. Токсическая (молниеносная) форма встречается очень редко, у подавляющего большинства больных наблюдается местная форма гематогенного остеомиелита.
При местной форме по мере развития заболевания происходят следующие местные изменения: гнойный экссудат распространяется по двум направлениям: ло костномозговому каналу в диафизарную часть кости и через канал остеона, гаверсов канал — на поверхность кости. Происходит воспаление надкостницы, под которой нередко скапливается гной, вызывая ее отслойку. Гнойное I юс паление переходит на окружающие кость мягкие ткани, образуются флегмоны, а затем открываются наружные свищи. Нередко параоссальные флегмоны сопровождаются глубокими и распространенными гнойными затеками, открывающимися отдаленными от остеомиелитическо-ю очага гнойными свищами. Это особенно характерно для остеомиелита таза, позвоночника и бедра.
Острый гематогенный остеомиелит поражает в основном детей и подростков, мальчиков в 3—5 раз чаще, чем девочек. Заболевание начинается внезапно, но иногда отмечают небольшое недомогания за 1—2 дня до начала заболевания.
При выяснении анамнеза удается установить такие предрасполагающие факторы, как ушиб конечности, перенесенные в прошлом ангины, гнойным фарингит, наличие кариозных зубов, гнойных процесы (фурункулы, панариций, инфицированные раны и т.д.). Все это может быть источником инфекции при гематогенном остеомиелите.
При осмотре больного устанавливаются признаки гнойной интоксикации: вялость, адинамия, заторможенность, липкий пот, бледность кожи, учащенное дыхание, тахикардия до 110—120 ударов в 1 мин. Тоны сердца становятся глуше, появляется систолический шум. Нередко определяется увеличение селезенки и печени, отмечается рвота, парез кишечника, боль в области почек с положительным симптомом Пастернацкого.
В первые сутки заболевания при осмотре больного обращает внимание вынужденное (полусогнутое) положение пораженной конечности. Как активные, так и пассивные движения в ближайшем к очагу суставе резко ограничены из-за усиливающихся болей.
Для установления очага остеомиелита необходимо осторожное поколачивание над костью. Поколачивание в области пяточной кости выявляет болевой очаг по оси конечности. Появление резкой боли в одном из метаэпифизов указывает на локализацию острого гнойного воспа- ления в кости. В более поздние сроки заболевания над пораженной частью конечности кожные покровы становятся напряженными, инфильтрированными, а затем гипе- ремированными. При пальпации определяются инфильтрация мягких тканей, болезненность и местная гипертермия. При сравнительном измерении конечностей в симметрич- ных областях определяется увеличение окружности пораженной конечности, обусловленное нарастающим отеком.
Для острого гематогенного остеомиелита характерен лейкоцитоз до 20,0-109/л с увеличением количества ней-трофилов, СОЭ всегда повышена. Отмечается умеренное снижение уровня гемоглобина. Одновременно наступает диспротеинемия — уменьшение альбуминовой фракции белков сыворотки крови, возрастание уровня а г и а2-I лобулинов. Наблюдаются изменения в моче: следы белка, лейкоциты в осадке, цилиндры. При септикопиемиче-ской форме остеомиелита нередко определяется бактериурия.
Достоверные рентгенологические признаки остеомиелита обычно появляются не ранее чем через 10—14 дней с момента заболевания. С этого срока удается установить утолщение надкостницы, «размывание» архитектоники костной структуры с последующим образованием полости в кости. Наиболее ранним, но непостоянным рентгенологическим признаком острого остеомиелита является уплотнение тени мягких тканей, прилегающих к пораженной части кости.
Лечение- комплексное, обоснованное Краснобаевым. Основные принципы:
1. воздействие на макроорганизм
2. воздействие на возбудитель заболевания
3. своевременная и полноценная санация местного очага
Оптимальным хирургическим методом считается раннее декомпрессивное дренирование кости путем нанесения нескольких фрезевых отверстий в области остеомиелитического очага после рассечения мягких тканей. Через перфорационные каналы вводят дренажи во внутрикостный гнойник и осуществляют активную его санацию. Для этого используют вакуумирование или (чаще) длительное промывное дренирование растворами антисептиков (хлоргексидина, фурацилина, риванола и др.), которое продолжают не менее 7—10 су т и прекращают при ликвидации нагноительного процесса и улучшении общего состояния больного.Широкая трепанация кости при остром гематогенном остеомиелите не рекомендуется, так как создается большая опасность генерализации гнойного процесса— появление отдаленных септикопиемических метастазов.Консервативные лечебные методы включают антибиотикотерапию, иммунотерапию, дезинтоксикационные мероприятия, коррекцию обменных процессов и др. Антиби-отикотерапию целесообразно проводить остеотропными антибиотиками (линкомицин, морфоциклин, фузидин, ген-тамицин и др.). Наиболее эффективны внутрикостный и регионарный (внутриартериальный и внутривенный) пути их введения.Иммунотерапия включает в первую очередь лечение препаратами пассивной иммунизации (гипериммунная антистафилококковая плазма, стафилококковый гамма-глобулин), которое сочетают с применением стафилококкового анатоксина, бактериофага, препаратов неспецифической иммунотерапии (продигиозан, лизоцим, метилурацил и т. д.) и десенсибилизирующих средств.
Длительная инфузионная терапия в зависимости от целей включает применение различных препаратов: гемо-деза, реополиглюкина, белковых кровезаменителей, переливания крови, альбумина, протеина, плазмы и др.
3. Паропроктит- воспаление клетчатки вокруг прямой кишки заднего прохода. Этиология заболевания в целом та же, что и у взрослых. Острый процесс начинается с поражения анальной крипты (пазухи) и/или железы. Постепенно инфекция распространяется на клетчатку околопрямокишечной зоны, а затем происходит отграничение пораженных участков от здоровых и, таким образом, образуется абсцесс (гнойник). Если не было произведено адекватное лечение, гнойник чаще всего самопроизвольно вскрывается наружу (на кожу) или в подкожную клетчатку. Формируется свищевой ход, процесс приобретает в большинстве случае хроническое течение. В чем же отличия парапроктита у младенцев и у взрослых? У взрослых микроорганизмом, вызывающим инфекцию, чаще всего становится кишечная палочка, у малышей же это – стафилококк. Причиной развития заболевания в детском возрасте часто становится морфологическая особенность строения – аномальные протоки анальных желез. Они имеют дополнительные разветвления, каналы, что способствует развитию воспаления в благоприятных условиях: Частый стул, нередко характерный для новорожденных Запоры – состояние, которое также часто встречается у младенцев Несформированная иммунная система Все эти факторы в комплексе влияют на то, что парапроктит у младенцев все-таки встречается, хотя и реже, чем у взрослых.
43 Билет
1.Спаечная кишечная непроходимость это нарушение пассажа по кишечнику, вызванное спаечным процессом в брюшной полости. Это наиболее распространенная форма непроходимости кишечника.
Спаечная кишечная непроходимость имеет три формы: обтурации, странгуляции и динамической непроходимости кишечника. При обтурационной форме спайки, сдавливая кишку, не вызывают нарушения ее кровоснабжения и иннервации. У лиц со странгуляцией происходит сдавление брыжейки кишки, что часто осложняется некрозом кишечника. При динамической форме непроходимости обширный спаечный процесс в брюшной полости приводит к замедлению моторно-эвакуаторной функции кишечника.
Наибольшее значение в диагностике спаечной кишечной непроходимости отводится рентгенологическому исследованию.
На обзорной рентгенограмме брюшной полости у лиц с низкой спаечной кишечной непроходимостью выявляются интенсивные чаши Клойбера, тонкокишечные аркады, которые в отличие от других видов непроходимости кишечника фиксированы. Определяются утолщения складок Керкринга, растяжение кишечных петель выше препятствия (локальный метеорит). При высоком перекрытии просвета кишечника чаши Клойбера, аркады единичные, но в нижних отделах живота обнаруживают затемнение.
При изучении пассажа водной взвеси бария сульфата по кишечнику к признакам спаечной кишечной непроходимости относят: появление горизонтальных уровней жидкости при отсутствии арок (симптом «горизонтальных уровней»), создающих впечатление «объемности» изображения (симптом »’растянутой пружины»); задержку бариевой взвеси в отдельных тонкокишечных петлях, симптом «провисания» кишечных петель, который проявляется опусканием терминальных петель подвздошной кишки в нижние отделы брюшной полости и даже в полость малого таза. Симптом «горизонтальных уровней» образуют разные контрастные среды, но не как обычно — воздух (арка) — жидкость, а только жидкость, нижний уровень которой состоит из более тяжелой бариевой взвеси, верхний — из жидкости, появившейся в результате экссудации. Уровень жидкости без газа появляется на 2-4 ч раньше, указывая на уже наступившие микроциркуляторные нарушения.
Основной симптом спаечной кишечной непроходимости при рентгеноконтрастном исследовании — задержка водной взвеси бария сульфата в тонкой кишке дольше 4-5 ч. Однако при введении бариевой взвеси в двенадцатиперстную кишку через зонд патологической считается задержка контраста в кишечнике свыше 1,5-2 ч.
У больных со спаечной болезнью наблюдается задержка водной взвеси бария сульфата лишь в отдельных кишечных петлях свыше 9-12 ч (симптом «локального депо») при своевременном ее попадании в слепую кишку.В последние годы в диагностике спаечной кишечной непроходимости находит широкое применение лапароскопия.
Лечение. С крайне острой формой- экстренная операция после кратковременной предоперац. подготовки. С острой и подострой формой после консервативных мероприятий:
* опорожнение желудка через зонд с промыванием каждые 2-3 ч
* ганглионарная блокада
* внутривенная стимуляция кишечника ( 10% р-р хлорида натрия по 2 мл на 1 год жизни) и 0,05 р-р ниостигмина метилсульфата по 0,1 мл на 1 год жизни )
* сифонная клизма через 30-40 мин после стимуляции
Одновременно рентгенологически контролирут пассаж взвеси сульфата бария по кишечнику. + коррекция нарушений гомеостаза, стабилизация гемодинамики и восстановления микроциркуляции. У 50% больных СКН купируется консервативными способами.
Хирургическое лечение при неэффективности консервативного, заключается в устранении препятствия ( рассечение спаек).
2. Парапроктит- воспаление клетчатки вокруг прямой кишки заднего прохода. Этиология заболевания в целом та же, что и у взрослых. Острый процесс начинается с поражения анальной крипты (пазухи) и/или железы. Постепенно инфекция распространяется на клетчатку околопрямокишечной зоны, а затем происходит отграничение пораженных участков от здоровых и, таким образом, образуется абсцесс (гнойник). Если не было произведено адекватное лечение, гнойник чаще всего самопроизвольно вскрывается наружу (на кожу) или в подкожную клетчатку. Формируется свищевой ход, процесс приобретает в большинстве случае хроническое течение. В чем же отличия парапроктита у младенцев и у взрослых? У взрослых микроорганизмом, вызывающим инфекцию, чаще всего становится кишечная палочка, у малышей же это – стафилококк. Причиной развития заболевания в детском возрасте часто становится морфологическая особенность строения – аномальные протоки анальных желез. Они имеют дополнительные разветвления, каналы, что способствует развитию воспаления в благоприятных условиях: Частый стул, нередко характерный для новорожденных Запоры – состояние, которое также часто встречается у младенцев Несформированная иммунная система Все эти факторы в комплексе влияют на то, что парапроктит у младенцев все-таки встречается, хотя и реже, чем у взрослых.
Острый парапроктит у детей Признаки острого процесса такие же, как и у взрослых. Наблюдается подъем температуры тела до высоких цифр, плохое самочувствие, плохой аппетит, малыш становится капризным, часто без видимой причины плачет. У детей до года парапроктит может также проявляться усилением плача во время дефекации. Имеется болезненность в области анального отверстия, около него, на которую может указать ребенок более старшего возраста. На коже около заднего прохода можно увидеть покрасневший, уплотненный, горячий на ощупь и болезненный участок. В зависимости от локализации инфекции симптомы могут отличаться. Как выглядит парапроктит у детей на фото, можно увидеть в специальном разделе нашего сайта. Подкожный, подлизистый парапроктит у грудничков может иметь не такие явные симптомы, температура иногда не поднимается выше 37,5° С. Тем не менее, признаков обычно достаточно, чтобы заподозрить заболевание и обратиться к врачу. Чаще всего у детей развивается именно такой вариант. При более глубоком расположении процесса симптоматика нарастает медленнее, обычно сначала из симптомов появляется только повышенная температура и ухудшение самочувствия. Боли при дефекации сначала незначительны и усиливаются постепенно. При осмотре врач обратит внимание на припухлость, уплотнение и болезненность в области ягодицы, иногда обращает на себя внимание явное несоответствие в размерах ягодиц, сглаживание складок слизистой ануса. Во время пальцевого исследования обнаружиться гнойник в наружных или глубоких слоях таза. Будет определен размер и локализация абсцесса. При лабораторных исследованиях определяется ускорение СОЭ, увеличение содержание лейкоцитов в крови – признаки бактериальной инфекции. Дополнительных исследований при парапроктите у новорожденных, как правило, не требуется. Помочь установить диагноз может УЗИ.
Хронический П. Хронический процесс подразумевает под собой наличие свищевого хода, наружного и внутреннего отверстия свища. В зависимости от их расположения бывают свищи: Полные – они открываются в прямую кишку и на кожу Неполные открытые – они выходят на кожу, но не связаны с прямой кишкой Неполные закрытые – они открываются в прямую кишку, но заканчиваются слепо в жировой клетчатке Очень часто у детей свищи – не результат острого процесса, а врожденная патология. После инфицирования эти свищи могут превращаться из неполных в полные. По отношению к сфинктеру чаще всего свищи у детей внутрисфинктреные. Первый признак хронического парапроктита у новорожденных – это свищевой ход, на который в большинстве случаев и без воспаления обращают внимание родители. Что собой представляет как острый, так и хронический парапроктит у детей на фото, можно узнать, заглянув в специальный раздел сайта. Во время обострений клиника процесса похожа на острый парапроктит, но в более легкой форме. Обострения случаются довольно часто. Иногда свищ самопроизвольно закрывается на долгое время. Специалисты диагностируют хронический парапроктит у грудничков по внешним признакам и опросу родителей. При пальцевом исследовании обнаруживается свищевой ход и при обострении – гнойник. Для определения локализации хода, его отношения к сфинктеру, прямой кишке проводится зондирование, фистулография, УЗИ.
Процесс лечения зависит от формы заболевания. Если это острая патология, то в большинстве случаев необходимо хирургическое вмешательство, выполнено в экстренном порядке. Как и у взрослых, при операции выполняется вскрытие и дренаж абсцесса, удаление вовлеченной в процесс анальной крипты и железы. Чаще всего результатом хирургического лечения становится выздоровление.
3.Черепно-мозговая травма (ЧМТ) – повреждение механическим способом черепа и внутричерепного содержимого (головного мозга, сосудов, мозговых оболочек и черепных нервов).
К основным причинам возникновения ЧМТ относят: падения, бытовые или спортивные травмы, дорожно-транспортные происшествия, фокальные и диффузные аксональные повреждения.
Выделяют несколько форм ЧМТ по характеру и тяжести повреждения головного мозга:
Сотрясение головного мозга.
Ушиб головного мозга: легкой степени; средней степени; тяжелой степени.
Диффузное аксональное повреждение.
Сдавление головного мозга: эпидуральная; субдуральная; внутримозговая гематома; вдавленный перелом; субдуральная гигрома; очаг ушиба-размозжения головного мозга.
Сотрясение головного мозга. При сотрясении головного мозга ребенок может находиться в сознании или терять его на несколько секунд или минут, кости черепа не повреждаются. Типично появление амнезии, которая проявляется разными её формами: ретроградной (отсутствие воспоминаний о произошедшем, предшествовавшем ЧМТ), конградной (отсутствие воспоминаний о произошедшем во время ЧМТ, когда у ребенка было нарушено сознание) или антероградной (ребенок не помнит ничего). Обычно при сотрясении амнезия кратковременна, сопровождается тошнотой, рвотой. После восстановления сознания обычно жалуются на слабость, головную боль, головокружение, шум в ушах, потливость, приливы крови к лицу, нарушение сна. Иногда у детей наблюдается вестибулярная гиперестезия и боль при движениях глазных яблок, кратковременная негрубая асимметрия глубоких рефлексов, гипергидроз, мелкоразмашистый нистагм. Жизненно важные функции не повреждены. Общее состояние больных обычно улучшается в течение первой, реже второй недели после травмы.
В лечении сотрясения и ушибов мозга легкой и средней степени рекомендуется постельный режим от 5 до 14 дней (можно в домашних условиях). В первые часы травмы (как при сотрясении, так и при ушибе) 1 мл 0,1% раствора атропина сульфата п/к. Дегидратация – 40% раствор глюкозы 20-40-60 мл в/в 5 -10-14 дней (кроме больных сахарным диабетом) или 10-15% раствор натрия хлорида 10-15-20 мл в/в 5-10 дней. Димедрол в таблетках по 0,02-0,05 г или в инъекциях – 1-2% раствор 2 мл (1-2-3 раза в день) в течение 3-5-10 дней. Назначаются анальгетики. При упорной головной боли, если низкое ликворном давление вводят в/в дистиллированную воду – 10, 15, 20 мл в течение 3-5-7 дней.
44 Билет
1.Среди всех различных форм непроходимости кишечника у детей лидирует инвагинация. Это патологический процесс, когда один отдел кишечника внедряется в просвет другого. Инвагинация может поразить любой отрезок кишечника, но наиболее часто она возникает между началом толстого и нижней частью тонкого. При этом нарушается кровоснабжение части стенки, входящей в просвет кишки, в результате чего этот участок отекает и становится причиной болезненных ощущений. Бывает: илеоцекальная, тонкокишечная и толстокишечная инвагинация.
Чаще всего от подобного заболевания страдают маленькие дети, преимущественно в возрасте от полугода до двух лет, причем каждый третий случай – у ребенка в возрасте до года. Девочки от инвагинации страдают реже, чем мальчики.
Основные симптомы инвагинации
Признаки заболевания проявляются внезапно. Так, родители могут отметить у своего ребенка следующие симптомы:
- Раздраженность – малыш беспокойно себя ведет, суетится, его сложно успокоить.
- Боли в животе. Они проявляются эпизодами, через каждые 5-30 минут. В это время ребенок бледен, вскрикивает, поскольку боли достаточно сильные, прижимает колени к животику. В промежутках между эпизодами он выглядит вполне нормально. Однако со временем состояние малыша ухудшается, он становится вялым.
- Вздутие живота. Если ощупать верхнюю его половину, то можно обнаружить там небольшое образование.
-Рвота. Сначала она будет частой, но чем хуже будет становиться ребенку, тем позывы будут становиться реже. В рвотных массах можно заметить зеленую жидкость – это свидетельствует о том, что в месте инвагинации возникла полная кишечная непроходимость.
- Нарушения стула. Через несколько часов после того, как началось развитие болезни, ребенок испытывает частые позывы к дефекации. Иногда появляется диарея. В каждом втором случае инвагинации спустя 12 часов и позже в стуле можно заметить кровь. На прогрессирование болезни укажет красный цвет испражнений и наличие в них слизи. Иногда стул может вовсе отсутствовать.
Диагностика и лечение инвагинации
Сопоставление амнестических данных, возраста больного, клинической картины, предрасполагающих и разрешающих факторов, пальпация живота позволяет подтвердить или исключить диагноз при первичном осмотре.
При инвагинации нередко определяется колбасовидное образование в животе.
R-графия живота на ранних этапах заболевания не имеет большой диагностической ценности, лишь на поздних сроках будет видна типичная картина кишечной непроходимости: кишечные арки и уровни жидкости.
Большое значение в постановке диагноза имеет ультразвуковое исследование органов брюшной полости. В подавляющем большинстве визуализируется инвагинат в виде так называемой «мишени».Так же иногда сразу проводят пневмоирригографию или пневмоскопию, специальные рентгенологические методы исследования, заключающийся в снимке живота после введения воздуха в прямую кишку, что позволяет наверняка определить есть инвагинация или ее нет.
При подтверждении диагноза «острая кишечная инвагинация», на ранних сроках(до 24 часов), наиболее щадящим методом лечения является пневмодезинвагинация. В прямую кишку вводится специальный зонд, и под давлением нагнетается воздух. Последний выталкивает внедрившуюся часть кишки обратно. В ряде случаев, чаще всего на поздних сроках заболевания, не удается расправить инвагинат с помощью воздуха, что является показанием к срочной операции.
Во время операции хирург руками очень осторожно выталкивает внедрившуюся часть кишечника обратно.Если и это не удается сделать, выполняется резекция части кишечника вместе с инвагинатом.
2.Черепно-мозговая травма (ЧМТ) – повреждение механическим способом черепа и внутричерепного содержимого (головного мозга, сосудов, мозговых оболочек и черепных нервов).
К основным причинам возникновения ЧМТ относят: падения, бытовые или спортивные травмы, дорожно-транспортные происшествия, фокальные и диффузные аксональные повреждения.
Выделяют несколько форм ЧМТ по характеру и тяжести повреждения головного мозга:
Сотрясение головного мозга.
Ушиб головного мозга: легкой степени; средней степени; тяжелой степени.
Диффузное аксональное повреждение.
Сдавление головного мозга: эпидуральная; субдуральная; внутримозговая гематома; вдавленный перелом; субдуральная гигрома; очаг ушиба-размозжения головного мозга.
Сотрясение головного мозга. При сотрясении головного мозга ребенок может находиться в сознании или терять его на несколько секунд или минут, кости черепа не повреждаются. Типично появление амнезии, которая проявляется разными её формами: ретроградной (отсутствие воспоминаний о произошедшем, предшествовавшем ЧМТ), конградной (отсутствие воспоминаний о произошедшем во время ЧМТ, когда у ребенка было нарушено сознание) или антероградной (ребенок не помнит ничего). Обычно при сотрясении амнезия кратковременна, сопровождается тошнотой, рвотой. После восстановления сознания обычно жалуются на слабость, головную боль, головокружение, шум в ушах, потливость, приливы крови к лицу, нарушение сна. Иногда у детей наблюдается вестибулярная гиперестезия и боль при движениях глазных яблок, кратковременная негрубая асимметрия глубоких рефлексов, гипергидроз, мелкоразмашистый нистагм. Жизненно важные функции не повреждены. Общее состояние больных обычно улучшается в течение первой, реже второй недели после травмы.
Ушиб головного мозга – это очаговые макроструктурные повреждения мозгового вещества, имеющие легкую, среднюю и тяжелую степени.
Ушиб мозга легкой степени характеризуется потерей сознания на несколько пар или даже десятков минут. После восстановления сознания основными жалобами являются головная боль, головокружение, тошнота и рвота. Амнезия по длительности занимает больше времени, нежели при сотрясении. У детей наблюдается умеренная брадикардия или тахикардия, артериальная гипертензия. Как правило, жизненные функции не повреждены. В неврологической симптоматике присутствует нистагм легкой анизокории, признаки пирамидной недостаточности, субарахноидальное кровоизлияние – менингеальные симптомы. При ушибе легкой степени может быть перелом костей свода черепа. На 3-5-ый день происходит восстановление сознания, ребенок начинает ориентироваться пространстве и времени. Но при этом могут быть расстройства памяти о текущих событиях, проблемы в интеллектуальной деятельности. Неврологическая симптоматика проходит на 10-14-е сутки. При ушибе легкой степени происходит локальный отек вещества мозга, точечные диапедезные геморрагии, ограниченный разрыв мелких пиальных сосудов.
Ушиб мозга средней степени приводит к потере сознания в течение десятков минут или часов. Первые 3-5 суток после травмы у детей наблюдается умеренное оглушение, речевой дисфункции, выражены вялость, адинамия, сонливость, быстрая утомляемость, дезориентация в пространстве и времени, амнезия (ретроградная) и амнезия на события при травме. Могут быть переломы костей свода черепа и основания, субарахноидальное кровоизлияние, мелкоочаговые кровоизлияния. Но при ушибе могут повреждаться не только корковая зона, но и белое вещество головного мозга. Дети жалуются на головную боль, многократную рвоту, иногда наблюдаются психические расстройства. У многих больных имеются показатели очагового поражения полушарий головного мозга в форме контралатеральной гиперрефлексии, центрального пареза мимической мускулатуры, нистагма, реакция зрачков на свет снижается, появляются патологические стопные знаки, моно- или гемипарезы, речевые расстройства (дизартрия), а также моторная, сенсорная или амнестическая афазии. В некоторых случаях прослеживается мозжечковая и менингеальная симптоматика. Очаги ушиба рассасываются примерно за 14-18 суток.
При ушибе мозга тяжелой степени больной теряет сознание на несколько часов или несколько недель. При этом происходят нарушения жизненно важных функций, появляется артериальная гипертензия или гипотензия, брадикардия или тахикардия, нарушение дыхания, гипертермия. В клинической симптоматике отмечают: парез взора, парез и паралич конечностей, нарушения глотания, плавающие движения глазных яблок, нистагм, двусторонний мидриаз или миоз, генерализованные или фокальные судорожные припадки, речевые расстройства, изменения психики. Часто при ушибе головного мозга тяжелой степени имеется перелом свода и основания черепа, массивное субарахноидальное кровоизлияние, разрушаются ткани мозга, утрачивается конфигурация борозд и извилин, разрываются связи с мягкими мозговыми оболочками.
Сдавление головного мозга. К возникновению сдавления мозга приводят внутричерепные гематомы, вдавленный перелом костей черепа, очаги размозжения мозга, ущемление ствола мозга. Клинически сдавление головного мозга выражено жизненно опасным нарастанием общемозговых и очаговых расстройств через определенный промежуток времени после получения травмы либо сразу после нее. Такой промежуток называется «светлый промежуток» – это промежуток времени, за который происходит полное или частичное восстановление сознания пострадавшего между первичной и вторичной его потерей. У больных происходит индивидуально: у кого-то полное, у кого-то остается оглушение без восстановления, у остальных и вовсе не происходит восстановления. Продолжительность светлого промежутка составляет минуты или часы, а в отдельных случаях исчисляется сутками и неделями.
К сдавлению мозга при ЧМТ обычно приводят гематомы:
Эпидуральная гематома представляет собой травматическое кровоизлияние между внутренней поверхностью костей черепа и твердой мозговой оболочкой, вызывающее местную и общую компрессию головного мозга. Чаще всего разрыв сосудов твердой мозговой оболочки создает предпосылки для образования эпидуральной гематомы (ЭГ) в месте удара. Среди всех случаев ЧМТ частота ЭГ составляет 0,5-0,8%. Объем ЭГ в среднем 80-120 мл, диаметр 7-8 см, преимущественная локализация – височно-теменная, височно-лобная, височно-базилярная области. ЭГ состоит из жидкой крови и сгустков, отдавливает подлежащую твердую оболочку и вещество мозга. Наиболее часто источником кровотечения при ЭГ являются поврежденные средняя оболочечная артерия и ее ветви, иногда оболочечные вены, синусы и сосуды диплоэ. Для симптоматики характерно: светлый промежуток, гомолатеральный мидриаз, контралатеральный гемипарез, нередки брадикардия, артериальная гипертензия.
Субдуральная гематома – травматическое кровоизлияние между твердой и паутинной мозговыми оболочками, вызывающее общую или местную компрессию головного мозга. В отличие от ЭГ субдуральная гематома (СГ) возникает не только на стороне травмы, но и на противоположной. Объем СГ колеблется от 30 до 250 мл, в среднем 80-150 мл. Они могут занимать площадь 10x12 см и больше. Образование СГ обычно связано с разрывом пиальных вен. Нередко источником СГ являются поврежденные поверхностные сосуды полушария головного мозга (корковые артерии). СГ располагаются преимущественно на выпуклой стороне полушарий в теменно-лобной, теменно-височной областях, иногда распространяются на переднюю и среднюю черепные ямки. Классический вариант течения острых СГ встречается редко и характеризуется трехфазным изменением состояния сознания: первичная утрата в момент травмы, светлый промежуток – до 2 сут, вторичное выключение сознания. Выражена очаговая симптоматика в виде гомолатерального мидриаза, контралатерального пареза, затем развивается вторичный стволовой синдром. Среди очаговых симптомов – речевые нарушения, гемипарез, экстрапирамидная симптоматика.
В результате ЧМТ может развиваться субдуральная гигрома в виде отграниченного скопления ликвора в субдуральном пространстве со сдавлением головного мозга. Субдуральная гигрома возникает вследствие разрыва субарахноидальных цистерн, чаще на основании мозга. В клинической картине обычно выражены менингеальные симптомы, нередко нарушения психики по типу лобного синдрома, типичны прогрессирующая брадикардия и судорожный синдром.
Исходя из положений, согласно которым патоморфологическую картину закрытой или открытой черепно-мозговой травмы характеризует состояние очагов травматического размозжения, состояние циркуляторных механизмов и отсутствие и наличие осложнений, Л. И. Смирнов различает следующие пять периодов течения травматической болезни мозга.
1. Начальный период имеет продолжительность 12—18—24 часа. Это—период непосредственного действия механической энергии и максимальной выраженности функциональных расстройств циркуляторных механизмов. Дисгемические явления в мозгу выражаются последовательно сменяющимися процессами: кратковременной ангиосиастической ишемией, ангиопаралитической гиперемией, престатическим состоянием кровотока, которое сопровождается кровоизлияниями. В редких случаях происходит задержка обратного развития ангиоспазмов, что может привести к формированию очагов белого размягчения.
2. Ранний период имеет длительность от 42 часов до 2 —6 недель. Это — период тканевых реакций, характеризующийся процессами очищения тканевого дефекта от продуктов распада мозговой ткани и крови, негнойным воспалением на отдалении, лабильностью циркуляторных механизмов. Отдаленные тканевые реакции на наличие травматических некрозов чаще всего проявляются в форме серозного лептоменингита, несколько реже — асептического периваскулярного энцефалита. В случаях легкой травмы нарушения кровообращения и водного обмена постепенно исчезают без каких-либо органических изменений мозговой ткани, однако при этом остается неустойчивое равновесие циркуляторных механизмов.
3. Промежуточный период — период развертывающегося рубцевания и поздних осложнений — начинается на 2 —3-й неделе после ранения и нередко затягивается до 3 месяцев.
4. Поздний период, в течение которого заканчивается рубцевание, наступает с 4—5-й недели после нанесения травмы в более легких и неосложненных случаях и с 3-го месяца в тяжелых случаях. Этот период иногда может затянуться на 1 — 7 года.
5. Резидуальное состояние — период сформированного рубца.
3. См 43 билет (2)
Осложнения
Самые грозные осложнения острого парапроктита — распространение воспаления на клетчаточные пространства таза, гнойное расплавление стенки прямой кишки выше уровня аноректальной линии. В этом случае кишечное содержимое попадает в параректальную клетчатку и открывается возможность широкого распространения инфекции. Отмечены случаи гнойного расплавления уретры. Учитывая непосредственное соседство с тазовой брюшиной, сообщение тазовой клетчатки с забрюшинной, нельзя исключить возможность прорыва гноя в брюшную полость и забрюшинное пространство. Такие осложнения, как правило, возникают при запоздалом обращении к врачу пожилых, ослабленных больных, при наличии сахарного диабета, сосудистых расстройств и т. п. При позднем обращении больных и при несвоевременно выполненной операции возможно развитие гнилостного процесса на фоне парапроктита, начавшегося как банальный.
Кроме того, возможны и другие осложнения острого парапроктита: прорыв гноя из одного клетчаточного пространства в другое, прорыв гнойника (пельвиоректального) в просвет прямой кишки или влагалище, прорыв гноя из полости абсцесса через кожу промежности (спонтанное вскрытие).
После вскрытия гнойника спонтанно или хирургическим способом без ликвидации гнойного хода и пораженной крипты в дальнейшем, как правило, формируется свищ прямой кишки. Если свищ не образовался, но при этом остался очаг воспаления в области анальных желез и межсфинктерного пространства, то через какое-то время возникает рецидив острого парапроктита.
Билет №45
Панариций. Клиника. Диагностика. Лечение.
Полипы и трещины прямой кишки. Дифференциальная диагностика. Показания к хирургическому лечению. Способы оперативного вмешательства.
Черепно-мозговая травма у детей. Хирургическая тактика внутричерепных гематом.
1.Панариция - острое гнойное воспаление тканей пальцев кистей рук и стоп. Классификация:
Кожный – очаг локализуется между сосочковым слоем кожи и эпидермиса.
Ногтевой (подногтевой) – очаг локализуется под ногтевой пластиной.
Околоногтевой – очаг локализуется в валиках у боковых поверхностей ногтевой пластины.
Паронихия – воспаление валика, окружающего основание ногтя.
Подкожный – очаг локализуется в подкожной жировой клетчатке пальца.
Сухожильный – воспаление сухожильного влагалища и сухожилия пальца.
Суставной – очаг локализуется в суставной щели с вовлечением в процесс связочного, хрящевого аппарата пальца.
Костный – очаг локализуется в костной ткани пальца
Пандактилит – гнойное воспаление всех тканей пальца
Этиология: микро- и макротравм пальца (котлотые раны, занозы, заусеницы, ушибы).
В патогенезе: повышенная вирулентность возбудителей и снижение иммунологической реактивности организма пациентов.
Клиника: наличие местных (в области пат.очага гиперемия, боль, повышение локальной температуры, нарушения функций органа) и общих (симптомы интоксикации) признаков.
При кожной форме панариция гной располагается под эпидермисом в виде пузыря, отслаивает его. Боль и отек слабо выражены, признаки интоксикации отсутствуют.
При подногтевой форме гной скапливается под ногтевой пластинкой, отслаивая ее. Боль пульсирующая и нарастает при перкуссии ногтевой пластины.
При околоногтевой форме на ограниченном участке околоногтевого валика появляются отек и гиперемия. Под эпидермисом отмечают скопление гноя. Болевой синдром не выражен.
При паронихии визиализируются нависание и болезненная отечность околонегтевого валика над ногтевой пластиной.
При подкожной форме: постепенно нарастающий дергающий, пульсирующий характер боли.
При суставной форме: сгибательно-разгибательные движения пальца резко ограничены из за усиления болей в пораженном суставе. Формирование пат.подвижности сустава свидетельствует о вовлечении в пат.процесс связочного, хрящевого и костного аппарата пальца.
При костной форме: фаланга пальца буловидно утолщена. Болевой синдром выражен, носит пульсирующий характер. Признаки общей интоксикации выражены. При наличии свища отделяемое скудное, гнойное, иногда с мелкими костными секвестрами.
Сухожильный панариций: попытка разгибания пальца приводит к резкому усилению боли, а сгибание значительно уменьшает ее остроту. Пальпация пуговчатым зондом по линии проекции сухожилий сгибателей резко болезненна.
При пандактилите – резко выражены местные признаки гнойного воспаления всех тканей пальца на фоне признаков общей интоксикации
Лечение:
Консервативное: АБ препараты широкого спектра действия, физиотерапия (УВЧ-терапия, местная гипо- или гипертермия тканей и создание условий для оттока восп.экссудата).
Хирургическое: наличие гнойной стадии воспаления или отсутствие эффекта от консервативной терапии.
При кожной форме – разрез в области макс.флюктуации с иссечением отслоенного эпидермиса.
При паронихии – дугообразный разрез вдоль края ногтя.
При околоногтевой – Г-образный разрез в области некротического очага.
При подногтевой форме – удаление ногтя.
При подкожной форме – разрез по боковым поверхностям пальца или Г-образный разрез. Дренирование раны.
При суставной форме – артротомия двумя паралелльными разрезами по тыльно-боковой поверхности поврежденного сустава, промывание, дренирование сустава, некрэктомия.
При сухожильной – вскрытие сухожильного влагалища – переднебоковой поверхности основной фаланги, его дренирование и промывание.
При костной форме – вскрытие пораженных тканей, включая кость секвестр – и некрэктомия, дренирование.
При пандактилите – секвестр- или некрэктомия, дренирование, в тяж.случаях – ампутация или экзартикуляция пальца.
2. Одиночные доброкачественные полипы — наиболее частый вид опухолей прямой кишки у детей. Их обнаруживают обычно в возрасте от 3 до 6 лет. Мальчики и девочки заболевают одинаково часто. Считают, что в основе образования полипов лежат воспалительные изменения слизистой оболочки, а также бластоматозные процессы в кишечной стенке.
Клинически полип прямой кишки проявляется кровотечениями из анального отверстия, в редких случаях — болями при испражнении, тенезмами. Кровотечение имеет различный характер: прожилки крови, отдельные капли, более массивное кровотечение, возникающее во время или после акта дефекации. Оно вызывается давлением и раздражением полипа плотными каловыми массами. При этом иногда ребенок жалуется на боли в области прямой кишки. Полип может воспалиться, что является причиной тенезмов и учащенных позывов на дефекацию. Нередко наблюдается выпадение полипа через задний проход во время дефекации и его ущемление, напоминающие выпадение прямой кишки.
Диагноз полипа прямой кишки в большинстве случаев нетруден. При обращении больного с жалобами на кровотечение из прямой кишки в первую очередь надо думать о полипе прямой кишки. Исследование начинают с осмотра области прохода и исключают наличие трещины, геморроя. Затем переходят к пальцевому исследованию прямой кишки. Очень важно обращать внимание на опорожнение кишки. С этой целью лучше всего сделать перед обследованием очистительную клизму. Полип ощущается в форме небольшой, величиной с вишню, лесной орех, округлой опухоли, располагающейся чаще на боковых и задней стенках прямой кишки. Большинство полипов имеет различной длины ножку, но некоторые плотно прилегают к кишечной стенке. Консистенция полипа мягкая, поверхность слегка шероховатая, пальпация безболезненна.
Надо отметить, что пальцевому исследованию доступны полипы, расположенные не выше 6 —7 см от анального отверстия. Поэтому при подозрении на полип, кроме пальцевого исследования, прибегают к осмотру с зеркалами (мы используем с этой целью вагинальные зеркала), ректороманоскопии и ирригографии с введением бария. Такое исследование необходимо производить и потому, что выше одиночного полипа может располагаться еще один или несколько полипов. Хотя у детей множественные полипы не так часты, но возможность их существования всегда надо иметь в виду. В тех случаях, когда находят рассеянные полипы, говорят о полипозе прямой или толстой кишки.
Иногда при ректороманоскопии полип может остаться незамеченным, так как теряется в складках слизистой оболочки. Повторное исследование уточняет диагноз. Детям старшего возраста можно произвести фиброколоскопию.
Лечение полипов прямой кишки у детей в ряде случаев может производиться амбулаторно. Допустимо удалять одиночные подвижные полипы, расположенные не далее 5 — 8 см от анального отверстия и доступные пальцевому осязанию или осмотру с помощью зеркал. Расположенные выше полипы, не имеющие ножки, следует удалять в стационаре.
Больного назначают на определенный день для оперативного вмешательства, для того чтобы подготовить соответствующим образом кишечник. Накануне вечером и утром в день операции ставят очистительную клизму. Завтрак больному не дают, ибо имеют в виду возможность дачи наркоза. Вопрос о методе обезболивания решается индивидуально в зависимости от высоты расположения полипа, его подвижности, возраста ребенка.
Техника операции. В тех случаях, когда полип без особого труда выводится наружу, необходимости в обезболивании нет. Пальцем опухоль вывихивают через задний проход, ножку прошивают кетгутовым швом, перевязывают, отсекают концы нити, а потом ножницами пересекают ножку. В тех случаях, когда полип не выводится наружу, пользуются зеркалами или крючками для разведения заднего прохода под кратковременным общим обезболиванием. Слизистую оболочку кишки низводят при помощи мягких зажимов, подтягивают вниз полип и на основание его ножки накладывают кровоостанавливающий зажим, ниже которого ножку прошивают кетгутовой лигатурой, перевязывают на обе стороны. По зажиму полип отсекают ножницами или скальпелем, после чего зажим снимают (рис. 87). Необходимо надежно перевязать ножку, так как соскальзывание лигатуры угрожает кровотечением.
После операции назначают постельный режим на 1—2 дня. Питание обычное — по возрасту.
Трещины заднего прохода, как правило, возникают у детей, страдающих запорами. Твердые каловые массы вызывают надрывы слизистой оболочки заднего прохода или нижнего отдела прямой кишки. У некоторых детей в анамнезе имеются указания на длительные поносы, наличие остриц. При длительных поносах слизистая оболочка прямой кишки отекает, становится легко ранимой. Зуд в области заднего прохода, вызываемый острицами, также может повести к образованию трещин. Иногда трещины возникают вследствие надрывов слизистой оболочки при рубцовом сужении заднего прохода.
Трещины вначале бывают поверхностными, увидеть их можно только при тщательном осмотре ребенка и раздвигании анальных складок. Чаще они локализуются на задней полуокружности. При появлении трещин заднего прохода дети становятся беспокойными, жалуются на боли. Боясь усиления боли, они задерживают стул, что в свою очередь приводит к уплотнению каловых масс и еще большей травматизации слизистой оболочки с углублением трещин. В конце дефекации выделяется несколько капель алой крови.
Лечение. Начинать лечение следует с мероприятий, направленных против основного заболевания. При запорах назначают послабляющую диету, внутрь — вазелиновое масло. Для снятия спазма наружного жома применяют теплые ванны, электрофорез с новокаином, свечи с анестезином, теплые клизмы из настоя ромашки.
Лечение трещин, начатое в первые дни их возникновения, дает хороший результат. Чем дольше существует трещина, тем труднее ее лечение. Эффективным является насильственное растяжение сфинктера. Тонус сфинктера восстанавливается медленно. За это время трещина успевает зажить.
3. Черепно-мозговая травма у детей составляет 30-40 % от общего числа травматических повреждений. Летальность при изолированной черепно-мозговой травме может достигать 38 - 40 %, а при сочетанной - 70 % и более. Особенности черепно-мозговой травмы у детей 1. Быстрое развитие общемозговой симптоматики и угнетение сознания с возможным улучшением состояния в короткое время. 2. Часто отмечаются переломы костей черепа. 3. У детей младшего возраста преобладают разрывы белого вещества, в то время как у взрослых и у детей старших возрастных групп чаще встречаются очаги контузии. Этиология и патогенез. Наиболее часто причиной развития черепно-мозговой травмы (ЧМТ) у детей является автотравма и падение с высоты. Ключевое звено патогенеза ЧМТ - прогрессирующая внутричерепная гипертензия с развитием отека мозга, что и лежит в основе угнетения сознания.
Классификация Выделяют закрытую и открытую ЧМТ. При закрытой черепно-мозговой травме повреждения апоневроза отсутствуют, в то время как при открытой всегда отмечается повреждение апоневроза. К открытой ЧМТ также относится перелом костей основания черепа. Независимо от вида выделяют шесть клинических форм ЧМТ: 1. Сотрясение головного мозга. 2. Ушиб головного мозга легкой степени. 3. Ушиб головного мозга средней степени тяжести. 4. Ушиб головного мозга тяжелой степени. 5. Сдавление мозга на фоне ушиба. 6. Сдавление мозга без сопутствующего ушиба.
Клиническая картина черепно-мозговой травмы: 1. Сотрясение головного мозга. I. Общемозговые нарушения: - Кратковременное угнетение сознания непосредственно после травмы (в течение 20-30 мин); - Сомноленция; - Головная боль в лобно-височной области, головокружение; - Тошнота, единичные эпизоды рвоты; - Вегетососудистые нарушения. II. Очаговая и менингеальная симптоматика отсутствует или выражена незначительно. 2. Ушиб головного мозга легкой степени. Для ушиба головного мозга любой степени тяжести характерно сочетание общемозговой и очаговой неврологической симптоматики. - Угнетение сознания до уровня оглушения в течение первого часа после получения травмы (30-60 мин); - Характерна ретро-, кон- и антеградная амнезия; - Функция жизненно важных органов не нарушена; - Очаговая неврологическая симптоматика, соответствующая области поражения минимальна, сохраняется от 2 до 14 сут. 3. Ушиб головного мозга средней степени тяжести. - Угнетение сознания до сопора или комы в течение ближайших часов после травмы (от нескольких часов до 2 сут); - Отмечается отчетливая очаговая неврологическая симптоматика (парезы, параличи, расстройства речи); - Могут возникать транзиторные нарушения функций жизненно важных органов; - Антероградная амнезия. 4. Ушиб головного мозга тяжелой степени. - Угнетение сознания до уровня комы в течение нескольких суток; - Отмечаются тяжелые нарушения витальных функций; - Имеет место выраженная очаговая неврологическая симптоматика; - Судорожный синдром; - Диэнцефально-катаболический синдром (тахикардия, гипертермия, устойчивая к проводимой терапии, гиперемия щек, вегето-висцеральные нарушения). 5. Эпидуральная гематома - В первые часы после травмы отмечаются общемозговые симптомы, очаговая неврологическая симптоматика отсутствует или выражена незначительно; - Характерно наличие «светлого промежутка»; - Угнетение сознания; - Признаки прогрессирующего дислокационного синдрома (брадикардия, тенденция к артериальной гипертензии, брадипноэ вплоть до остановки дыхания); - Анизокория (расширение зрачка и отсутствие фотореакции на стороне гематомы); - Очаговая неврологическая симптоматика: судорожный синдром, моно- и гемипарезы, косоглазие, парез взора вверх; - Наличие патологических рефлексов (патологические стопные знаки, рефлекс Бабинского). 6. Субдуральная гематома. - Симптомы сдавления головного мозга при субдуральной гематоме нарастают постепенно и часто не достигают значительной степени выраженности; - Характерно наличие длительного «светлого промежутка» (дни, недели); - Превалирование симптомов раздражения над симптомами выпадения; - Наличие менингеальной симптоматики (особенно выражена ригидность затылочных мышц, верхний симптом Брудзинского). 7. Субарахноидальное кровоизлияние. - Угнетение сознания различной степени тяжести; - Характерно наличие менингеальной симптоматики; - Генерализованные или очаговые судороги клонического характера; - Психомоторное возбуждение; - Многократная рвота; - Повышение температуры тела до 38,0 39,0 °С. Неотложная помощь Объем терапевтических мероприятий, проведение которых необходимо на догоспитальном этапе, зависит от степени угнетения сознания и нарушения основных витальных функций - дыхания и кровообращения. Следует подчеркнуть, что независимо от характера и степени тяжести травмы на догоспитальном этапе должны быть устранены гипоксия, гиперкапния и артериальная гипотензия. 1. При легкой ЧМТ, не сопровождающейся угнетением сознания, показано проведение симптоматической терапии (обезболивание, устранение тошноты и рвоты) с последующей госпитализацией пациента в стационар. Введение седативных препаратов на догоспитальном этапе в данном случае нецелесообразно. 2. У пациентов с тяжелой черепно-мозговой травмой и нарушением витальных функций необходимы неотложные мероприятия, направленные на обеспечение проходимости дыхательных путей, адекватной вентиляции и нормализации показателей гемодинамики. А. Обеспечение проходимости дыхательных путей. При угнетении сознания до уровня комы показана интубация трахеи и перевод ребенка на ИВЛ, независимо от длительности транспортировки. Б. Обеспечение адекватной вентиляции и оксигенации. При тяжелой степени угнетения сознания (сопор, кома) и наличии признаков неадекватного самостоятельного дыхания показан перевод ребенка на ИВЛ в режиме умеренной гипервентиляции. В. Обеспечение адекватной гемодинамики. Основная задача догоспитального этапа - обеспечение нормализации объема циркулирующей крови и стабилизация основных показателей, отражающих состояние кардиоваскулярной системы: ЧСС, АД, время наполнения капилляров, почасовой темп диуреза, температура тела. Все усилия на догоспитальном этапе должны быть направлены на проведение адекватной инфузионной терапии и ликвидацию артериальной гипотензии, а не на устранение внутричерепной гипертензии, поэтому назначение диуретиков до устранения гиповолемии категорически противопоказано. В то же время при проведении инфузионной терапии следует помнить, что изолированная ЧМТ в большинстве случаев не сопровождается гиповолемическим шоком, поэтому необходимо исключить все другие повреждения, которые могут привести к развитию артериальной гипотензии и острой недостаточности кровообращения (повреждения внутренних органов, повреждение спинного мозга и т. д.). Оптимальными растворами для проведения инфузионной терапии при ЧМТ на догоспитальном этапе является 0,9 % раствор натрия хлорида и Рингер-лактат. Показания к госпитализации 1. Угнетение сознания (как на момент осмотра, так и во время травмы); 2. Наличие переломов костей черепа; 3. Наличие очаговой неврологической симптоматики; 4. Алкогольная интоксикация, эпилепсия в анамнезе; 5. Сильная головная боль, рвота, лихорадка; 6. Судороги; 7. Ото- и риноликворея
Билет №46
Сочетанная черепно-мозговая травма. Хирургическая тактика при сочетанных черепно-мозговых травмах. Интенсивная терапия.
Язвенная болезнь желудка и 12-перстной кишки. Причины и происхождение, клинические формы, диагностика. Показания к хирургическому лечению.
Остеомиелиты. Этиология. Патогенез. Классификация. Клиника. Дифференциальная диагностика.
2. Язвенная болезнь - это хронически протекающее заболевание, при котором образуются язвы в слизистой оболочке желудка или двенадцатиперстной кишки. Для этого заболевания характерна склонность к прогрессированию и развитию различных осложнений. Нередко язвенная болезнь у детей на современном этапе отличается неблагоприятным течением с формированием множественных и хронических язв, которые плохо поддаются консервативной терапии и требуют хирургического вмешательства. Язвенная болезнь может быть диагностирована у детей уже с 5-6-летнего возраста.
Язвенные поражения в основном (85%) локализуются на передней или задней стенке луковицы двенадцатиперстной кишки, у 15% больных отмечаются постбульбарные (внелуковичные) язвы. Язвенная болезнь двенадцатиперстной кишки встречается в 6-7 раз чаще, чем язвенная болезнь желудка.
Причины
Основным причинным фактором развития хронической язвы желудка или 12-перстной кишки считают инфекцию Хеликобактер пилори – H.pylori (Hp). В разделе “Ликар-гастроэнтеролог/Желудок/Больной, Вы заразились язвой желудка” изложена характеристика этого возбудителя и методы диагностики инфекции. Большую роль в формировании болезни играют психо-эмоциональные факторы: психотравмы, повторяющиеся стрессы в жизни ребенка, конфликтные ситуации в семье и школе. Доказана роль токсико-аллергических факторов: частый и необоснованный прием лекарств, токсикомания, употребление алкогольных напитков, курение и наркомания у школьников, проявления пищевой и лекарственной аллергии. К факторам риска по развитию язвенной болезни относят наследственную предрасположенность, неблагоприятное течение беременности и родов у матери, искусственное вскармливание на первом году жизни.
Клинические проявления язвенной болезни у детей зависят от стадии заболевания и локализации язвы. Наиболее постоянным и важным симптомом является боль. Характерная особенность этой боли – связь с приемом пищи. Даже в тех случаях, когда боль носит более или менее постоянный характер, можно выявить ее усиление через некоторое время после еды. Боли могут возникать непосредственно после приема пищи – через 30-60 минут (так называемые ранние боли), либо через 2-3 часа (поздние боли). Большое диагностическое значение имеют ночные боли, которые нередко бывают очень интенсивными и часто исчезают после приема пищи (стакана молока, кефира, нескольких глотков воды).
Боли по характеру приступообразные, режущие, колющие, иррадиируют в спину, правое плечо, лопатку. Локализация болей определяется местонахождением язвы: боли чаще возникают в эпигастральной области и справа от средней линии.
В период обострения болей больные ищут наиболее удобную позу, в которой боль уменьшается. Чаще это поза с согнутым туловищем и притянутыми к животу ногами, сидя в постели или лежа на боку. Если язва расположена на передней стенке желудка, то облегчение боли может быть в положении на спине или выгнувшись назад.
Несмотря на наибольшее диагностическое значение болевого синдрома, у некоторых больных он может отсутствовать: это наблюдается в случаях так называемых “немых” или скрыто протекающих язв. Известно, что такие тяжелые осложнения язвенной болезни как кровотечение и перфорация развиваются именно у тех пациентов, у которых не были ярко выражены боли. Одним из частых и наиболее ранних симптомов язвенной болезни является изжога. Нередко она предшествует появлению болей и тоже может носит периодический характер: голодная, ночная изжога.
Отрыжка, тошнота и рвота у больных встречаются несколько реже, чем боль и изжога. Рвота связана с болью. Можно установить такую последовательность симптомов: изжога – боль – тошнота – рвота - облегчение диспепсического синдрома.
Аппетит у детей чаще всего сохранен, иногда даже усилен. Язык обложен белым налетом, влажный. Запоры характерны для больных с обострением заболевания. Отмечается сезонность болевого и дипепсического синдромов (весна, осень).
При осмотре детей выявляются признаки умеренно выраженной хронической интоксикации и гиповитаминоза. При пальпации живота определяется болезненность и местная мышечная защита передней брюшной стенки в верхней части живота и правом подреберье.
Осложнения язвенной болезни:
кровотечение, сопровождающееся рвотой с примесью крови, меленой (черный стул), слабостью, головокружением, тахикардией (учащение сердцебиений);
пенетрация (проникновение язвы в другие органы), характеризующаяся упорным болевым синдромом, резкими болями, иррадиирующими в спину, рвотой, не приносящей облегчения, и упорной изжогой;
перфорация (прорыв язвы в брюшную полость), возникающая остро и сопровождающаяся резкой болью в эпигастральной области, напряжением передней брюшной стенки и симптомами раздражения брюшины.
Диагностика
Наблюдения в гастроэнтерологической клинике свидетельствуют, что тщательное изучение анамнеза, анализ факторов риска, оценка клинических проявлений болезни, осмотр ребенка и пальпаторное исследование органов брюшной полости позволяют в 70-80% случаев своевременно распознать заболевание желудка и двенадцатиперстной кишки. Затруднения в диагностике на ранних этапах развития болезни часто связаны с вовлечением в патологический процесс других органов пищеварения (поджелудочная железа, желчевыводящая система, кишечник), что обусловливает "смазанность" клинических проявлений язвенной болезни у детей.
Дополнительные методы исследования желудка и двенадцатиперстной кишки могут быть разделены на три группы:
Методы, основанные на изучении морфологических особенностей желудка и двенадцатиперстной кишки (рентгенологические исследования, гастродуоденофиброскопия, гистологическое, гистохимическое изучение биоптатов гастродуоденальной слизистой).
Методы изучения функционального состояния гастродуоденальной системы (фракционное желудочное зондирование, рН-метрия, радиотелеметрия, манометрия и др.).
Методы выявления Хеликобактер пилори.
Основным в подтверждении диагноза язвенной болезни на сегодняшний день является гастрофибродуоденоскопия. Ее проводят в динамике заболевания для оценки состояния язвы под влиянием терапии. В зависимости от особенностей клинического течения и результатов дополнительных методов исследований врач-гастроэнтеролог выставляет диагноз и назначает комплекс терапии.
Лечение язвенной болезни у детей предполагает такие основные направления: - ликвидация инфекции Нр, нормализация уровня секреции соляной кислоты в ЖКТ (препаратОмез и др); - повышение защитных свойств слизистой оболочки желудка и двенадцатиперстной кишки; - воздействие на вегетативную нервную систему с целью коррекции равновесия между ее отделами.
Диетотерапия и режимные моменты при язвенной болезни аналогичны таковым при хронических гастродуоденитах . Желательно при обострении заболевания ребенка госпитализировать в специализированное детское гастроэнтерологическое отделение. Однако в некоторых ситуациях, когда ребенок неконтактный и выражает категорический протест против госпитализации, допустимо лечение в домашних условиях.
Оперативное лечение показано в детском возрасте в случаях развившихся осложнений (например, перфорация язвы, некупируемое кровотечение). Операция должна быть щадящей. При перфорации язвы желудка у детей рекомендуют её ушивание швами.
3. Остеомиелит - воспаление костного мозга с вовлечением в процесс составных частей кости (компактной кости и периосте).
Классификация остеомиелита
По этиологическому признаку: 1. Неспецифический (вызывается гноеобразующими микробами). 2. Специфический (туберкулезный, сифилитический, бруцеллезного). В зависимости от путей проникновения инфекции: 1. Гематогенный. 2. Негематогенний (вторичный): a) травматический; b) огнестрельный; c) при переходе воспаления на кость с окружающих тканей. По клиническому течению: 1. Острый (формы остеомиелита по Т. Н. Краснобаева): a ) токсичный; b) септикопиемический; c) местный. 2. Хронический: d) хронический остеомиелит как результат острого; e) первично-хронический остеомиелит: • склерозирующий остеомиелит Гарре; • альбуминозний остеомиелит Оллье; • абсцесс Броди; • антибиотическое остеомиелит Попкирова; • опухолевидное остеомиелит.
Острый гематогенный остеомиелит
Острый гематогенный остеомиелит - общая Пиогенная метастазируя инфекция в аллергизованы организме с локализацией воспалительного процесса в костном мозге. Распространенность В 90% случаев наблюдается у детей, у мальчиков в 2-3 раза чаще, чем у девочек.
Этиология острого гематогенного остеомиелита
Вызывается гноеутворюючимы микробами - стафилококком в 60-80% случаев, стрептококком - 5-30%, грамнегативными бактериями, анаэробами и смешанной флорой в 10-15%. Патогенез На современном этапе считается, что реализация костной инфекции у детей происходит на основе взаимодействия многих факторов в условиях морфофункциональной незрелости тканей, органов и систем. Схема патогенеза острого гематогенного остеомиелита: 1. Входные ворота инфекции. Выход инфекции в кровь и диссеминация в организме. 2. Захват инфекционного агента клетками ретикулоэндотелиальной системы кости. 3. Альтерация интеросальных сосудов. Провоцирующие факторы - травма, иммунная недостаточность. 4. Экссудация жидкости. Повышение внутрикостного давления. 5. Окклюзия внутрикостного сосудов. Преобразование экссудата в навоз. 6. Полное нарушение внутрикостного кровообращения. Внутрикостный остеонекроз с распространением процесса. 7. Выход гноя под надкостницы. Развитие периостита с нарушением кровоснабжения надкостницы. 8. Некроз надкостницы. Фазы острого гематогенного остеомиелита I фаза. Отек костного мозга (1-2 сутки). II фаза. Костно-мозговая флегмона (2-4 сутки). III фаза. Пидокисна флегмона (4-5 сутки). IV фаза. Флегмона мягких тканей (6-7 сутки). Стадии течения острого гематогенного остеомиелита: 1. Острая (2-4 недели). 2. Подострая (от 2-4 недель до 2-3 месяцев с выходом в выздоровление или хроническую стадию с формированием секвестров. 3. Хроническая (начиная с 2-3 месяца).
Клиника острого гематогенного остеомиелита
Токсическая (адинамична) форма Характеризуется молниеносным развитием и крайне тяжелым течением с преобладанием общих и септических явлений. После продромального периода (1-4 суток) - резкие подъемы температуры до 39-40 градусов. Бред, судороги, потеря сознания. Развитие шокового легкого и шоковой почки. Обнаружить участок болезненности на конечности не удается. Больные погибают на 1-3 сутки. Септикопиемическими (тяжелая) форма Отмечается у 40% больных. Начинается выраженным ознобом с повышением температуры тела до 39 градусов.Симптомы выраженной интоксикации. Острые боли в пораженной конечности. В течение 1-2 суток - местные изменения в виде болезненной отечности мягких тканей, гиперемии, повышение кожной температуры. В дальнейшем - местные фазные изменения с развитием межмышечной флегмоны. Местная (легкая) форма. Легкое начало и течение заболевания с преобладанием местных воспалительных явлений.
Диагностика острого гематогенного остеомиелита
1. Пункция кости с внутрикостной термометрией и остеотонометриею - превышение внутрикостной температуры свыше 37,2 градусов и давлении более 100 мм вод. ст. - Свидетельствует о наличии остеомиелита. 2. Цитологические методы диагностики - исследование костномозгового пунктом тату на лейкоцитарный состав. 3. Кожная термометрия и тепловидения - кожная температура над очагом воспаления выше окружающих тканей на 2-4 градуса. 4. УЗИ - позволяет выявить отечность мягких тканей. 5. Рентгенологическая диагностика: а) обзорная рентгенография. Информативная со 2 недели. Отмечается исчезновения губчатой вещества кости с развитием линейного периостита; b) электрорентгенография. Косвенные признаки остеомиелита проявляются на 3-5 сутки; c) цифровая субтракционная ангиография (ЦСА) помогает установить очаг заболевания. Подробнее об этом и других методах ангиографии можно прочитать в приложении 4 в конце книги {прим. ред.)
Осложнения острого остеомиелита
К осложнениям острого остеомиелита относят ненастоящий сустав (формируется после патологического перелома), сегментарный дефект кости (образуется после удаления тотального секвестра), деструктивный вывих и нестабильность в суставах (вследствие полной или частичной деструкции эпифиза), нарушения роста и деформацию костей (на принципе полной или частичной деструкции ростковом зоны). Все вышеперечисленные осложнения подлежат хирургическому лечению (реконструктивные вмешательства на суставах, костная пластика, дистракционный остеосинтез). Неадекватное по времени и объему лечения острого остеомиелита приводит к его подострого течения, сопровождающийся стихания острых воспалительных явлений, улучшением общего состояния больного и улучшением параклинических показателей, но со стороны locus morbi хранятся умеренная инфильтрация мягких тканей и некоторое повышение местной температуры, хотя боль, как правило, стихает. Если патологический процесс длится более 4-6 месяцев, то в таких случаях речь идет уже о переходе к хронической стадии заболевания - вторично-хронического остеомиелита.
Лечение острого остеомиелита
Базируется на следующих принципах: 1. Влияние на макроорганизм. Борьба с интоксикацией, иммунотерапия, десенсибилизирующая и витаминотерапия. 2. Влияние на микроорганизм. Рациональная антибиотикотерапия. 3. Влияние на очаг заболевания. Своевременная и адекватная локальная декомпрессия, локальная антибиотикотерапия, рациональная фиксация.Хирургические мероприятия при остром гематогенно остеомиелите заключаются в декомпрессии очаге заболевания (I-II фазы), периостотомии (III фаза), дренировании флегмоны мягких тканей (IV фаза).
Билет №47
Остеомиелиты. Принципы терапии: консервативное и оперативное лечение. Осложнения.
Гидронефроз. Эмбриогенез, классификация, клиника, методы исследования, дифф.-диагностические критерии.
Повреждения печени. Клиника. Диагностика. Лечение.
1. Лечение остеомиелита у детей
Современная терапия детского остеомиелита базируется на двух основных принципах — влиянии на микро- и макроорганизмы и непосредственно на очаг заболевания (то есть поражённый участок кости). Все методы лечения проводятся в стационарных условиях:
иммунотерапия;
десенсибилизирующая терапия — подкожное введение стафилококковых антифагина, стафилококкового анатоксина, фильтрата, стафилококковой, стрептококковой вакцины, бактериофага для утраты повышенной чувствительности организма к аллергену;
витаминотерапия;
антибиотики;
локальная декомпрессия — устранение сдавления костного мозга, его сосудов и корешков, удаление патологических образований, сдавливающих сосудистые и нервные структуры, часто сочетается со стабилизацией;
фиксация поражённого участка;
периостотомия — хирургическая операция, при которой рассекается надкостница (периоста) с отслоением (частичным) от кости;
дренирование (отток, откачивание гнойного содержимого) флегмоны (очага воспаления) мягких тканей.
После выписки из больницы проводятся амбулаторно массаж, лечебная физкультура, санация поражённых очагов, бальнеотерапия (воздействие минеральными водами). Стационарное лечение продолжают проводить дважды в год (обычно осенью и весной), включая иммуномодуляторы, десенсибилизирующую, магнито- , лазеро- и витаминотерапию, электрофорез с антибиотиками. Регулярно проводится контрольное рентгенологическое исследование: через полгода после выписки, а в дальнейшем — раз в год в течение трёх лет. В реабилитации детей важную роль играет санаторно-курортное лечение. Если проигнорировать основные методики терапии, последствия данного заболевания могут быть самыми плачевными.
К осложнениям острого остеомиелита относят ненастоящий сустав (формируется после патологического перелома), сегментарный дефект кости (образуется после удаления тотального секвестра), деструктивный вывих и нестабильность в суставах (вследствие полной или частичной деструкции эпифиза), нарушения роста и деформацию костей (на принципе полной или частичной деструкции ростковом зоны). Все вышеперечисленные осложнения подлежат хирургическому лечению (реконструктивные вмешательства на суставах, костная пластика, дистракционный остеосинтез). Неадекватное по времени и объему лечения острого остеомиелита приводит к его подострого течения, сопровождающийся стихания острых воспалительных явлений, улучшением общего состояния больного и улучшением параклинических показателей, но со стороны locus morbi хранятся умеренная инфильтрация мягких тканей и некоторое повышение местной температуры, хотя боль, как правило, стихает. Если патологический процесс длится более 4-6 месяцев, то в таких случаях речь идет уже о переходе к хронической стадии заболевания - вторично-хронического остеомиелита.
2. Гидронефроз – прогрессирующее расширение лоханки и чашечек почки, возникающее вследствие нарушения оттока мочи из почки из-за препятствия в области лоханочно-мочеточникового сегмента. Данное нарушение оттока мочи приводит к истончению паренхимы почки и угасанию ее функции.
Общая частота развития гидронефроза составляет 1:1500. У мальчиков гидронефроз встречается в 2 раза чаще, чем у девочек. В 20% гидронефроз может быть двусторонним.
Причины гидронефроза у детей
В основном различают 5 видов аномалий, вызывающих обструкцию в области лоханочно-мочеточникового соустья:
складка слизистой в виде клапана в области соустья
стриктура прилоханочного отдела мочеточника
высокое отхождение мочеточника от лоханки
фиброзные тяжи, спайки, вызывающие фиксированное искривление мочеточника, благодаря сращению последнего с лоханкой или почкой
добавочные сосуды к почке, вызывающие сдавление мочеточника или его перегиб.
Указанные аномалии вызывают нарушение нормального оттока мочи из почки, что в конечном итоге приводит к превращению последней в тонкостенную, обычно многокамерную кисту, сама же паренхима почки резко атрофируется.
Важную роль в развитии гидронефроза играет тип почечной лоханки. При внепочечном (экстраренальном) расположении лоханки компенсаторная функция почки более длительно выражена, за счет расширения лоханки вне почечной паренхимы. При внутрипочечной (интраренальной) лоханке расширение имеет место в основном за счет атрофии окружающей ее ткани паренхимы и поэтому почка значительно быстрее погибает.
Классификация гидронефроза
Гидронефроз подразделяют на 3 стадии:
I стадия (пиелоэктазия) – расширение только лоханки почки
II стадия – расширение лоханки и чашечек почки, уменьшение толщины паренхимы и значительное снижение функции почки
III стадия (терминальная) – атрофия паренхимы почки и превращение ее в тонкостенный мешок.
А.Я. Пытель и Н.А. Лопаткин (1970) различают: а) первичный, или врожденный, гидронефроз как результат порока развития почки или верхнего отдела мочеточника; б) вторичный, или приобретенный, гидронефроз, возникающий вследствие приобретенных заболеваний (повреждение мочевых путей, мочекаменная болезнь, опухоль мочеточника и мочевого пузыря).
Патогенез гидронефроза
Повышенное внутрипочечное давление и расширение чашечек сдавливают кровеносные сосуды, усиливают ишемизацию паренхимы, уменьшают клубочковую фильтрацию. Повторяющиеся пиело-ренальные рефлюксы вызывают мочевую инфильтрацию межуточной ткани и наводнение ее белком с последующим развитием склеротической ткани.
Развитие гидронефроза ускоряет присоединяющаяся инфекция. Инфицированная моча вследствие пиело-ренальных рефлюксов ускоряет гибель паренхимы. При нарушенном пассаже мочи функция нефрона снижается и, следовательно, внутрипочечное давление нарушает лимфо- и кровообращение в почке.
Таким образом, в паренхиме почки, независимо от вида обструкции пиелоуретерального сегмента, возникают идентичные изменения, конечным результатом которых является атрофия почечной ткани. Наиболее ускоренный тип ее развития отмечен у детей младшего возраста и при пиелонефрите.
Клиническая картина гидронефроза
Чаще всего гидронефроз протекает бессимптомно. Диагноз гидронефроз достаточно часто устанавливается при УЗИ обследовании органов мочевыделительной системы у плода. В более старшем возрасте поводом для обследования служит инфекция мочевых путей (изменения в анализах мочи, повышение температуры тела) во время какого-либо инфекционного заболевания, либо случайная находка при проведении УЗИ органов брюшной полости или мочевыделительной системы. Изменения в анализах мочи в виде лейкоцитурии, микро- и макрогематурии. У некоторых детей диагноз гидронефроз устанавливается в связи с обнаружением в подреберье видимой или легко ощутимой опухоли. Боль – наиболее частный симптом. Характер ее зависит от степени выраженности стеноза лоханочно-мочеточникового сегмента и вида осложнения. При отсутствии пиелонефрита и умеренно нарушенной уродинамики жалобы на боль появляются лишь в поздние сроки. У детей младшего возраста в этот период боли обычно связывают с нарушением функции желудочно-кишечного тракта.
При значительно выраженной обструкции верхних мочевых путей боли интенсивные и продолжительные.
При гидронефрозе так же возможно возникновение почечной колики на почве внезапно возникшего затрудненного оттока мочи из обычно инфицировавшейся гидронефротической или прегидронефротической почки. У взрослых пациентов внезапная обтурация лоханки, вызванная резким перегибом мочеточника при нефроптозе или камнем, так же характеризуется острыми болями типа почечной колики.
Диагностика гидронефроза у детей
Вследствие развития внутриутробной диагностики, гидронефроз определяется уже на ранних стадиях беременности при УЗИ обследовании органов мочевыделительной системы плода. Обычно исследование проводят на 16-18 недели беременности с обязательной визуализацией почек. Наиболее чувствительным для исследования мочевых путей считают 28 неделю беременности.
Таким образом, одним из основных первостепенных методов обследования является УЗИ почек и мочевого пузыря.
Узи признаки гидронефроза
При проведении ультразвукового исследования выявляется увеличение размеров почки за счет расширения лоханки и чашечек, истончение паренхимы и ее уплотнение. Обеднение кровотока в ткани почки отмечается при выполнении УЗИ с доплерографией.
При выявлении признаков гидронефроза в результате проведения УЗИ обследования органов мочевыделительной системы, показано проведение рентгенурологического обследования, включающего внутривенную урографию, цистографию, ретроградную пиелографию. В качестве дополнительных методов обследования, для дифференциальной диагностики сомнительных случаев гидронефроза, применяется УЗИ исследование с лазиксной нагрузкой. При необходимости используют ангиографию, динамическую или статическую нефросцинтиграфию.
Внутривенная урография при гидронефрозе
Для гидронефроза при проведении внутривенной урографии характерно расширение лоханки, монетообразная деформация чашечек. Мочеточник чаще всего не контрастируется или визуализируется на отсроченных снимках.
Лечение гидронефроза – оперативное
В нашей клинике для лечения гидронефроза применяются: лапароскопическая пиелопластика с установкой внутреннего стента, миниинвазивные (хирургический доступ из разреза 3-4 см) открытые операции пластики пиелоуретерального сегмента по Хайнес-Андерсену (Anderson, Hynes), стентирование лоханочно-мочеточникового сегмента стентами различной длины и диаметра в зависимости от возраста пациента.
3.
Билет №48
Профилактика гнойной хирургической и внутрибольничной инфекции (приказ №720).
Повреждения полых органов брюшной полости. Клиника. Диагностика. Лечение.
Хронический остеомиелит. Клиника. Диагностика. Лечение.
Санитарно - профилактический режим - это целый комплекс организованных, профилактических и противоэпидемических мероприятий, надежно препятствующих возникновению внутрибольничной инфекции. Он определяется профилем медицинского учреждения. 31 июня 1978 года издан приказ МЗ СССР № 720 «Об улучшении медицинской помощи больным с гнойными хирургическими заболеваниями и усилением мероприятий по борьбе с внутрибольничной инфекцией». Для среднего медицинского персонала чрезвычайно важно, с целью предупреждения возникновения внутрибольничной инфекции, знать: пути проникновении инфекции в рану, а так же комплекс мероприятий, направленных на предупреждение попадания инфекции в рану. А в случае попадания инфекции в рану, знать методы борьбы с ней.
Различают два источника хирургической инфекции: экзогенный (внешний) и эндогенный (внутренний). Эндогенная инфекция встречается значительно реже экзогенной, т.к. хирурги знают о такой возможности и в предоперационном периоде тщательно изучают больного, чтобы выявить очаги вялотекущей гнойной инфекции и ликвидировать их до операции. Капельная инфекция возникает от попадания в рану капелек слюны, разлетающихся по воздуху при разговоре.
Профилактика: ношение 4-х слойных масок, не разрешается разговаривать в операционной и перевязочной.
^ Контактная инфекция имеет наибольшее практическое значение, т.к. в большинстве случаев загрязнение ран происходит контактным путем. В настоящее время профилактика контактной инфекции является главной задачей операционных сестер и хирургов. ^ Имплантационная инфекция вносится вглубь тканей при инъекции или с инородными телами, протезами, шовным материалом. Профилактика: тщательная стерилизация шовного материала, протезов, предметов, имплантируемых в ткани организма. ^ Химические методы - это применение химических антисептиков (спирты, окислители, соли тяжелых металлов, галлоидосодержащие вещества, формальдегиды, фенолы, красители, производные нитрофурана, детергенты, сульфаниламидные препараты). ^ Физические методы - это дренирование раны (активное и пассивное), применение гипертонических растворов (10% раствор NaCl), высушивание, УФО, кварцевание, применение лазера и ультразвука, электрофорез с растворами антисептиков, магнитные мази. ^ Биологическая антисептика - применение вакцин, сывороток, антибиотиков, ферментов (трипсин, химотрипсин), фитонцидов (хлорфиллипт). Асептика - это комплекс мероприятий, обеспечивающих предупреждение попадания микробов в операционную рану. Для этой цели используются организационные мероприятия, физические факторы, некоторые антисептические и химические препараты.
Различают открытые и закрытые травмы живота. Открытые травмы делят напроникающие и непроникающие. Открытые и закрытые ранения могут быть с повреждением внутренних органов и без него.
Повреждения полых органов подразделяют на ушибы, раздавливания, полные или частичные разрывы (надрывы). К надрывам относят повреждения серозной и мышечной оболочек органа с сохранением целости слизистой оболочки.
Повреждения паренхиматозных органов делят на повреждения без нарушения целости капсулы органа и с ее нарушением (трещины, разрывы, отрывы, размозжения).
Повреждения органов забрюшинного пространства (полых и паренхиматозных) аналогичны повреждениям органов брюшной полости. При нарушении целости сосудов в этой области возникает кровоизлияние в забрюшинную клетчатку и образуется забрюшинная гематома.
Симптомы повреждения полых органов пищеварения при закрытой травме живота встречаются реже, чем симптомы повреждения паренхиматозных органов. Симптоматика данной патологии разнообразна. Некоторые симптомы появляются сразу же после травмы, другие - в более позние сроки. Часто вначале возникает шок. В ранние сроки после травмы пульс учащен. Отмечается боль в животе, которая вначале локализована, а затем становится разлитой. Очень важным ранним симптомом является напряжение мышц брюшной стенки. Печеночная тупость часто исчезает при разрывах желудка и очень редко - при разрывах кишок. В более поздние сроки нарастают симптомы перитонита: постепенно увеличивается вздутие живота, появляются икота и рвота, язык обложенный и сухой, симптом Щеткина определяется по всему животу, кишечные шумы ослаблены или не выслушиваются. Пульс частый и малый. Кроме клиники перитонита, при разрывах полых органов всегда имеются признаки кровотечения, выраженные в большей или меньшей степени.
Неотложная помощь и госпитализация. Все больные с закрытой травмой живота не только при повреждении органов брюшной полости и забрюшинного пространства, но даже при малейшем подозрении на него, подлежат немедленной госпитализации в хирургическое отделение. Категорически запрещается вводить обезболивающие препараты до окончательного решения вопроса о целесообразности проведения лапаротомии. Транспортировку таких больных осуществляют на носилках.
Открытые ранения живота могут быть поверхностными, то есть только в пределах кожи и подкожной основы, и глубокими - подфасциальными (относительно поверхностной фасции).
Симптомы. Имеется рана брюшной стенки с продолжающимся или самостоятельно остановившимся наружным кровотечением той или иной интенсивности. Болезненность локальная. Признаков перитонита и внутрибрюшного кровотечения нет. Окончательный ответ на вопрос о том, является ли ранение проникающим или нет, можно дать только во время хирургической обработки раны в операционной.
Проникающие ранения живота. Характерным их признаком является повреждение целости париетальной брюшины.
Симптомы связаны с развитием внутрибрюшного кровотечения и (или) перитонита в результате повреждения внутренних органов. При проникающих ранениях чаще происходит повреждение полых органов (тонкой кишки). При этом наблюдаются перитонеальные явления, кровотечение в брюшную полость обычно бывает массивным и обусловлено не только нарушением целости стенки органа, но и повреждением сосудов брюшной стенки и брюшной полости. Часто встречаются множественные повреждения одного и того же органа.
Отмечаются бледность кожных покровов и видимых слизистых оболочек, тахикардия, снижение артериального давления, учащение дыхания, боль в животе, разлитая болезненность при пальпации, напряжение брюшной стенки, положительный симптом Щеткина. В брюшной полости обнаруживают свободную жидкость. Исчезает печеночная тупость, живот вздут, возникает рвота.
Неотложная помощь. Рану следует закрыть асептической повязкой. При выпадении через рану сальника или петель кишок вправлять их в брюшную полость запрещается. При безусловных признаках проникающего ранения допустимо обезболивание. В зависимости от состояния больного проводят противошоковые мероприятия. Всех больных с проникающими и непроникающими ранениями живота госпитализируют в хирургический стационар в экстренном порядке на носилках.
3. Хронический остеомиелит - остеомиелит с течением воспалительного процесса более 4-6 месяцев. Выделяют: • Вторично-хронический остеомиелит как следствие острого гематогенного остеомиелита. • Первично-хронический (или атипичный) остеомиелит с хроническим течением без четкой субъективной симптоматики.
Вторично-хронический остеомиелит Клиника вторично-хронического остеомиелита
Вторично-хронический характеризуется чередованием ремиссии и обострений. В фазу ремиссии ребенок чувствует себя хорошо, жалоб нет, температура тела нормальная. Среди локальных данных можно определить лишь умеренное увеличение объема пораженного сегмента. В фазу обострения состояние больного ухудшается, повышается температура тела, растут симптомы интоксикации, появляется боль в locus morbi и другие признаки воспаления: боль при перкуссии и пальпации, инфильтрация мягких тканей, повышение местной температуры. Вскоре возникает параосальная флегмона или открывается свищ, из которого выходит гной, а иногда и мелкие секвестры. Такое чередование фаз обострения и ремиссии длится годами и инициирует дистрофические поражения почек, печени, сердца, а также может перейти в хрониосепсис.
Диагностика вторично-хронического остеомиелита
Рентгенологическое исследование при вторично-хроническом остеомиелите обнаруживает как деструктивные, так и пролиферативные изменения кости в виде склероза, полостных внутрикостных образований большего или меньшего размера с секвестры или без них. В период обострения появляется периостит, который впоследствии ассимилируется. При значительных явлениях склероза и небольших по размерам полостных очагах воспаления последние на обзорной рентгенограмме могут не определяться и проявляться лишь при томографии. Фистулография помогает определить ход свища и его связь с внутрикостным очагом воспаления и секвестром.
Первично-хронический остеомиелит Клиника первично-хронического остеомиелита
В отличие от вторично-хронического процесса, которому предшествует манифестовани острый хронический остеомиелит, при первично-хроническом течении заболевания острой фазы нет, болезнь изначально характеризуется "холодным" течением и "смазанностью" клинических проявлений. Дискомфорт, незначительные боли в течение длительного времени остаются нелокализированными, преобладает симптом длительного "щажение" пораженной конечности, может быть повышение температуры тела до субфебрильных цифр. Больные обращаются в стационар в связи с устойчивым болевым синдромом или же при появлении четкой локальной симптоматики: инфильтрация параосальных тканей, повышение местной температуры, боль при пальпации кости, ее утолщение, редко может наблюдаться флегмона мягких тканей и даже может открыться свищ. Лабораторные тесты малоинформативные (могут быть умеренно повышенными лейкоцитоз, лимфоцитоз, ускорение СОЭ).
Среди первично-хронического гематогенного остеомиелита выделяют: • Абсцесс Brodie • Остеомиелит Garre • Апьбуминозний остеомиелит Oilier • антибиотическое остеомиелит Попкирова • опухолевидное остеомиелит Абсцесс Brodie чаще встречается у мальчиков и локализуется преимущественно в метафизе длинных трубчатых костей. Типичным и любимым местом гнойника являются кости, образующих коленный сустав, большеберцовая кость поражается в 80% случаев; в близлежащем суставе может возникать "дружественных" синовит. При рентгенологическом исследовании у метафиза длинной трубчатой кости определяется круглая или овоидные полость с четкими склерозированные пределами, очень редко в полости абсцесса может находиться маленький секвестр. Остеомиелит Garre еще иначе называется склерозирующим и чаще поражает диафиз и метадиафиз бедренной и большеберцовой костей. При этой патологии отмечается утолщение кости, уплотнение параосальных мягких тканей, мышц, но кожа, как правило, не меняется. Рентгенологически отмечается воронкообразное (иногда полуворонкообразное) утолщение кости на принципе плотной гомогенного склероза, костно-мозговой канал резко сужен. Очень редко на фоне склероза могут находиться ячейки деструкции и маленькие секвестры. Альбуминозний остеомиелит Oilier также зачастую поражает бедренную и большеберцовой кости. Рентгенологическая картина заболевания тождественна типичном хроническом ГО, но клинически типового навоза не бывает - вместо него образуется белковый экссудат, напоминающий синовиальную жидкость. Антибиотический остеомиелит (впервые было описано С. Попкировим) разворачивается как следствие вялого течения патологического процесса на фоне массивной пролонгированной общей антибиотикотерапии. Болезнь характеризуется несоответствием клинической и рентгенологической картин: при почти бессимптомном локальном клиническом течении рентгенологически определяются манифестовани деструктивно-пролиферативные тотальные или субтотальные изменения пораженной кости, вплоть до образования крупных секвестров. Опухолевидное ход первично-хронического ХО сопровождается несоответствием клинической и рентгенологической картин (скудность первой при выразительности второй). Рентгенологические проявления опухолевидного остеомиелита в основном отмечаются в двух вариантах: • с преобладанием метафизарных деструкции и кистоподибнимы изменениями; • диафизарные деструкция с "лукообразными" реакциями надкостницы. Решающее значение в постановке диагноза в подобных ситуациях имеет цитологическое исследование пунктата из очага поражения, которое помогает отклонить диагноз бластоматозного процесса.
Лечение хронического остеомиелита
При хроническом остеомиелите, как и при остром, проводится комплексное лечение, объем которого зависит от фазы заболевания, распространенности процесса, наличия осложнений и сопутствующих изменений со стороны паренхиматозных органов. В фазу обострения влияние на микро- и макроорганизм мало чем отличается от характера терапии острой стадии. Влияние на очаг воспаления в фазу обострения предусматривает декомпрессию внутрикостного гнойника с помощью постоянных игл Апексюка или катетеров, локальную антибиотикотерапию, дренирование пидокисных и межмышечной флегмон, санацию свищей. К хирургическому вмешательству прибегают после стихания воспалительных явлений. Хирургическому лечению подлежат все виды хронического остеомиелита - как первично-, так и вторично-хронические варианты течения. Хирургическое вмешательство предусматривает: 1. Радикальную некрэктомию (удаление всех нежизнеспособных тканей: секвойи встретил, патологических грануляций, избыточного склероза, свищей). 2. Интраоперационную санацию пораженного сегмента (промывание антисептиками, обработка С02-лазер). 3. Множественные перфорации остаточных костных стенок в случае их выразительного склероза и пластика остаточных костных полостей аутоспонгиозою.
49 билет
Встречаются формы остеомиелита, которые с самого начала протекают хронически, не давая обострения процесса.
Этиология и патогенез
Возникая вскоре после перенесенной инфекции или проявляясь через длительный промежуток времени, такие формы остеомиелита протекают медленно, что обусловливается характером, локализацией инфекции и своеобразной реакцией костной ткани на нее.
Патологическая анатомия
Патологоанатомические изменения в костях при хроническом тифозном остеомиелите имеют свои особенности, отличающие этого рода остеомиелит от стафило- и стрептококкового. При локализации очага в диафизе бодра анатомическая картина довольно характерна. На рентгенограмме можно легко видеть ограниченный очаг в кортикальном слое с вяло выраженными репаративными изменениями в ближайших элементах кости. Соответственно костному очагу имеется утолщение периоста. Во время операции под утолщенной, отечной надкостницей обнаруживается изолированный очаг грануляционной ткани и скудное количество тягучей жидкости. Грануляционная ткань проникает на небольшую глубину коркового слоя. Окутанный грануляционной тканью участок коркового слоя имеет зеленоватый цвет, почти не кровоточит, легко крошится, что указывает на его некробиотическое состояние. Гнойной полости чаще всего не бывает.
Такие изменения обычно не достигают эндоста и костного мозга. После иссечения очага в глубине остается слой измененной кортикальной субстанции. Происхождение таких некрозов кости можно объяснить тем, что субпериостальный медуллярный слой чаще всего вовлекается в воспаление; это из-за того, что тромбоз тифозными палочками возникает в наиболее мелких сосудистых разветвлениях — периостальных сосудах.
Характерная картина обнаруживается и в мягких тканях. Вокруг периоста, в межмышечных пространствах есть специфическая грануляционная ткань, но свободного гноя нет. В кортикальном слое находят небольшое отверстие (нередко здесь же можно обнаружить мелкий секвестр). Это отверстие на рентгенограмме распознается как мелкий очажок, который даже может быть не замечен при неудачной проекции.
Очаги поражения могут существовать в кости многие годы, не при водя к нагноению. Слабая склонность к абсцедированию объясняется тем, что инфекция чистыми палочками Эберта или паратифозными сопровождается крайне скудным образованием лейкоцитов, особенно полинуклеаров.
Симптомы первичного хронического остеомиелита
При первично-хроническом остеомиелите внешних признаков воспалительного процесса в первые недели и месяцы заболевания может не быть, но на костях, которые легко прощупываются через кожу (большеберцовая кость), постукиванием удается установить наиболее болезненное место. На бедро, окруженном массой мощных мышц, долго не удается прощупать ничего патологического. Такой «скрытый» период заболевания можно объяснить тем, что первичный очаг возникает чаще всего в кортикальном слое. Когда же воспалительный процесс захватывает периост или эндост и эксудативные явления усиливаются, тогда появляется болезненность, возникает инфильтрат и формируется абсцесс, который, вскрываясь, дает хронический свищ. От образования инфильтрата до возникновения абсцесса может пройти несколько месяцев, а в некоторых случаях — даже и лет. Однако абсцесс образуется не всегда. Чаще костные абсцессы образуются при метафизарных очагах. Гной в таких абсцессах либо жидкий, тягучий, либо кровянистого, слегка кофейного цвета. Температура тела и пульс в период хронического течения остеопериоститов остаются нормальными; в период же обострения с образованием абсцесса температура доходит до 38,5—39°. Общее состояние больного остается хорошим даже при длительном течении заболевания.
Яндекс.Директ
|
|
|
|
Диагноз
Дифференцировать первичные хронические остеомиелиты практически приходится главным образом с сифилитическим и туберкулезным поражением костей. Боли, усиливающиеся по ночам, множественность поражения костей, локализация на большеберцовой кости — эти признаки могут говорить в одинаковой мере как в пользу сифилиса, так и в пользу хронического инфекционного остеопериостита. Отрицательные реакции Вассермана, Закс-Георги, отсутствие прочих признаков сифилиса, безуспешность специфического лечения, тиф и тифоподобпые заболевания в прошлом (даже отдаленном), бактериологические и особенно рентгенологические данные говорят в значительной мере против сифилиса.
Тифозные остеопериоститы возникают преимущественно на диафизах; очаг обычно строго локализован; редко наблюдаются общие тяжелые симптомы; секвестры обычно тонкие, узкие и не имеют больших гиперосто8ов и фунгозной рарефикации новой кости, как при обычных остеомиелитах стафилококкового происхождения.
Положительная реакция агглютинации с возбудителем тифа и паратифа, особенно высокий титр ее, является также признаком тифозного (паратифозного) остеомиелита.
Рентгенологические данные. Явления периостита не имеют такого разлитого характера, а ограничены лишь областью очага. В случае хронического остеомиелита бедра на рентгенограмме обнаруживаются признаки периостита с изолированными мелкими очагами, точную топографию которых нелегко установить. Однако при остеомиелитах и остеопериоститах бедра далеко не всегда можно рентгенографически определить вполне изолированный очаг; чаще можно заметить лишь утолщение кортикального слоя и явления свежего периостита.
Лечение первичного хронического остеомиелита
Консервативное лечение сводится к применению антибиотиков, солнечных ванн, к проведению грязелечения. Последнее оказывает особенно благоприятное действие при наличии свищей: исчезают боли, инфильтраты, нередко стойко закрываются свищи. Однако в подострых случаях грязелечение может вызвать обострение процесса.
Общие принципы оперативного лечения можно сформулировать следующим образом. Радикальные операции предпочтительнее в холодном периоде (в периоде инфильтрата или склероза); очаг следует не вскрывать, а удалять его в пределах здоровых тканей. Образовавшуюся костную полость лучше всего заполнять мышечным лоскутом на ножке. В период абсцесса радикальные вмешательства не рекомендуются, достаточно бывает вскрыть абсцесс и провести лечение антибиотиками.
2) Травма почки (повреждение)
П очки в
связи с их анатомически положением в
определенной степени защищены от
внешнего воздействия. Однако они нередко
повреждаются при травме живота, поясничной
области и забрюшинного пространства.
В 70-80 % травма
почки сочетается
с повреждениями других органов и систем.
В урологические отделения большинство
больных поступают с изолированными
повреждениями почек. Пострадавших с
сочетанными повреждениями чаще направляют
в общехирургические отделения.
очки в
связи с их анатомически положением в
определенной степени защищены от
внешнего воздействия. Однако они нередко
повреждаются при травме живота, поясничной
области и забрюшинного пространства.
В 70-80 % травма
почки сочетается
с повреждениями других органов и систем.
В урологические отделения большинство
больных поступают с изолированными
повреждениями почек. Пострадавших с
сочетанными повреждениями чаще направляют
в общехирургические отделения.
Эпидемиология
Огнестрельные повреждения (ранения) почек встречаются преимущественно в военное время. По данным опыта Великой Отечественной войны, они составляли 12,1 % по отношению ко всем ранениям мочеполовых органов. В последующих военных конфликтах было отмечено увеличение числа ранений почек в 2-3 раза, что, по-видимому, связано с изменением характера огнестрельного оружия. Главная особенность современных огнестрельных повреждений – образование полости по ходу раневого канала, значительно превышающей диаметр ранящего снаряда, с обширной зоной разрушения и некроза, при этом частота сочетанных повреждений превышает 90 %.
В мирное время, среди пациентов урологических стационаров, на долю больных с закрытыми повреждениями почек приходится 0,2-0,3 %.
Классификация
Механическая травма почки по типу подразделяется на:
Закрытая (тупая или подкожная) травма почки:
Ушиб почки (множественные кровоизлияния в почечной паренхиме при отсутствии макроскопического разрыва субкапсулярной гематомы).
Повреждение жировой клетчатки вокруг почки и/или фиброзной капсулы почки.
Субкапсульный разрыв без проникновения в чашечно-лоханочную систему. При этом формируется большая субкапсулярная гематома.
Разрыв фиброзной капсулы и ткани почки с проникновением в чашечно-лоханочную систему.
Размозжение почки.
Травма сосудистой ножки или отрыв почки от сосудов и мочеточника.
Контузия (при дистанционной литотрипсии - ДЛТ).
Открытая (проникающая или ранение) травма почки:
Пулевое ранение.
Осколочное ранение.
Колющее ранение.
Режущее ранение…
В зависимости от характера повреждения:
Изолированная Т.
Сочетанная Т.
Также обязательно указывают область повреждения почки:
Повреждение верхнего сегмента.
Повреждение нижнего сегмента .
Повреждение тела почки.
Повреждение сосудистой ножки.
В зависимости от наличия осложнения:
Осложненная травма.
Не осложненная травма.
Закрытая травма почки
М еханизм
повреждения может быть различным. Имеют
значение сила и направление удара, место
его приложения, анатомическое расположение
почки и ее топографическое взаимоотношение
с XI и XII ребрами, позвоночником, физические
свойства органа, развитие мускулатуры,
подкожной жировой клетчатки и
паранефральной клетчатки, степень
наполнения кишечника, величина
внутрибрюшного и забрюшинного давления.
Разрыв почки происходит либо вследствие
прямой травмы (ушиб поясницы, падение
на твердый предмет, сдавливание тела),
либо от непрямого воздействия (падение
с высоты, ушиб всего тела, прыжки).
Воздействие этих факторов может вызывать
сдавливание почки между ребрами и
поперечными отростками поясничных
позвонков, и также гидродинамическое
воздействие, за счет повышения давления
жидкости (моча, кровь) в почке.
еханизм
повреждения может быть различным. Имеют
значение сила и направление удара, место
его приложения, анатомическое расположение
почки и ее топографическое взаимоотношение
с XI и XII ребрами, позвоночником, физические
свойства органа, развитие мускулатуры,
подкожной жировой клетчатки и
паранефральной клетчатки, степень
наполнения кишечника, величина
внутрибрюшного и забрюшинного давления.
Разрыв почки происходит либо вследствие
прямой травмы (ушиб поясницы, падение
на твердый предмет, сдавливание тела),
либо от непрямого воздействия (падение
с высоты, ушиб всего тела, прыжки).
Воздействие этих факторов может вызывать
сдавливание почки между ребрами и
поперечными отростками поясничных
позвонков, и также гидродинамическое
воздействие, за счет повышения давления
жидкости (моча, кровь) в почке.
При наличии предшествующих травме патологических изменений в почке (гидронефроз, пионефроз, аномалии почек, хронический пиелонефрит) повреждение почки происходит при незначительных по силе ударах – так называемый, самопроизвольный разрыв почки.
К особому виду закрытых травм относят случайное их повреждение во время инструментальных исследований верхних мочевых путей. Разработка и внедрение новых технологий в клиническую урологическую практику привели к появлению особого вида закрытых повреждений почки, к которым относится ударно-волновая дистанционная литотрипсия.
Анатомические изменения в поврежденном органе могут варьировать от незначительных кровоизлияний в ткани до полного ее разрушения. Травматическое поражение может быть и без явного нарушения целостности органа. В этих случаях при гистологическом исследовании обнаруживают морфологические признаки нарушения кровообращения и дистрофические изменения в паренхиме. Функциональные же нарушения при такой травме почки могут быть выражены даже в большей степени.
Открытая травма (ранение) почки
П ричины
и условия возникновения открытых
повреждений почек различны. Особенно
тяжелые открытые повреждения почек
отмечаются при их ранении современным
огнестрельным оружием. Это связано со
сложным строением раневого канала,
обширностью зоны поражения тканей
вокруг раневого канала, частым сочетанным
поражением нескольких смежных областей.
Такие ранения часто осложняются
травматическим шоком и массивной
кровопотерей.
ричины
и условия возникновения открытых
повреждений почек различны. Особенно
тяжелые открытые повреждения почек
отмечаются при их ранении современным
огнестрельным оружием. Это связано со
сложным строением раневого канала,
обширностью зоны поражения тканей
вокруг раневого канала, частым сочетанным
поражением нескольких смежных областей.
Такие ранения часто осложняются
травматическим шоком и массивной
кровопотерей.
Большинство огнестрельных ранений почек с полным основанием можно отнести к тяжелым. Довольно часто встречается полное размозжение почки. Особенно тяжелыми бывают ранения из дробового ружья. Возможный отрыв почки от сосудистой ножки не всегда приводит к смертельному кровотечению, поскольку внутренняя оболочка артерии вворачивается в просвет сосуда.
Ножевые раны чаще имеют вид линейных разрезов, которые могут располагаться как радиально, так и в поперечном направлении по отношению к почечным сосудам. Последнее обстоятельство имеет определенное значение для выбора объема и характера оперативного вмешательства. Чем ближе ранение к почечной ножке, тем больше опасность повреждения крупных сосудов и больше зона инфаркта с последующим его нагноением и расплавлением. При повреждении чашечно-лоханочной системы, мочеточника и невыполнении оперативного вмешательства, наступает мочевая инфильтрация с развитием флегмоны забрюшинного пространства, а при ранениях проникающих в брюшную полость – перитонит.
Cимптомы
Симптомы при закрытых повреждениях
Для повреждений почек характерно тяжелое состояние пациентов, обильное кровотечение, выраженные боли, часто – выделение мочи в окружающие ткани, расстройства мочеиспускания (дизурия) и нарушение функций внутренних органов, что нередко способствует развитию как ранних, так и поздних осложнений.
Клинические проявления разнообразны и во многом определяются видом и степенью тяжести травмы. Для повреждения почек характерна триада симптомов:
Боль в поясничной области.
Припухлость поясничной области.
Гематурия (кровь в моче).
По характеру боли могут носить тупой, острый, коликообразный характер, с иррадиацией в паховую область. Тошнота, рвота, вздутие живота, симптомы раздражения брюшины, повышение температуры тела нередко становятся причиной диагностической ошибки.
Гематурия – самый частый и существенный признак травмы почки. Микрогематурия выявляется практически у всех больных подобным повреждением.
Помимо перечисленных симптомов, травма почки может сопровождаться и нетипичными, но важными с диагностической точки зрения признаками:
Дизурия вплоть до полной задержки мочи вследствие тампонады мочевого пузыря сгустками крови.
Боли внизу живота.
Симптомы раздражения брюшины.
Нарушения функции желудочно-кишечного тракта (ЖКТ).
Признаки внутреннего кровотечения.
Лихорадка (в результате развития посттравматического пиелонефрита и нагноения урогематомы).
В зависимости от клинической картины выделяют 3 степени тяжести:
Травма почки легкой степени – общее состояние пострадавшего слабо нарушено, имеют место умеренные боли в поясничной области, кратковременная незначительная микро- или макрогематурия, околопочечная гематома отсутствует, признаков раздражения брюшины нет. Данный вид повреждения обозначают как ушиб почки.
Травма почки средней степени тяжести – общее состояние из удовлетворительного быстро переходит в состояние средней степени тяжести (пульс учащается, артериальное давление снижается), гематурия выражена и может продолжать увеличиваться. Скопление крови вмочевом пузыре может вызвать дизурию (нарушение мочеиспускания), вплоть до полной задержки мочи. Под кожей в области травмы, у части больных, отчетливо заметна гематома. Боль незначительна и зачастую иррадиирует в нижнюю часть живота, паховую область, половые органы. Обтурация мочеточника сгустками крови может привести к развитию почечной колики. Урогематома может приводить к развитию симптомов раздражения брюшины.
Травма почки тяжелой степени – на первый план выступают коллапс и шок, наблюдаются сильные боли в поясничной области на стороне поражения, профузная и длительная макрогематурия. Урогематома и признаки внутреннего кровотечения имеют тенденцию к нарастанию.
Симптомы при открытом повреждении (ранении)
Открытые повреждения (ранения) почки по клиническим проявлениям, принципам диагностики и лечения во многом схожи с закрытыми. Основные симптомы ранений:
Боль в области раны.
Гематурия.
Урогематома.
Наличие раны и раневого канала.
Истечение мочи из раны.
Истечение мочи из раны, хотя и самый достоверный симптом, однако редко встречается в ранние сроки после повреждения. При подозрении на ранение почки можно использовать методику с реактивом Несслера, с целью определения мочи в кровянистых выделениях из раны. Урогематома при ранениях почки формируется редко.
Боль в поясничной области бывает различной интенсивности и зависит от состояния раненного и степени повреждения не только почки, но и других органов. Боль обуславливает защитное напряжение мышц живота, причем чем раньше оно появляется и чем сильнее выражено, тем больше оснований заподозрить одновременное поражение органов брюшной полости.
Гематурия также как и при закрытых повреждениях, - ведущий и самый частый симптом травмы почки. Кровь в моче появляется довольно быстро после ранения; уже при первом мочеиспускании или при катетеризации мочевого пузыря, в моче содержится большое количество сгустков крови, что может привести к тампонаде мочевого пузыря. По степени гематурии нельзя судить о виде и объеме поражения почки. Наоборот, самые тяжелые ранения области ворот почки, могут совсем не сопровождаться появлением крови в моче, а небольшие надрывы почечной паренхимы порой ведут к профузной гематурии.
Диагностика
В первую очередь необходимо определить гемодинамические показатели. В случае, когда гемодинамика не стабильна, показано оперативное лечение. При стабильных гемодинамических показателях возможно полное обследование пациента.
О наличии травмы почки могут свидетельствовать гематурия (микро- и макрогематурия), боли в пояснице, в боковых отделах живота и нижней части грудной клетки, припухлость и кровоизлияния, а также напряжение мышц живота, переломы ребер, сочетанные травмы органов брюшной полости, наличие огнестрельных или колото-резанных ран в проекции почки, переломы остистых отростков позвонков.
Лабораторная диагностика
Определение микрогематурии (кровь в моче не видимая на глаз).
Гематокрит (контроль).
Гемоглобин (контроль)
Инструментальные методы диагностики
Рентгенологические методы.
УЗИ.
Компьютерная томография.
Магнитно-резонансная томография.
Ангиография.
Лечение
Травма почки требует госпитализации в ближайший хирургический стационар. Для консультации или участия в оперативном вмешательстве целесообразно пригласить специалиста уролога.
При наличии закрытой травмы почки, в большинстве случаев (при стабильных гемодинамических показателях) лечение заключается в динамическом наблюдении и консервативной терапии.
При открытой травме (ранении) почки, проведение консервативной терапии возможно лишь в отдельных случаях:
Изолированное ранение холодным оружием, без значительного разрушения тканей.
При умеренной и кратковременной гематурии и удовлетворительном состоянии пациента.
Абсолютные показания к оперативному лечению при открытых и закрытых травмах:
Нестабильные гемодинамические показатели.
Нарастающая и пульсирующая гематома.
Относительные показания к оперативному лечению при открытых и закрытых травмах:
Нечетко определенная степень травмы.
Экстравазация мочи в большом количестве.
Наличие большого участка нежизнеспособной ткани почки.
Тяжелое повреждение.
Сочетанные травмы, требующие оперативного вмешательства.
Преморбидные или инцидентальные заболевания поврежденной почки.
Неудовлетворительный эффект от проведенного консервативного лечения.
3) )Врожденный вывих бедра - это крайне запущенная степень дисплазии тазобедренного сустава и представляет собой недоразвитие тазобедренного сустава. Отсутствует правильное сочленение костей тазобедренного сустава. Головка бедренной кости выходит за пределы вертлужной впадины, в результате образуется вывих. Либо имеется предрасположенность к вывиху, что в некоторых случаях тоже рассматривают как собственно вывих сустава.
Врожденный вывих бедра у детей встречается в 5-7 случаях из 1000 новорожденных. Девочки в 3-6 раз болеют чаще мальчиков. Левый сустав поражается чаще, иногда заболевание может быть двустороннее.
Симптомы врожденного вывиха бедра
Выявить врожденный вывих бедра у детей можно только после рождения по следующим симптомам.
Ограничение отведения бедра. Ребенок лежит на спине, ножки ребенка сгибаются под углом 90 градусов в коленных и тазобедренных суставах. После чего разводятся до упора по сторонам до упора. При врожденном вывихе угол разведения ног уменьшается в сравнении с нормальным 160-180 градусов.
Симптом Маркса-Ортолани (симптом «щелчка»). Ребенок лежит на спине, ножки сгибаются в коленных и тазобедренных суставах под прямым углом. Они сводятся вместе, а затем постепенно раздвигаются по сторонам. Со стороны вывиха отчетливо слышен щелчок.
Укорочение длинны ножки ребенка со стороны вывиха. Для выявления этого симптома нужно согнуть ножки вашего ребенка в коленях и постараться прижать их к животу.
Несимметричные кожные складки на ногах. На выпрямленных ногах ребенка и спереди и сзади кожные складки должны быть относительно симметричны.
При обнаружении одного из этих четырех симптомов следует немедленно обратиться к лечащему врачу для более тщательного осмотра. Для уточнения диагноза применяют рентген и ультразвук.
Лечение врожденного вывиха бедра
Последствия врожденного вывиха бедра при отсутствии лечения могут быть довольно серьезными. Невылеченный в детстве вывих может привести к диспластическому коксартрозу во взрослом возрасте.
Чем раньше вы начнете лечение данного заболевания, тем более эффективным оно будет. Чаще всего используют традиционное лечение. Мать уже в роддоме обучают ЛФК и правильному пеленанию (ножки должны лежать свободно и максимально отводиться в стороны). Суть консервативного лечения в том, чтобы относительно зафиксировать кости тазобедренного сустава в таком положении, при котором головка бедренной кости будет находиться в центре вертлужной впадины. В таком положении головка сустава постоянно раздражает и стимулирует к отстройке недоразвитую крышку суставной впадины.
Для фиксирования ножек младенца в постоянно отведенном состоянии используют специальные ортопедические приспособления (стремена Павлика, подушка Фрейка, шина Виленского и шина Волкова). Чаще всего при лечении врожденного вывиха бедра применяют именно Стремена Павлика (изобретение чешского ортопеда Арнольда Павлика). Шина позволяет фиксировать ноги ребенка в положении разведения, при этом сохраняя подвижность ног в определенных пределах. Длительность лечения контролируется рентгеном. Длится до тех пор, пока не сформируется крышка вертлужной впадины сустава.
При лечении детей старше года используют постепенное липкопластырное вытяжение Соммервила, усовершенствованное Мау. Суть метода примерно та же – инициируется отстройка крышки вертлужной впадины.
Если консервативное лечение не дало результатов, или в случаях, когда заболевание было обнаружено поздно, применяют хирургическое вмешательство. На сегодняшний день существует большое множество различных видов операций, направленных на лечение врожденного вывиха бедра. Чаще используют внесуставные операции. При таких операциях сохраняются выработанные адаптационные механизмы и создаются благоприятные условия для дальнейшего функционирования сустава. Для лечения врожденного вывиха бедра у детей и подростков чаще используют операцию Солтера. Для лечения взрослых – надацетабулярную остеотомию таза по Хиари и прочие артропластические операции профессора А.М. Соколовского.
Правильное и своевременно начатое лечение является залогом быстрого выздоровления при врожденном вывихе бедра.
50 билет
Острый аппендицит у детей это самое распространенное хирургическое заболевание в этом возрасте. Операции при остром аппендиците составляют 75% всех экстренных оперативных вмешательств. Сообщается следующая заболеваемость острым аппендицитом: от года до 3 — 0,6 на 1000; от 4 до 7 — 2,6 на 1000; 13 лет — 8 на 1000. Анатомо-физиологические особенности илеоцекального отдела и аппендикса у детей.
Высокая подвижность слепой кишки в возрасте до трех лет из-за длинной брыжейки и нарушения процесса эмбрионального развития оказывает существенное влияние на клинические проявления заболевания.
У детей первого года жизни аппендикулярный клапан отсутствует или слабо развит, что обусловливает свободное отхождение кишечного содержимого из аппендикса в слепую кишку, отсутствие возможности формирования каловых камней и застойных процессов в отростке.
Вариабельность расположения червеобразного отростка: нисходящее положение (35%); медиальное и срединное положение (26%); ретроцекальное положение (20%); латеральное положение (15%), что обусловливает разнообразие симптомов острого аппендицита у детей.
У детей до трех лет червеобразный отросток формы конуса, что не способствует возникновению застойных явлений, и редкость заболевания в этом возрасте.
Тонкость стенки червеобразного отростка и слабое развитие мышечных слоев обусловливают более раннее развитие острого аппендицита у детей до 3 лет.
Недостаточное развитие фолликулярного аппарата червеобразного отростка, играющего важную роль в патогенезе аппендицита.
Наличие анастомозов между лимфатическими сосудами илеоцекального отдела кишечника с лимфатической системой внутренних органов брюшной полости и забрюшинного пространства, создающих условия для генерализации воспалительного процесса лимфатическим путем.
Морфофункциональная незрелость нервных сплетений червеобразного отростка, особенно у детей младшего возраста, чем объясняется тяжесть острого аппендицита у детей в первые годы жизни.
Недоразвитие сальника у детей в первые годы жизни обусловливает генерализацию воспалительного процесса при осложненном аппендиците.
Обильное кровоснабжение брюшины, быстрое вовлечение ее в воспалительный процесс, с низкой способностью к отграничению воспалительного процесса и высокой всасывающей способностью.
Патогенез острого аппендицита у детей
Существуют две теории, объясняющие механизм развития воспаления в отростке: нерв но-сосудистая и теория застоя.
Нервно-сосудистая теория объясняет возникновение острого аппендицита через нарушения деятельности ЖКТ и висцеро-висцеральную импульсацию, которая отражается на сосудистой трофике аппендикса. Спазм гладких мышц и сосудов приводит к нарушению питания стенки отростка вплоть до некроза. Изменяется проницаемость слизистой оболочки для микрофлоры с последующим развитием воспаления.
Теория застоя объясняет развитие острого аппендицита обструкцией червеобразного отростка кишечным содержимым с последующим повышением давления в его просвете, ухудшением лимфатического оттока, ведущим к отеку и набуханию ткани отростка. Нарушение венозного оттока в условиях высокого внутрипросветного давления и отека приводит к ишемии слизистой оболочки и инвазии микрофлоры.
Патология.
Катаральный аппендицит у детей характеризуется отечной и гиперемированной серозной оболочкой. Микроскопически определяются дефекты слизистой оболочки, покрытые фибрином и лейкоцитами.
Флегмонозный аппендицит у детей проявляется гнойным воспалением всех слоев червеобразного отростка. Макроскопически отросток гиперемирован, напряжен и утолщен, покрыт фибрином. Микроскопически определяется микроциркуляторная инфильтрация всех слоев отростка, В слизистой оболочке отмечаются изъязвления, нагноение и частичное отторжение.
Гангренозный аппендицит у детей характеризуется глубокими деструктивными изменениями всей стенки червеобразного отростка. Макроскопически отросток утолщен, темно-серого цвета, с гнойно-фибринозными наложениями. Микроскопически — некроз стенок отростка.
Признаки острого аппендицита у детей
Боль в животе постоянного характера, возникающая постепенно, с локализацией в эпигастральной области или околопупочной области, перемещающаяся в правую подвздошную область, не исчезающая во время сна.
Рвота рефлекторного характера, одно- или двукратная, не приносящая облегчения.
Температурная реакция в пределах до 38 °С.
Расхождение пульса и температуры: при повышении температуры тела на один градус частота пульса учащается на 8-10 в минуту.
Нарушения функции кишечника проявляются в виде задержки стула.
Напряжение мышц брюшной стенки при пальпации.
Симптом Филатова — усиление боли при пальпации в правой подвздошной области.
Боль в правой подвздошной области при глубокой пальпации живота.
Положительный симптом Щеткина-Блюмберга — усиление болезненности в животе после постепенной глубокой пальпации с последующим отнятием руки от брюшной стенки.
Особенности симптомов острого аппендицита у детей в зависимости от возраста
|
||||||||||||||||||||||||||||||||||||||||
Особенности острого аппендицита у детей первых трех лет.
Клиническое течение более тяжелое, с преобладанием общих симптомов из-за недифференцированности реакций нервной системы ребенка на воспалительный процесс.
Неспособность маленького ребенка точно локализовать боль в животе из-за недостаточности морфофункциональной зрелости корковых структур мозга.
Более раннее развитие деструктивных форм аппендицита с генерализацией воспаления по брюшной полости в силу ряда анатомо-физиологических особенностей.
Способность вовлечения в патологический процесс других органов с ранним развитием обменных, гемодинамических и микроциркуляторных нарушений.
Изменение поведения ребенка — нарушение сна, беспокойство, плач, отказ от приема пищи.
Рвота, которая носит многократный характер.
Повышение температуры тела до 38-39 °С.
Расстройства стула — у 12-70 % детей отмечается жидкий стул. В случаях задержки стула показана очистительная клизма, что облегчает диагностику.
Обследование живота во время физиологического или медикаментозного сна позволяет определить следующие симптомы: пассивное напряжение мышц брюшной стенки, болезненность в правой подвздошной области, симптом «подтягивания правой ножки и отталкивания правой ручкой» при пальпации, симптом Щеткина-Блюмберга.
Пальцевое ректальное исследование в сомнительных случаях показано у всех детей, так как оно помогает в дифференциальной диагностике с другими заболеваниями.
В периферической крови — гиперлейкоцитоз.
Диагностика острого аппендицита у детей
Лабораторная диагностика заключаете я в исследовании общего анализа крови. Нарастание количества лейкоцитов в периферической крови до 10000-12000 указывает на наличие воспалительного процесса.
Пальцевое ректальное исследование проводится в сомнительных для диагностики случаях с целью выявления признаков острого аппендицита тазовой локализации, исключения заболеваний органов таза у девочек, исключения вероятности опухолевых образований в забрюшинном пространстве.
Ультразвуковое исследование брюшной полости, почек, половых органов у девочек:
Прямые признаки острого аппендицита:
— в продольном сечении — трубчатая структура со слепым концом с одной стороны:
— в поперечном сечении — симптом «мишени»;
— величина наружного диаметра более 6 мм;
— толщина стенки отростка более 2 мм;
— неоднородная структура отростка, несжимаемая при компрессии.
Косвенные признаки острого аппендицита:
— наличие свободной жидкости вокруг аппендикса;
— наличие свободной жидкости в тазу;
— утолщение стенки слепой кишки;
— парез кишечника.
Лечение острого аппендицита у детей
При невозможности подтвердить или снять диагноз острого аппендицита после первичного обследования осуществляется диагностическое наблюдение в условиях хирургического отделения с повторными осмотрами каждые 2-3 ч. Наблюдение осуществляется в течение 12 ч, после чего диагноз острого аппендицита исключается или принимается решение о проведении диагностической лапароскопии.
Этапы лечения:
— антибиотики до операции назначаются за 30 мин всем детям с целью профилактики раневых послеоперационных осложнений. Во время операции антибиотики вводятся по показаниям в зависимости от степени воспалительного процесса:
— доступ в брюшную полость по Волковичу-Дьяконову;
— обнаружение червеобразного отростка и оценка воспалительных изменений (катаральный, флегмонозный, гангренозный, перфоративный);
— аппендэктомия:
— удаление из брюшной полости электроотсосом воспалительного экссудата;
— ушивание операционной раны с наложением косметического шва при неосложненных формах аппендицита.
При выявлении катарального аппендицита показано дополнительное обследование брюшной полости: осмотр брыжейки тонкой кишки на наличие мезаденита, ревизия подвздошной кишки с целью проверить наличие дивертикула Меккеля, осмотр придатков матки у девочек.
Острый аппендицит после операции
Ранний двигательный режим.
Раннее энтеральное кормление.
Антибиотики при остром аппендците у детей
— при неосложненном (флегмонозном) аппендиците не показана;
— при гангренозном аппендиците проводится в течение 24-48 ч;
— при перфоративном аппендиците проводится в течение 5 суток.
Контрольное УЗИ брюшной полости на 3-4-й день и перед выпиской из хирургического отделения.
Швы снимаются на 7-8 сутки.
2) Ожоговая болезнь. Что такое ожоговая болезнь? Стадии ожоговой болезни. При достаточно обширной травме у пострадавшего возникает ожоговая болезнь. Она включает в себя комплекс многочисленных клинических синдромов, развивающихся вследствие термического повреждения кожных покровов и подлежащих тканей. В течении ожоговой болезни выделяют четыре периода: I — ожоговый шок, II — острая ожоговая токсемия, III — септикотоксемия (ожоговая инфекция), IV — реконвалесценция. I. Ожоговый шок является первым периодом ожоговой болезни. Продолжительность шока (от нескольких часов до нескольких суток) определяется преимущественно площадью поражения. Любая ожоговая рана является первично микробно зафязненной, однако в период ожогового шока влияние инфекции еще не выражено. II. Острая ожоговая токсемия является вторым периодом заболевания. Он начинается со 2—3 суток, продолжается 7—8 дней и характеризуется преобладанием явлений выраженной интоксикации. III. Период септикотоксемии (ожоговой инфекции) условно начинается с 10-х суток и характеризуется преобладанием инфекционного фактора в течении заболевания. При отрицательной динамике процесса возможно развитие ожоговой кахексии, приводящей в последующем к гибели больного. IV. Период реконвалесценции характеризуется постепенной нормализацией функций и систем организма. Он наступает после заживления ожоговых ран, либо после оперативного их закрытия. Наиболее грозным проявлением ожоговой болезни, несущим непосредственную угрозу для жизни больного, является ожоговый шок. Вопросы этиологии, патогенеза и принципы лечения данного патологического состояния представлены в тему ШОКОВЫЕ СОСТОЯНИЯ. Считается, что при поверхностном ожоге любой степени 15— 20% поверхности тела или при глубоком ожоге более 10% поверхности тела обычно развивается ожоговый шок. Степень его зависит от обширности ожога: при общей площади поражения до 20% обычно развивается легкий ожоговый шок, от 20% до 60% — тяжелый и при более обширном поражении — крайне тяжелый ожоговый шок (В. К. Сологуб и соавт., 1979).
Источник: http://www.meduniver.com/Medical/Neotlogka/159.html MedUniver
3) Эпифизарный остеомиелит (симптомы)
 Хромота
в раннем детском возрасте после начала
ходьбы всегда патологична. Двусторонние
изменения в тазобедренных суставах
могут маскировать хромоту и создавать
впечатление неустановившейся походки
ребенка.
Обычной
причиной хромоты в раннем детском
возрасте (при отсутствии перенесенного
лихорадочного заболевания и болей)
является врожденный вывих бедра, редко
coxa vara, при наличии болей ревматоидный
артрит (болезнь Still), временно поразивший
один или оба тазобедренных сустава,
очень редко туберкулезный коксит и
преходящий синовит.
В
детском и подростковом возрасте ранними
симптомами заболевания тазобедренного
сустава независимо от причины являются
боли и хромота. Каждый ребенок с такими
симптомами должен быть тщательно и
всесторонне клинически исследован и,
если будут выявлены какие-либо
положительные симптомы, подвергнут
рентгенографии.
Ранними
физикальными симптомами заболевания
тазобедренного сустава у детей и
подростков будут ограничение движений
в суставе, спазм мышц, регулирующих в
нем подвижность, иногда спазм передних
брюшных мышц. Рефлекторный мышечный
спазм, блокирующий движения в тазобедренном
суставе, появляется каждый раз, когда
сустав раздражен воспалительным
процессом инфекционного или травматического
характера.
Ограничение
движений может быть так слабо выражено,
а мышечный спазм в ранней стадии
заболевания бывает таким легким, что
выявить их можно только специальными
приемами. Рефлекторный мышечный спазм,
ограничивающий подвижность в суставе,
может быть временным, но в том, что он
действительно является преходящим,
нельзя быть уверенным до тех пор, пока
он не исчезнет.
Ранние
признаки и симптомы сходны или даже
одинаковы при преходящем синовите,
туберкулезе, болезни Perthes и детской coxa
vara. При всех этих заболеваниях, исключая
юношескую форму coxa vara, рентгенологическое
исследование ранней стадии заболевания
может оказаться безрезультатным.
Отрицательные данные рентгенологического
исследования при положительных
клинических симптомах не дают, однако,
права исключить серьезное органическое
заболевание и только время может
показать, что беспокойство было не
напрасным.
Хромота
в раннем детском возрасте после начала
ходьбы всегда патологична. Двусторонние
изменения в тазобедренных суставах
могут маскировать хромоту и создавать
впечатление неустановившейся походки
ребенка.
Обычной
причиной хромоты в раннем детском
возрасте (при отсутствии перенесенного
лихорадочного заболевания и болей)
является врожденный вывих бедра, редко
coxa vara, при наличии болей ревматоидный
артрит (болезнь Still), временно поразивший
один или оба тазобедренных сустава,
очень редко туберкулезный коксит и
преходящий синовит.
В
детском и подростковом возрасте ранними
симптомами заболевания тазобедренного
сустава независимо от причины являются
боли и хромота. Каждый ребенок с такими
симптомами должен быть тщательно и
всесторонне клинически исследован и,
если будут выявлены какие-либо
положительные симптомы, подвергнут
рентгенографии.
Ранними
физикальными симптомами заболевания
тазобедренного сустава у детей и
подростков будут ограничение движений
в суставе, спазм мышц, регулирующих в
нем подвижность, иногда спазм передних
брюшных мышц. Рефлекторный мышечный
спазм, блокирующий движения в тазобедренном
суставе, появляется каждый раз, когда
сустав раздражен воспалительным
процессом инфекционного или травматического
характера.
Ограничение
движений может быть так слабо выражено,
а мышечный спазм в ранней стадии
заболевания бывает таким легким, что
выявить их можно только специальными
приемами. Рефлекторный мышечный спазм,
ограничивающий подвижность в суставе,
может быть временным, но в том, что он
действительно является преходящим,
нельзя быть уверенным до тех пор, пока
он не исчезнет.
Ранние
признаки и симптомы сходны или даже
одинаковы при преходящем синовите,
туберкулезе, болезни Perthes и детской coxa
vara. При всех этих заболеваниях, исключая
юношескую форму coxa vara, рентгенологическое
исследование ранней стадии заболевания
может оказаться безрезультатным.
Отрицательные данные рентгенологического
исследования при положительных
клинических симптомах не дают, однако,
права исключить серьезное органическое
заболевание и только время может
показать, что беспокойство было не
напрасным.



 Болезни
почекЛечение болезни
почек не диализом,а китайской
медициной!Эффективное
лечениеkidneyfailurehospital.comАдрес и телефонЕсть
противопоказания. Посоветуйтесь с
врачом.
Болезни
почекЛечение болезни
почек не диализом,а китайской
медициной!Эффективное
лечениеkidneyfailurehospital.comАдрес и телефонЕсть
противопоказания. Посоветуйтесь с
врачом. Гостиница
The Ajman Palace 5*Спецпредложения
гостиницы The Ajman Palace только на Ostrovok.ru.
Спешите!Все отели
АджманЦеныРасположение
на картеОб Островкеostrovok.ruАдрес и телефон
Гостиница
The Ajman Palace 5*Спецпредложения
гостиницы The Ajman Palace только на Ostrovok.ru.
Спешите!Все отели
АджманЦеныРасположение
на картеОб Островкеostrovok.ruАдрес и телефон Лечение
и профилактика для всех!ЕВРОМЕД
в Омске. Все виды операций! Опытные
хирурги!Клиника
ЕВРОМЕД в ОмскеСкидкиСовременные
методы леченияeuromed-omsk.ruАдрес и телефонЕсть
противопоказания. Посоветуйтесь с
врачом.
Лечение
и профилактика для всех!ЕВРОМЕД
в Омске. Все виды операций! Опытные
хирурги!Клиника
ЕВРОМЕД в ОмскеСкидкиСовременные
методы леченияeuromed-omsk.ruАдрес и телефонЕсть
противопоказания. Посоветуйтесь с
врачом. Израиль
приглашает на лечение.Многопрофильная
больница Рамбам. Европейские стандарты
лечения. Госцены.Отзывы
пациентовДоступные
ценыОнлайн
консультацияГоворим
по-русскиrambam-health.org.ilАдрес и телефонЕсть
противопоказания. Посоветуйтесь с
врачом.
Израиль
приглашает на лечение.Многопрофильная
больница Рамбам. Европейские стандарты
лечения. Госцены.Отзывы
пациентовДоступные
ценыОнлайн
консультацияГоворим
по-русскиrambam-health.org.ilАдрес и телефонЕсть
противопоказания. Посоветуйтесь с
врачом. Акулий
Жир излечит ваши суставы!Эффективный
«Акулий Жир» от болей в суставах.
Заказывайте прямо сейчас!sharkoil-cream.com
Акулий
Жир излечит ваши суставы!Эффективный
«Акулий Жир» от болей в суставах.
Заказывайте прямо сейчас!sharkoil-cream.com Гостиница
The Ajman Palace 5*Спецпредложения
гостиницы The Ajman Palace только на
Ostrovok.ru. Спешите!Все отели
АджманЦеныРасположение
на картеОб Островкеostrovok.ruАдрес и телефон
Гостиница
The Ajman Palace 5*Спецпредложения
гостиницы The Ajman Palace только на
Ostrovok.ru. Спешите!Все отели
АджманЦеныРасположение
на картеОб Островкеostrovok.ruАдрес и телефон Сила
моря для Вашего здоровья!Укрепляем
иммунитет ребенка. Доставка по
Казахстану. Заходите!Скидка
20%Бесплатная
консультацияДоставка
в подарокОтзывыlamifarenshop.kzАдрес и телефонЕсть
противопоказания. Посоветуйтесь
с врачом.
Сила
моря для Вашего здоровья!Укрепляем
иммунитет ребенка. Доставка по
Казахстану. Заходите!Скидка
20%Бесплатная
консультацияДоставка
в подарокОтзывыlamifarenshop.kzАдрес и телефонЕсть
противопоказания. Посоветуйтесь
с врачом. Хирургическое
лечение в ГерманииНовейшие
методы хирургического лечения.
Ведущие хирурги и клиники
ГерманииДетская
хирургияОнкологическая
хирургияНейрохирургияru.leading-medicine-guide.deЕсть
противопоказания. Посоветуйтесь
с врачом.
Хирургическое
лечение в ГерманииНовейшие
методы хирургического лечения.
Ведущие хирурги и клиники
ГерманииДетская
хирургияОнкологическая
хирургияНейрохирургияru.leading-medicine-guide.deЕсть
противопоказания. Посоветуйтесь
с врачом. Операции
по удалению грыж! ЗаписьНужна
операция? Срочно обращайся в АКБ!
Консультация хирурга бесплатна!
Жмиhirurg.akb30.ruЕсть
противопоказания. Посоветуйтесь
с врачом.
Операции
по удалению грыж! ЗаписьНужна
операция? Срочно обращайся в АКБ!
Консультация хирурга бесплатна!
Жмиhirurg.akb30.ruЕсть
противопоказания. Посоветуйтесь
с врачом.