
- •Лабораторна робота № 1
- •Мета роботи: Визначення твердості матеріалів методом Роквелла.
- •Теоретичні відомості.
- •Порядок роботи на приладі.
- •Порядок виконання роботи.
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторна робота № 3
- •Мета роботи: Визначення характеристик оптичної системи мікроскопа.
- •Теоретичні відомості.
- •Порядок виконання роботи.
- •Література.
- •Лабораторна робота № 8 Тема: Вимірювання питомого поверхневого опору тонких плівок на ізоляційних підкладках.
- •Теоретичні відомості.
- •Порядок роботи.
- •Література.
- •Лабораторна робота № 9 Тема: Дослідження властивостей напівпровідникових матеріалів. Мета: Визначення ширини забороненої зони германію та кремнію методом зміщення р-п переходу в прямому напряму.
- •Порядок виконання роботи.
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторна робота № 15
- •Мета роботи: Визначення складу припою за кривою охолодження.
- •Теоретичні відомості.
- •Порядок виконання роботи.
- •Література.
- •Лабораторна робота № 16
- •Порядок роботи.
- •Література.
- •Титульна сторінка
- •Лабораторна робота № 1
- •Лабораторна робота № 8
- •Порядок роботи.
- •Лабораторна робота № 9
- •Порядок виконання роботи
- •Лабораторна робота № 15
- •Порядок виконання роботи.
- •Порядок виконання роботи.
- •Додаток. Градуювальна таблиця термопари ха
Питання до захисту лабораторної роботи.
1. Як перевести оС у К ?
2. Побудувати графік залежності напруги на діоді від температури за наступними даними:
|
Т, оС |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
UGe, В |
0,16 |
0,15 |
0,127 |
0,109 |
0,091 |
0,08 |
0,065 |
3. Чому зі збільшенням температури напруга на діодах зменшується ?
4. Визначити залежність опору кремнієвого діода від температури і побудувати графік.
|
Т, оС |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
USi, В |
0,473 |
0,445 |
0,415 |
0,390 |
0,365 |
0,348 |
0,323 |
5. Розрахувати за методом найменших квадратів рівняння апроксимуючої прямої.
|
Т, оС |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
USi, В |
0,472 |
0,443 |
0,415 |
0,389 |
0,376 |
0,351 |
0,324 |
6. Визначити рівняння лінії тренду за даними таблиці і намалювати на комп’ютері графік залежності падіння напруги на діоді від температури.
|
Т, оС |
14 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
UGe, мВ |
178,4 |
170,6 |
156,3 |
126,8 |
108 |
92 |
83,5 |
68,6 |
7. Розрахувати ширину забороненої зони в еВ за рівнянням залежності U=f(T, oC):
U=(202,34 – 1,7431*T, oC)/1000
8. Визначити ширину забороненої зони за даними таблиці.
|
Т, оС |
USi, В |
UGe, В |
|
20 |
0,4755 |
0,1706 |
|
70 |
0,3566 |
0,0835 |
9. Визначити ширину забороненої зони напівпровідникового матеріалу за наступними даними:
|
Т, оС |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
U, В |
0,472 |
0,443 |
0,415 |
0,389 |
0,376 |
0,351 |
0,324 |
Література.
1. Брук В.А., Гаршенин В. В., Курносов А.И. Производство полупроводниковых приборов. М., Профтехиздат, 1963.
2. Пасынков В.В., Чиркин Л.К., Шинков А.Д. Полупроводниковые приборы. М., Высшая школа, 1981.
3. Крутякова М.Г., Чарыков Н.А., Юдин В.В. Полупроводниковые приборы и основы их проектирования. М., Наука, 1984.
-
Левинштейн М.Е., Симин Г.С. Знакомство с полупроводниками. М., Наука, 1984.
Лабораторна робота № 15
Тема: Діаграми стану подвійних сплавів.
Мета роботи: Визначення складу припою за кривою охолодження.
Прилади і матеріали: піч СУОЛ, термопара хромель-алюмель, зразки матеріалів.
Теоретичні відомості.
Перехід металу з рідкого стану в тверде з утворенням кристалів називається кристалізацією. Особливістю переходу з рідкого стану в твердий являється те, що в чистих металах він протікає при постійних температурах, які залежать від природи металу і тиску.
Розташування атомів в рідині характеризується відсутністю далекого порядку, тобто відсутністю правильного розташування атомів, що періодично повторюється в трьох вимірах.
Внутрішня енергія неврегульованої рідини більше впорядкованої будови твердого тіла, тому при переході з одного стану в інше спостерігається виділення (чи поглинання) тепла.
Теплота, що виділяється під час переходу металу з рідкого стану в твердий, називається прихованою теплотою плавлення. Температура кристалізації визначається як температура, при якій вільні енергії рідкої і твердої фаз рівні. Зміна вільної енергії рідкого і твердого станів залежить від температури (рис.1).
Температура Тs називається рівноважною температурою кристалізації (плавлення). Процес кристалізації при цій температурі не відбувається, оскільки в цих умовах вільні енергії рідкого і твердого станів рівні.
Процес кристалізації починається, коли виникає різниця вільних енергій, яка утворюється внаслідок меншої вільної енергії твердого металу в порівнянні з рідким. Таким чином, для переходу металу з рідкого стану в тверде потрібне переохолодження нижче рівноважної температури кристалізації .
Для проведення термічного аналізу випробовуваний материал помещают в тигель і доводять до плавлення. Після цього метал повільно охолоджують з постійною швидкістю і через рівні проміжки часу заміряють його температуру. Для виміру високих значень температур зазвичай використовують термоелектричні пірометри. Термоелектричні пірометри складаються з термопари і реєструючого пристрою .
Термопара складається з двох провідників різних металів або сплавів і має ту властивість, що якщо з'єднати (зварити) одні кінці проввідників, а інші приєднати до гальванометра, то при нагріві спаю виникає електрорушійна сила, що викликає відхилення стрілки гальванометра. Величина електрорушійної сили залежить від матеріалу термопари і температури замкнених кінців кола. Результуюча ЕРС тим більше, чим більше різниця температур гарячого і холодного спаїв. При постійній температурі одного з кінців, виведених до вимірювального приладу (званого холодним спаєм), результуюча ЕРС визначається температурою другого кінця (гарячого спаю), який вводиться в розплавлений метал.
В якості термопар застосовують наступні
поєднання металів : платинородій (10% Rh)
- платина (ПП1); платинородій (30% Rh ) -
платинородій(ПР30/6), хромель-алюмель
(ХА); хромель-копель(ХК).
якості термопар застосовують наступні
поєднання металів : платинородій (10% Rh)
- платина (ПП1); платинородій (30% Rh ) -
платинородій(ПР30/6), хромель-алюмель
(ХА); хромель-копель(ХК).
Таблиця 1
Хімічний склад сплавів для термопар
|
Хромель |
Алюмель |
Копель |
Константан |
Платинородій |
|
Ni - 89,0 % Cr - 9,8 % Fe - 1,0 % Mn - 0,2 % |
Ni - 94 % Al - 2 % Si - 1,0 % Fe - 0,5 % Mn - 2,5 %
|
Ni - 43 - 44 % Fe - 2 - 3 % Cu - 53 - 55 %
|
Ni - 40 % Cu - 59 % Mn - 1 %
|
Pt - 90 % Rh - 10 % |
Таблиця 2
Сфера застосування термопар
|
Термопара |
Температурна межа, оС |
|
Медь - константан Хромель - копель Срібло - константан Залізо - константан Хромель - алюмель Платина - платинородій |
400 600 600 650 1100 1600 |
Гарячий спай термопари, захищений від контакту з рідким металом, занурюється в метал з таким розрахунком, щоб спай знаходився в середині об'єму металу, що дозволяє характеризувати його дійсну температуру. Холодний спай термопари виводять до вимірювальних приладів. За показамии цих приладів - по окремих замірах температури через певні проміжки часу отримують графіки
Т=f(τ), в координатах температура - час ( рис.2 ).
Сплав ця речовина, отримана сплавлянням двох або більше компонентів. Будова сплаву залежить від типу взаємодії компонентів. У металевих сплавах можливе одержання механічної суміші, хімічних сполук і твердих розчинів.
Діаграми стану сплаву будують експериментальним шляхом, які представляються в графічній формі і показують зміну складу залежно від вмісту компонентів і температури. Діаграми стану дозволяють визначити, яку структуру матимуть повільно охолоджені сплави, а також вирішити питання про те, чи можна змінити мікроструктуру в результаті термічної обробки сплаву.
Вид діаграми визначається характером взаємодії, які виникають між компонентами в рідкому і твердому станах.
Загальні закономірності співіснування стійких фаз, що відповідають теоретичною умовою рівноваги, можуть бути виражені правилом фаз.
![]() ,
,
де:
С- число ступенів вільності
К - кількість компонентів тих, що становлять сплав
f - кількість фаз
2 - число змінних (тиск і температура).
Для двокомпонентної системи (К=2) діаграми розглядають без урахування газової фази, тобто вважають що p=const, а зовнішнім чинником, що змінюється, вважають тільки температуру (n=1).
Тоді правило фаз набере наступного вигляду.
![]()
При числі ступенів вільності рівної "0" система знаходиться в рівновазі при строго певній температурі (рідка і тверда фази).
Якщо число ступенів вільності дорівнює одиниці, то можлива зміна в деяких межах одного з перерахованих параметрів, і це не викличе зменшення або збільшення числа фаз.
Властивості будь-якого сплаву залежать від того, які з'єднання або які фази утворили компоненти сплаву.
Як приклад по вивченню фазового і структурного стану сплавів розглянемо діаграму системи "олово−свинець"(див. рис. 6).
Сплав системи Sn − Pb відноситься до сплавів типу "механічні суміші".
Діаграмою стану цього сплаву є діаграма з обмеженою розчинністю компонентів в твердому стані.
Згідно цієї діаграми лінія 3 − лінія ліквідус, а лінія 5 − солідус. Крім того, лінія 5 відповідає температурі, при якій в процесі охолодження сплавів в них протікає евтектична реакція з утворенням евтектики при температурі 1830С і змісті ( 37% Pb і 63% Sn.
Особливості кристалізації сплавів Pb − Sn розглянемо для наступних складів:
1. 10% Pb і 90% Sn
2. 37% Pb і 63% Sn
3. 70% Pb і 30% Sn
Криві охолодження цих сплавів представлені на рис. 3, 4, 5.
Кристалізація сплаву починається при температурі T1 (верхня критична температура) і протікає при змінній температурі до T2 (нижня критична температура).
В інтервалі температур T1 - T2 з рідини виділяються кристали надмірного компонента (β).
Якщо з рідини виділяються кристали β, то концентрація Sn в рідкій фазі зменшується, а концентрація Pb в рідкій фазі збільшується. В процесі кристалізації концентрація компонентів в рідкій фазі змінюється і прагне до такої концентрації (37% Pb і 63% Sn), коли обидва компоненти α і β з рідини кристалізуються сумісно. Одночасна кристаллизація α і β протікає при постійній температурі.
У сплаві, що містить 37% Pb і 63% Sn, з рідкої фази проходить одночасна кристалізація обох компонентів (рис. 4). В результаті утворюється однорідна механічна суміш. Структуру, що складається з двох або більше твердих фаз, що одночасно кристалізуються з рідини, називається евтектикою.
У сплаві, що містить 70% Pb і 30% Sn, процес кристалізації починається при температурі T1. В.ПоповичЗ рідкої фази починають кристалізуватися кристали компонента, що знаходиться в надлишку відносно евтектичної концентрації, тобто α (рис.3). Якщо з рідини виділяються кристали α, то в процесі кристалізації рідка фаза збагачується оловом. Коли концентрація компонентів в рідкій фазі досягне евтектичної концентрації (тобто 37% Pb і 63% Sn), то почнеться сумісна кристалізація обох компонентів при постійній температурі T2.
Криві охолодження показують, що сплави системи Pb − Sn в інтервалі концентрацій 2,5 ÷ 81 % свинцю остаточно тверднуть при постійній температурі − T2. Це дає основу вважати, що тверднуча при постоійній температурі - T2 частина рідкого сплаву має постійний склад. Такому складу відповідає сплав, що містить 37% Pb і 63% Sn. Для сплавів типу механічні суміші температура кінця кристалізації не залежить від концентрації сплаву, вона постійна для усіх сплавів. Температура початку кристалізації змінюється залежно від концентрації компонентів в сплаві.
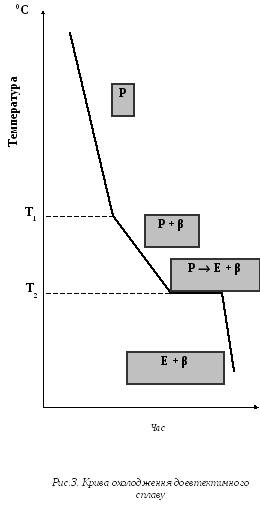
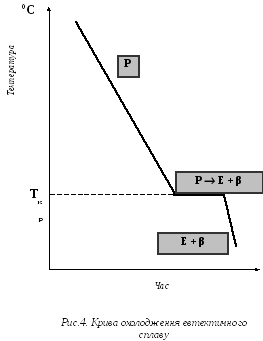
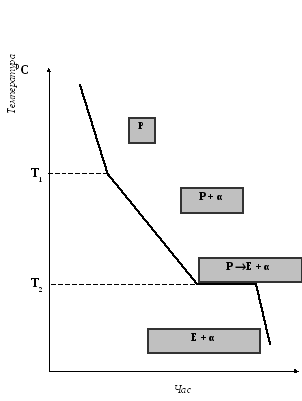
Рис.5. Крива охолодження заевтектичного
сплаву

 Sn %
Pb
Pb
Sn %
Pb
Pb
Рис.6. Інженерний варіант діаграми стану системи Sn - Pb:
1 − рідкий стан; 2 − рекомендована температура припою при змочуванні;
3 − ліквідус; 4 − кашкоподібний стан; 5 − солідус; 6 − евтектика (α + β);
7 − твердий розчин свинцю в олові (β); 8 − твердий розчин олова у свинці (α); 9 − твердий сплав
