
- •1.1 Основные определения и понятия
- •1.1.1 Общее определение технической термодинамики
- •1.1.2 Рабочее тело, идеальный газ
- •1.1.3 Параметры состояния рабочего тела
- •1.1.4 Уравнение состояния рабочего тела
- •1.1.5 Смеси газов
- •1.1.6 Теплоемкость газов
- •1.2 Первое начало термодинамики и анализ термодинамических процессов в газах
- •1.2.1 Термодинамическая система и термодинамический процесс
- •1.2.2 Внутренняя энергия рабочего тела – газа, четвертый параметр состояния
- •1.2.3 Первый закон термодинамики
- •1.2.4 Энтальпия – пятый параметр состояния
- •1.2.5 Энтропия (s), шестой параметр состояния
- •1.2.6 Частные случаи вычисления количества тепла по изменению параметров состояния в термодинамических процессах
- •1.2.7 Исследование общего термодинамического процесса
- •1.2.8 Исследование частных случаев политропного процесса
- •1.2.9 Анализ общих характеристик политропных процессов в диаграммах p – υ и t – s
- •1.3 Второй закон термодинамики и анализ термодинамических циклов
- •1.3.1 Второй закон термодинамики. Основные определения
- •1.3.2 Термодинамические циклы
- •1.3.3 Цикл Карно
- •1.4 Водяной пар
- •1.4.1 Водяной пар – рабочее тело в энергетике
- •1.4.2 Уравнение состояния для реальных газов
- •1.4.3 Процесс парообразования для воды
- •1.4.4 Таблицы и диаграммы состояния водяного пара
- •1.5 Процессы истечения и дросселирования газов и паров
- •1.6 Термодинамические циклы газовых машин и паровые циклы
- •1.6.1 Общая характеристика циклов газовых машин
- •1.6.2 Цикл одноступенчатого компрессора
- •5.3 Цикл многоступенчатого компрессора
- •1.6.4 Циклы поршневых двигателей внутреннего сгорания
- •1.6.5 Идеальный цикл паросиловой установки
- •1.6.6 Реальный цикл паросиловой установки – цикл Ренкина
- •2.1 Теплопроводность
- •2.1.4 Теплопроводность цилиндрических стенок
- •2.2 Конвективный теплообмен
- •2.3 Теплообмен излучением
- •2.3 Теплообмен излучением
- •2.5 Расчет теплообменных аппаратов
1.1.6 Теплоемкость газов
Подвод (или отвод) тепла к телу в процессе вызывает изменение параметров состояния, главным образом температуры. Поэтому для вычисления количества тепла при изменении состояния тела можно использовать изменение температуры и величину, характеризующую свойства тела. Величина, характеризующая способность тела изменять температуру в процессах с подводом (или отводом) тепла называется теплоемкостью.
Теплоемкостью тела называется количество тепла, которое необходимо подвести (или отвести) к телу, чтобы изменить его температуру на 1 К.
Удельной теплоемкостью называется теплоемкость, отнесенная к единице массы вещества.
Понятие теплоемкости используется для вычисления количества тепла участвующего в процессе.
В зависимости от того, к какой единице массы относится теплоемкость, различают три вида удельной теплоемкости.
Массовой теплоемкостью называется удельная теплоемкость, отнесенная к 1 кг массы газа. Она обозначается С и имеет размерность Дж/(кг· K), кДж/(кг·K).
Объемной теплоемкостью называется теплоемкость, отнесенная к массе газа, содержащегося в 1 м3 газа, взятом при нормальных условиях. Она обозначается с/ и имеет размерность Дж/(нм3·К), кДж/(нм3·К).
Киломольной или молярной теплоемкостью называется теплоемкость, отнесенная к 1 киломолю газа. Она обозначается μС и имеет размерность Дж/(кмоль·K).
Связь между разными видами удельной теплоемкости следующая:

где υН – удельный объем
газа, взятого при нормальных условиях
и равный
![]() м3/кг.
м3/кг.
Исходя из принятой характеристики удельной теплоемкости, количество тепла в процессе может быть определено по следующим формулам:

где ![]() – число киломолей рабочего тела;
– число киломолей рабочего тела;
![]() – объем рабочего тела при нормальных
условиях, м3.
– объем рабочего тела при нормальных
условиях, м3.
Приведенные уравнения справедливы при условии постоянного значения теплоемкости в заданном интервале температур, либо если теплоемкость принимается постоянной условно.
В действительности теплоемкость изменяется в зависимости от вида процесса, в котором участвует газ, а для данного процесса изменяется с изменением температуры. Графическая зависимость теплоемкости от температуры представлена на рисунке 1.1.
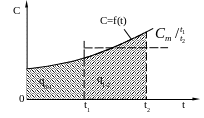
Рисунок 1.1 – Зависимость теплоемкости газа от температуры
Для бесконечно малого участка зависимости С = f(t) истинная теплоемкость при данной температуре тела t, для 1 кг массы может быть определена из условия:

откуда:
![]() .
.
При изменении температуры рабочего тела в процессе от t1 до t2 количество тепла участвующего в процессе на 1 кг массы тела будет равно:

где, очевидно, что: C = f(t).
Величина истинной теплоемкости, определяется для разных веществ экспериментальным путем и обычно выражается степенной зависимостью вида:
![]()
где a0 , a1 , a2 , a3 – эмпирические коэффициенты.
Для упрощения практических расчетов по определению количества тепла вводится условное понятие средней удельной теплоемкости тела в данном процессе, которая для 1 кг массы в интервале температур от t1 до t2 будет равна:
 .
.
Использование средней теплоемкости облегчает задачу вычисления количества тепла в процессе, т.к. в этом случае:
![]() .
.
Значения средней теплоемкости также определяются экспериментальным путем, а для расчетов задаются в виде таблиц или эмпирических зависимостей.
Так как в практических расчетах может
потребоваться значение средней
теплоемкости в любом интервале температур,
то в таблицах и формулах задается
значение средней теплоемкости с
фиксированным нижним пределом, равным
0°С, т.е. средняя теплоемкость задается
только в интервале температур от 0° до
t °С, и может быть
использована для расчета количества
тепла в любом интервале температур
путем следующего преобразования. Из
условия
![]() следует, что:
следует, что:

откуда средняя теплоемкость в данном интервале температур равна:
 .
.
Величина теплоемкости сильно зависит
так же от условий протекания процесса
и для каждого процесса имеет свое
определенное значение. При этом ее
значение меняется от ±![]() (для изотермического процесса, dT=0)
до 0 (для адиабатного процесса, dq=0).
Так как число различных термодинамических
процессов бесконечно велико, то также
велико и число значений теплоемкости
в процессах. Для вычисления величины
теплоемкости в любом процессе вводятся
две основные, стандартные теплоемкости
для двух, (принятых за опорные значения)
процессов. Это теплоемкость в процессах,
протекающих при постоянном давлении,
она обозначается Ср и
теплоемкость при постоянном объеме –
Сυ .
(для изотермического процесса, dT=0)
до 0 (для адиабатного процесса, dq=0).
Так как число различных термодинамических
процессов бесконечно велико, то также
велико и число значений теплоемкости
в процессах. Для вычисления величины
теплоемкости в любом процессе вводятся
две основные, стандартные теплоемкости
для двух, (принятых за опорные значения)
процессов. Это теплоемкость в процессах,
протекающих при постоянном давлении,
она обозначается Ср и
теплоемкость при постоянном объеме –
Сυ .
Связь между ними устанавливается уравнением Майера:
Ср – Cυ = R, кДж/кг·К – для 1 кг газа;
μCp – μCυ = 8,3142 , кДж/Кмоль·К – для 1 кмоля.
В термодинамике часто используется также отношение:
 которое называется коэффициентом
Пуассона.
которое называется коэффициентом
Пуассона.
В таблицах и эмпирических формулах для истинных и средних теплоемкостей задаются только два значения теплоемкости Ср или Сυ , a теплоемкость в остальных процессах вычисляется с их помощью в зависимости от характеристики данного процесса.
При обозначениях теплоемкостей
учитываются указанные выше обозначения
ее видов. Например, μCυ
– истинная, киломольная теплоемкость
при постоянном объеме,
![]() – средняя, объемная теплоемкость при
постоянном давлении и т.д.
– средняя, объемная теплоемкость при
постоянном давлении и т.д.
Теплоемкость газовых смесей определяется как сумма теплоемкостей входящих в ее состав компонентов с учетом их количественных соотношений.
Для 1 кг смеси газов, массовая теплоемкость будет равна:
 .
.
Для 1 нм3 смеси газов, объемная теплоемкость будет равна:
 .
.
