
- •Chimie bioorganique sous forme « question-réponse »
- •Tambov 2013
- •Sommaire
- •Introduction
- •1. Classification et nomenclature des composés organiques biologiquement importants
- •2. Constitution des composés organiques
- •3. Principes généraux de la capacité réactionnelle des composés organiques
- •4. Acides aminés, peptides, protéines
- •5. Glucides : mono-, di- et polysaccharides
- •6. Les nucléotides et les acides nucléiques
- •7. Les lipides et les biorégulateurs micromoléculaires
- •8. Identification des composés organiques
4. Acides aminés, peptides, protéines
Question 45. Quels composés appartiennent aux α-acides aminés ? Quel est le rôle des α-acides aminés dans le fonctionnement des organismes vivant ?
Réponse. Les α-acides aminés – sont des composés hétérofonctionnels, dont les molécules contiennent deux groupes fonctionnels : le groupe carboxyle (−COOH) et le groupe aminé (−NH2), en plus, tout les deux groupes sont liés au même atome de carbone. On nomme les α-acides aminés selon la nomenclature internationale, et l’atome de carbone, auquel le groupe aminé est lié, a le deuxième numéro d’ordre. Pour plusieurs α-acides aminés, surtout pour ceux qui font partie de protéines, on employe les noms selon la nomenclature triviale.

D es
plusieurs peptides et protéines présentés dans des organismes
vivants sont formés par les restes de vingt α-acides aminés. Les
molécules de tout les α-acides aminés contiennent le même
fragment, le groupe H2N–СН–СООН,
dont le deuxième atome de carbone est lié au radical hydrocarboné
–R. Le radical hydrocarboné peut avoir la nature chimique
différente.
es
plusieurs peptides et protéines présentés dans des organismes
vivants sont formés par les restes de vingt α-acides aminés. Les
molécules de tout les α-acides aminés contiennent le même
fragment, le groupe H2N–СН–СООН,
dont le deuxième atome de carbone est lié au radical hydrocarboné
–R. Le radical hydrocarboné peut avoir la nature chimique
différente.
La classification rationnelle moderne des acides aminés est basée sir la polarité des radicaux, c’est-à-dire sur leur capacité d’interagir avec l’eau lors des valeurs physiologiques de pH (proches à 7,0). On distingue les acides aminés contenant les radicaux suivants : 1) apolaires (hydrophobes) ; 2) polaires (hydrophiles ; 3) aromatiques ; 4) électronégatifs ; 5) électropositifs. Par la suite on cite les formules structurelles des acides aminés, leurs noms selon la nomenclature triviale, leurs dénominations abrégées et leurs symboles alphabétiques internationaux.
α-acides aminés au radical apolaire (hydrophobe)


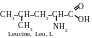
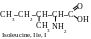


α-acides amines au radical polaire neutre
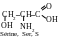



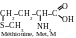
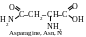
α-acides amines au radical polaire électronégatif

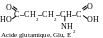


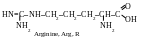
α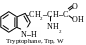 -acides
amines au radical aromatique
-acides
amines au radical aromatique

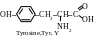
Dans des conditions ordinaires les α-acides aminés présentent des substances cristallines incolores hydrosolubles.
La synthèse du protéine dans l’organisme est possible juste en présence de tout les 20 α-acides aminés. La source essentielle des α-acides aminés pour l’organisme vivant – les protéines alimentaires. Des certains α-acides aminés peuvent se synthétiser dans l’organisme (à partir d’autres acides aminés ou d’autres produits du métabolisme), mais les autres α-acides aminés ne se synthétise pas dans l’organisme de l’homme, ils peuvent entrer avec la nourriture, c’est pourquoi la nourriture protéique est si importante pour l’homme. Tels acides aminés s’appellent essentiels (irremplaçables) : valine, leucine, isoleucine, lysine, thréonine, méthionine, phénylalanine, tryptophane).
En cas de certaines maladies les acides remplaçables peuvent devenir irremplaçables. Par exemple, en cas de phénylcétonurie l’organisme arrête de synthétiser l’acide amine tyrosine.
Des plusieurs α-acides aminés sont utilisés à la médecine. Ainsi, la glycine améliore des processus métaboliques dans les tissus du cerveau et des muscles. L’acide glutamique s’applique lors du traitement des maladies du système nérveux central, la méthionine et l’hystidine – pour le traitement des maladie du foie etc.
Question 46. Comment peut-on construire les formules des stéréoisomères (énantiomères) des α-acides aminés ? Si tout les α-acides aminés naturels sont optiquement actifs ?
Réponse. Les molécules de tout les α-acides aminés, excepté la glycine, possèdent le même atome de carbone (deuxième) qui est lié aux quatre substituants différents : au groupe carboxyle (−COOH), au groupe aminé (−NH2), au radical hydrocarboné R et à l’atome d’hydrogène, c’est-à-dire au moins un atome de carbone dans ces acides aminés est asymétrique. Les élement de symétrie sont absents dans les molécules de tout ces α-acides aminés, conséquemment, tout les α-acides aminés (outre la glycine) sont des composés optiquement actifs, et ils peuvent exister sous forme de deux énantiomères. Pour figurer correctement les énantiomères il faut mettre la chaîne carbonée verticalement. En haut on présente le groupe essentiel (carboxyle). Deux substituant restés (le groupe aminé et l’atome d’hydrogène) près de deuxième atome de carbone (asymétrique) se trouvent à gauche et àdroite de la chaîne carbonée. Dans la projection de Fischer la position du groupe aminé à gauche de la chaîne carbonée correspond à la configuration L, à droite - à la configuration D :
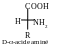

Les molécules des acides aminés isoleucine et thréonine comprennent deux atomes asymétriques de carbone (deuxième et troisième). Conséquemment, ils peuvent exister sous forme de deux paires d’énantiomères :
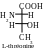

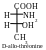



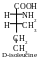
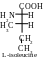
Parmi ces isomères on utilise juste les isomères L-thréonine et L-isoleucine pour construire des protéines dans l’organisme de l’homme.
Les autres α-acides aminés sont aussi présentés dans la protéine en L-forme. Les α-acides aminés de D-série peuvent être des composants des peptides d’une série de microorganismes et de bactéries.
Question 47. Comment les propriétés acido-basiques et l’amphotérisation des α-acides aminés se manifestent-elles ? Queslles propriétés des α-acides aminés conditionnent leur constitution ?
R éponse.
Les α-acides aminés forment des sels et avec les alcalins, et aves
les acides, c’est-à-dire ils sont des composés amphotères, parce
que leurs molécules contiennent des groupes fonctionnaux acides
(−COOH) et basiques (−NH2) :
éponse.
Les α-acides aminés forment des sels et avec les alcalins, et aves
les acides, c’est-à-dire ils sont des composés amphotères, parce
que leurs molécules contiennent des groupes fonctionnaux acides
(−COOH) et basiques (−NH2) :
L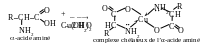 es
α-acides aminés forment des sels intracomplexes du type chélateux
avec les cations des métaux lourds :
es
α-acides aminés forment des sels intracomplexes du type chélateux
avec les cations des métaux lourds :
La liaison chimique formée suivant le mécanisme donneur-accépteur est indiquée par la flèche dirigée de l’atome d’azote à l’atome de cuivre dans la formule du chélate. L’atome d’azote se présente comme le donneur, en prêtant son paire électronique pour la formation de la liaison, et l’atome de cuivre se présente comme l’accépteur, en prêtant l’orbitale libre (vacante).
D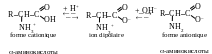 ans
des solutions aqueuses les α-acides aminés amphotères existent
sous forme du mélange en équilibre de l’ion dipolaire, en formes
cationique et anionique :
ans
des solutions aqueuses les α-acides aminés amphotères existent
sous forme du mélange en équilibre de l’ion dipolaire, en formes
cationique et anionique :
La forme cationique prédomine dans des solutions fortement acides (pH = 1..2), la forme anionique – dan des solutions fortement basiques (pH = 13..14). Les α-acides aminés sont en état solide sous forme d’ions dipolaires. Habituellement dans des équations des réactions avec la participation des α-acides aminés on écrit les acides aminés en forme non-ionisée.
La constitution ionique des molécules des α-acides aminés conditionne leurs températures de fusion (plus de 200 ºC), fixité (non-volatilité), hydrosolubilité, insolubilité dans des dissolvants organiques apolaires. L’hydrosolubilité assure ole fonctionnement biologique des α-acides aminés : absorbabilité, mouvements dans l’organisme etc.
Question 48. Comment détérmine-t-on le pH des solutions des α-acides aminés dans l’eau distillé ?
Réponse. Les valeurs du pH des solutions reçues lors de la dissolution des α-acides aminés dans l’eau dépend de la nature de groupes fonctionnels dans le radical hydrocarboné de l’acide, notamment la quatité de groupes acides et basiques.
On examine les acides aminés à radical hydrocarboné apolaire. Leur molécule contient un groupe acide (−COOH) et un groupe basique (−NH2). Dans des solutions aqueuses les molécules des acides aminés sont ionisée. L’eau distillé utilisé pour la reception de la solution ne contient pas d’ions H+ et OH- en excès - le milieu est neutre (pH = 7), conséquemment, les formes ioniques des acides aminés dans la solution se forment à la suite du transfert des ions H+ à partir du groupe acide (−COOH) vers le groupe basique (−NH2). Ainsi, presque toutes les molécules de l’acide aminé existent dans la solution sous forme des ions dipolaires, et le milieu se considère comme proche à neutre.
Les molécukles des aicdes glutamiquies et aspartiques contiennent deux groupes carboxyles acides (−COOH) et un groupe basique (−NH2). Dans la solution les ions H+ se transportent à partir du groupe carboxyle vers le groupe aminé dans la position α. Le proton, formé lors de la dissosiation du deuxième groupe carboxyle, passe dans la solution. Ainsi, l’excès d’ions H+ s’accumule dans la solution, conséquemment, le milieu est acide (pH < 7).
Les molécules des acides aminés la lysine, l’arginine et l’histidine contiennent un groupe carboxyle acide et deux groupes aminés basiques. Dans la solutions les ions H+ se transportent à partir du groupe carboxyle vers le groupe aminé dans la position α. Lors de l’interaction du deuxième groupe aminé et de l’eau, l’excès des ions OH- s’accumule dans la solution, conséquemment, le milieu est basique (pH > 7).
Question 49. Qu’est-ce que c’est « le point isoélectrique de l’α-acide aminé » ? Par quelle manière les α-acides aminés circulent dans le champ électrique ?
Réponse. La valeur du pH du milieu, où presque toutes les molécules de l’acide aminé existent sous forme des ions bipolaires s’appelle le point isoélectrique de cet acide aminé, on indique ce point pI. Au point isoélectrique la charge sommaire de la molécule de l’acide aminé est égale à zero. Les ions dipolaires ne se déplacent pas au champ électrique, conséquemment, lors de la valeur du pH du milieu, numériquement égale au pI, la solution de l’acide aminé ne conduit pas du courant électrique.
En cas de valeurs du pH inférieures au pI l’acide aminé existe dans la solution essentiellement en forme de cation. Sous l’action du champ électrique statique, par exemple, lors de l’électrophorèse, le cation de l’acide aminé se déplace vers l’électrode électronégatif (catode).
En cas de valeurs du pH supérieures au pI l’acide aminé existe dans la solution essentiellement en forme d’anion. Sous l’action du champ électrique statique, par exemple, lors de l’électrophorèse, l’anion de l’acide aminé se déplace vers l’électrode électropositif (anode).
Dans le milieu acide l’α-acide aminé est le cation, il est dirigé vers la catode et se réduit. Dans le milieu basique (alcalin) l’α-acide aminé est l’anion, il se dirige vers l’anode et s’oxyde.
À l’aide de l’électrophorèse on peut repartir les mélanges des α-acides aminés en acides aminés individuels.
Par exemple, on a le mélange de trois acides aminés : alanine (pI = 6,1), lysine (pI = 9,7) et acide glutamique (pI = 3,2). Il faut détérminer la direction de leur mouvement, si l’électrophorèse se réalise lors de pH = 6,1.
Pour la lysine la valeur de pH du milieu de l’électrophorèse est inférieur à la valeur de pI (6,1 < 9,7), conséquemment, la lysine existe dans la solution essentiellement sous forme de cation et, sous l’influence du champ électrique statique, elle dirige vers la catode.
Pour l’acide glutamique la valeur pH du milieu de l’électrophorèse est supérieur à la valeur de pI (6,1 > 3,2), conséquemment, l’acide glutamisque existe dans la solution essentiellement sous forme d’anion et, sous l’influence du champ électrique statique, elle dirige vers l’anode.
Question 50. Écrivez la formule structurelle de la valine. Nommez cet acide aminé selom la nomenclature internationale. Pour ce composé écrivez un isomère de position de fonction, de squelette carbonée et de nature de fonction.Si la valine est optiquement active ? Si oui, figurez et nommer les énantiomères. Quel est le milieu de la solution de cet acide dans l’eau distillée ? En quelle forme ionique cet acide aminéxiste dans le suc gastrique (pH = 1) ? Lors de quel pH la solution de cet acide ne produit pas de courant électrique ?
Réponse. Pour nommer la valine selon la Nomenclature nationale on trouve la chaîne carbonée la plus longue, on l’énumère à partir du groupe fenctionnel essentiel (carboxyle). La chaîne contient 4 atomes de carbone, c’est l’acide butanoïque ayant le groupe aminé près de 2-ième atome de carbone et le groupe méthyle – près de 3-ième. La chaîne carbonée est ramifiée, pour la formation de l’isomère de squelette carbonée il faut disposer les atomes de carbone en une chaîne, il vient l’isomère – l’acide 2-aminopentanoïque. Pour former l’isomère de position de fonction on peut porter le groupe aminé vers le troisième atome de carbone, et le groupe méthyle – vers le deuxième, il vient l’acide 3-amino-2-méthylbutanoïque. Pour former la troisième isomère il faut changer n’importe quel groupe fonctionnel, par exemple, en cas de substitution du groupe –OH par le groupe aminé on reçoit l’amide de l’acide 2-hydroxy-3-méthylbutanoïque.
La valine est un composé optiquement actif, parce que sa molécule contient un atome assymétrique de carbone (C2), et les élements de symétrie sont absents, conséquemment on peut présenter cet acide sous la forme de deux configurations absolues (R- et S-isomères), comme sous la forme de deux configurations (L- et D-isomères).
La composition de la molécule comprend un groupe carboxyle et un groupe aminé, la valine est un composé amphotère, c’est pourquoi sa solution dans l’eau distillée possède du milieu neutre. Dans le milieu fortement acide (pH = 1) la valine se protone suivant le groupe aminé et devient le cation. La valeur de pH dont en cas la solution de l’acide aminé ne conduit pas du courant électrique, s’appelle le point isoélectrique ; pour la valine c’est 6,0.
acide
2-amino-3-méthylbutanoïque
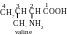



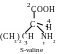



 CH3CHCHCOOH
CH3CHCHCOOH
valine
sous la forme du cation (pH = 1)
Question 51. À l’aide de quelle réaction on peut transformer l’isoleucine en acide 3-méthylpenténoïque ? Et la sérine en 2-aminoéthanol ?
Réponse. On écrit les formules du composé initial et du produit de la première réaction


I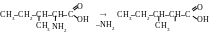 l
est en vue que pour l’obtention de l’acide 3-méthyl-2-penténoïque
il faut éliminer le groupe aminé à partir d’une molécule de
l’isoleucine. Si on le fait, une liaison se libère à partir de
deuxième atome de carbone :
l
est en vue que pour l’obtention de l’acide 3-méthyl-2-penténoïque
il faut éliminer le groupe aminé à partir d’une molécule de
l’isoleucine. Si on le fait, une liaison se libère à partir de
deuxième atome de carbone :
P our
que la liaison double se forme entre le deuxième et troisième
atomes de carbone, il est nécessaire de libérer une liaison du
troisième atome de carbone. En ce cas le groupe méthyl (−CH3)
doit se garder dans la molécule. On peu le faire, en éliminant
l’atome d’hydrogène à partie du troisième atome de carbone :
our
que la liaison double se forme entre le deuxième et troisième
atomes de carbone, il est nécessaire de libérer une liaison du
troisième atome de carbone. En ce cas le groupe méthyl (−CH3)
doit se garder dans la molécule. On peu le faire, en éliminant
l’atome d’hydrogène à partie du troisième atome de carbone :
A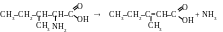 insi,
pour obtenir l’acide 3-méthyl-2-penténoïque, la molécule de
l’isoleucine doit perdre le groupe aminé et l’atome d’hydrogène.
En état libre ces particules sont instables et forment une molécule
d’ammoniac NH3.
L’élimination de la molécule d’ammoniac à partir de l’acide
aminé avec la formation de l’acide insaturé est une marque du
déroulement de la réaction de désamination intramoléculaire (voir
question 36). On peut écrire l’équation de la réaction par la
manière suivante :
insi,
pour obtenir l’acide 3-méthyl-2-penténoïque, la molécule de
l’isoleucine doit perdre le groupe aminé et l’atome d’hydrogène.
En état libre ces particules sont instables et forment une molécule
d’ammoniac NH3.
L’élimination de la molécule d’ammoniac à partir de l’acide
aminé avec la formation de l’acide insaturé est une marque du
déroulement de la réaction de désamination intramoléculaire (voir
question 36). On peut écrire l’équation de la réaction par la
manière suivante :
Maintenant on écrit les formules de la sérine et du 2-amino-éthanol:
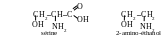
En comparant ces formules on arrive à la conclusion que pour le résolution du problème donné il est nécessaire d’éliminer l’atone de carbone et deux atomes d’oxygène du groupe carboxyle. Ainsi, au cours de la réaction la sérine doit perdre le groupe carboxyle. Telle réaction s’appelle la réaction de décarboxylation, le groupe carboxyle s’élimine sous la forme de l’oxyde de carbone (IV) (le dioxyde de carbone).
L a
décarboxylation des α-acides aminés se déroule dans l’organisme
en présence d’enzymes spéciaux – de décarboxylases. On peut
écrire l’équation de la réaction par la manière suivante :
a
décarboxylation des α-acides aminés se déroule dans l’organisme
en présence d’enzymes spéciaux – de décarboxylases. On peut
écrire l’équation de la réaction par la manière suivante :
Question 52. Quel composé se forme à la suite de la désamination réductrice de la sérine et de la désamination oxydative de l’acide glutamique ? Si les produits de la désamination oxydative in vivo (dans l’organisme) et in vitro (dans le tube à essai) seront différents ?
Réponse. Lors de la désamination réductrice le groupe aminé à la deuxième position se substitue par l’atome d’hydrogène. Encore un atome d’hydrogène s’attache au groupe aminé avec la formation d’une molécule d’ammoniac :
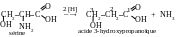
En résultat on reçoit l’acide 3-hydroxypropanoïque.
La désamination oxydative de l’α-acide aminé dans l’organisme vivant se passe suivant deux stades. Au cours du premier stade la déhydrogénation (l’élimination d’hydrogène) de l’α-acide aminé initial avec la formation de l’imino-acide se réalise sous l’action de déshydrogènases. Au cours du deuxième stade à la suite de l’hydrolyse de l’imino-acide (intéraction à l’eau) on reçoit l’α-cétoacide et l’ammoniac. Pour l’acide glutamique on peut écrire ces stades par la manière suivante :
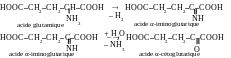
Dans des conditions de laboratoire on réalise la désamination oxydative à l’aide de l’acide azoté. En ce cas ce sont les hydroxy-acides qui se forment, et l’azote gazeux se dégage :

Question 53. Quesl composés se forment en cas d’intéraction de la valine et de l’acide pyruvique dans l’organisme ?
Réponse. On écrit les formules des composés initiaux :


La valine présente l’α-acide aminé, l’acide pyruvique est l’α-céto-acide. La réaction de transamination (du transfert du groupe aminé) se passe dans l’organisme vivant sous l’action d’enzymes-transaminases. Le donneur du groupe aminé – c’est l’α-acide aminé, son accepteur – l’α-cétoacide. En ce cas l’α-acide aminé se transforme en α-céto-acide, et l’α-céto-acide agissant se transforme en α-acide aminé à constitution de radicaux correspondante (c’est-à-dire, le groupe aminé et le céto-groupe changent de places l’un avec l’autre).
Lors de l’intéraction de la valine et de l’acide pyruvique la réaction suivante a lieu :
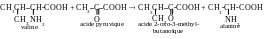
Les produits de la réaction sont l’acide 2-oxo-3-méthylbutanoïque et l’acide 2-aminopropanoïque (l’alanine). À l’aide de cette réaction les acides aminés remplaçables ses synthétisent dans l’organisme, l’excès d’acides indésirables se supprime, et la liaison entre les processus du métabolisme de protéines et les glucides se réalise.
Question 54. Qu’est-ce que c’est les peptides ? Quelle est leur différence essentielle de protéines ? Nommer les réactions dont à la suite les peptides se forment dans l’organisme.
Réponse. Les peptides et les protéines – sont des composés formés par des restes des α-acides aminés. On considère que les peptides dans la molécule peuvent contenir jusqu’à 100 restes d’acides aminés. Parmi les peptides on distingue les oligopeptides (les peptides micromoléculaires) dont la chaîne contient non plus que 10 restes d’acides aminés. Les peptides qui contiennent un grand nombre de reste d’acides aminés sont les polypeptides. Pour les macromolécules contenant environ 100 restes d’acides aminés ou plus, les notions la protéine te le peptide presque se coïncident. Les chaînes polypeptidiques et protéiques se forme au résultat de la réaction de polycondensation des α-acides aminés avec la formation d’une liaison peptidique (amidique) entre les chaînons monomères :
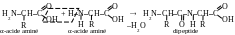
Les chaînes polypeptidiques (polyamidiques) aux peptides et protéines, comme eb règle, ont la constitution non-ramifiée. Tel bout de la chaîne sur lequel se trouve l’acide aminé à un groupe aminé libre s’appelle N-termianle du peptide (de la protéine), un autre bout sur lequel se trouve l’acide aminé à un groupe carboxyle libre, s’appelle C-terminal du peptide (de la protéine). Habituellement on écrit les chaînes peptidiques et protéiques à partir de N-terminal. Tout les organismes vivants contiennent des peptides. À la différence de protéines ils ont une constitution anino-acide inhomogène, qui parfois comprend les acides aminés de D-série. Ils peuvent contenir des fragments cycliques, des chaînes ramifiées etc. Les peptides, en possédans de la haute activité physiologique, règlent des processus biologiques différents. Suivant l’action biorégulatrice on distingue les peptides en certains groupes :
- les composés, possédant de l’activité hormonale (glucagon, oxytocine, vasopressine etc.) ;
- les substances, réglant les processus digestifs (gastrine, peptide gastrique inhibitoire etc.) ;
- les peptides, réglant l’appétit (endorphines, neuropeptide-Y, leptine etc.) ;
- les composés, possédant l’effet analgésique (peptides opioïdes) ;
- les substances, réglant l’activité nerveuse supérieure, les processus biochimiques, liés aux mécanismes de la mémoire, de l’étude, à la survenue du sentiment d’angoisse, de rage etc. ;
- les peptides qui règlent la pression artérielle et le tonus de vaisseaux (angiotensine II, bradykinine etc.).Telle distinction est conditionnelle, parce que l’action de la plupart des peptides ne se limite pas par un sens. Ainsi, par exemple, la vasopressine outre l’action de vaso-constriction et antidiurétique, améliore la mémoire.
Chaque enzyme possède la nature protéique.
Question 55. Comment écrire la formule du trypeptide dont la nomination abrégée est ala-lys-asp ? Quel nom corresond à c e peptide ? Comment se déroule son hydrolyse enzymatique sous l’action de l’enxyme la trypsine qui décompose les liaisons peptidiques, formées par le groupe carboxyle de la lysine et del’arginine ?
Réponse. Pour les acides aminés on a accepté des notations littérales qui présentent les premiers trois lettres de leut nom selon la noménclature triviale. Ala – est une désignation symbolique de l’alanine, lys – de la lysine, asp – de l’acide aspartique. Suivant l’exemple donné, Le N-terminal de la chaîne – est le groupe aminé de l’alanine, C-terminale – est le groupe carboxyle de l’acide aspartique. Pour écrire le peptide, il faut écrire tout ces trois acides aminés par telle manière pour que le groupe aminé, l’α-atome d’hydrogène et le groupe carboxyle se trouvent en même ligne.
On installe verticalement (en bas ou en haut) les radicaux des acides aminés. Le groupe carboxyle d’un acide aminé (le groupe –OH s’élimine à partir de lui) et l’α groupe aminé (l’atome d’hydrogène s’élimine à partir de lui) font partie à la formation de la liaison peptidique. Les groupes carboxyles et les groupes aminés, présentés dans le radical hydrogéné, ne participent pas dans la formation de la liaison peptidique.

On forme les noms des peptides par la voie du dénombrement successif des restes des acides aminés à partir de N-terminal de la chaîne. Dans ce cas on remplace la terminaison « -ine » du nom trivial de l’acide par « -yl », excepté l’acide aminé étant C-terminal de la chaîne (son nom ne change pas). Dans l’exemple donné le peptide s’appelle : l’acide alanyllysylaspartique.
Car l’enzyme la trypsine décompose seulement les liaisons peptidiques, formées par le groupe carboxyle de la lysine (l’arginine est absente dans le tripeptide donné), on peut écrire l’équation de l’hydrolyse enzymatique par la manière suivante :
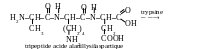

Question 56. Caractériser les structures primaire, secondaire, tertiaire et quaternaire de protéines.
Réponse. La structure primaire de protéines – est un ordre d’alternance des α-acides aminés en chaîne polypeptidique (fig. 1) :

Figure 1. Structure primaire de l’insuline
Les acides aminés se sont liés par des liaisons peptidiques. On peut constater la structure primaire par la voie de l’élimination successive des α-acides aminés à partir du bout de la molécule et de leur identification.
La structure secondaire de protéine est présentée par deux conformations (fig. 2). Une des structures secondaires de la molécule protéique présente l’hélice (on nomme cette structure α-structure ou α-spirale). Cette conformation de la chaîne polypeptidique présente l’hélice dextrogyre. On peut la figurer, en imaginant, que la chaîne polypeptidique enroule la surface du cylindre, en se gyrant dans le sens des aiguilles d'une montre (à droite). Environ 3,6 restes d’acides aminés dont un tour (36 restes – 10 tours) ; le pas de l’hélice (la distance entre des tours – voisins) – 0,54 nm ; le diamètre – 0,5 nm. Les surgaces de deux groupes peptidiques voisins s’installent à angle 105º, et les radicaux latéraux des α-acides aminés se trouve à côté extérieur de l’hélice, c’est-à-dire, ils sont dirigés contre la surface du cylindre imaginé.
Le rôle essentiel dans la fixation de l’α-hélice appartient aux liaisons d’hydrogène qui se forment entre l’atome carbonyle d’oxygène de chaque premier reste d’acide aminé et l’atome d’hydrogène du groupe −NH− de chaque cinquième reste d’acide aminé (c’est-à-dire, les liaisons d’hydrogène se forment entre des liaisons peptidiques installées sur les tours-voisins de l’hélce). Les liaisons d’hydrogène ont dirigé presque parallèlement à l’axe de l’α-hélice. Habituellement, les chaînes protéiques sont spiralisés impargaitement, et les α-hélices s’altèrnent avec des sites linéaires.
Une autre structure secondaire des polypeptides et des protéines – est une structure β (le feuillet β). Les chaînes polypeptidiques allongées se couchent en feuilles plissés. Les chaînes sont liées l’une à l’autre par des liaisons d’hydrogène multiples entre des groupes peptidiques.
|
|
|
|
Figure 2. La structure secondaire de la protéine : A – spiralesque, B – feuillet
L a
structure tertiaire de la protéine se détérmine par la disposition
générale en espace de la chaîne polypeptidique, comprenant des
élements de telle ou telle structure secondaire. On distingue les
structures tertiaires de protéines globulaires (sphériques) et
fibrillaires (les fils allongés).
a
structure tertiaire de la protéine se détérmine par la disposition
générale en espace de la chaîne polypeptidique, comprenant des
élements de telle ou telle structure secondaire. On distingue les
structures tertiaires de protéines globulaires (sphériques) et
fibrillaires (les fils allongés).
Figure 3. La structure tertiaire de la protéine : globulaire et fibrillaire.
Lors de la formation de la structure tertiaire, les chaînes polypeptidiques se replient, en ce cas les radicaux latéraux des restes des α acides aminés, qui ont été éloignés l’un de l’autre à la chaîne non-repliée, peuvent s’engager dans l’interaction. Plusieurs types de liaisons participent dans la formation et la stabilisation des structures tertiaires des molécules protéiques.
Les liaisons d’hydrogène se forment entre des groupes fonctionnels des radicaux latéraux (par exemple entre des groupe hydroxyles de la sérine et de la thréonine, ou entre le groupe hydroxyle et le groupe carbonyle de la glutamine et de l’asparagine), ainsi qu’entre les groupes fonctionnels des radicaux latéraux et les atomes de la liaison peptidique.
Les liaisons ioniques se forment au dépends de l’intéraction électrostatique entre les radicaux ionogènes (capables de former les ions). Par exemple, le radical de l’acide aspartique contient le groupe carboxyle qui ne participe pas dans la formation de la liaison peptidique. Le groupe électronégatif –COO− se forme en cas de sa dissociation. Le groupe aminé qui ne participe pas dans la formation de la liaison peptidique est présentée dans le rqadical de la lysine. Ce groupe est capable de prendre un proton et recevoir la charge positive (−NH3+). La liaison ionique se forme entre ces groupes chargés. L’acide glutamique peut former le groupe électronégatif, l’arginine et l’histidine peuvent former des radicaux électropisitifs.
Les intéractions hydrophobes (liaisons apolaires) surviennent suite à la gravitation mutuelle des radicaux apolaires (qui ne contiennent pas de groupes fonctionnels) u dépends de forces de van der Waals. Ce type de liaison est propre pour les radicaux de l’alanine, de la valine, de la leucine, de l’isoleucine etc.
Le liaisons disulfures se forment entre des groupes mercapto, présentés au radical de la cystéine. Les groupes –SH s’oxydent facilement avecla formation des ponts disulfures. La kératine (la protéine de cheveux et de laine) contient beaucoup de liaisons disulfures. Les types de liaisons essentiels sont présenté au figure 4.

Fig. 4. Le shéma de la formation des liaisons ioniques (1), d’hydrogène (2), hydrophobes (3), disulfures (4) entre des radicaux des acides aminés lors de la formation de la structure tertiaire.
La structure quaternaire de protéine – est un complexe de plusieurs chaînes polypeptidiques. En ce cas chaque chaîne (sous-unité) garde les structures primaire, secondaire et tertiaires propres pour elle. La structure quaternaire s’entretien au dépends des liaisons d’hydrogène et des intéractions hydrophobes entre les sous-unités. La protéine à structure quaternaire remplie des fonctions biologiques qui ne sont pas propres pour des unités distincts. La structure quaternaire est pas propre pour les protéines particulières. Par exemple, l’hémoglobine, dont la fonction biologique – le transfert de l’oxygène à partir de poumons vers des tissus et organes de l’organisme. La structure quaternaire de cette protéine présente le complexe de quatre protéines complexes, comprenant une chaîne polypeptidique (la globine) et une partie non-protéique (l’hème)

Fig. 5. La constitution de la structure quaternaire de l’hémoglobine.
Question 57. Quelle est la classification des protéine ?
Réponse. La classification unique, prenant en compte des différents paramètres des protéines, n’existe pas. Habituellement c’est une caractéristique qui est à la base de toutes les classifications crées. On distingue les protéines :
selon la forme des molécules (globulaires et fibrillaires) ;
selon la masse moléculaire (macro- et micromoléculaires) ;
selon la composition et la constitution chimique (la présence ou l’absence de la partie protéique) ;
selon les fonction remplies ;
selon la localisation dans une cellule (nucléaires, cytoplasmiques, lysosomales etc.) ;
selon la localization dans l’organisme (les protéines du sang, du foie etc.) ;
selon la possibilité de régler adaptativement la quantité de protéines données : les protéines qui se synthétisent avec la vitesse constante (constitutives), et les protéines, dont la synthèse peut se renforcer sous l’influence des facteurs du miieu (induites) ;
selon la durée de vie dans la cellule (de protéines qui se renouvellent très vite, dont la demi-vie fais moins de 1 h à proténes qui se renouvellent très lentement, dont la demi-vie peut faire des semaines et des mois) ;
selon les cites pareils de la structure primaire et les fonctions proches (le familles des protéines).
On rapporte aux protéines globulaires les protéines dont le rapport des axes longitudinal et traversal ne dépasse pas 1 : 10, et fait plus souvent 1 : 3 et 1 : 4, c’est-à-dire la moléule protéique possède la forme de l’ellipse. On rapporte la plupart des protéines individuelles de l’homme aux protéines g lobulaires. Elles possèdent la structure compacte, lors de la formation du globule les radicaux hydrophobes se dirigent au sein de la molécule, et les radicaux hydrophiles se trouvent à l’extérieur du globule, c’est pourquoi la plupart d’eux sont bien hydrosolubles. Les exemples : l’albumine d’oeuf, la myoglobine, l’hémoglobine, beaucoup d’enzymes.
Les protéines fibrillaires possèdent une structure étendue, filiforme, dont le rapport des axes longitudinal et traversal est plus de 1 : 10. On rapporte aux protéines fibrillaires les collagènes, l’élastine, la kératine, remplissant la fonction structurelle dans l’organisme humaine, la myosine, faisant partie de la contraction musculaire, et la fibrine – la protéine du systhème sanguin coagulant.
Selon la composition on distingue les protéines simples et complexes. Les protéines simples contiennent seulement les restes des acides aminés. Les protéines complexes outre les restes des α-acides aminés contiennent un composant supplémentaire de nature non-peptidique (le groupe prosthétique). C’est une substance organique, l’acide phosphorique ou l’ion de métal etc.
Les protéines, contenant le reste de l’acide phosphorique (habituellement sous la forme de l’éther avec le groupe hydroxyle de la sérine), s’appellent les phosphoprotéines : c’est le caséinogène du lait ; la vitelline, la vitellinine et la phosphitine, éxtrait du jaune d’oeuf ; l’ ichthuline, présentée dans oeufs des poissons etc.
Les glucides présentent le groupe prostétique des glycoprotéines (ce sont les composants du sérum sanguin (les immunoglobulines, les transférines etc.) ; les composants de groupe sanguins ; ls antigènes de beaucoup de virus ; des certains hormones et enzymes).
Les lipides font partie de lipoprotéines. On distingue les lipoprotéines en libres, ou hydrosolubles (les lipoprotéines du plasma sanguin, du lait, du jaune d’oeuf, etc.) et insolubles et structurelles (les lipoprotéines des membranes des cellules, de la gaine de myéline des fibres nerveuses, des chloroplastes des plantes).
Les nucléoprotéines contiennent des accides nucléiques : les désoxyribonucléoprotéines (DNP) et les ribonucléoprotéines (RNP).
Les protéines remplissent des plusieurs fonctions dans l cellule. On peut les diviser en groupes suivants :
les enzymes (les protéines spéciales, accélérant la vitesse du déroulement des réactions chimiques) ;
les protéines régulatrices (les protéines – hormones, faisant partie dans l’entretien de la stabilité du milieu interne de l’organisme et influençant les cellules –cibles spécifiques) ;
les protéines réceptives (servent à la transmission du signal hormonal) ;
les protéines de transfert (font partie de la transmission des ligaands spécifiques d’un organe à un autre, souvent ce sont les molécules mal hydrosolubles qui se transportent en complexe avec les protéines : ainsi, la protéine du plasma snguin l’albumine transporte les cides gras et la bilirubine (le produit de la décomposition de l’hème), et l’hémoglobine des érhytrocytes fait partie du transfert de O2 des poumons aux tissus etc.) ;
les protéines structurelles (donnent une forme, créent l’appui, détérminent les propriétés mécaniques du tissu donné : par exemple, le composant essentiel des cartilages et des tendons est une protéine fibrillaire le collagène, ayant une haute solidité, et une autre protéine structurelle (l’élastine), grâce à sa cnstitution unique, elle assure la capacité de se dilater dans toutes les directions aux tissus particuliers (les visseaux, les poumons) ;
les protéines protectrices (par exemple, les immunoglobulines possèdent une cpacité de reconnaître et de fixer les molécules étrangères, les particules virales et les bactéries, à la siute de quoi se passe leur neutralisation ; les protéines du système se coagulation sanguine – le fibrinogène, la thrombine – possèdent les propriétés protectrices : ils font partie de la formation du thrombus qui bloque le vaisseau lésé et empêche la perte du sang) ;
les protéines contractiles (prêtent des capacités de contraction ou de migration à la cellule : l’actine et la myosine – les protéines fibrillaires, faisant partie de la contraction des muscles squelettiques ; la tubuline, dont à partir les organelles celluaires sont construites – les microtubules, les élements importants des cils et des flagelles, dont à l’aide les cellules se déplacent).
Pourtant, il existe une grande quantité des protéines, ayant des fonctions uniques, mais qui ne sont pas indiquées dans cette classification.
L’exemple d’une famille des protéines – la famille de la myoglobine qui, outre la myoglobine, contient tout les types de l’hémoglobine
Question 58. Quelles réactions qualitatives applique-t-on pour la détérmination des acides aminés et des protéines ?
Réponse. La réaction ninhydrique – la formation de la coloration bleu-violet en cas d’interaction de la solution de l’acide aminé ou de la protéine avec la ninhydrine (le réactif organique) – est propre pour tout les α-acides aminés et les protéines.
La réaction biurétique – l’apparition de la coloration rouge-violet en cas d’interaction du peptide et de la protéine avec la solution du sulfate de cuivre au milieu basique – sert pour la détection des liaisons peptidiques au peptides et protéines.. La coloration violet peut avoir des teintes différentes (rouge, bleu). La réaction est conditionnée par la présence des liaisons peptidiques −CO−NH−, reliant les restes des acides aminés. Tout les peptides et les protéines, contenant au minimum deux telles liaisons, s’introduissent dans la réaction.
Il existe aussi les réactions particulières, dont à l’aide on peut détecter les α-acides aminés ou les groupes des acides aminés parentaux. On applique la réaction xantoprotéique pour la détection des α-acides aminés hétérocycliques (la phénylalanine, la tyrosine, l’histidine, le tryptophane). Par exemple, le composé nitrique jaune se forme en cas d’action de l’acide azotique concentré sur la solution de l’acide aminé la tyrosine (ou sur la solution de protéine qui contient un reste de l’acide aminé la tyrosine). En cas d’addition de la solution d’alcalin la couleur devient orange. Dans cette réaction c’est le radical arômatique de l’acide aminé la tyrosine qui subit les transformations, mais la liaison chimique n’est pas touchée.
Les acides aminés contenant du soufre, se détectent par la réaction de Fol (avec l’acétate de plomb). Tout d’abord on chauffe la solution de protéine avec la solution d’alcalin concentrée (la protéine s‘hydrolise partiellement, et le soufre se dégage sous la forme de l’ion S2-), et ensuite on ajoute de la solution de l’acétate de plomb (CH3COO)2Pb et observe la formation du dépôt noir du sulfure de plomb PbS :
(СH3COO)2Pb + 2 NaOH ® Pb(OH)2 + 3 CH3COONa
Pb(OH)2 + 2 NaOH ® Na2PbO2 + 2 H2O
Na2PbO2 + Na2S + H2O ® PbS¯ + 4 NaOH
S’il y a peu de soufre dans la protéine, c’est la coloration jaune-brun qui se forme à la place du dépôt noir.
On peut détecter l’ion de soufre S2-, si on ajoute dans la solution, reçue après la chauffe de la proténe avec l’alcalin, la solution du nitroprussiate de sodium Na2[Fe(CN)5NO] ; la couleur rouge, conditionnée par la formation du sel complexe, apparait :
Na2S + Na2[Fe(CN)5NO] ® Na4[Fe(CN)5NOS]
Question 59. Si à l’aide de la réaction xantoprotéique (avec l’acide azotique) peut-on distinguer la phénilalanine de la tyrosine ? Si oui, en quoi consiste la différence ? Si non, racontez, puorquoi.
Réponse. La réactin xantoprotéique – est une réaction colorée, dont à l’aide on peut détérminer les acides aminés au radical aromatique hydrocarboné, c’est pourquoi suivant cette réaction on ne peut pas distinguer la phénilalanine et la tyrosine, dont les radicaux contiennent le cycle benzénique, car en cas d’action de l’acide azotique dans tout les deux cas se forme les nitro-composé à couleur jaune.
Question 60. Quel acide aminé s’est trouvé dans la solution, si en cas d’interaction à l’acétate de plomb le dépôt noir se forme dans la solution basique : a) l’alanine ; b) la sérine ; c) l’histidine ; d) le tryptophane ; e) la cystéine ; f) la tyrosine ?
Réponse. La réaction à l’acétate de plomb (la réaction de Fol) – est une réaction aux acides contenant du soufre. Parmi tout les acides aminés nommés juste un acide contient du soufre – la cystéine – cet acide s’est trouvé dans la solution.

 A
A
 B
B