
- •Chimie bioorganique sous forme « question-réponse »
- •Tambov 2013
- •Sommaire
- •Introduction
- •1. Classification et nomenclature des composés organiques biologiquement importants
- •2. Constitution des composés organiques
- •3. Principes généraux de la capacité réactionnelle des composés organiques
- •4. Acides aminés, peptides, protéines
- •5. Glucides : mono-, di- et polysaccharides
- •6. Les nucléotides et les acides nucléiques
- •7. Les lipides et les biorégulateurs micromoléculaires
- •8. Identification des composés organiques
2. Constitution des composés organiques
Question 16. Comment peut-on caractériser la notion : constitution des composés organiques ?
Réponse. La constitution des composés organiques – est une plaine description de la structure d’une molécule. Elle contient deux niveau de description : constitution chimique et constitution spatiale. La constitution chimique – est une séquence (ordre) des liaisons des atomes vu leur valence. La constitution chimique n’examine pas la position spatiale des atomes, formant la molécule. Une branche spéciale de la chimie – stéréochimie étudie la constitution spatiale des composés organiques. Le haut niveau de la science et de la technique permet d’établir la constitution spatiale même des molécules très complexes. La constitution spatiale est interdépendant avec les propriétés physique, chimiques de la substance et avec son activité biologique.
Question 17. Quelles substances sont nommées « les isomères » ?
Réponse. Les isomères – sont les composés à la même composition qualitative et quantitative, qui se distinguent par la constitution chimique et spatiale et ont des propriétés physiques, chimiques ou biologiques différentes.
Question 18. Quelles substances s’appellent les isomères structuraux ou les isomères de constitution ?
Réponse. Les isomères structuraux ou les isomères de constitution sont les composés à la même composition qualitative et quantitative, mais à la constitution chmique différente (se distinguent par la séquence des liaisons des atomes).
Question 19. Quels composés sont les stéréosomères ?
Réponse. Les stéréoisomères (les isomères spatiaux) – sont les composés , dont les molécules ont la même séquence des liaisons chimiques des atomes , mais la position différente de ces atomes par rapport l’un à l’autre dans l’éspace.
Question 20. Quels sont les types de l’isomérie structurelle ?
Réponse. L’isomérie structurelle a trois types :
1 )
isomérie de squelette carboné (isomères de chaîne) : par
exemple, butane et 2-méthylpropane :
)
isomérie de squelette carboné (isomères de chaîne) : par
exemple, butane et 2-méthylpropane :

2) isomérie de position de fonction (ou de liaisons multiples) : par exemple, 1-butanol et 2-butanol :

o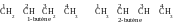 u
1-butène et 2-butène :
u
1-butène et 2-butène :
3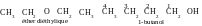 )
isomérie de nature de fonction (entre des classes) : par
exemple, l’éther diéthylique et 1-butanol.
)
isomérie de nature de fonction (entre des classes) : par
exemple, l’éther diéthylique et 1-butanol.
Question 21. Quels sont les types de l’isomérie spatiale (stéréoisomérie) ?
Réponse. On divise la stéréoisomérie en isomérie de conformation et en isomérie de configuration.
O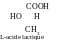
 n
rapporte aux isomères de configuration : l’isomérie
géométrique (cys-, trans-) : cys-2-butène et trans-2-butène,
et l’énantiomérie (isomérie optique ou de miroir) : D-acide
lactique ou L-acide lactique :
n
rapporte aux isomères de configuration : l’isomérie
géométrique (cys-, trans-) : cys-2-butène et trans-2-butène,
et l’énantiomérie (isomérie optique ou de miroir) : D-acide
lactique ou L-acide lactique :
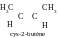
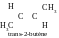
On rapporte aux isomères de conformation les isomères se formant en cas de tour d’une molécule relativement à une liaison simple, se sont les conformations cachées ou inhibées :

Question 22. Qu’est-ce que c’est la configuration d’une molécule ?
Réponse. La configuration – est un ordre de disposition des atomes dans l’espace sans prendre en compte les différences, survenant suite à la rotation autour de simples σ-liaisons. Par exemple, on peut dire que 2-butène a deux isomères de configuration : cys-2-butène et trans-2-butène. L’acide lactique peut exister sous forme de deux isomères de configuration : D-acide lactique et L-acide lactique.
Question 23. Qu’est-ce que c’est la conformation d’une molécule ?
Réponse. Les conformations d’une molécule sont ses formes géométriques différentes se formant suite àla rotation autour de simples σ-liaisons. Les isomères de conformation – se sont les stéréoisomères, qui se forment en cas de tour des sites particuliers d’une molécule autour de liaisons simples.
Question 24. Qu’est-ce que c’est la série homologique ?
Réponse. La série homologique – est une série de composés proches par leur constitution possédant des propriétés chimiques semblables, dans laquelle les membres particuliers de la série se distinguent l’un de l’autre par un ou quelques groupes ─CH2─.
Chez les membres de la série homologique la plupart des réaction se déroulent également (seulement les premiers membres de la série font exception). Conséquemment, en sachant les réactions chimiques seulement d’un membre de la série, on peut affirmer assez sûrement que les autres membres de la série homologique subissent des transformations du même type.
Pour n’importe quelle série homologique on peut tirer une formule générale, réflétant la relation entre les atomes de carbone et d’hydrogène des membres de cette série ; on appelle telle formule formule générale de la série homologique. Ainsi, CnH2n+2 – la formule des alcanes. CnH2n+1OH – la formule des alcools monoatomiques aliphatiques.
Question 25. Comment faut-il écrire la formule d’un homologue de l’acide butanoïque ayant deux atomes de carbone de plus ?
Réponse. Tout d’abord on écrit la formule de l’acide butanoïque. La racine du nom – butane, alors, la molécule contient quatre atomes de carbone.
Étape 1. Écrire la chaîne carbonée principale contenant quatre atomes de carbone.
Étape 2. Détérminer, quel groupe fonctionnel doit être présenté dans ce composé. Vu la terminaison « -ique », c’est le groupe carboxyle ─COOH. À chaque atome de carbone on ajoute les atomes d’hydrogène pour que sa valence fasse quatre. On reçoit la formule :
L’homologue doit se rapporter à la même classe de composés organiques, car il présente un acide aliphatique à un groupe carboxyle et au radical hydrocarboné non-ramifié.
É tape
3. Détérminer, par quoi l’homologue se distingue de l’acide
initial. Par condition, sa molécule doit comprendre deux atomes de
carbone de plus. Conséquemment, le radical hydrocarboné doit avoir
deux groupes ─CH2─,
c’est-à-dire la molécule de l’homologue contient 6, pas 4
atomes de carbone. On écrit la chaîne carbonée principale
contenant six atomes de carbone, le premier atome de carbone
appartient au groupe carboxyle ─COOH. À chaque atome de carbone on
ajoute les atomes d’hydrogène pour que la valence des atomes de
carbone fasse quatre :
tape
3. Détérminer, par quoi l’homologue se distingue de l’acide
initial. Par condition, sa molécule doit comprendre deux atomes de
carbone de plus. Conséquemment, le radical hydrocarboné doit avoir
deux groupes ─CH2─,
c’est-à-dire la molécule de l’homologue contient 6, pas 4
atomes de carbone. On écrit la chaîne carbonée principale
contenant six atomes de carbone, le premier atome de carbone
appartient au groupe carboxyle ─COOH. À chaque atome de carbone on
ajoute les atomes d’hydrogène pour que la valence des atomes de
carbone fasse quatre :
On nomme le compose reçu. La chaîne carbonée principale (et unique) contient 6 atomes de carbone, conséquemment, la racine est « hexane ». Il y a un seul groupe fonctionnel, il fait la terminaison – « acide ..-ique ». On n’indique pas le numéro de l’atome de carbone du groupe carboxyle dans ce nom, parce que c’est evident, qu’il est premier toujours . Le nom de l‘homologue : l’acide hexanoïque.
Question 26. Comment peut-on écrire la formule de l’homologue du butanal ayant quatre atome d’hydrogène en moins ?
Réponse. Tout d’abord on écrit la ormule du butanal. La racine du nom – butane, donc, la molécule contient quatre atomes de carbone.
Étape 1. Écrire la chaîne carbonée principale contenant quatre atomes de carbone.
É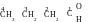 tape
2. Détérminer, quel groupe fonctionnel doit être présenté dans
ce composé. Le suffixe « -al » prouve la présence du
groupe aldéhyde ─COH. À chaque atome de carbone ajouter les
atomes d’hydrogène pour que la valence de chaque atome de carbone
fasse quatre. Il vient la formule :
tape
2. Détérminer, quel groupe fonctionnel doit être présenté dans
ce composé. Le suffixe « -al » prouve la présence du
groupe aldéhyde ─COH. À chaque atome de carbone ajouter les
atomes d’hydrogène pour que la valence de chaque atome de carbone
fasse quatre. Il vient la formule :
L’homologue doit appartenir à la même classe de composés organiques, c’est-à-dire, il est un aldéhyde.
Étape 3. Détérminer, par quoi l’homologue se distingue de l’aldéhyde initial. Par condition, sa molécule contient quantre atomes d’hydrogène en moins. La réduction de la moléculede 4 atomes d’hydrogène est équivalent à sa réductuon de deux groupes ─CH2─, c’est-à-dire, la chaîne de l’homologue contient deux atomes de carbone en moins. Conséquemment, la molécule de l’homologue contient 2, pas 4 atomes de carbone. On écrit la chaîne carbonée principale formée par deux atomes de carbone, le premier atome de carbone appartient au groupe aldéhyde ─CHO. À chaque atome de carbone on ajoute les atomes d’hydrogène pour que la valence de chaque atome de carbone fasse quatre.
O n
nomme le composé reçu. La chaîne carbonée principale (et unique)
contient deux atomes de carbone, alors, la racine est « éthane ».
La groupe fonctionnel dans ce composé est unique, on le nom en
qualité de suffixe « -al ». On n’indique pas le numéro
de l’atome de carbone du groupe carboxyle dans ce nom, il est
évident, qu’il est toujours premier. Le nom de l’homologue :
éthanal. On appelle aussi cet aldéhyde l’aldéhyde acétique ou
l’acétaldéhyde.
n
nomme le composé reçu. La chaîne carbonée principale (et unique)
contient deux atomes de carbone, alors, la racine est « éthane ».
La groupe fonctionnel dans ce composé est unique, on le nom en
qualité de suffixe « -al ». On n’indique pas le numéro
de l’atome de carbone du groupe carboxyle dans ce nom, il est
évident, qu’il est toujours premier. Le nom de l’homologue :
éthanal. On appelle aussi cet aldéhyde l’aldéhyde acétique ou
l’acétaldéhyde.
Question 27. Comment peut-on écrire la formule de l’isomère de chaîne carbonée de l’acide pentanoïque ?
Réponse. Tout d’abord il faut écrire la formule de l’acide pentanoïque. selon le nom, il est évident, que la chaîne non-ramifiée (directe) à cinq atomes de carbone est au principe de la molécule de l’acide. La formule de l’acide initial :

Selon la notion « isomère de chaîne carbonée » dans la formule de cet isomère de l’acide pentanoïque la chaîne carbonée doit avoir la constitution, qui se diffère de a constitution du squelette carboné de l’acide pentanoïque. Ça peut être juste la structure ramifiée. Pour cinq atomes de carbone il existe 3 variantes probables de la constitution de la chaîne carbonée :
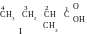


On nomme les composés reçus. Dans les composés I et II la chaîne carbonée la plus longue contient quatre atomes de carbone, donc, la racine de tout les deux noms « butane », en cas de présence du groupe carboxyle la terminaison est « acide ..-ique ». Toutes les deux molécules contiennent un radical méthyle lié aux différents atomes de carbone. En qualité de préfixe on indique le nom du radical et le numéro d’un atome de carbon lié à lui. On commence à énumérer la chaîne par le groupe fonctionnel. Conséquemment, les noms des composés I et II – acide 2-méthylbutanoïque et acide 3- méthylbutanoïque. Dans le composé III la chaîne carbonée la plus longue contient trois atomes de carbone, donc, la racine du nom est « propane », la terminaison – « acide -ique ». Cette molécule possède la structure plus ramifiée : il existe deux radicaus méthyles (cela exige la présence du particule multipliant « di- » dans le nom, tout les deux radicaux sont liés au deuxième atome de carbone (dans le nom on répète le numéro deux fois). Le nom du troisième isomère : acide 2,2-diméthylpropanoïque.
La composition de tout les trois isomères et du composé initial est pareille : C5H10O2, mais la constitution chimique est différente.
Question 28. Comment faut-il écrire la formule de l’isomère de position de la liaison multiple du 1-pentène ?
Réponse. Tout d’abord il faut écrire la formule du 1-pentène. Selon le nom, il est évident que la chaîne non-ramifiée (directe) formée par cinq atomes de carbone est à la base de la molécule. La terminaison «-ène » indique la présence d’une double liaison. Le chiffre 1 montre la position de la double liaison : entre le premier et le deuxième atomes de carbone. La formule de l’alcène initial :

Suivant la définition de la notion « isomère de position de la double liaison », dans la formule de l’isomère inconnu la liaison multiple doit se trouver entre des autres atomes de carbone. Théoriquement, on peut représenter encore 3 composés :

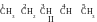

Au premier regard ce sont les composés différents. Mais quand on essaye de nommer ces composés reçu selon la nomenclature systématique, il vient que c’est impossible de garder la même numération de la chaîne des isomères que chez le composé initial, puisque selon les règles on énumère la chaîne depuis tel bout auquel la liaison double est plus proche. Suivant cette règle on reçoit :
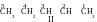

Il est visible que les formulesI et II correspondent au même composé : 2-pentène, et la formule III correspond au composé initial, c’est 1-pentène.
Ainsi, il existe juste deux isomères correspondant à la même formule brute C5H10, qui se diffèrent par la constitution chimique, notamment par la position de la double liaison. Ce sont 1-pentène et 2-pentène.
Question 29. Comment faut-il écrire la formule de l’isomère de fonction du butanal ?
Réponse. On commence pas la formule du butanal. Selon le nom il est visible que la chaîne non-ramifiée (directe) formée par quatre atomes de carbone est à la base de la molécule. Le suffixe « -al » indique qu’un des atomes de carbone appartient au groupe aldéhyde :
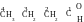
S uivant
la définition de la notion « l’isomère de fonction »
un autre groupe fonctionnel (pas aldéhyde) doit être présenté
dans la formule de l’isomère inconnu. Ça peut être, par exemple,
le groupe cétone :
uivant
la définition de la notion « l’isomère de fonction »
un autre groupe fonctionnel (pas aldéhyde) doit être présenté
dans la formule de l’isomère inconnu. Ça peut être, par exemple,
le groupe cétone :
La composition de tout les deux isomères est pareille : C4H8O, mais la constitution chimique est différente, en plus, la différence consiste en fait que les molécules contiennent des différents groupes fonctionnels, c’est-à-dire, les substances appartiennent aux différentes classes des composés.
On nomme le composé reçu. La chaîne carbonée la plus longue contient quatre atome de carbone, donc, la racine de tout tiqueles deux noms – « butane », en cas de présence du groupe cétone le suffixe est « -one ». Il vient le nom – 2-butanone. Ce n’est pas la peine d’indiquer dans ce nom le chiffre 2, parce que pour ce composé c’est la position unique du groupe.
P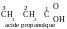
 our
les acides carboxyliquesles isomères de fonction sont les esters :
our
les acides carboxyliquesles isomères de fonction sont les esters :
pour les alcools – les éthers : CH3─CH2─OH CH3─O─CH3
éthanol éther diméthylique
p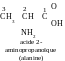 our
les acides aminés – non seuement les esters. mais aussi les amides
des hydroxyacides :
our
les acides aminés – non seuement les esters. mais aussi les amides
des hydroxyacides :
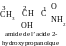
Q uestion
30.
La sérine (acide 2-amino-3-hydroxypropanoïque) sous forme d’isomère
fait partie de formation des molécules protéïques. Représenter la
formule dévéloppée plane de cet isomère et de son énantiomère.
uestion
30.
La sérine (acide 2-amino-3-hydroxypropanoïque) sous forme d’isomère
fait partie de formation des molécules protéïques. Représenter la
formule dévéloppée plane de cet isomère et de son énantiomère.
Réponse. Écrivez la formule de la sérine :
Le deuxième atome de carbone est asymétrique (c’est-à-dire, il est lié aux quatrièmes remplaçant différents : groupe carboxyle, groupe aminé, atome d’hydrogène, troisième atome d’hydrogène de la chaîne). C’est la première condition de l’activité optique du composé. La deuxième condition – l’absence des élement de symétrie dans la molécule – est gardée. Alors, la substance est optiquement active, elle peut exister sous forme de deux énantiomères – isomères spatiaux, qui présentent l’effet miroir l’un pour l’autre.
P
COOH
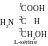
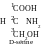

H2N
H
CH2OH
L-sérine
Si le groupe aminé se trouve à gauche de l’axe carboné, on rapporte l‘isomère à la L-série. Pour représenter l’isomère D on figure l’effet miroir des remplaçants de l’atome de carbone asymétrique. Dans ce cas le groupe aminé est à droite de l’axe carboné. Souvent on n’indique pas l’atome de carbone asymétrique, le croisement des lignes indiquant les liaions particulières montre son présence.
Question 31. Comment peut-on détérminer, à quel type d’isomère appartiennent les acides oléïque et élaïdique ?
Réponse. Pour répondre à cette question il faut écrire les formules de ces acides. Les acides oléïque et élaïdique présentent des acides carboxyliques insaturés à une double liaison, ce sont des cys- trans- isomères.
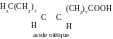

Ces acides sont des isomères stériques (stéréoisomères), car ils se diffèrent par la position des atomes et des groupes relativement à une double liaison dans l’espace.
Question 32. Comment peut-on détérminer à quel type d’isomère appartiennent les composés suivants : acide butanoïque et l’éther méthylique de l’acide propanoïque ?
R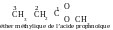 éponse.
Pour répondre à cette question il faut écrire les formules de ces
composés. La racine du nom est « butan », donc, une
molécule de l’acide butanoïque contient une chaîne carbonée
non-ramifiée, composées de quatre atomes de carbone, dont un atome
fait partie du groupe carboxyle. Une molécule de l’acide
propanoïque contient trois atomes de carbone ; car l’éther
est méthylique, il est formé au cours de l’interaction de l’acide
propanoïque et de l’éther méthylique. Les formules des
composés :
éponse.
Pour répondre à cette question il faut écrire les formules de ces
composés. La racine du nom est « butan », donc, une
molécule de l’acide butanoïque contient une chaîne carbonée
non-ramifiée, composées de quatre atomes de carbone, dont un atome
fait partie du groupe carboxyle. Une molécule de l’acide
propanoïque contient trois atomes de carbone ; car l’éther
est méthylique, il est formé au cours de l’interaction de l’acide
propanoïque et de l’éther méthylique. Les formules des
composés :

La formule brute de tout les deux composés est pareille : C4H8O2, mais la constitution chimique est différente. Ces composés appartiennent aux classes difféentes, parce qu’ils contiennent des groupes fonctionnels différents. Conséquemment, ils sont des isomères de position de fonction.
Question 33. Comment peut-on détérminer à quel type d’isomère appartiennent les composés : 1-butanol et 2-butanol ?
Réponse. Pour répondre à cette question il faut écrire les formules de ces composés. La racine des noms de deux composés est « butan », donc, leur molécule contient une chaîne carbonée non-ramifiée, composées de quatre atomes de carbone. Tout les deux composés ont le suffixe « -ol », donc, tout les deux appartiennent à la classe d’alcool. Les molécules d’alcool contiennent le groupe hydroxyle (−OH). Mais dans le premier composés ce groupe est lié au premier atome du carbone de chaîne, dans le deuxième – au deuxième. Les formules des composés :

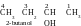
La formule brute de tout les deux composés est pareille : C4H9OH, mais la constitution chimique est différente. Alors, ce sont des isomères structuraux. Ils appartiennet à la même classe et se diffère juste par la position du groupe fonctionnel. Conséuemment, se sont les isomères de position de fonction.
Question 34. Comment peut-on détérminer, si la leucine et l’isoleucine sont des isomères ?
Réponse. Pour répondre à cette question il faut écrire les formules de ces composés. Ce sont les acides aminés qui font partie de protéines. Leurs noms chimiques sont : acide 2-amino-4-méthylpentanoïque et l’acide 2-amino-3- méthylpentanoïque.
La racine de tout les deux noms est « pentan », conséquemment, dans la molécule de l’acide pentanoïque la chaîne carbonée formée par cinq atomes de carbone, dont un atome fait partie du groupe carboxyle, est essentielle. Toutes les deux molécules contiennent des groupes aminés, liés aux deuxième atome de carbone (près du groupe carboxyle), et le radical méthyle (−CH3), lié au quatrième et troisième atomes de carbone. Les formules des composés :
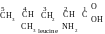

La formule brute de tout les deux composés est la même : C6H13O2N, et la constitution de la chaîne carbonée est différente. Conséquemment, ils sont des isomères de squelette carbonée.
