
- •Підготовка до роботи
- •Лабораторна робота № 1 Хімічна кінетика та хімічна рівновага.
- •Контрольні питання:
- •Лабораторна робота № 2 Розчини електролітів
- •Контрольні питання:
- •Лабораторна робота № 3. Гідроліз солей
- •Контрольні питання:
- •Лабораторна робота № 4. Розчини неелектролітів.
- •Лабораторна робота № 5. Окислювально-відновні реакції.
- •Контрольні питання:
- •Сполуки з комплексними катіонами.
- •Сполуки з комплексними аніонами.
- •Гідратна ізомерія.
- •Контрольні питання:
- •Лабораторна робота № 7. Електрорушійна сила (ерс) гальванічного елементу.
- •Зміст роботи
- •Контрольні питання:
- •Лабораторна робота № 8. Метали.
- •Література
- •1. Лабораторна робота № 1
- •“Розини електролітів” 7
- •3. Лабораторна робота № 3
- •“Комплексні сполуки” 14
- •Методичні вказівки
- •Підписано до друку ________2001р. Формат 60х84 1/16
- •Врц, 83055, м.Донецьк-55, пр. Театральний, 28. Тел.(0622) 92-42-97
Контрольні питання:
Які речовини називаються електролітами?
Як формулюються основні положення теорії електролітичної дисоціації?
Як дисоціюють кислоти, основи, солі, наведіть приклади.
Що таке ступінь дисоціації?
Як впливають на ступінь дисоціації природа розчинника, розведення розчину, температура, наявність одноіменних іонів?
Яку хімічну активність демонструють сильні та слабкі електроліти?
Які електроліти називаються амфотерними?
Лабораторна робота № 3. Гідроліз солей
Мета роботи: практичне вивчення характеру гідролізу солей, впливу температури, розведення на цей процес. В процесі виконання роботи студенти повинні набути навички проведення експеріментальних досліджень.
Дослід №1. Визначення характеру гідролізу.
В чисті пробірки помістити по мікрошпателю сухих солей: сульфату алюмінію, сульфату калію, соди (карбонату натрію), бури (Na2B4O7) і розчинити в невеликому об`ємі дистильованої води (~1мл) . (Для досліда можна використовувати готові розчини цих солей). Визначити за допомогою універсального індикаторного паперу рН розчинів цих солей і записати у лабораторний журнал. Які із цих солей гідролізуються? Написати рівняння реакцій гідролізу.
Дослід № 2. Вплив температури на гідроліз.
У пробірку внести біля 1 мл розчину ацетату натрію, додати 2-3 краплі розчину індикатору фенолфталеїну і сильно нагріти. Визначити зміну кольору. Розчин охолодити до кімнатної температури. Як змінився колір? Пояснити зміну кольору індикатору при нагріванні і охолодженні розчину. Написати рівняння реакцій гідролізу.
Дослід № 3. Необоротний гідроліз.
До 4-5 крапель розчину сульфату алюмінію додати рівний об`єм розчину соди (карбонату натрію). Відзначити випадіння осаду (його колір) та виділення газу. Одержанній осад розділити на дві частини і випробувати його розчинність в кислоті та в надлишку розчину лугу. Зробити висновок про склад осаду. Написати рівняння відповідних реакцій.
Дослід № 4. Вплив розведення на гідроліз.
До 4-5 крапель розчину хлориду сурьми (III) або хлориду вісмуту (III) додати воду по краплям, до випадіння осаду. Написати рівняння гідролізу солі, вказати склад осаду. Потім додати декілька крапель соляної кислоти. Що відбувається? Поясніть зміщення рівноваги гідролізу солі.
Завдання для самостійної роботи. Вивчити теоретичний матеріал відповідно за темою, підготувати відповіді на контрольні питання.
Контрольні питання:
Що таке гідроліз? Які солі підлягають гідролізу? Наведіть приклади, для яких складіть рівняння реакцій у молекулярній, іонній та скороченій іонній формах.
Як впливає підвищення та зниження температури на гідроліз?
Як впливає розведення на гідроліз?
Наведіть приклади необоротнього гідролізу. Напишить рівняння відповідних реакцій.
Лабораторна робота № 4. Розчини неелектролітів.
Мета роботи: практичне вивчення за допомогою експеріментальних досліджень властивостей розчинів неелектролітів. В результаті виконання лабораторної роботи студенти повинні набути навички проведення досліджень по визначенню густини розчинів ареометром, залежності густини розчину від концентрації неелектролітів, підвищення точки кипіння розчину, зниження температури заморожування.
Дослід № 1. Виготовлення розчину заданої концентрації.
Для виготовлення 1- моляльного розчину цукру відмірити мірною колбою 50 мл дистильованої води та перелити у стакан ємкістю 150 мл. Зважити кількість цукру, що разраховано, на технічних терезах та розчинити його у воді.
Розрахувати масову частку цукру у розчині, що отримано.
Дослід № 2. Визначення густини розчину ареометром.
Розчин цукру, що отримали у досліді 1, перелити у циліндр та визначити густину цього розчину ареометром. Розрахувати молярну концентрацію та титр розчину. Розрахувати мольну долю цукру у розчині.
Дослід № 3. Вивчення залежності густини розчину від концентрації.
Приготувати 2-моляльний розчин цукру, для чого до розчину, що отримано у досліді 1, додати кількість цукру, що розрахована та зважена на технічних терезах. Перемішати і визначити густину розчину, що отриман, ареометром. Порівняти з густиною розчину, що одержан у досліді 2. Зробити висновок. Розрахувати масову частку, мольну долю цукру, молярну концентрацію і титр розчину, що отримано.
Дослід № 4. Визначення підвищення точки кипіння розчину.
2-моляльний
розчин, що отриман у досліді 3, перелити
у хімічний стакан і нагрівати до кипіння.
Одночасно закип’ятити
у іншому стакані дистильовану воду.
Визначити термометром температуру
кипіння дистильованої води та розчину
цукру у воді. Порівняти результати, що
отримали
і визначити підвишення температури
кипіння (t0
кип).
Для розчину , що отримали у досліді 4,
розрахувати
t0кип
теоретичне. Визначити помилку вимірювання
за формулою:![]()
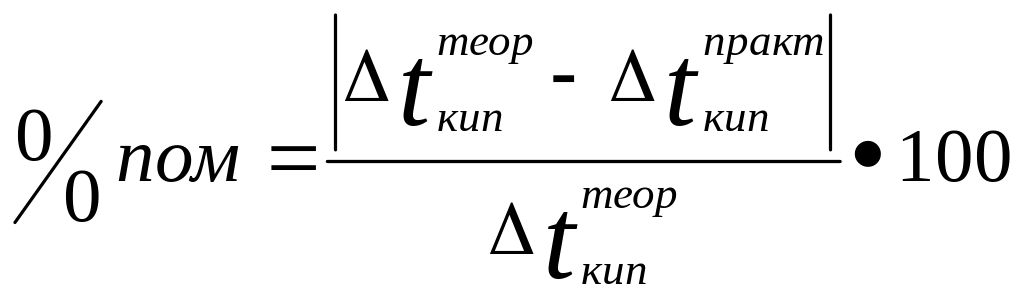 .
.
Для розчинів, що отримали у дослідах 1 та 2, розрахувати значення зниження температури замерзання та порівняти їх; розрахувати значення осмотичного тиску та порівняти їх. Результати, що отримали, записати у таблиці 4.1 і 4.2.
Таблиця 4.1.
G H2O,г |
g цукру,г
|
p |
|
Cm |
CM |
T |
Мольні долі |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблиця 4.2.
G H2O,г |
g цукру,г |
Cm |
tпракт кип |
tпракт кип |
% помилки |
tтеор зам |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Зробити висновки про властивості розчинів неелектролітів за експерементальними та розрахованними результатами.
Завдання для самостійної роботи. Вивчити теоретичний матеріал за темою лабораторної роботи та підготувати відповідь на контрольні питання.
Контрольні питання:
1.Які способи виразу концентрації розчинів використовано в данній роботі ? Що позначає кожний з них?
2.Які фактори впливають на властивості розбавлених розчинів?
3.Які характерні властивості мають розбавлені розчини?
4.Як формулюється закон Рауля?
5.Що таке кріоскопічна стала розчинника?
6.Наведіть приклади охолоджуючих сумішей та антифризів. Де вони використовуються?
7.Що таке ебуліоскопічна стала розчинника?
8.Що таке осмотичний тиск? Як формулюється закон Вант- Гоффа?
9.Як відносяться між собою осмотичний тиск двох розчинів при однаковій температурі?
