
- •Содержание
- •Введение
- •1 Горение
- •1.1 Общие сведения о горении
- •1.2 Процесс горения
- •1.3 Расход воздуха при горении
- •1.4 Температура горения
- •1.5 Диффузионное пламя
- •1.6 Тепловая теория горения
- •1.7 Цепная теория горения
- •1.8 Горение газовых смесей
- •1.9 Горение жидкостей
- •1.10 Горение твердых веществ
- •1.10.1 Горение металлов
- •Твёрдого тела при экзотермическом гетерогенном процессе
- •1.10.2 Горение пластмасс
- •1.11 Контрольные вопросы
- •2 Пожароопасные свойства веществ и материалов
- •2.1 Горючие газы
- •2.2 Горючие жидкости
- •2.3 Твёрдые горючие вещества
- •2.4 Самовозгорание
- •2.4.1 Вещества, самовозгорающиеся под действием воздуха
- •2.4.1.1 Масла и жиры
- •2.4.1.2 Каменный уголь и торф
- •2.4.1.3 Растительные материалы
- •2.4.1.4 Неорганические вещества
- •2.4.2 Вещества, самовозгорающиеся под действием воды
- •2.4.3 Вещества, самовозгорающиеся под действием окислителей
- •2.5 Воспламеняемость аэрозолей
- •2.6 Определение температуры вспышки и воспламенения расчетным методом
- •2.6.1 Расчет температуры вспышки индивидуальных веществ в закрытом тигле
- •2.6.2. Расчет температуры вспышки смесей горючих жидкостей в закрытом тигле
- •2.6.3 Расчет температуры воспламенения
- •2.7 Контрольные вопросы
- •3 Способы и средства тушения пожаров
- •3.1 Контрольные вопросы
- •4 Взрыв
- •4.1 Физические взрывы и их характеристика
- •4.2 Взрывчатые вещества
- •4.3 Кислородный баланс
- •4.4 Чувствительность взрывчатых систем к внешним воздействиям
- •4.4.1 Чувствительность взрывчатых систем к тепловому воздействию
- •4.4.2 Чувствительность взрывчатых систем к механическим воздействиям
- •4.4.3 Чувствительность взрывчатых систем к электрическому импульсу и взрыву инициирующих взрывчатых веществ
- •4.5 Способы взрывания
- •4.5.1. Огневой способ взрывания
- •4.5.2 Электроогневой способ взрывания
- •4.5.3 Взрывание детонированным шнуром
- •4.5.4 Электрический способ взрывания
- •4.6 Средства взрывания
- •4.7 Расчёт скорости ударной волны
- •4.8 Контрольные вопросы
- •5 Детонация
- •5.1 Особенности распространения детонации в смесевых системах
- •5.2 Распространение детонации в конденсированных взрывчатых веществах
- •5.3 Передача детонации через различные среды
- •5.3.1 Бризантность взрывчатых веществ
- •5.4 Кумуляция
- •5.5 Контрольные вопросы
- •6 Моделирование пожаров и взрывов
- •6.1 Динамика опасных факторов пожара в протяженных помещениях
- •6.2 Моделирование пожаров на складах лесоматериалов
- •6.3 Моделирование взрывов
- •6.4 Контрольные вопросы
- •Фонд контрольных заданий
- •Список использованных источников
- •Основные термины и определения.
- •Хлорная известь (белильная известь) - сильный окислитель, применяется для дезинфекции, отбеливания тканей.
1.6 Тепловая теория горения
Первой хронологически (конец ХIХ века) была тепловая теория, основоположниками которой считаются Маляр, Ле Шателье и Нуссельт. В основу этой теории положена гипотеза Вант-Гофа о температурной зависимости скорости химической реакции. Условием теплового взрыва является преобладание теплоприхода за счет энергии реакции над отводом тепла в окружающую среду. В этом случае в системе накапливается тепло, что приводит к саморазогреву и соответственно к саморазгону реакции.
Возникновение в горючей системе реакции окисления связано чаще всего с нагреванием системы тем или иным источником воспламенения. При нагревании горючей системы энергия молекул горючего и кислорода увеличивается и, когда она достигает некоторой величины, происходит их активизация, т.е. образуются активные центры (радикалы и атомы), имеющие свободные валентности, в результате чего молекулы горючего вещества легко вступают в соединение с кислородом воздуха. А.Н. Бах и К. Энглер в 1898 г. независимо друг от друга предложили перекисную теорию окисления, согласно которой при нагревании горючей системы происходит активизация кислорода путём разрыва одной связи между атомами, причём активная молекула вступает в соединение с горючим веществом, не распадаясь на атомы и образуя перекисные соединения типа: R1-O-O-R2 или R-O-O-OH.
Однако, перекисная теория не в состоянии объяснить некоторые характерные особенности процесса окисления, например, резкое действие, иногда ничтожных следов посторонних примесей.
Скорость химической реакции
![]() ,
м/с может быть выражена, исходя из закона
Аррениуса, следующим уравнением:
,
м/с может быть выражена, исходя из закона
Аррениуса, следующим уравнением:
![]() ,
(1.12)
,
(1.12)
где
![]() - константа скорости реакции (скорость
химической реакции при концентрациях
реагентов, приведенных к единице);
- константа скорости реакции (скорость
химической реакции при концентрациях
реагентов, приведенных к единице);
![]() ,
,
![]() ,
,
![]() -
концентрации реагентов, моль/м3;
-
концентрации реагентов, моль/м3;
![]() ,
,
![]() ,
,
![]() - стехиометрические коэффициенты,
определяемые соотношением концентраций
исходных реагентов в стехиометрическом
уравнении реакции;
- стехиометрические коэффициенты,
определяемые соотношением концентраций
исходных реагентов в стехиометрическом
уравнении реакции;
![]() -
основание натуральных логарифмов;
-
основание натуральных логарифмов;
- энергия активации, Дж/моль;
![]() - универсальная газовая постоянная,
= 8,3 Дж/(моль∙К);
- универсальная газовая постоянная,
= 8,3 Дж/(моль∙К);
– температура, К.
Тепловая теория самовоспламенения (называемая также теорией теплового взрыва) основана на сопоставлении скоростей процессов тепловыделения при экзотермическом окислении и теплоотвода от реагирующей смеси в стенке содержащего его сосуда. Условие самовоспламенения определяется равенством этих скоростей. Температура стенок сосуда, при которой достигается это равенство, называется температурой самовоспламенения. Начиная с этой температуры (характерной в каждом случае для данных конкретных условий - размера и формы сосуда, теплофизических свойств газа) происходит саморазогрев, который может привести к вспышке (самовоспламенению).
С учётом изложенного для саморазогрева в реагирующей среде можно записать:
![]() ,
(1.13)
,
(1.13)
где
![]() -
теплоемкость при постоянном объёме,
Дж/К ;
-
теплоемкость при постоянном объёме,
Дж/К ;
![]() - плотность газа, кг/м3;
- плотность газа, кг/м3;
- температура газа, К;
![]() - время, с;
- время, с;
- тепловой эффект реакции, Вт;
- скорость реакции, м/с;
![]() - поверхность реакционного сосуда, м2;
- поверхность реакционного сосуда, м2;
![]() -
объем реакционного сосуда, м3;
-
объем реакционного сосуда, м3;
- коэффициент теплоотдачи, Вт/( м2К);
![]() - температура стенки сосуда, К.
- температура стенки сосуда, К.
Д.А.Франк-Каменецким был предложен критерий теплового самовоспламенения, основанный на нарушении стационарного распределения температур в реактивном сосуде при достаточной скорости тепловыделения:
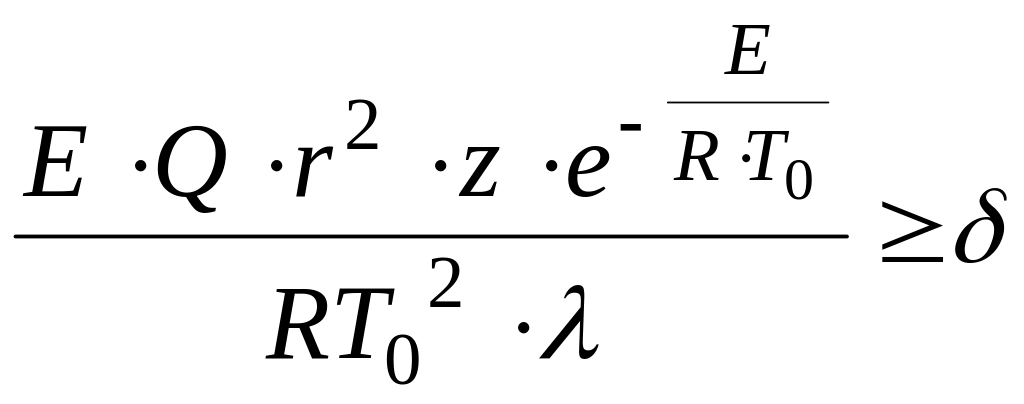 ,
(1.14)
,
(1.14)
где
![]() - характерный размер сосуда, м;
- характерный размер сосуда, м;
![]() - предэкспоненциальный множитель;
- предэкспоненциальный множитель;
![]() - коэффициент теплопроводности газовой
смеси, Вт/(мК);
- коэффициент теплопроводности газовой
смеси, Вт/(мК);
![]() - безразмерный критерий, равный 3,3; 0,88 и
2 соответственно для сферического,
плоскопараллельного и цилиндрического
сосудов.
- безразмерный критерий, равный 3,3; 0,88 и
2 соответственно для сферического,
плоскопараллельного и цилиндрического
сосудов.
Критерий Д.А.Франк-Каменецкого следует
понимать так: если при подстановке всех
параметров, определяющих
,
мы получим значение
![]() ,
то воспламенения не будет, при
,
то воспламенения не будет, при
![]() произойдет воспламенение. Из уравнения
критерия следует, что теплота реакции
и радиус сосуда
,
в котором происходит реакция, - важные
определяющие факторы взрыва. Тепловой
взрыв выражен тем ярче, чем лучше
выполняются неравенства:
произойдет воспламенение. Из уравнения
критерия следует, что теплота реакции
и радиус сосуда
,
в котором происходит реакция, - важные
определяющие факторы взрыва. Тепловой
взрыв выражен тем ярче, чем лучше
выполняются неравенства:
![]()
1
1
Если эти неравенства выполняются плохо, то тепловой взрыв вырождается – одновременно с ростом температуры происходит быстрое выгорание исходного вещества, которое смазывает картину взрыва.
Возникновение горения чаще всего связано с нагреванием горючей системы тем или иным источником воспламенения. Согласно теории академика Н.Н. Семёнова, процесс окисления сопровождается выделением тепла и при определенных условиях может самоускоряться. Этот процесс самоускорения реакции окисления с переходом её в горение называется самовоспламенением.
В случае теплового самовоспламенения оно возникает вследствие превышения скорости тепловыделения над скоростью теплоотвода.
Рассмотрим процесс теплового
самовоспламенения на примере горючего
газа или паров горючей жидкости с
воздухом, помещенных в сосуд объёмом
.
При повышении температуры сосуда и
горючей смеси скорость реакции и
выделение тепла увеличится. Зависимость
скорости выделения тепла от температуры
![]() ,
Дж/с определяются:
,
Дж/с определяются:
![]() ,
(1.15)
,
(1.15)
где - теплота сгорания газа, Дж;
- объём горючей смеси, м3;
- константа скорости реакции;
![]() -
концентрация реагирующего вещества,
кг/м 3;
-
концентрация реагирующего вещества,
кг/м 3;
![]() -
порядок реакции;
-
порядок реакции;
- энергия активации, Дж/моль;
- универсальная газовая постоянная Дж/(моль·К);
- температура смеси, К.
Выделяющееся тепло передаётся горючей смеси, и она нагревается. Как только температура смеси превысит температуру стенок сосуда, начнётся отвод тепла через стенки сосуда в единицу времени, пропорционально разности температур смеси и стенок сосуда и определяются зависимостью:
![]() ,
(1.16)
,
(1.16)
где
![]() - скорость отвода тепла через стенки
сосуда, Дж/с;
- скорость отвода тепла через стенки
сосуда, Дж/с;
- коэффициент теплопередачи, Дж/(К·м2 с);
- поверхность стенок сосуда, м2;
- температура смеси, К;
- температура стенок сосуда, К
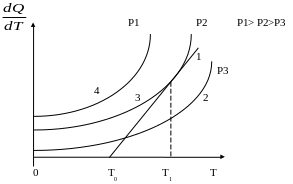
Рисунок 1.5 – Зависимость тепловыделения от температуры при разных давлениях
На
рисунке 1.5 кривые 2, 3 и 4 показывают
зависимость тепловыделения от температуры
при разных давлениях и одинаковом
составе смеси. При постоянных температурах
сосуда и среды и постоянном составе
смеси количество отводимого из зоны
горения тепла характеризуется прямой
1. При изменении состава смеси изменится
и скорость теплопотерь и, следовательно,
наклон прямой. Чем выше давление, тем
больше выделяется тепла при реакции
(кривая 4). В условиях, определяемых
кривой 2, самовоспламенение возникнуть
не может, так как теплопотери (прямая
1) выше тепловыделений при этом давлении.
Точка касания кривой 3 с прямой
соответствует равновесию между выделяемым
и отводимым теплом при
![]() - минимальной температуре самовоспламенения
данной горючей системы в заданных
условиях. При незначительном подводе
энергии извне возможно самовоспламенение.
Кривая 4 характеризует условия, при
которых неизбежно самовоспламенение,
так как выделяется тепло больше, чем
отводится.
- минимальной температуре самовоспламенения
данной горючей системы в заданных
условиях. При незначительном подводе
энергии извне возможно самовоспламенение.
Кривая 4 характеризует условия, при
которых неизбежно самовоспламенение,
так как выделяется тепло больше, чем
отводится.
Анализируя приведённую схему, Н.Н. Семёнов установил зависимость:
![]() ,
(1.17)
,
(1.17)
где
![]() -
минимальное давление воспламенения,
Па;
-
минимальное давление воспламенения,
Па;
![]() -
минимальная температура самовоспламенения,
К;
-
минимальная температура самовоспламенения,
К;
- порядок реакции;
![]() -
постоянная, зависящая от состава и
других свойств смеси.
-
постоянная, зависящая от состава и
других свойств смеси.
На основании этого уравнения (1.17) можно теоретически заранее определить, возможно ли самовоспламенение горючей смеси в данных конкретных условиях. Соотношение, связывающее минимальное давление с температурой самовоспламенения, было подтверждено многочисленными экспериментами и оказалось ценным при изучении процессов горения.
