
- •Содержание
- •Введение
- •1 Горение
- •1.1 Общие сведения о горении
- •1.2 Процесс горения
- •1.3 Расход воздуха при горении
- •1.4 Температура горения
- •1.5 Диффузионное пламя
- •1.6 Тепловая теория горения
- •1.7 Цепная теория горения
- •1.8 Горение газовых смесей
- •1.9 Горение жидкостей
- •1.10 Горение твердых веществ
- •1.10.1 Горение металлов
- •Твёрдого тела при экзотермическом гетерогенном процессе
- •1.10.2 Горение пластмасс
- •1.11 Контрольные вопросы
- •2 Пожароопасные свойства веществ и материалов
- •2.1 Горючие газы
- •2.2 Горючие жидкости
- •2.3 Твёрдые горючие вещества
- •2.4 Самовозгорание
- •2.4.1 Вещества, самовозгорающиеся под действием воздуха
- •2.4.1.1 Масла и жиры
- •2.4.1.2 Каменный уголь и торф
- •2.4.1.3 Растительные материалы
- •2.4.1.4 Неорганические вещества
- •2.4.2 Вещества, самовозгорающиеся под действием воды
- •2.4.3 Вещества, самовозгорающиеся под действием окислителей
- •2.5 Воспламеняемость аэрозолей
- •2.6 Определение температуры вспышки и воспламенения расчетным методом
- •2.6.1 Расчет температуры вспышки индивидуальных веществ в закрытом тигле
- •2.6.2. Расчет температуры вспышки смесей горючих жидкостей в закрытом тигле
- •2.6.3 Расчет температуры воспламенения
- •2.7 Контрольные вопросы
- •3 Способы и средства тушения пожаров
- •3.1 Контрольные вопросы
- •4 Взрыв
- •4.1 Физические взрывы и их характеристика
- •4.2 Взрывчатые вещества
- •4.3 Кислородный баланс
- •4.4 Чувствительность взрывчатых систем к внешним воздействиям
- •4.4.1 Чувствительность взрывчатых систем к тепловому воздействию
- •4.4.2 Чувствительность взрывчатых систем к механическим воздействиям
- •4.4.3 Чувствительность взрывчатых систем к электрическому импульсу и взрыву инициирующих взрывчатых веществ
- •4.5 Способы взрывания
- •4.5.1. Огневой способ взрывания
- •4.5.2 Электроогневой способ взрывания
- •4.5.3 Взрывание детонированным шнуром
- •4.5.4 Электрический способ взрывания
- •4.6 Средства взрывания
- •4.7 Расчёт скорости ударной волны
- •4.8 Контрольные вопросы
- •5 Детонация
- •5.1 Особенности распространения детонации в смесевых системах
- •5.2 Распространение детонации в конденсированных взрывчатых веществах
- •5.3 Передача детонации через различные среды
- •5.3.1 Бризантность взрывчатых веществ
- •5.4 Кумуляция
- •5.5 Контрольные вопросы
- •6 Моделирование пожаров и взрывов
- •6.1 Динамика опасных факторов пожара в протяженных помещениях
- •6.2 Моделирование пожаров на складах лесоматериалов
- •6.3 Моделирование взрывов
- •6.4 Контрольные вопросы
- •Фонд контрольных заданий
- •Список использованных источников
- •Основные термины и определения.
- •Хлорная известь (белильная известь) - сильный окислитель, применяется для дезинфекции, отбеливания тканей.
1 Горение
1.1 Общие сведения о горении
Для того чтобы началось горение надо, как известно, поднести к горючему предмету горящую спичку. Но и спичка не загорается сама, ее надо чиркнуть о коробку. Таким образом, для того, чтобы началась химическая реакция, необходимо предварительное нагревание. Поджигание создает в начальный момент необходимую для реакции температуру. Дальше высокую температуру поддерживает тепло, которое выделяется при реакции.
Начальный местный подогрев должен быть достаточен для того, чтобы выделение тепла при реакции превышало теплоотдачу в окружающую среду. Поэтому каждая реакция имеет свою, как говорят, температуру воспламенения. Горение начинается только тогда, когда начальная температура выше температуры воспламенения. Например, температура воспламенения дерева - 255 оС, бензина - около 200 оС, белого фосфора – 50 оС.
Горение дров, угля, нефти – это химическая реакция соединения этих веществ с кислородом воздуха. Поэтому такая реакция идет с поверхности: пока не выгорит внешний слой, следующий не может принять участие в горении. Этим и объясняется медленность горения. В справедливости сказанного нетрудно убедиться на практике. Если размельчать горючее, то скорость горения может значительно увеличить. Для этой цели производится распыление угля во многих печных устройствах. Так же размельчается и смешивается с воздухом топливо в цилиндре мотора.
Горение вызывало к себе внимание у передовых умов человечества с древних времён, однако, правильное представление о горении сложилось сравнительно недавно. По господствовавшим представлениям в химии XVII- XVIII веков теория флогистона (от греч. рhlogistos – воспламеняемый, горючий) объясняла, что существует «огненная материя», которая, якобы, содержится во всех горючих веществах, в том числе и в металлах, и выделяется из них при горении. В конце XVIII в. взамен её принята новая научная теория горения – кислородная. М. В. Ломоносов (1711-1765 г.г.) впервые доказал, что сущность процесса горения заключается в химическом соединении горючего вещества с воздухом. В 1773 г. французский ученый А.Л. Лавуазье экспериментальным путём установил, что при горении не весь воздух соединяется с горючим веществом, а только входящий в его состав кислород. Так во второй половине XVIII века было научно доказано, что горение - это реакция окисления. Далее было установлено, что окисление в природе широко распространено. Это ржавление, гниение и другие процессы, которые в отличие от горения происходят в обычных температурных условиях. Общую теорию таких процессов разработал в конце XIX в. А.Н. Бах. Но теория А.Н. Баха не смогла объяснить ряд явлений, связанных с окислением (действие катализаторов, антиокислителей и др.)
Горением называется сложный физико-химический процесс, основой которого является быстро протекающая реакция окисления, сопровождающаяся выделением тепла и излучением света.
Есть и другие трактовки термина «горение». Горением называется физико-химический процесс, для которого характерны три признака:
- химическое превращение;
- выделение тепла;
- излучение света.
Например, «горение» электрической лампочки нельзя назвать горением, хотя при этом выделяются тепло и свет. В этом явлении нет одного из признаков горения - химического процесса. Свечение нити лампочки – это накаливание ее при пропускании электрического тока.
Горение представляет собой сложный физико-химический процесс превращения горючих веществ и материалов в продукты горения, сопровождающийся выделением тепла и света.
Наука о горении - чрезвычайно многосторонняя область, весьма обширная и во многом ещё противоречивая. Поэтому некоторые специалисты считают, что термину «горение» трудно дать чёткую трактовку. В обычных условиях, т.е. при нахождении горючих веществ и материалов в воздухе, горение представляет собой реакцию их взаимодействия с кислородом воздуха. Для возникновения и продолжения процесса горения необходимо наличие горючего вещества, окислителя и источника воспламенения. При этом эти обязательные компоненты составляют горючую систему (рисунок 1.1), а источник воспламенения является импульсом, вызывающим в ней реакцию горения. Система является горючей только при определенном соотношении в ней горючего вещества и воздуха. Так, например, система, состоящая из паров бензина и воздуха, является горючей только при содержании в ней от 0,76 до 5,4 % бензина.
Источником воспламенения называется любое тело, имеющее температуру и запас тепла, достаточный для нагревания некоторого объёма горючей системы до возникновения в ней горения.
К источникам воспламенения относятся:
1) источники тепла (пламя, искра, нагретое тело);
тепловое проявление видов энергии:
а) химической (экзотермическая реакция);
б) механической (удар, сжатие, трение);
в) электрической (электрический разряд).
В качестве окислителя, помимо кислорода (воздуха), могут участвовать в процессе горения хлор (Cl), фтор (F), сера (S), бром (Br), а так же кислородосодержащие вещества: перманганат калия (KМnO4), селитры (KNO3, NaNO3, NH4NO3), бертоллетова соль (KClO3), азотная кислота (HNO3). Необходимо отметить, что магний (Mg) горит в углекислом газе (CO2).
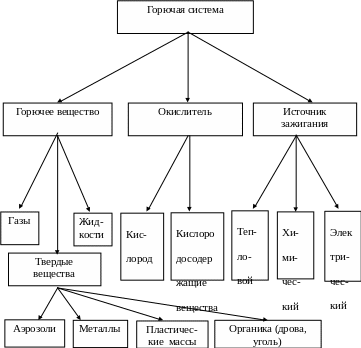
Рисунок 1.1 – Горючая система
Как видно из таблицы 1.1, для возгорания смеси пропан-воздух в реакции
C3H8 + 5O2 + 18,8 N2 = 3CO2 + 4H2O + 18,8N2
достаточен электрический заряд всего в 0,3 мДж. Он даёт хорошо различимую статическую искру, которую мы чувствуем, когда идём по синтетическому ковру, а затем дотрагиваемся до заземлённого предмета. А для некоторых реактивных газов, таких как водород, этилен и ацетилен для возгорания смеси с воздухом требуются еще меньшие количества энергии.
Горючее вещество и кислород являются реагирующими веществами в горючей системе, а источник воспламенения вызывает в ней реакцию горения. При установившемся горении источником воспламенения служит зона реакции.
Таблица 1.1 - Минимальные энергии зажигания парогазовоздушных смесей
Паровоздушная смесь |
Энергия зажигания, мДж |
Паровоздушная смесь |
Энергия зажигания, мДж |
Аммиак |
0,680 |
Метан |
0,29 |
Ацетилен |
0,011 |
Метиловый спирт |
0,14 |
Ацетон (при 25 °С) |
0,406 |
Пропан |
0,26 |
Бензин Б-70 |
0,15 |
Этан |
0,24 |
Бензол |
0,21 |
Этилен |
0,095 |
Бутан |
0,26 |
Этиловый спирт |
0,14 |
Водород |
0,013 |
|
|
Горючие системы могут быть химически однородными и неоднородными. К химически однородным относятся системы, в которых горючее вещество и воздух равномерно перемешаны друг с другом, например, смесь горючих газов, паров или пылей с воздухом.
К химически неоднородным относятся системы, в которых горючее вещество и воздух не перемешаны друг с другом и имеют поверхности раздела, например, твердые горючие материалы и жидкости, находящиеся на воздухе, струи горячих газов и паров, поступающие в воздух. При горении химически неоднородных горючих систем кислород воздуха непрерывно диффундирует сквозь продукты сгорания к горючему веществу и затем вступает с ним в реакцию.
Химическая реакция горения в большинстве случаев является сложной, т.е. состоит из большого числа элементарных химических процессов. Кроме того, химическое превращение при горении тесно связано с рядом физических процессов, например, переносом тепла и масс, и характеризуется соответствующими гидро- и газодинамическими закономерностями. В силу комплексной природы горения, суммарная скорость горения практически никогда не тождественна скорости чисто химического взаимодействия реагентов системы.
К особому виду горения относится тление, для которого характерны как накал конденсированной фазы, так и близко примыкающее к твердой поверхности галогенное пламя. Сущность этого вида горения изучена недостаточно. Наиболее часто с ним встречаются при горении целлюлозных материалов (древесина, хлопок). По видимому, к тлению склонны также материалы, которые имеют в составе своих молекул небольшое (по сравнению с массой остальных элементов) количество кислорода. Нередко под тлением понимают беспламенное горение. Это определение является недостаточно точным, поскольку известны не подверженные тлению, но способные беспламенно (в виде накала) гореть материалы (например, некоторые металлы). Очевидно, только высокопористые неплавящиеся горючие материалы, в порах которых имеется некоторое количество кислорода, достаточное для окисления некоторой части газообразных продуктов пиролиза, склонны к тлению. Режим горения в виде тления занимает, очевидно, промежуточное положение между режимами сугубо гетерогенного горения (в виде накала поверхности материала) и обычного диффузионного горения. Основным условием горения материалов в виде тления является недостаток поступающих к горящему материалу кислорода и тепла.
Кинетическим называется горение заранее приготовленной горючей смеси, скорость которого не зависит от диффузии кислорода в зону горения и определяется только скоростью передачи тепла теплопроводностью от зоны горения к негорящей ещё смеси. Поэтому скорость кинетического горения характеризуется нормальной скоростью распространения пламени, которая не превышает нескольких метров в секунду. Горение с такой скоростью в замкнутом объеме представляет собой взрыв, поэтому смеси паров, газов и пыли с воздухом называют взрывоопасными.
Основными термодинамическими характеристиками горючей смеси являются:
- теплотворная способность;
- теоретическая (адиабатическая) температура горения, т.е. та температура, которая могла бы быть достигнута при полном сгорании без потерь тепла.
По агрегатному состоянию горючего и окислителя различают:
1) гомогенное горение - горение газов и парообразных горючих в среде газообразного окислителя (кислород воздуха);
2) гетерогенное горение - горение жидких и твердых горючих в среде газообразного окислителя;
3) горение взрывчатых веществ и порохов.
Для любого вида горения характерны две стадии: воспламенение и последующее сгорание (догорание) вещества. Время, затрачиваемое на обе стадии, составляет общее время горения. Основной задачей техники сжигания является обеспечение минимального суммарного времени горения при максимальной полноте горения (полноте тепловыделения):
![]() ,
(1.1)
,
(1.1)
где
![]() - время полного сгорания какого-либо
вещества, с;
- время полного сгорания какого-либо
вещества, с;
![]() -
время, необходимое для возникновения
физического контакта между горючим
веществом и кислородом воздуха (при
газообразном состоянии горючих веществ
- время смесеобразования), с;
-
время, необходимое для возникновения
физического контакта между горючим
веществом и кислородом воздуха (при
газообразном состоянии горючих веществ
- время смесеобразования), с;
![]() - время, затрачиваемое на протекание
самой химической реакции, с.
- время, затрачиваемое на протекание
самой химической реакции, с.
Для неоднородной смеси (горючей системы)
![]() >>
>>![]() и, следовательно, практически
и, следовательно, практически
![]() .
Такое горение, которое определяется
главным образом скоростью сравнительно
медленно протекающего процесса диффузии,
называют диффузионным.
.
Такое горение, которое определяется
главным образом скоростью сравнительно
медленно протекающего процесса диффузии,
называют диффузионным.
При горении однородных горючих систем,
когда
![]() ,
можно считать
,
можно считать
![]() .
Такое горение называют кинетическим.
Скорость его определяется скоростью
химической реакции, значительной при
высокой температуре.
.
Такое горение называют кинетическим.
Скорость его определяется скоростью
химической реакции, значительной при
высокой температуре.
