
- •Содержание
- •Введение
- •1 Горение
- •1.1 Общие сведения о горении
- •1.2 Процесс горения
- •1.3 Расход воздуха при горении
- •1.4 Температура горения
- •1.5 Диффузионное пламя
- •1.6 Тепловая теория горения
- •1.7 Цепная теория горения
- •1.8 Горение газовых смесей
- •1.9 Горение жидкостей
- •1.10 Горение твердых веществ
- •1.10.1 Горение металлов
- •Твёрдого тела при экзотермическом гетерогенном процессе
- •1.10.2 Горение пластмасс
- •1.11 Контрольные вопросы
- •2 Пожароопасные свойства веществ и материалов
- •2.1 Горючие газы
- •2.2 Горючие жидкости
- •2.3 Твёрдые горючие вещества
- •2.4 Самовозгорание
- •2.4.1 Вещества, самовозгорающиеся под действием воздуха
- •2.4.1.1 Масла и жиры
- •2.4.1.2 Каменный уголь и торф
- •2.4.1.3 Растительные материалы
- •2.4.1.4 Неорганические вещества
- •2.4.2 Вещества, самовозгорающиеся под действием воды
- •2.4.3 Вещества, самовозгорающиеся под действием окислителей
- •2.5 Воспламеняемость аэрозолей
- •2.6 Определение температуры вспышки и воспламенения расчетным методом
- •2.6.1 Расчет температуры вспышки индивидуальных веществ в закрытом тигле
- •2.6.2. Расчет температуры вспышки смесей горючих жидкостей в закрытом тигле
- •2.6.3 Расчет температуры воспламенения
- •2.7 Контрольные вопросы
- •3 Способы и средства тушения пожаров
- •3.1 Контрольные вопросы
- •4 Взрыв
- •4.1 Физические взрывы и их характеристика
- •4.2 Взрывчатые вещества
- •4.3 Кислородный баланс
- •4.4 Чувствительность взрывчатых систем к внешним воздействиям
- •4.4.1 Чувствительность взрывчатых систем к тепловому воздействию
- •4.4.2 Чувствительность взрывчатых систем к механическим воздействиям
- •4.4.3 Чувствительность взрывчатых систем к электрическому импульсу и взрыву инициирующих взрывчатых веществ
- •4.5 Способы взрывания
- •4.5.1. Огневой способ взрывания
- •4.5.2 Электроогневой способ взрывания
- •4.5.3 Взрывание детонированным шнуром
- •4.5.4 Электрический способ взрывания
- •4.6 Средства взрывания
- •4.7 Расчёт скорости ударной волны
- •4.8 Контрольные вопросы
- •5 Детонация
- •5.1 Особенности распространения детонации в смесевых системах
- •5.2 Распространение детонации в конденсированных взрывчатых веществах
- •5.3 Передача детонации через различные среды
- •5.3.1 Бризантность взрывчатых веществ
- •5.4 Кумуляция
- •5.5 Контрольные вопросы
- •6 Моделирование пожаров и взрывов
- •6.1 Динамика опасных факторов пожара в протяженных помещениях
- •6.2 Моделирование пожаров на складах лесоматериалов
- •6.3 Моделирование взрывов
- •6.4 Контрольные вопросы
- •Фонд контрольных заданий
- •Список использованных источников
- •Основные термины и определения.
- •Хлорная известь (белильная известь) - сильный окислитель, применяется для дезинфекции, отбеливания тканей.
1.10.1 Горение металлов
Почти все металлы, металлоиды и их соединения при нагревании плавятся и образуют над поверхностью слой паров. Горение металлов во многом зависит от их температуры плавления и кипения, а также температуры плавления и кипения их окислов. По характеру горения металлы делятся на две группы: летучие и нелетучие. Летучие металлы и их свойства приведены в таблице 1.10.
Все эти металлы имеют низкую температуру плавления и при горении находятся в жидком состоянии. Температура их кипения (кроме калия) ниже температуры плавления окислов, поэтому на жидком металле могут находиться твердые окислы.
При контакте металлов с источником воспламенения, например, пламенем, они нагреваются и окисляются. Окислы всех металлов, приведенных в таблице 1.10, пористые и не способны изолировать поверхность металла от дальнейшего окисления, а, следовательно, и нагревания. Через некоторое время металл расплавляется и начинает испаряться. Пары его диффундируют сквозь пористый твердый окисел в воздух. Когда концентрация паров в воздухе достигнет нижнего предела воспламенения, возникает горение. Зона диффузионного горения устанавливается вблизи поверхности окисла и большая часть теплоты реакции передается металлу, в результате чего он нагревается до температуры кипения. Кипение металла вызывает разрыв корки окисла и более интенсивное горение.
Таблица 1.10 - Свойства летучих металлов и их окислов
Металлы |
Температура, °С |
Окислы металлов |
Температура плавления, °С |
|
плавления |
кипения |
|||
Li |
179 |
1370 |
Li2O |
1570 |
Na |
98 |
883 |
Na2O |
920 |
K |
64 |
760 |
K2O |
разлагается при 300-400 |
Mg |
651 |
1107 |
MgO |
2800 |
Ca |
851 |
1482 |
CaO |
2585 |
Так как температура горения летучих металлов превышает температуру кипения их окислов, последние находятся в зоне горения в газообразном состоянии. Из зоны горения пары окислов диффундируют как в твердую корку окислов, так и в воздух, где они, охлаждаясь, конденсируются и превращаются затем в мельчайшие твердые частицы окисла - дым. Образование белого плотного дыма является одним из признаков горения летучих металлов.
Нелетучие металлы имеют свои особенности горения (таблица 1.11).
Таблица 1.11 - Свойства нелетучих металлов и их окислов
Металлы |
Температура, °С |
Окислы металлов |
Температура, °С |
||
Плавления |
кипения |
плавления |
кипения |
||
Al |
659 |
2406 |
Al2O3 |
2145 |
3527 |
Be |
1283 |
2477 |
BeO |
2550 |
3850 |
Тi |
1677 |
3277 |
TiO2 |
1855 |
3827 |
Из данных таблицы 1.11 видно, что окислы часто имеют температуру плавления ниже температуры кипения металлов, поэтому они могут находиться на поверхности металла в жидком состоянии. В связи с этим окислы в значительной степени замедляют окисление металлов. Горение этих металлов происходит энергичнее в состоянии порошков, аэрозолей и стружки без образования дыма.
Титан способен образовывать твердый раствор окисла в металле, поэтому у него отсутствует отчетливая поверхность раздела между окислом и металлом. Кислород воздуха имеет возможность диффундировать через окисел, в результате чего горение может продолжаться, если титан покрыт слоем твердой окиси. Температура горения титана около 3000 °С, т. е. ниже, чем температура кипения его окисла. В связи с этим в зоне горения окись титана находится в жидком состоянии, поэтому при горении титана плотного белого дыма также не образуется.
Многие металлы и сплавы способны загораться. Отдельные металлы, которые обычно считаются негорючими, воспламеняются и горят в мелко раздробленном состоянии. Аэрогели и аэрозоли многих металлов пожаро- и взрывоопасны, известны разрушительные промышленные взрывы металлической пыли.
В связи с применением металлов в высокотемпературных и коррозионных средах, в реактивных двигателях, в качестве ракетного топлива потребовались более глубокие исследования горения металлов. Особый интерес представляют исследования металлов как горючего в связи с проблемой завоевания межпланетных пространств (Цандер Ф.А. «Проблема полета при помощи реактивных аппаратов», 1932 г.; Кондратюк Ю.В. «Завоевание межпланетных пространств», 1929 г.). Активное развитие эти исследования получили в последние 60 лет.
Горение металла - это экзотермический гетерогенный процесс, при котором одно из реагирующих веществ - металл (сплав) - находится в твёрдой фазе, а другое - окислитель - в окружающей среде. Продукты реакции могут находиться в твёрдом, жидком и газообразном состоянии.
Скорость гетерогенного химического процесса не может возрастать неограниченно, она определяется как истинной скоростью протекания химической реакции на поверхности металла, так и скоростью подвода реагирующих веществ к этой поверхности благодаря диффузии. При низких температурах, когда скорость реакции мала по сравнению со скоростью диффузии (кинетическая область), суммарная скорость процесса определяется истиной кинетикой на поверхности металла и экспоненциально возрастает с повышением температуры (согласно закону Аррениуса) до тех пор, пока скорость химической реакции не станет сравнимой со скоростью диффузии. После этого процесс переходит в диффузионную область, и скорость его определяется скоростью диффузии, весьма слабо возрастая с повышением температуры.
Кривая 1 (рисунок 1.9) показывает изменение скорости реакции или пропорционально ей скорости теплоприхода (т. е. количества тепла, выделяющегося на единице поверхности за единицу времени). Нижняя часть этой кривой соответствует кинетической области, в которой скорость реакции экспонециально возрастает с повышением температуры и не зависит от скорости газового потока.
Верхняя часть кривой соответствует диффузионной области, в которой скорость реакции слабо возрастает с повышением температуры, но значительно зависит от скорости газового потока. Пунктирные кривые соответствуют скоростям реакции при разных скоростях газового потока (чем больше скорость, тем выше положение кривой).
Кривые 2 (2', 2'', 2''') соответствуют разным скоростям теплоотвода с поверхности металла. Так как даже теплоотдача лучеиспусканием гораздо меньше зависит от температуры, чем скорость химической реакции, то в незначительных интервалах температур кривые 2', 2'', 2''' можно считать прямолинейными.
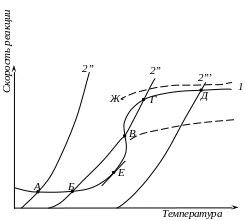
Рисунок 1.9 - Стационарные термические режимы поверхности
