
- •Этапы получения сверхпродуцентов методами ги
- •Ферменты, используемые в ги: днк-полимераза 1, концевая днк-трансфераза, поли-(а)-полимераза:
- •Пцр, принципы метода.
- •Методы сайт-направленного мутагенеза с использованием пцр.
- •Создание и скрининг генетических библиотек.
- •Конструирование векторов для клонирования на основе плазмид. Векторы, позволяющие проводить прямой отбор гибридных молекул днк.
- •Конструирование векторов для клонирования на основе фага .
- •Клонирование в космидах, фазмидах.
- •Регуляция экспрессии лактозного оперона.
- •Обращенно-фазовая и гидрофобная хроматография белков
- •Ионообменная хроматография белков.
- •Электрофорез белков: электрофорез с использованием додецилсульфата натрия
- •Место мхах в процессе наработки рекомбинантного белка.
- •Хелатирование
- •Несколько слов о мхах
- •Принципы мхах
- •Хелатирующие группы
-
Обращенно-фазовая и гидрофобная хроматография белков
ОФХ используется для разделения белков, но только в том случае, если:
-
в эксперименте у нас цель изучить первичную структуру, а вторичная и т.д. нам не важна
-
в том случае, когда белок легко ренатурирует
Причина: все из-за того, что элюенты ОФХ (водно-органические смеси) могут вызывать денатурацию исследуемых белков, следовательно, для крупных глобулярных белков этот метод используется редко.
По сути разделение происходит по растворимости в воде. Воде выгодно деструктурироваться, чтобы гидрофобный участок белка взаимодействовал с гидрофобным лигандом.

Гидрофобная хроматография уже может разделять крупные глобулярные белки.
Еще этот метод раньше назывался «высаливающей» хроматографией, так как тут обычно в элюенте используется раствор соли обычно с крупным двузарядным анионом и однозарядным катионом (чаще всего сульфат аммоний) в концентрации от 1М до 0 (в высокой концентрации все белки бы просто выпали в осадок). Соль усиливает гидрофобные взаимодействия с сорбентом.
Соответсвенно, порядок элюирования: сначала менее гидрофобные, потом более.
Лиганды тут тоже отличаются от ОФХ – они меньше и очент распространены ароматические виды.
-
Ионообменная хроматография белков.

На матрице иммобилизованы заряженные лиганды, на которые садятся противоположно заряженные белки.
Связывание происходит при низкой ионной силе:

То есть если у вас катионобменная хроматография, то начинается вы ее на 0,5-1,5 pH НИЖЕ, чем pI белка, потому что вам нужно его зарядить положительно.
А если у вас анионобменная хроматография, то начинается вы ее на 0,5-1,5 pH ВЫШЕ, чем pI белка, потому что вам нужно его зарядить отрицательно.
В зависимости от природы ионогенных групп анионобменники могут быть сильными или слабыми:

Соответвенно, они отличаются своими кривыми титрования, аналогично сильным и слабым кислотам:

Сильные ионобменники заряжены в ШИРОКОМ диапазоне pH, а слабые – в узком.
Поэтому для слабых возникает противоречие – если мы хотим положительно заряжить наш белок, то нужно понижать pH, одна это плохо повлияет на величину заряда катионобменника (минус уже более слабый). Поэтому чаще используются сильные ионобменники.
-
Гельпроникающая хроматография белков.
Гель-проникающая хроматография (гель-фильтрация, эксклюзионная хроматография) – распределительная хроматография, основанная на разделении молекул за счет различия их размеров. Этот метод позволяет разделить белки как по форме, так и по величине(массе).
Принцип, лежащий в основе метода проникающей хроматографии, весьма прост. Хроматографическую колонку заполняют набухшим гелем или пористыми стеклянными шариками и уравновешивают с помощью соответствующего растворителя. Крупные молекулы, не проникающие в поры сита, проходят между частицами геля, в то время как небольшие молекулы «застревают» в них и движутся с меньшей скоростью. Чем меньше размер (молек. масса) вещества, тем больше элюэнта требуется для вымывания этого соединения с колонки.

Синим цветом нарисованы малые молекулы, красным – большие.
Неподвижной фазой являются материалы, обычно гели, со строго контролируемой пористостью. Наиболее часто в качестве гелей применяют органические полимеры с трехмерной сетчатой структурой. Среди наиболее популярных гелей можно выделить декстрины с поперечными сшивками (торговое название сефадекс), полиакриламидный гель, агарозные гели, пористый кварц, полистиролы. Декстрановые гели используются для фракционирования сферических молекул с мол. весом примерно 800 000 и произвольно свернутые белки, в то время как агарозные гели применяются для разделения молекул и частиц с молекулярным весом порядка нескольких миллионов дальтон.
Стеклянные шарики обладают рядом преимуществ над обычными гелями:
-
Химически инертны
-
Шарики не слипаются между собой
-
Шарики легко промывать и стерилизовать
-
Более одинаковые поры, что повышает эффективность разделения
Все материалы для гель-проникающей хроматографии обладают разными пределами фракционирования:

Mr – молекулярная масса соединения в г/моль, в первом столбце - разные модели гелей.
Состав элюента сильного значения не имеет, однако следует при подборе элюента принять во внимание устойчивость разделяемых белков и твердой фазы в этом элюенте. Чаще всего в качестве элюента используют водный раствор нейтральной соли (NaCl).
С помощью метода гель-проникающей хроматографии можно определить молекулярную массу исследуемого белка, построив калибровочный график.

По оси у откладывается молекулярная масса; Ve – объем элюента, необходимый для выноса белка из колонки; Vo – объем элюента, размещающегося в незанятом гранулами сефадекса пространстве колонки.
Для определения молекулярной массы неизвестного белка нужно провести гель-пропускающую хроматографии для смеси этого белка с другими белками, молекулярная масса которых известна. После построения прямой неизвестная молекулярная масса рассчитывается методом линейной интерполяции.
Однако если белки имеют категорически разную структуру, то разделение произойдет не по молекулярной массе, а по форме белков и этот метод определения молекулярной массы белка уже не будет достоверным. Поэтому необходимо предварительно проденатурировать белки в гуанидин хлориде, для того чтобы привести их к статистически одинаковой структуре, а затем уже провести гель-фильтрацию.
При использовании данного метода необходимо учитывать ограничения, возникающие из-за того, что гель, образующий материал не вполне инертен, как это предполагает теория метода, и может взаимодействовать с разделяемыми веществами, что искажает зависимость объема элюции от размера молекулы. Это особенно сказывается при разделении малых количеств белка, так как сорбционная емкость матрицы геля невелика и в крупномасштабных опытах ее взаимодействие с белком мало отражается на процессе.
Разрешающая способность метода не очень велика, в то же время простота проведения и мягкость условий эксперимента являются его бесспорными преимуществами. Применимость метода на первых этапах очистки ограничивается тем, что для удовлетворительного фракционирования белков объем наносимого раствора не должен превышать 3-5% общего объема колонки. Ввиду этого к гель-хроматографии обычно прибегают в середине или на завершающих этапах выделения белка. Разумеется, при отделении низкомолекулярных примесей, в частности при обессоливании, объем образца может быть значительно большим, поскольку не требуется высокого разрешения. В таком упрощенном варианте гель-фильтрацию используют особенно часто.
Несмотря на указанные ограничения, гель-хроматография — удобный способ фракционирования белков. Также метод гель-проникающей хроматографии может быть использован для обессоливания (удаления неорганических солей от белков) растворов ВМС и замены буфера.
-
Аффинная хроматография белков.
Аффинная (биоспецифическая) хроматография
-
Лиганд иммобилизуется (связывается) на матрице (твердом носителе), биоспецифически связывает целевое вещество в разделяемой смеси.
-
Чаще лиганд иммобилизуют на матрице через спейсер (химическая молекула, позволяющая пространственно удалить лиганд от поверхности матрицы), тк часто аффинную хроматографию используют для разделения высокомолекулярных соединений (например, белков) и таким образом удается избежать стерических затруднений (что происходит, если лиганд связан непосредственно с матрицей).
-
Основные понятия:
-
Матрица - твердый носитель, используется для присоединения лиганда, должна быть физически и химически инертной.
-
Спейсер - используется для улучшения связывания между лигандом и целевой молекулой путем устранения стерических препятствий
-
Лиганд - молекула, которая обратимо связывается со специфической целевой молекулой или группой целевых молекул. Разделяются на 2 группы:
-
лиганды с индивидуальной специфичностью
-
лиганды с групповой специфичностью
-
Взаимодействия аффинной хроматографии (лиганд-партнер):
-
Антитело-антиген (белок, вирус, клетка)
-
Фермент – субстрат, кофактор, ингибитор
-
Нуклеиновая кислота (НК) – комплементарная НК
-
Белок (рецептор, связывающий белок) – лиганд
-
Металл – хелаторная группа в белке

-
Лиганды с индивидуальной специфичностью (ЛИС):
-
взаимодействуют с единственным партнером
-
как правило, труднодоступны (относительно сложно подобрать к каждому парнеру свой лиганд, дорого)
-
высокоспецифичны
-
Пример: антитела (существуют антитела практически к любому белку). Наиболее широко используются среди ЛИС. Коммерчески доступны антитела к белкам человека, модельных животных (мышь, крыса).
-
Существуют пары (например, для работы с рекомбинантным белкам):
-
авидин (белок; используется как метка, в виде слитого (гибридного) белка с другими белками) - биотин (низкомолекулярныое соединение, витамин; легко связать с разными хим в-вами (им модифицируют ДНК, хроматографический материал). Таким образом, получают рекомбинантный белок (слитой с авидином, т.е. "пришитый к авидину") и очистить на биотинвой колонке. ИЛИ можно получить авидиновую колонку и очистить на ней модифицированный биотин (биотин+н.к., биотин+белок)
-
глутатион (пептид, отвечает за поддержание окислительно-восстановительного потенициала клеток) - глутатион - S-трансфераза ( фермент, переводит глутатион из окисленной формы в восстановленную). Если глутатион иммобилизовать на матрице, то глуталион-S-трансфераза будет эффективно с ним связываться => эту пару используют для разделения рекомбинантных белков (получают рекомбинантную глутатион-S-трансферазу, связанную с интересующим нас белком)

-
Лиганды с групповой спцифичностью (ЛГС):
-
Способны связываться с разными объектами.
-
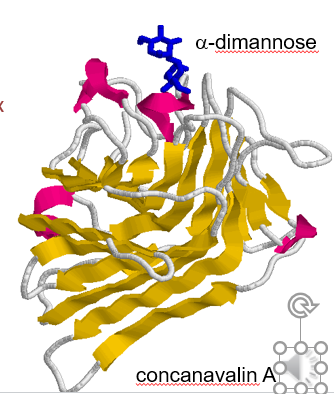
Лектины. Лектинами называют белки или гликопротеиды растительного или животного происхождения, проявляющие более или менее избирательное сродство к остаткам индивидуальных сахаров или групп сходных сахаров. Используются для очистки богатых сахарами гликопротеинов (например, иммуноглобулинов). Разнообразие остатков сахаров встречающихся в природе не велико, но они в различных комбинациях входят в состав различных биологически активных веществ: полисахаридов, гликопротеидов, гликолипидов и др. В аффинной хроматографии чаще других используется конканавалин А (Con A), который связывает молекулы содержащие альфа-D-маннопиранозил, альфа-D-глюкопиранозил и стерически сходные с ними остатки. Используют, например, для очистки иммуноглобулинов богатых сахарами (IgM). Доступны сорбенты и с другими лектинами в качестве лигандов.
-
Кофермент А (еще используют другие коферменты). Кофермент А участвует во множестве ферментативных реакций и имеет широкое применение в качестве лиганда с групповой специфичностью. Его закрепляют на матрице через аминогруппу остатка аденина, оставляя свободным концевой тиоловый радикал.

-
Нуклеозид фосфаты. Они являются кофакторами/субстратами определенных ферментов. Их также иммобилизуют на матрице в качестве лигандов. В качестве аффинных лигандов с групповой специфичностью часто используют нуклеозидфосфаты: моно-, ди-, трифосфаты аденозина, гуанозина и уридина, а также аденозин-3',5'-циклофосфат.

Выпускают также сорбенты с самими НАД и НАДФ в качестве лигандов. (Закрепление на матрице через аминогруппу остатков аденина.) Такой набор лигандов определяется тем, что соответствующие сорбенты обладают групповой специфичностью ко многим ферментам, использующим в качестве коферментов НАД+ и НАДФ+.

-
Триазиновые красители. Получают крупнотоннажно (используют для корашивания шерсти, т.е. связываются с белками). Эти красители образуют группу лигандов используемых для очистки различных белков. Торговое название ‒ проционовые красители. Наибольшее распространение получил краситель Cibacron Blue (Procion Blue). Также используют Procion Red HE-38.


-
Лиганды для протеаз. Лигандами для связывания протеаз могут служить главным образом аналоги субстратов и ингибиторы протеаз. Коммерчески доступны сорбенты для протеаз несущие в качестве лигандов аминокислоты и пептиды (аргинин, триптофан, Аla-Ala-Ala), аналоги субстратов (Gly-Tyr-азобензилянтарная кислота), синтетические и природные ингибиторы трипсина (п-аминобензамидин) и химотрипсина, ингибитор кислых протеиназ пепстатин, природные антибиотики бацитрацин и грамицидин. К ним относят аргинин и бензамидин, связанные с сефарозой.

-
Олиго(dT) и полиуридиновая кислота. Иммобилизуют на матрице, используют для очистки тотальной матричной РНК эукариот. Большинство молекул эукариотических мРНК содержит на своем 3'-конце более или менее протяженную полиадениновую последовательность (средняя длина – около 100 адениловых остатков). Это обстоятельство дало возможность создать аффинный сорбент с групповой специфичностью к любой молекуле мРНК, содержащей такую последовательность. На матрице закрепляют комплементарный гомополимер олиго(U) или олиго(dT) (используется чаще, тк олигонуклеотиды ДНК более стабильны, чем олигонуклеотиды РНК) длиной около 100 остатков. Наиболее распространённый сегодня коммерческий сорбент Oligo(dT)-Cellulose (GE Helthcare, NEB, Sigma, Thermo Scientific). Фирма Pharmacia (до этого Amersham) выпускала Poly(U)-Sepharose.

-
Металлохелат аффинная хроматография. Относится к лигандам с групповой специфичностью. Метод широко используется дл очистки рекомбинантных белков. Суть метода: на матрице иммобилизуют ион металла через стационарный хелатирующий лиганд, с металлом взаимодействует за счет донорной координирующей группы белок - координационное (хелатирующее) взаимодействие.

-
Стационарные лиганды: Нитрилотриуксусная кислота (НТК, NTA), иминодиуксусная кислота (ИДК, IDA)

-
Металлы: Cu2+, Ni2+, Fe3+, Co2+, Zn2+
-
Основной вклад в связывание белка вносят остатки His (гистидина). В белках для связывания с сорбентом необходимо наличие минимум двух сближенных остатков His, что крайне редко у природных белков. Стандартным подходом является введение в рекомбинантные белки гистидиновых (чаще всего His6) последовательностей (якорей, тагов) на C или N- конец белка для упрощения процедуры очистки. Вклад в связывание вносят также остатки Cys (цистеина) и Cys-Cys, а также амино- и карбоксильные группы.
-
Методы элюции
-
Взаимодействия между лигандом и веществом: ионные, водородные, гидрофобные или их набор.
-
Методы элюции как и в других видах хроматографии: изменение ионной силы р-ра, pH р-ра, состава элюента (добавление органических р-рителей в воду=> влияние на гидрофобные белки) --> мягкое снятие лиганда. Исключение: сильные взаимодействия (например, авидин-биотин) => применяется денатурация белка - временная или необратимая (экстримальные значения pH, высокие концентрации хаотропного агента)
-
Специфическая элюция: добавляют агент, который сильнее связывается с лигандом или с интересующим белком

-
Таким образом, разделение в аффинной хроматографии зависит от заряда белка, гидрофобности/гидрофильности белка

-
Электрофорез белков. Изоэлектрофокусирование
Принцип метода:
В растворе белки находятся в виде заряженных частиц. Заряд на поверхности белков возникает в результате диссоциации группировок, находящихся в боковых радикалах аминокислот (карбоксильных, амино-, имидазольных и др. групп), а также при связывании ионов. Так как степень диссоциации группировок зависит от рН раствора, то величина и знак суммарного заряда белковой молекулы зависят от рН среды, а также от ионной силы (интенсивности электрического поля, создаваемого ионами в растворе). Для расчета ионной силы следует найти произведение концентрации каждого иона на квадрат его заряда, сложить все полученные величины и итоговую сумму разделить пополам.
Если в растворе присутствуют два или более электролитов, то вычисляется общая суммарная ионная сила раствора. Для каждого белка существует такое значение рН среды (обозначаемое как рI – изоэлектрическая точка), при котором положительные и отрицательные заряды ионизированных групп скомпенсированы, поэтому заряд всей белковой молекулы равен нулю.
В буфере с рН, равным рI изучаемого белка, отсутствие заряда на белковой молекуле делает невозможным ее движение в электрическом поле. Из-за разницы в аминокислотном составе разные белки имеют разные значения рI.
При рН ≠ pI молекулы белка приобретают заряд и под действием электрического поля перемещаются к противоположно заряженному электроду - катоду (-) или аноду (+).
Например, кислые белки, богатые моноаминодикарбоновыми аминокислотами (асп, глу), в слабощелочном буфере приобретут отрицательный суммарный заряд из-за диссоциации СООН групп до СОО- и H+ и будут двигаться к аноду.
Для электрофоретического разделения оптимально такое значение рН рабочего буфера, которое обусловливает максимальное различие зарядов разных белков, составляющих исходную смесь, а не их максимальный заряд.
Обычно электрофорез проводят в среде (буфере) со значением рН, на 3 — 4 единицы отличающимся от среднего значения рI для белков данного типа. Это позволяет добиться хорошей электрофоретической подвижности (см. ниже) и вместе с тем - сохранить ощутимые различия молекул по заряду.
Предпочтительно использовать буфер известной и постоянной ионной силы на основе однозарядных ионов. От рабочего буфера также требуется существенная емкость, так как локальная концентрация белка в образующихся при разделении смеси зонах скопления молекул может оказаться значительной. Поэтому используют буферы с концентрацией не менее 0,1 — 0,2 М.
При проведении электрофореза электрическое поле создают с помощью источника питания – стабилизированного выпрямителя, способного давать регулируемое напряжение до 500 – 1000 В при силе тока в несколько десятков миллиампер (мА). Предпочтительнее использовать выпрямитель со стабилизацией по току.
Грамотное применение электрофоретического метода предполагает оперирование физическими величинами, перечисленными ниже. φ – потенциал, В (вольт). Потенциал в данной точке электрического поля численно равен работе, совершаемой электрическими силами при перемещении единичного положительного заряда из этой точки в бесконечность. U – напряжение, В (вольт). Напряжение на участке электрической цепи равно разности потенциалов на концах этого участка, если на этом участке нет источника сторонних сил, разделяющих разноименные заряды (отсутствуют гальванические элементы, фотоэлементы, генераторы магнитного поля и т.д.). При электрофорезе участок электрической цепи – это буфер.
В буфере отсутствуют источники сторонних сил, поэтому U = φ1- φ2 = Δ φ. Уравнение 1
По закону Ома: U = I*R, Уравнение 2
где I – сила тока, R – сопротивление проводника (буферного раствора). Е – напряженность электрического поля, В/см.
E =Δφ / L = U/ L, Уравнение 3
где L – длина проводника в см.
Электрофорез проводят в однородном электрическом поле, то есть поле, напряженность E которого во всех точках одинакова. Электрический ток пропускают через проводник - буферный раствор, налитый в канал из изолирующего материала (например, стекла) или пропитывающий какую-либо поддерживающую среду - носитель (например, бумагу или гель). Сопротивление R буферного раствора задается двумя факторами: концентрацией в нем свободных ионов и их электрофоретической подвижностью.

Именно различия в электрофоретической подвижности белков, содержащихся в анализируемой смеси, делают возможным разделить эти белки в пространстве (в разных зонах электрофореграммы).
Скорость V движения белков к тому или иному электроду снижается из-за их трения об окружающую среду. Сила трения (или, иначе, сопротивления окружающей среды) прямо пропорциональна скорости движения белковых молекул:
Fтрения = f ´V
Уравнение 5
Коэффициент трения белковой молекулы, обозначенный как f, зависит как от размера, формы и степени гидратированности этой молекулы, так и от свойств самой среды.
Электрофоретическая подвижность связана с коэффициентом трения в соответствии с уравнением 6.
u =q/f
Уравнение 6
где q – общий заряд молекулы белка, f – коэффициент трения.
При электрофорезе работа силы трения заряженных компонентов разделяемой смеси о среду приводит к нагреву геля. Кроме того, образование тепла вызывается прохождением электрического тока. В итоге происходит значительное возрастание температуры, которое ухудшает результаты электрофоретического разделения, так как изменяет вязкость и проводимость среды, увеличивает скорость диффузии молекул, способствует испарению летучих компонентов, приводит к денатурации белков.
Поэтому при проведении электрофореза следует обеспечить охлаждение системы (например, помещая прибор для электрофореза в холодильную камеру).
Электрофоретическая подвижность белка зависит: - от самой молекулы: ее размера (молекулярной массы), формы, электрического заряда, степени диссоциации и гидратации, - от концентрации молекул, - от среды: ее вязкости, рН, температуры и ионной силы, - от характеристик используемого электрического поля.
Изоэлектрическое фокусирование
Метод изоэлектрического фокусирования заключается в создании системы с градиентом рН. Белки, движущиеся в электрическом поле, достигают в этой системе такой области, в которой значение рН равно их изоэлектрической точке. При этом значении суммарный заряд белка равен нулю и он не способен перемещаться в электрическом поле. Изоэлектрическое фокусирование обладает наивысшей разрешающей способностью при разделении смеси белков, хотя этот метод не позволяет разделить белки по величине их молекул. При изоэлектрическом фокусировании диффузия ограничена. Как только белковая молекула диффундирует и попадает в зону, отличающуюся по значению рН от ее изоэлектрической точки, она получает заряд и мигрирует в обратном направлении.

