
- •Предисловие
- •Общие методические указания
- •Основные единицы международной системы (си) физических единиц
- •Учебные материалы по разделам курса физики
- •Физические основы классической механики
- •Примеры решения задач
- •Решение
- •Решение
- •Контрольная работа 1 теоретические вопросы
- •II. Молекулярная физика и термодинамика Основы молекулярно-кинетической теории идеальных газов и термодинамики
- •Механика жидкостей и газов
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Контрольная работа 2 теоретические вопросы
- •III. Электричество и магнетизм Электростатика и постоянный электрический ток
- •Электромагнетизм
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Р ешение
- •Решение
- •Решение
- •Решение
- •Решение
- •Контрольная работа 3 теоретические вопросы
- •IV. Оптика
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Контрольная работа 4 теоретические вопросы
- •V. Физика твердого тела Элементы кристаллографии
- •Свойства твердых тел
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Контрольная работа №5 теоретические вопросы
- •VI. Элементы атомной и ядерной физики Постулаты Бора
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Контрольная работа №6 теоретические вопросы
- •Основные физические постоянные
- •Некоторые астрономические величины
- •Плотности некоторых твердых тел
- •Плотности некоторых жидкостей
- •Плотности некоторых газов
- •Тепловые свойства веществ Твердые тела
- •Упругие свойства некоторых твердых тел
- •Список рекомендуемой литературы
- •Список использованной литературы при составлении задач
- •Варианты контрольных работ
Механика жидкостей и газов
Первый закон Фика – масса вещества, перенесенная за время ∆t при диффузии
![]() ,
,
где![]() –
градиент плотности в направлении,
перпендикулярном к площадке
,
–
градиент плотности в направлении,
перпендикулярном к площадке
,
![]() –
коэффициент
диффузии (
–
средняя
арифметическая скорость,
–
коэффициент
диффузии (
–
средняя
арифметическая скорость,
![]() –
средняя
длина свободного пробега молекул).
–
средняя
длина свободного пробега молекул).
Импульс,
перенесенный газом за время
![]() ,
определяет силу
внутреннего трения
Fтр
в газе:
,
определяет силу
внутреннего трения
Fтр
в газе:
![]() ,
,
где
![]() –
градиент
скорости течения газа в направлении,
перпендикулярном к площадке
,
–
градиент
скорости течения газа в направлении,
перпендикулярном к площадке
,
![]() –
динамическая вязкость.
–
динамическая вязкость.
![]() .
.
Формула Стокса (сила сопротивления движению шарика радиусом r со скоростью )
![]() .
.
Уравнение Бернулли:
![]() ,
,
где
![]() – динамическое давление,
– динамическое давление,
![]() – статическое давление. [p] = Па
(паскаль) = Н/м2.
– статическое давление. [p] = Па
(паскаль) = Н/м2.
Количество теплоты, перенесенное за время вследствие теплопроводности, определяется формулой
![]() ,
,
где
![]() –
градиент
температуры в направлении, перпендикулярном
к площадке
,
–
градиент
температуры в направлении, перпендикулярном
к площадке
,
![]() –
коэффициент теплопроводности.
–
коэффициент теплопроводности.
Первое начало термодинамики
![]() ,
,
где
![]() – количество теплоты, полученное
телом,
– количество теплоты, полученное
телом,
![]() –
изменение внутренней энергии
–
изменение внутренней энергии
![]() ,
,
![]() –
работа,
совершаемая телом при изменении его
объема. Полная
работа объема газа
–
работа,
совершаемая телом при изменении его
объема. Полная
работа объема газа
 .
.
Уравнение
теплового баланса (без
учета теплопотерь сумма теплот
![]() ,
отданное холодным телам, равно сумме
теплот
,
отданное холодным телам, равно сумме
теплот
![]() ,
принятой этими телами)
,
принятой этими телами)
![]() .
.
Работа, совершаемая при изотермическом изменении объема газа
 .
.
Давление газа и его объем связаны при адиабатическом процессе уравнением Пуассона
![]() ,
,
 ,
,
где
показатель адиабаты
 .
Уравнение
Пуассона может быть записано еще в таком
виде:
.
Уравнение
Пуассона может быть записано еще в таком
виде: ![]() ,
, 
или ![]() ,
т.е.
,
т.е.  .
.
Работа, совершаемая при адиабатическом изменении объема газа
 ,
,
где р1 и V1 – давление и объем газа при температуре Т1.
Коэффициент полезного действия (КПД) тепловой машины
 ,
,
где
![]() –
количество теплоты, полученное рабочим
телом от нагревателя,
–
количество теплоты, полученное рабочим
телом от нагревателя,
![]() –
количество
теплоты, отданное холодильнику. Для
идеального цикла Карно
–
количество
теплоты, отданное холодильнику. Для
идеального цикла Карно
 ,
,
где
![]() и
Т2
–
термодинамические
температуры нагревателя и холодильника.
и
Т2
–
термодинамические
температуры нагревателя и холодильника.
Энтропия – термодинамическая функция, выражающая состояние системы и степень беспорядка в ней
![]() ,
,
где k – постоянная Больцмана, W – вероятность состояния системы.
Разность
энтропии
![]() двух
состояний 2
и
1
определяется
формулой
двух
состояний 2
и
1
определяется
формулой
 .
.
Изменение энтропии (∆S) при нагревании тела от температуры Т1 до Т2:
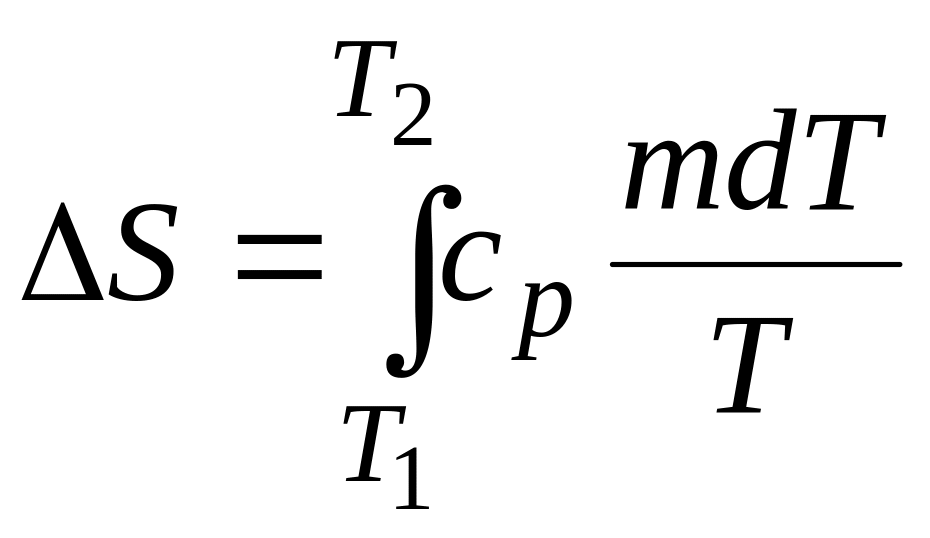 .
.
Второе начало термодинамики – энтропия изолированной системы не может убывать
![]() .
.
С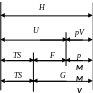 вязь
между основными термодинамическими
функциями и параметрами
вязь
между основными термодинамическими
функциями и параметрами
Н = U + рV,
U = F + ТS,
G = F + рV,
где Н – энтальпия; U – внутренняя энергия; G – свободная энергия Гиббса; F – свободная энергия
Гельмгольца, ТS и рV – связанные энергии, вносящие вклад в различные превращения в системе (фазовые превращения, химические реакции, адиабатные явления и др.).
Фазовыми переходами I рода называются такие превращения, при которых скачком меняется первая производная от термодинамической функции.
 ;
;  ;
;
 ;
;  .
.
Под фазовыми переходами I рода понимают фазовые превращения, сопровождающиеся поглощением или выделением скрытой теплоты и скачкообразным изменением удельного объема V 0 и энтропии S 0.
К фазовым переходам I рода относятся кристаллизация, плавление, парообразование, конденсация, полиморфные переходы и пр.
Основным уравнением, характеризующим фазовые переходы I рода, является уравнение Клапейрона-Клаузиуса
 ,
,
где
![]() и
и
![]() –
объемы одной и второй фаз.
–
объемы одной и второй фаз.
Зависимость температуры фазовых превращений от давления:
![]() .
.
Плавление – это превращение кристаллического тела в жидкое состояние при температуре плавления ТL.
Теплота плавления
Q = Lm,
где L – удельная теплота плавления, m – масса тела.
Кристаллизация – это процесс перехода вещества из жидкого состояния в твердое кристаллическое при охлаждении.
Полиморфизм – свойство одного и того же вещества пребывать при определенных условиях в разных кристаллографических модификациях.
Полиморфные превращения – это переход одной фазы твердого вещества в другую фазу того же вещества.
Теплота кипения (парообразования)
![]() ,
,
где r – удельная теплота парообразования.
Теплота сгорания топлива
![]() ,
,
где q – удельная теплота сгорания топлива.
Изменение энтропии при фазовом превращении
 или
или
 ,
,
где
Q,
![]() – теплота и энтальпия фазового
превращения,
– теплота и энтальпия фазового
превращения,
![]() – температура фазового превращения.
– температура фазового превращения.
Изменение энергии Гиббса системы при нагревании тела, при постоянном давлении
![]() ,
,
где
![]() ,
– начальная температура тела,
– изменение энтальпии.
,
– начальная температура тела,
– изменение энтальпии.
Изменение энергии Гиббса при кристаллизации переохлажденной жидкости, при постоянном давлении
![]() ,
,
где
![]() (
(![]() )
– переохлаждение,
– температура плавления,
– энтальпия плавления.
)
– переохлаждение,
– температура плавления,
– энтальпия плавления.
Минимальный размер кристаллика lk и работа его образования Ak из переохлажденной жидкости при кристаллизации. Для кристаллика кубической формы
![]() ,
, ![]() ,
,
где
![]() –
переохлаждение,
– температура плавления,
–
переохлаждение,
– температура плавления,
![]() – удельная теплота плавления,
– плотность,
– удельная теплота плавления,
– плотность,
![]() – межфазное поверхностное натяжение.
– межфазное поверхностное натяжение.
Скорость массовой кристаллизации жидкой фазы
![]() .
.
Линейная скорость затвердевания жидкой фазы
![]() ,
,
где
![]() – коэффициент теплопроводности,
– площадь растущей поверхности,
– коэффициент теплопроводности,
– площадь растущей поверхности,
![]() – градиент температуры.
– градиент температуры.
Фазой называется часть системы, которая имеет границу раздела и может быть отделена от общей системы механическим путем. Число фаз обозначают буквой Ф. Фазами могут считаться газообразное, жидкое, твердое состояния и др. Так, в системе лёд-вода при 0С имеются две фазы (Ф = 2).
Компонент
– независимая часть системы, имеющая
свою химическую
формулу, т.е. компонент – это индивидуальное
вещество. Числе компонентов
обозначается буквой К
в системе, например, лед-вода К = 1,
компонентом
является химическое соединение
![]() ,
а число фаз Ф
=
2.
,
а число фаз Ф
=
2.
Термодинамическая степень свободы системы определяется числом независимых переменных (давление – р, температура – Т, концентрация – С и т.д.), которые можно изменять в определенных пределах, не нарушая равновесия. Чисто степеней свободы обозначается буквой i.
Закономерности всех изменений системы в зависимости от внутренних и внешних условий подчиняются правилу фаз Гиббса
![]() ,
,
где В – число внешних воздействий (температура, давление и т.д.).
Обычно для простых веществ, сплавов и растворов принимают два внешних фактора: температуру и давление. В этом случае В = 2, а правило фаз Гиббса пишут в виде
![]() .
.
Если же за внешний фактор принять один из этих параметров (либо температуру, либо давление), тогда В = 1:
![]() .
.
Например, в системе лед-вода при атмосферном давлении и при температуре 0°С:
![]() ,
,
т.е. система такая существует, но она не имеет степеней свободы.
Если
![]() система называется нонвариантной, если
система называется нонвариантной, если
![]() –
моновариантной,
если
–
моновариантной,
если
![]() – бивариантной.
При
– бивариантной.
При
![]() система существовать не может.
система существовать не может.
С
учетом химических реакций между
компонентами системы число независимых
компонентов
![]() уменьшается в зависимости от числа
уравнений У,
с
помощью которых можно связать концентрации
веществ. В этом случае правило фаз будет
иметь вид:
уменьшается в зависимости от числа
уравнений У,
с
помощью которых можно связать концентрации
веществ. В этом случае правило фаз будет
иметь вид:
І = – Ф + В,
где
![]() =
К – У.
=
К – У.
Сплавами называют твердые вещества, полученные путем расплавления двух или нескольких компонентов и последующей кристаллизации.
По характеру взаимодействия компонентов различают такие сплавы как твердые растворы, механические смеси и химические соединения.
Диаграмма состояния – это график зависимости температуры плавления и кристаллизации сплава в зависимости от состава.
Концентрация – величина, определяющая содержание компонента в смеси, растворе, сплаве. Способы выражения концентрации различны.
Относительная
массовая концентрация
![]() – отношение массы компонента mi
к общей массе смеси
– отношение массы компонента mi
к общей массе смеси
![]() .
.
