
- •Збірник вправ для самостійного розв'язування розрахункових задач із загальної хімії
- •6. Завдання для самостійної підготовки з теми:
- •14.Завдання для самостійної підготовки з теми:
- •20. Завдання для самостійної підготовки з теми:
- •Завдання для самостійної підготовки з теми: Основні класи неорганічних сполук
- •Завдання для самостійної підготовки з теми: Атомно-молекулярне вчення. Основні хімічні поняття і закони. Газові закони
- •Завдання для самостійної підготовки з теми: Стехіометричні закони хімії
- •Завдання для самостійної підготовки з теми: Атомно-молекулярне вчення. Визначення молярної маси магнію еквіваленту
- •Завдання для самостійної підготовки з теми: Будова атома
- •Завдання для самостійної підготовки з теми: Хімічний зв'язок
- •Завдання для самостійної підготовки з теми: Швидкість хімічних реакцій. Каталіз.
- •Завдання для самостійної підготовки з теми: Хімічна рівновага
- •Завдання для самостійної підготовки з теми: Періодичний закон і періодична система хімічних елементів д.І. Менделєєва
- •Завдання для самостійної підготовки з теми: Розчини
- •Завдання для самостійної підготовки з теми: Приготування розчинів певної масової та об’ємної концентрації
- •Завдання для самостійної підготовки з теми: Електролітична дисоціація
- •Завдання для самостійної підготовки з теми: Теорія електролітичної дисоціації. Добуток розчинності
- •Завдання для самостійної підготовки з теми: Теорія електролітичної дисоціації. Водневий показник
- •Завдання для самостійної підготовки з теми: Теорія електролітичної дисоціації. Гідроліз солей
- •Завдання для самостійної підготовки з теми: Класифікація і номенклатура неорганічних сполук. Координаційні сполуки
- •Завдання для самостійної підготовки з теми: Окисно–відновні процеси
- •Завдання для самостійної підготовки з теми: Окисно-відновні процеси. Електроліз
- •Список використаних джерел
Збірник вправ для самостійного розв'язування розрахункових задач із загальної хімії
ЗМІСТ
1. Завдання для самостійної підготовки з теми: Основні класи неорганічних сполук 2
2. Завдання для самостійної підготовки з теми:Атомно-молекулярне вчення. Основні хімічні поняття і закони. Газові закони. 6
3. Завдання для самостійної підготовки з теми:
Стехіометричні закони хімії 7
4. Завдання для самостійної підготовки з теми: Атомно-молекулярне вчення. Визначення молярної маси магнію еквіваленту 8
5. Завдання для самостійної підготовки з теми:
Атомно-молекулярне вчення. Визначення відносної молекулярної
маси сарбон (IV) оксиду 9
6. Завдання для самостійної підготовки з теми:
Атомно-молекулярне вчення. ……10
7. Завдання для самостійної підготовки з теми: Будова атома. 11
8. Завдання для самостійної підготовки з теми: Хімічний зв'язок. 12
9. Завдання для самостійної підготовки з теми: Швидкість хімічних реакцій. Каталіз. 14
10.Завдання для самостійної підготовки з теми: Хімічна рівновага. 15
11.Завдання для самостійної підготовки з теми: Періодичний закон
і періодична система хімічних елементів Д.І. Менделєєва. 17
12.Завдання для самостійної підготовки з теми: Розчини. 19
13.Завдання для самостійної підготовки з теми:
Приготування розчинів певної масової та об’ємної концентрації. 20
14.Завдання для самостійної підготовки з теми:
Електролітична дисоціація. 25
15.Завдання для самостійної підготовки з теми: Теорія електролітичної дисоціації. Добуток розчинності. 26
16.Завдання для самостійної підготовки з теми: Теорія електролітичної дисоціації. Водневий показник. 27
17.Завдання для самостійної підготовки з теми: Теорія електролітичної дисоціації. Гідроліз солей. 28
18.Завдання для самостійної підготовки з теми: Класифікація і номенклатура неорганічних сполук. Координаційні сполуки. 29
19.Завдання для самостійної підготовки з теми:
Окисно–відновні процеси 30
20. Завдання для самостійної підготовки з теми:
Окисно-відновні процеси. Електроліз. 32
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ………………………………….…33
Завдання для самостійної підготовки з теми: Основні класи неорганічних сполук
1. Написати формули ангідридів зазначених кислот: H₂SO₄; H₃BO₃; H₄P₂O₇; HOCl; HMnO₄.
2.Написати рівняння реакцій, за допомогою яких можна здійснити вказані перетворення:
Zn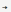 K₂ZnO₂;
K₂ZnO₂;
NH₃ HNO₃;
S H₂SO₄;
Cu CuS
CuS
3. Які з указаних газів вступають в хімічну взаємодію з розчином лугу: HCl, H₂S, NO₂, N₂, Cl₂, CH₄, SO₂, NH₃? Написати рівняння відповідних реакцій.
4. Назвать наступні сполуки: K₂O₂, MnO₂, BaO₂, MnO, CrO₃, V₂O₅.
5. Як довести амфотерний характер ZnO, Al₂O₃, Sn(OH)₂, Cr(OH)₃.
6. Чи можна здійснити в розчинах вказані реакції:
CuSO₄ + BaCl₂ BaSO₄ + CuCl₂
FeS + K₂SO₄ FeSO₄ + K₂S
AgCl + KNO₃ AgNO₃ + KCl
Пояснити.
7. Які із вказаних кислот утворюють кислі солі: HI, H₂Se, H₂SeO₃, H₂C₂O₄, CH₃COOH?
8. З яких вказаних нижче сполук буде реагувати соляна кислота: N₂O₅, Zn(OH)₂, CaO, AgNO₃, H₃PO₄, H₂SO₄? Написати рівняння реакцій.
9. Які із вказаних сполук реагують з гідроксидом натрію: HNO₃, CaO, CO₂, CuSO₄, Cd(OH)₂, P₂O₅? Написати рівняння реакцій.
10. Написати рівняння реакцій,які свідчать про основні властивості FeO, Cs₂O, HgO, Bi₂O₃.
11. Написати рівняння реакцій, які доводять кислотний характер SeO₂, SO₃, Mn₂O₇,P₂O₅,CrO₃.
12. Скласти рівняння реакцій отримання хлориду магнію:
а) впливом кислоти на метал;
б) впливом кислоти на основу;
в) впливом солі на сіль.
13. Скласти рівняння реакцій між кислотами й основами, які призводять до утворення солей: NaNO₃, Na₂HPO₄, NaHSO₂, K₂S, Fe₂(SO₄)₃.
14. Написати рівняння реакцій утворення Mn₂P₂O₇, Ca₃(PO₄)₂, Mg(ClO₄)₂, Ba(NO₃)₂ в результаті взаємодії: а)основного і кислотного оксидів; б)основи і кислотного оксиду; в)основного оксиду і кислоти; г)основи і кислоти.
15. Написати рівняння реакцій, за допомогою яких можна добути в лабораторії наступні сполуки: а) хлороводень; б) плюмбум (2+) сульфід; в) барій сульфат; г) арґентум ортофосфат; д) ферум (III)гідроксид; е) купрум (II)нітрат.
