
- •Лекція 1 атомно-молекулярне вчення
- •1. Основи хімічної атомістики. Основні поняття хімії.
- •2. Стехіометричні закони хімії
- •3. Закони ідеальних газів
- •Маси однакових об’ємів різних газів за однакових температури і тиску співвідносяться між собою, як їхні молярні маси:
- •Лекція 2 будова атома
- •1. Історія створення вчення про будову атома
- •2. Основні положення теорії Бора
- •3. Хвильовий характер електрона
- •Принцип невизначеності Гейзенберга.
- •4. Квантові числа та атомні орбіталі.
- •5. Багатоелектронні атоми.
- •5.1. Принцип Паулі
- •5.2. Правила Клечковського.
- •5.3. Правило Хунда.
- •Лекція 3 періодична система елементів і періодичний закон
- •Способи класифікації хімічних елементів
- •Тріади Деберейнера
- •Частина розподілу елементів за «октавами» Ньюлендса
- •Періодичний закон
- •Дослідження г. Мозлі та сучасне формулювання періодичного закону
- •Зв’язок періодичної системи з будовою атомів
- •Періодичні та неперіодичні властивості елементів
- •Розміри атомів
- •Енергія йонізації
- •Спорідненість до електрона.
- •Електронегативність
- •Застосування періодичного закону та періодичної системи елементів.
- •Лекція 4 хімічний зв’язок
- •Міцність і довжина хімічного зв’язку
- •Валентність елементів.
- •Теорія г.Н. Льюїса та в. Косселя.
- •Теорія ковалентного зв’язку
- •Метод валентних зв’язків.
- •Властивості ковалентного зв’язку: напрямленість, насиченість, поляризованість
- •5. Донорно-акцепторний механізм утворення ковалентного зв’язку.
- •6.Делокалізований π-зв’язок.
- •7. Металічний зв'язок.
- •8. Іонний зв’язок.
- •Поляризація іонів.
- •Лекція 5 властивості молекул та міжмолекулярна взаємодія
- •Полярність молекул
- •Здатність молекул до поляризації
- •Взаємодія між молекулами
- •Водневий зв’язок.
- •Лекція 6 елементи хімічної термодинаміки
- •Основні поняття хімічної термодинаміки
- •2. Теплові ефекти. Внутрішня енергія та ентальпія
- •3. Термохімічні рівняння. Закони термохімії. Способи розрахунку теплових ефектів.
- •Тепловий ефект хімічної реакції дорівнює сумі теплових ефектів її проміжних стадій.
- •Термохімічні рівняння можна додавати або віднімати разом з їхніми тепловими ефектами як алгебричні рівняння.
- •Якщо в двох реакціях з різних вихідних речовин утворюються однакові продукти, то різниця теплових ефектів цих реакцій дорівнює тепловому ефекту переходу від одних вихідних речовин до інших.
- •4. Напрямленість процесів. Ентропія. Ізобарно-ізотермічний потенціал.
- •Лекція 7 основи кінетики хімічних реакцій
- •Кінетика гомогенних реакцій
- •Залежність швидкості реакції від концентрацій реагуючих речовин
- •Вплив температури на швидкість реакцій. Енергія активації.
- •Поняття про каталіз
- •Особливості кінетики реакцій у гетерогенних системах
- •Лекція 8 хімічна рівновага
- •Константа рівноваги.
- •Зміщення хімічної рівноваги. Правило Ле Шательє.
- •Лекція 9 розчини
- •1. Загальна характеристика розчинів
- •2. Концентрація розчинів
- •3. Процес розчинення. Характеристика процесів, які супроводжують процес розчинення
- •4. Розчинність. Вплив на розчинність природи речовини, температури, тиску
- •Насичений розчин фенолу у воді ↔ Насичений розчин води у фенолі.
- •5. Осмос. Осмотичний тиск
- •Лекція 10 розчини електролітів
- •Основи теорії електролітичної дисоціації
- •Роль розчинника у процесі дисоціації
- •Слабкі та сильні електроліти. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Іонна рівновага в гетерогенних системах. Добуток розчинності
- •Реакції обміну в розчинах лектролітів
- •Дисоціація води. Водневий показник. Кислотно-основні індикатори
- •Буферні розчини
- •Гідроліз
- •Лекція 11 електроліз
- •Основні визначення та фактори, які впливають на електроліз
- •Процес відновлення на катоді у водних розчинах
- •3. Процес окиснення на аноді у водних розчинах.
- •4. Приклади запису рівнянь електролізу водних розчинів різних Сполук і з різними електродами
- •5. Закони електролізу
- •Лекція 12 гальванічні елементи
- •1. Окиснення та відновлення
- •2. Електродні потенціали
- •3. Гальванічні елементи
- •4. Використання стандартних електродних потенціалів. Напрям перебігу окисно-відновних реакцій
- •5.Ряд електрохімічних потенціалів металів
- •Лекція 13 окисно-відновні реакції
- •1. Загальні поняття
- •2. Класифікація окисно-відновних реакцій (овр)
- •II.Реакції (процеси) дисмутації (диспропорції, самоокиснення-самовідновлення):
- •Реакції внутрішньомолекулярного окиснення-відновлення:
- •3. Найважливіші хімічні окисники і відновники. Типові окисники
- •Типові відновники
- •4. Правила складання рівнянь окисно-відновних реакцій
- •1. Метод електронного балансу;
- •4А) метод електронного балансу
- •4Б) метод напівреакції
- •Роль середовища в окисно-відновних процесах
- •Лекція 14 координаційні сполуки
- •Основні положення координаційної теорії
- •Класифікація координаційних сполук
- •Номенклатура координаційних сполук
- •Просторова будова комплексних сполук
- •Ізомерія комплексних сполук
- •Дисоціація комплексних сполук. Константа нестійкості і константа стійкості.
- •Хімічні властивості комплексних сполук
- •Метод валентних зв’язків
ЗМІСТ
ЛЕКЦІЯ 1 2
АТОМНО-МОЛЕКУЛЯРНЕ ВЧЕННЯ 2
ЛЕКЦІЯ 2 23
БУДОВА АТОМА 23
ЛЕКЦІЯ 3 41
ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ І ПЕРІОДИЧНИЙ ЗАКОН 42
ЛЕКЦІЯ 4 61
ХІМІЧНИЙ ЗВ’ЯЗОК 61
Взаємна поляризація іонів впливає не лише на зменшення частки іонності зв’язку. З позицій поляризаційних уявлень можна зрозуміти багато властивостей речовин. 85
ЛЕКЦІЯ 5 87
ВЛАСТИВОСТІ МОЛЕКУЛ ТА МІЖМОЛЕКУЛЯРНА ВЗАЄМОДІЯ 87
ЛЕКЦІЯ 6 97
ЕЛЕМЕНТИ ХІМІЧНОЇ ТЕРМОДИНАМІКИ 97
ЛЕКЦІЯ 7 113
ОСНОВИ КІНЕТИКИ ХІМІЧНИХ РЕАКЦІЙ 113
ЛЕКЦІЯ 8 125
ХІМІЧНА РІВНОВАГА 125
ЛЕКЦІЯ 9 135
РОЗЧИНИ 135
ЛЕКЦІЯ 10 РОЗЧИНИ ЕЛЕКТРОЛІТІВ 151
ЛЕКЦІЯ 11 ЕЛЕКТРОЛІЗ 185
Під час пропускання постійного електричного струму крізь розчин або розплав електроліту на електродах відбуваються окисно-відновні процеси перетворення складових електрохімічної системи на продукти її окиснення та відновлення. Тому електролізом називають сукупність процесів, які відбуваються на електродах під час проходження постійного електричного струму крізь провідник ІІ роду – розчини або розплави електролітів. 185
Електроліз складається з катодного та анодного процесів. 186
1. Катодний процес відбувається на катоді – негативно зарядженому електроді. На катоді зосереджуються електрони, які він легко віддає на відновлення частинок (катіонів або молекул) розчину або розплаву. 186
ЛЕКЦІЯ 12 ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ 195
Sn2+ ↔ Sn4+ + 2е –, Відновник 197
Fe3+ + 1e– ↔ Fе2+, Окисник 197
ЛЕКЦІЯ 13 ОКИСНО-ВІДНОВНІ РЕАКЦІЇ 217
ЛЕКЦІЯ 14 КООРДИНАЦІЙНІ СПОЛУКИ 229
Лекція 1 атомно-молекулярне вчення
Мета навчального заняття:
а) освітня: сформулювати знання про основні поняття хімії, стехіометричні закони хімії, закони ідеальних газів;
б) виховна: розкрити значення кожного поняття та суть хімічної атомістики;
в) розвивальна: розвивати уявлення про основні положення атомно-молекулярного вчення;
Обладнання: таблиці, схеми.
Методи навчання: загально-логічні (метод індукції, метод порівняння), методи хімічного дослідження (метод моделювання), загально-педагогічні методи (пояснювально-ілюстративний метод).
Ключові слова та терміни: атом, хімічний елемент, валентність, молекули, атомна маса, ізотопи, протонне число, нуклонне число, молекулярна (формульна) маса, моль, відносна густина, атомна теплоємність, стехіометричні закони хімії,, закон збереження маси, закон Бойля-Маріотта, закон Шарля, універсальна газова стала, рівняння Менделєєва-Клапейрона, закон простих об’ємних відношень, закон Авогадро, парціальний тиск газів, рівняння Ван-дер-Ваальса.
ПЛАН
Основи хімічної атомістики. Основні поняття хімії.
Стехіометричні закони.
Закони ідеальних газів.
1. Основи хімічної атомістики. Основні поняття хімії.
Змістовні формулювання в рамках атомістичної теорії на початку ХІХ ст. Висловив шкільний учитель з Англії Жд. Дальтон.
Головні постулати теорії Дальтона зводились до такого:
хімічні елементи складаються з атомів, які є найменшими частинками речовини; їх неможливо розділити на ще менші складові частинки і перетворити одну на одну;
атоми неможливо знищити;
усі атоми одного елемента абсолютно однакові і мають однакову масу;
атоми різних елементів мають різні маси;
під час хімічних реакцій між двома або більшим числом елементів їхні атоми сполучаються між собою в простих, цілочислових відношеннях;
відносні масові частки елементів, що сполучаються один з одним, безпосередньо пов’язують з масою самих атомів. Отже, коли 1 г сірки зв’язується з 2 г міді у співвідношенні 1:1, то це означає, що кожен атом міді вдвічі важчий за атом сірки.
Найважливіший висновок з теорії Дальтона такий: якщо атоми справді існують, то вони мають характеризуватися цілком певною атомною масою. Тому відразу хіміки почали шукати надійні методи визначення атомної маси та встановлення формул хімічних сполук.
Теорія Дж. Дальтона змогла пояснити відкриті на той час кількісні закони, які описували хімічну взаємодію.
У 1803 р. Дж. Дальтон, аналізуючи випадки, коли два елементи утворюють між собою не одну, а кілька сполук, відкрив закон кратних відношень:
якщо два елементи один з одним утворюють кілька хімічних сполук, то вагові кількості одного з елементів, що припадають у цих сполуках на одну й ту саму вагову кількість іншого елемента, відносяться між собою, як невеликі цілі числа.
Так, в оксидах азоту N2O, NO, N2O3, NO2, N2O5 на 14 масових часток азоту припадає відповідно 8, 16, 24, 32, 40 масових часток кисню. Останні відносяться між собою, як 1 : 2 : 3 : 4 : 5.
Ідею Дж. Дальтона щодо встановлення атомних мас елементів підтримав видатний шведський хімік Й. Я. Берцеліус, який стверджував, що без визначення атомних мас сутінки нової теорії не можуть змінитися на день. Й. Я. Берцеліус запровадив у хімію символи хімічних елементів, якими користуються і нині, а також формули сполук.
Й. Я. Берцеліус цілком сприяв розвитку атомістичних уявлень у хімії, однак його погляди були певною мірою суперечливими. Так, він відстоював електростатичну гіпотезу спорідненості елементів, яка припускала сполучення між собою атомів лише різних елементів. Згідно з цією гіпотезою кожний атом має різнойменно заряджені полюси, але в одному переважає позитивний заряд, а в іншому – негативний. Тільки такі атоми, в яких переважають різнойменні заряди, можуть сполучатись між собою. Отже, Й. Я. Берцеліус заперечував можливість сполучення між собою однакових атомів, а це виявилося гальмом у розвитку хімічних уявлень і трактування окремих експериментальних фактів (наприклад, простих об’ємних відношень у разі взаємодії газів).
Атомно-молекулярне вчення. Остаточно атомно-молекулярну теорію в хімії було визнано у 1860 р. на І Міжнародному конгресі хіміків у Карлсруе. Її основні положення зводяться до такого:
усі індивідуальні речовини є сукупністю молекул або кристалами, які в свою чергу, побудовані з атомів;
атоми одного виду (елемента) однакові між собою, але відрізняються від атомів іншого виду (елемента); атоми мають масу, яку називають атомною;
атом є носієм хімічних властивостей елемента, найменшою його частинкою; його не можна розкласти хімічним способом; під час хімічних перетворень атоми не з’являються з нічого і нікуди не зникають, змінюються лише способи зв’язування атомів;
внаслідок взаємодії атомів утворюються молекули: гомоядерні у простих речовин, гетероядерні – у складних; молекули розглядають як найменші частинки переважної більшості речовин, вони є носіями хімічних властивостей речовин; атоми елементів у молекулах хімічно зв’язані між собою;
під час фізичних явищ молекули зберігаються, під час перебігу хімічних процесів – руйнуються. Явища, при яких одні речовини перетворюються на інші, що відрізняються від вихідних за складом і властивостями, і при цьому не відбувається зміна складу ядер атомів, називаються хімічними явищами. Ознаками хімічних реакцій є енергетичний ефект, зміна забарвлення, утворення газу, осаду, поява чи зникнення запаху. Наприклад, горіння природного газу метану з утворенням води і вуглекислого газу. При фізичних явищах змінюється форма, агрегатний стан речовин. Вони не пов’язані з перетвореннями одних речовин на інші. Наприклад кипіння води та її випаровування. Хімічні явища завжди супроводжуються фізичними. Наприклад, при горінні природного газу виділяється тепло і світло.
хімічні реакції полягають в утворенні нових речовин із тих самих атомів, з яких складалися вихідні речовини.
Атом є представником хімічного елемента, тобто атом – це найменша хімічно неподільна частинка, яка є носієм властивостей елемента.
Хімічний елемент – це певний вид атомів з однаковими хімічними властивостями.
До ХХ ст. атоми вважали елементарними, тобто абсолютно неподільними частинками. Однак відкриття, зроблені на початку ХХ ст., засвідчили, що атоми мають непросту будову, складаються з позитивно зарядженого ядра та електронної оболонки, тому сучасне означення його таке:
атом – це електронейтральна система, яка складається з позитивно зарядженого ядра та електронів, що рухаються навколо нього.
Невелике за розміром ядро зосереджує основну частину маси атома. Хімічні властивості атома певного елемента залежать від будови його електронної оболонки, а загальне число електронів в атомі визначається значенням заряду атомного ядра. Отже, хімічний елемент – це певний вид атомів з однаковим зарядом атомних ядер.
Атоми можуть сполучатися між собою відповідно до їхніх валентностей і утворювати хімічні сполуки.
Валентність – це здатність атомів приєднувати певне число інших атомів. Внаслідок хімічного сполучення атомів утворюються молекули, тому, з одного боку, молекули – це угрупування атомів, сполучених між собою хімічними зв’язками і здатних до самостійного існування.
З іншого боку, молекули – це найменші частинки, що зберігають хімічні властивості речовини.
Молекули є носіями хімічних властивостей речовин. У хімічних реакціях відбувається руйнування одних зв’язків і утворення інших, перетворення одних молекул на інші.
На відміну від цього фізичні властивості речовин часто не пов’язані з окремими молекулами, а тільки з їх великою сукупністю. До таких властивостей можна віднести, наприклад, температуру кипіння і плавлення, густину, зміну агрегатного стану речовин та ін.
З визначення положень атомно-молекулярного вчення стало можливим правильне визначення атомних і молекулярних мас. Саме з 60-х років ХІХ ст. розпочався сучасний період розвитку хімії.
Важливу роль в одержанні значень відносних атомних мас елементів відіграло встановлене у 1819 р. П. Л. Дюлонгом (1785-1838) і А. П. Пті (1791-1820) правило, згідно з яким для більшості досліджених металів добуток питомої теплоємності і атомної маси є приблизно сталою величиною, що дорівнює 6,3 кал/(моль • °С)(26,5 Дж/(моль • К). Згодом цю величину назвали атомною теплоємністю. Отже,
Атомна маса × Питома теплоємність ≈ 6,3 кал/(моль • °С).
Питома теплоємність – це кількість теплоти, потрібної для підвищення температури 1 г речовини на один градус. Наприклад, питома теплоємність кальцію дорівнює 0,156 кал/(г • °С). Тоді відносна атомна маса кальцію має дорівнювати
Ar(Ca)
≈
 ≈ 40,4,
≈ 40,4,
що є близьким значенням до обчисленої атомної маси кальцію.
У вуглецевій шкалі, яка нині використовується в хімії та фізиці, затверджено єдиний еталон: атоми нукліда вуглецю-12 (12С), яким приписано атомну масу 12,0000. За одиницю вимірювання відносних атомних (і молекулярних) мас беруть так звану атомну одиницю маси (а. о. м.), тобто 1/12 частину маси атома 12С (1 а. о. м. = 1,66 · 10-24 г = 1 г/NA), тому
атомною масою називається відношення середньої маси атомів природної суміші ізотопів певного елемента до 1/12 частини маси атома вуглецю-12.
Визначені атомні маси елементів є безрозмірними величинами, вони відображають лише відносні маси атомів. Останні позначають символом Ar (r – від англ. relative – відносний). Наприклад, Ar (Ca) =40,08, тоді як mA(Ca) = 40,08 а. о. м.
Ізотопами називають різновиди атомів одного й того самого елемента, які різняться між собою масовим числом.
Згідно
із сучасними уявленнями ядра атомів
складаються з протонів і нейтронів, що
зв’язані силами внутрішньоядерної
взаємодії. Протон і нейтрон вважають
двома зарядовими станами однієї частинки
– нуклона. Маса протона дорівнює 1,007276
а. о. м., а заряд +1 а. о. з. (атомних одиниць
заряду, який дорівнює 1,601 · 10-19
Кл), маса нейтрона – 1,008665 а. о. м., заряд
– нуль. Сумарне число нуклонів у ядрі
називають масовим,
або нуклонним
числом.
Заряд ядра дорівнює числу протонів,
тому його також називають протонним
числом.
Масове число і заряд ядра ізотопу
позначають зліва від символу елемента
відповідно верхнім і нижнім індексами,
наприклад:
 .
.
Атомні маси елементів представлені в земній корі одним ізотопом (наприклад, F, Al), збігаються з атомною масою цього ізотопу. Атомні маси ізотопів на відміну від їхніх масових (або нуклонних) чисел не є цілими. Це пояснюється, по перше, тим, що відносні маси протона і нейтрона дещо більші за 1 (відповідно 1,007276 і 1,008665), по-друге, дефектом маси ∆m, по третє, невеликим внеском у загальну масу атома маси електронів.
Дефект маси – це різниця між сумою мас протонів і нейтронів, що входять до складу ядра, і масою ядра:
∆m = ∑mр + ∑mн – mя
Наприклад,
маса ядра ізотопу
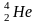 дорівнює
4,001506 а. о. м., тоді як сума мас двох протонів
і двох нейтронів: 2 · 1,007276 + 2 · 1,008665 а.о.м.
= 4,031882 а. о. м. Отже, дефект маси ∆m
у цьому разі становить 0,030276 а. о. м.
Зменшення маси ядра внаслідок його
утворення з протонів і нейтронів
пов’язане з величезними силами
внутрішньоядерної взаємодії, які значно
переважають сили кулонівського
відштовхування між протонами, тому під
час утворення ядер виділяється велика
кількість енергії, а маса зменшується
відповідно до співвідношення Ейнштейна:
дорівнює
4,001506 а. о. м., тоді як сума мас двох протонів
і двох нейтронів: 2 · 1,007276 + 2 · 1,008665 а.о.м.
= 4,031882 а. о. м. Отже, дефект маси ∆m
у цьому разі становить 0,030276 а. о. м.
Зменшення маси ядра внаслідок його
утворення з протонів і нейтронів
пов’язане з величезними силами
внутрішньоядерної взаємодії, які значно
переважають сили кулонівського
відштовхування між протонами, тому під
час утворення ядер виділяється велика
кількість енергії, а маса зменшується
відповідно до співвідношення Ейнштейна:
E=∆mc2,
де с – швидкість світла.
Якщо елемент перебуває у земній корі у вигляді суміші ізотопів, то його атомну масу визначають як середнє значення атомних мас усіх його ізотопів з урахуванням відносного вмісту кожного з них у земній корі. Так, природний хлор складається з нукліда 35Cl (частка загального числа атомів 75,53%), що має масу 34,969 а. о. м., і 37Cl (24,47%) масою 36,966 а. о. м. За цими даними можна обчислити середню атомну масу хлору:
Ar(Cl)
=

Молекулярна (формульна) маса речовини. Склад будь-якої чистої речовини можна передати хімічною формулою, яка, однак, не відображає будови речовини, а також того, складається вона з молекул чи йонів. Водночас для визначення молекулярної маси сполуки ця інформація взагалі не потрібна, оскільки важливо знати лише її якісний і кількісний склад.
Якщо речовина має молекулярну будову, тобто найменшими її частинками, доки вона існує, є молекули, то молекулярна маса відповідає так званій формульній масі. Як і атомна маса, молекулярна і формульна маси є безрозмірними величинами або виражаються в атомних одиницях маси (а. о. м.).
Молекулярною (формульною) масою називається відношення маси молекули (формульної маси) до 1/12 маси атома вуглецю-12.
Позначають її Mr і практично визначають як суму добутків атомних мас усіх елементів, що входять до складу молекули (формули речовини), на число цих атомів.
Кількість речовини. Моль. У реальних хімічних розрахунках дуже незручно користуватися мізерними масами атомів, молекул та йонів. Тому було введено поняття кількості речовини, яке пов’язують з певним числом частинок у взятій порції речовини. За системою одиниць СІ, одиницею кількості речовини є моль. Ця кількість речовини містить однакове число структурних одиниць речовини і пов’язана з атомними і молекулярними масами.
Моль – це одиниця кількості речовини, що містить стільки її структурних одиниць (молекул, атомів, йонів, електронів тощо), скільки атомів міститься в 12 г атома вуглецю-12.
Число структурних одиниць, яке міститься в 1 моль речовини, дорівнює 6,022 · 1023. Це число називається числом Авогадро іпозначається NA.
Встановлено, що в 12 г вуглецю-12 міститься 6,022 · 1023 атомів. Отже, 12 г вуглецю-12 – це 1 моль 12С.
Отже, NA – це множник, за допомогою якого атомні одиниці маси можна перетворити на грами, тобто молярна маса речовини у грамах чисельно дорівнює атомній масі (для одного моля атомів) або молекулярній масі (для одного моля молекул).
Масу 1 моль будь-якої речовини, виражену в грамах, називають молярною масою.
Чисельно вона відповідає формульній масі речовини. Молярну масу М(х) (речовини х) можна визначити за співвідношенням
М(х)
=
 ,
,
де n(x) – кількість речовини.
З наведеного співвідношення випливає, що число молів речовини дорівнює відношенню маси речовини (наважки) до її молярної маси:
n(x)
=
 .
.
Молярну масу речовини можна подати як добуток маси одного атома (молекули, іона) μ на число Авогадро:
M(x) = μ(x)NA
Масу атома (молекули, йона), m(x) виражену в грамах, називають абсолютною масою атома (молекули, йона).
Щоб знайти кількість речовини газу, вимірюють його об’єм V і приводять до нормальних умов (0 °С, 101,325 кПа) V0, оскільки відомо, що 1 моль будь-якого газу містить 6,022 · 1023 молекул і займає за нормальних умов однаковий об’єм, а саме 22,4 л:
n(x)
=

![]() ,
,
де
 -
молярний об’єм газу (н. у.).
-
молярний об’єм газу (н. у.).
Якщо відома кількість речовини, легко знайти число частинок у ній:
N = nNA.
За молярними масами атомів елементів і сполук розраховують маси та об’єми речовин, які беруть участь у хімічних реакціях. Такі розрахунки називають стехіометричними.
Під час складання рівнянь перед формулами речовин треба ставити коефіцієнти так, щоб число атомів кожного елемента у вихідних речовинах і продуктах реакції було однаковим.
Повне рівняння реакції містить багато корисної інформації. Воно показує, внаслідок взаємодії яких вихідних речовин утворюються зазначені продукти реакції. Коефіцієнти перед формулами називаються стехіометричними (молярними). Вони показують, з яких кількостей вихідних речовин утворюються певні кількості продуктів реакції.
