
Модуль6
.docx1. Области применения биологических агентов, полученных методами генетический инженерии.
С помощью этих методов возможно получение новых высокопродуктивных продуцентов белков и пептидов человека, антигенов, вирусов и др.
Развитие данных направлений позволит человек модифицировать организмы по своему желанию под конкретные цели и задачи. Эта находит своё применение во всех сфера сельского хозяйства, животноводства, медицине.
Конструирование организмов с заданными свойствами позволит существенно улучшить множество промышленных процессов и отказаться от вредных химических агентов в пользу более экологичных биологических аналогов.
2. Технологии генетического конструирования организмов in vitro. Источники ДНК для клонирования генов / рестрикция, ферментный и химико-ферментный синтез генов/. Методы введения ДНК. Экспрессия генов в рекомбинантных ДНК.
Основным инструментом генетического конструирования организмов стали две группы ферментов – рестриктирующие эндонуклеазы (рестриктазы) и лигазы.
Первая группа необходима для получения однородных фрагментов ДНК, вторые – для их соединения. Рестриктазы и лигазы в совокупности с другими ферментами (нуклеазами, обратной транскриптазой, ДНК-полимеразой и др.) обеспечивают проведение всех процедуры внедрения гена в клетку.
Техника генетического конструирования in vitro включает следующие процедуры:
- получение нужного гена;
- встраивание его в генетический элемент, способный к репликации (вектор);
- введение гена, входящего в состав вектора, в организм-реципиент;
- идентификацию (скрининг) и отбор клеток, которые приобрели желаемый ген или гены.
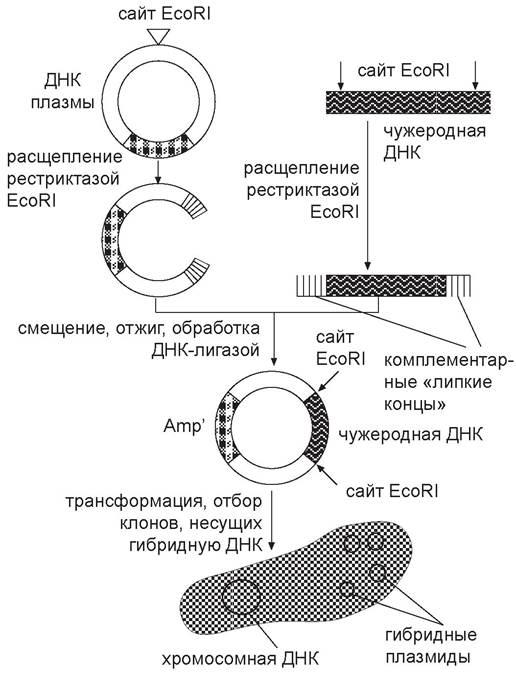 -
Схема генетического конструирования
-
Схема генетического конструирования
При введении в бактериальную клетку ДНК разрушается под действием ферментов. Чтобы этого не происходило, используют специальные векторы ДНК, способные при введении в клетку существовать автономно, а при делениях клетки – реплицироваться.
Вектор несет в своем составе генетический признак, необходимый для последующего распознавания и отбора трансгенных организмов. Обычно в качестве маркерных генов используют гены устойчивости к антибиотикам. В качестве векторов используют плазмиды и вирусы.
Введение изменённой днк в клетку осуществляется путем трансформации или конъюгации.
Трансформация – это процесс изменения генетических свойств клетки в результате проникновения в нее чужеродной ДНК.
Конъюгация – один из способов обмена генетического материала, при котором происходит однонаправленный перенос генетической информации от донора к реципиенту. Этот перенос находится под контролем особых конъюгативных плазмид.
Скрининг клеток, приобрётших признак проводят по наличию в них вектора и гена мишени.
3. Генная инженерия промышленно-важных продуцентов инсулина, соматотропина, интерферонов.
Получение рекомбинантного инсулина.
Способ получения рекомбинантного инсулина человека бактериями, предложенный учёным Нильсоном.
Способ заключается в культивировании штамма-продуцента Е. coli, продуцирующего проинсулин, содержащий два синтетических имуноглобулина связывающих домена стафилококкового белка А.
Удалось добиться высокой продуктивности штамма-продуцента за счет использования богатой питательной среды.
Выход проинсулина составлял 3 г/л питательной среды.
Схема выделения заключалась в разрушении бактериальных клеток, получении телец включения, содержащих проинсулин, растворении телец включения, окислительного сульфитолиза проинсулина, его ренатурации, очистке ренатурированного белка аффинной хроматографией на имуноглобулины, расщеплении проинсулина протеолитическими ферментами (трипсином и карбоксипептидазой Б) и заключительной очистке инсулина высокоэффективной обращенно-фазовой жидкостной хроматографией.
Биосинтез соматотропина.
При химико-ферментном синтезе ДНК получается ген, кодирующий предшественник соматотропина, поэтому был выбран специальный путь клонирования. На первом этапе клонировали двунитевую ДНК-копию мРНК и расщеплением рестиктазами получали последовательность, кодирующую всю аминокислотную последовательность гормона, кроме первых 23 аминокислот. Далее клонировали синтетический полинуклеотид, соответствующий этим 23 аминокислотам со стартовым ANG кодоном в начале. Два полученных фрагмента соединяли и подстраивали к паре lac-промоторов и участку связывания рибосом. Сконструированный ген трансплантировали в E. coli. Синтезированный в бактериях гормон обладал требуемой молекулярной массой, не был связан с каким-либо белком; его выход составлял около 100 000 молекул на клетку. Гормон, однако, содержал на N-конце полипептидной цепи дополнительный остаток метионина;
Получение интерферонов.
Лейкоцитарный интерферон - видоспецифический белок, синтезируемый лейкоцитами человека в ответ на воздействие вируса-интерфероногена. Интерферон не обладает избирательной противовирусной активностью и действует практически на все вирусы.
Генноинженерный лейкоцитарный интерферон получают в прокариотических системах (кишечной палочке). Биотехнология получения интерферона включает следующие этапы:
1) обработка лейкоцитарной массы индукторами интерферона;
2) выделение из обработанных клеток смеси иРНК;
3) получение суммарных комплементарных ДНК (кДНК) с помощью обратной транскриптазы;
4) встраивание кДНК в плазмиду кишечной палочки и ее клонирование;
5) отбор клонов, содержащих гены интерферона;
6) включение в плазмиду сильного промотора для успешной транскрипции гена;
7) экспрессия гена интерферона, т.е. синтез соответствующего белка;
8) разрушение прокариотических клеток и очистка интерферона с помощью аффинной хроматографии.
4. Клеточная инженерия. Получение биологических агентов методами клеточной инженерии in vivo.
Конструирование in vivo (клеточная инженерия) это технология получения и выделение мутантов с использование различных способов обмена наследственной информацией живых клеток.
Основой клеточной инженерии является слияние неполовых клеток (гибридизация соматических клеток) с образованием единого целого.
Слияние клеток может быть полным, или клетка-реципиент может приобрести отдельные части донорской клетки (митохондрии, цитоплазму, ядерный геном, хлоропласты и др.).
К рекомбинации ведут различные процессы обмена генетической информацией живых клеток (половой и парасексуальный процессы эукариотических клеток; конъюгация, трансформация и трансдукция у прокариот, а также универсальный метод – слияние протопластов).
У бактерий обмен генетической информацией происходит в результате взаимодействия конъюгативных плазмид (конъюгации).
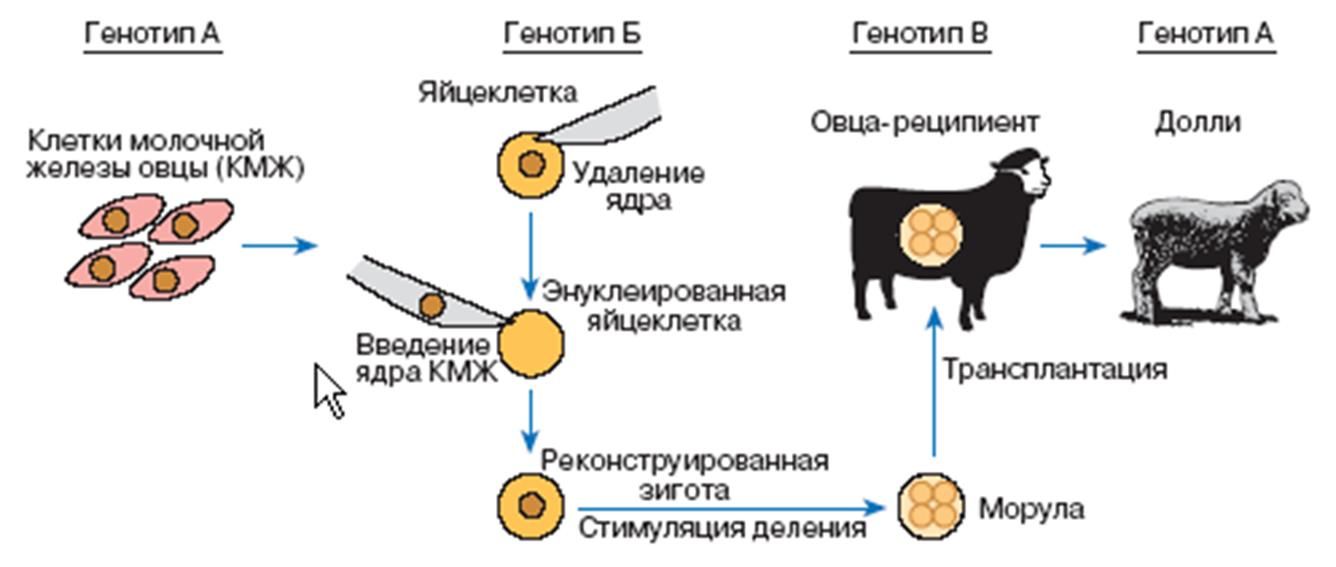
Пример клеточной инженерии для получения клонированного организма
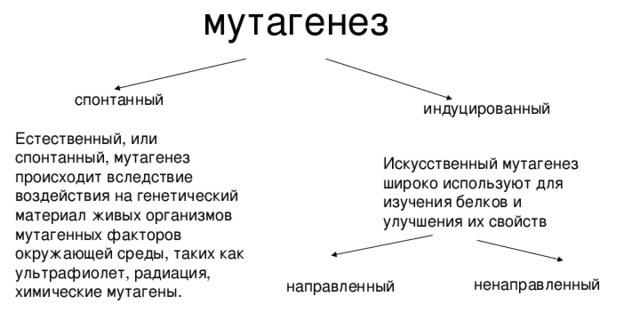
5. Мутагенез; методы получения и выделения мутантов.
Мутагенез — внесение изменений в нуклеотидную последовательность ДНК (мутаций).
Для выделения мутантов используют методы позитивной и негативной селекции.
1.Позитивная селекция. Используют селективную среду, на которой растут только мутантные колонии. Например, для поиска резистентных к пенициллину мутантов использую среду с пенициллином.
2.Негативная селекция. Используется для выявления мутантов, утративших признаки (ауксотрофы) по сравнению с родительскими клетками (прототрофными). Ауксотрофные мутанты утрачивают способность синтезировать жизненно важные нутриенты. Для их выявления используют метод реплик и минимальные питательные среды.
6. Гибридизация эукариотических клеток.
Гибридизация — процесс образования или получения гибридов, в основе которого лежит объединение генетического материала разных клеток в одной клетке. Образование гибридов у дрожжей, грибов и водорослей происходит в результате слияния клеток.
7. Плазмиды и конъюгация у бактерий. Фаги и трансдукция.
Плазмидами называют бактериальные репликоны (внехромосомные элементы наследственности), стабильно наследуемые. Плазмиды разделяют на конъюгативные, способные самостоятельно перенестись в реципиентные клетки с помощью конъюгации, и неконъюгативные, не обладающие этим свойством.
Трансдукция – перенос генетической информации от клетки донора к клетке реципиента, который осуществляется фагом. Фаги могут быть вирулентными – лизирующими зараженные ими бактерии – или умеренными – образующими с клеткой-хозяином своеобразный симбиоз.
8. Техника слияния протопластов.
Термин «протопласты» применяют для обозначения структур, которые образуются после полного удаления клеточной стенки у клеток растений, микроорганизмов, животных.
Для получения протопластов используют несколько методов:
1) выращивание клеток на средах с антибиотиками, высокими концентрациями аминокислот. В результате нарушаются процессы биосинтеза клеточной стенки;
2) основной метод – ферментный лизис клеточной стенки, например, лизоцимом.
С помощью слияния протопластов можно получать генетические рекомбинанты у тех видов и штаммов микроорганизмов, у которых не обнаружены собственные системы обмена наследственной информацией и которые в естественных условиях никогда не скрещиваются между собой.
9.Гибридомы. Получение и применение моноклональных антител.
Моноклональные антитела — это иммуноглобулины, синтезируемый одним клоном клеток. Моноклональное антитело связывается только с одной антигенной детерминантой на молекуле антигена. Гибридомная технология — слияние с помощью полиэтиленгликоля лимфоцитов селезенки предварительно иммунизированных организмов определенным антигеном с миеломными (раковыми) клетками, способными к бесконечной пролиферации (делению).
Гибридомы представляют собой бессмертные клоны клеток, синтезирующие моноклональные антитела. С их помощью можно определить любое иммуногенное вещество.
В медицине меченные изотопами или иным способом моноклональные антитела можно использовать для диагностики рака и определения локализации опухоли, для диагностики инфаркта миокарда. Получены моноклональные антитела к различным возбудителям: малярии, трипаносомозу, лейшманиозу, токсоплазмозу и др.
